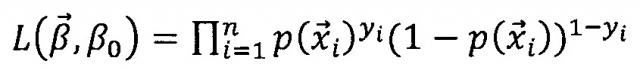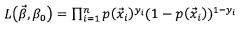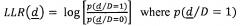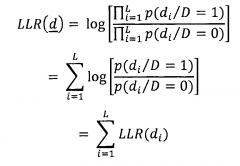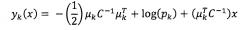Оценка и наблюдение острого повреждения легких (ali)/синдрома острой дыхательной недостаточности (ards)
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике, а именно к средствам медицинского мониторинга острого повреждения легких (ALI). Постоянный запоминающий носитель, на котором сохранены инструкции, исполняемые электронным устройством обработки данных, включающим в себя дисплей, включает в себя прием значений множества физиологических параметров для пациента, прием информации о введении лекарственных средств, относящейся к введению одного или более лекарственных средств пациенту, вычисление значения индикатора ALI на основании по меньшей мере принятых значений множества физиологических параметров для пациента и принятой информации о введении лекарственных средств и отображение представления вычисленного значения индикатора ALI на дисплее. Устройство для наблюдения за пациентом содержит электронное устройство обработки данных, включающее в себя дисплей, и постоянный запоминающий носитель. Способ наблюдения за пациентом проводят посредством устройства. Использование изобретений позволяет расширить арсенал средств поддержки принятия решений в области наблюдения за пациентом и оценки пациента. 3 н. и 12 з.п. ф-лы, 19 ил.
Реферат
Нижеследующее относится к области медицинского мониторинга, области клинических систем поддержки принятия решений, области наблюдения за интенсивной терапией и оценки пациента и так далее.
Острое повреждение легких (ALI) представляет собой губительное осложнение острого расстройства и одну из ведущих причин полиорганной недостаточности и смертности в отделении интенсивной терапии (ОИТ). ALI также иногда встречается как синдром острой дыхательной недостаточности (ARDS). По оценкам, ALI распространено у 7-10% от всех пациентов ОИТ, и демонстрирует высокую смертность больше 40% после выписки из больницы. Однако врачи ОИТ обнаруживают меньше одной трети пациентов с ALI.
Один подход к обнаружению или прогнозированию ALI известен как оценка прогнозирования ALI, в которой используют информацию о хроническом и остром расстройстве для того, чтобы идентифицировать пациентов, у которых с большей вероятностью разовьется ALI во время их присутствия. Однако этот подход обеспечивает малое представление о времени развития. Другой известный подход представляет собой средство обнаружения ALI, которое представляет собой электронную систему для исследования электронных медицинских записей пациентов на предмет свидетельств ALI. Средство обнаружения ALI является чрезвычайно чувствительным и специфичным. Однако оно применяет существующее определение ALI к медицинской записи, которое определяют в отношении характеристик газов артериальной крови (ABG) и радиографии грудной клетки. Таким образом, средство обнаружения ALI ограничено тем, что оно опирается на доступность пациенту анализа ABG и рентгенологического анализа грудной клетки. Получение и использование рентгенографических свидетельств билатеральных инфильтратов, обозначающих ALI, может быть ресурсоемким, занимать много времени и причинять вред пациенту, и во многих случаях ОИТ релевантные данные не доступны по меньшей мере во время критических начальных этапов поступления и сортировки пациентов.
В WO 2007/052108 A2 раскрыты способы и системы отслеживания показателей жизнедеятельности для прогнозирования и лечения физиологических расстройств. В способах и системах используют датчики для формирования сигналов, которые можно анализировать на предмет тенденций, отклонений или сравнения с предшествующими состояниями или критериями. Датчики могут быть расположены таким образом, что поставщику медицинских услуг нет необходимости наблюдать за субъектом.
В WO 2009/098627 A1 раскрыто устройство для прогнозирования дыхательной стабильности пациента, содержащее запоминающее устройство для данных пациента, хранящее данные пациента, и анализатор, осуществляющий связь с памятью, который вычисляет меру дыхательной стабильности пациента.
В US 2008/0004904 A1 раскрыта медицинская система, которая содержит сеть, с которой связано одно или более устройств сбора медицинских данных, причём каждое устройство передает данные, соответствующие формату, обеспечивающему взаимодействие. Сервер, соединенный с сетью, хранит данные для каждого субъекта в соответствии с форматом, обеспечивающим взаимодействие.
Далее рассмотрены усовершенствованные устройства и способы, в которых преодолены указанные выше ограничения и другое.
По одному аспекту постоянный запоминающий носитель хранит инструкции, исполняемые электронным устройством обработки данных, которое содержит дисплей для наблюдения за пациентом на предмет острого повреждения легких (ALI) посредством операций, которые включают в себя: (i) прием значений множества физиологических параметров для пациента; (ii) приём информации (36) о введении лекарственных средств, относящейся к введению одного или более лекарственных средств пациенту; (iii) вычисление значения индикатора ALI на основании по меньшей мере принятых значений множества физиологических параметров для пациента и принятой информации о введении лекарственных средств; и (iv) отображение представления вычисляемого значения индикатора ALI на дисплее.
По другому аспекту устройство содержит электронное устройство обработки данных, которое содержит дисплей, и постоянный запоминающий носитель как изложено в предыдущем абзаце, которая функционально соединена с электронным устройством обработки данных для того, чтобы исполнять инструкции, хранимые на постоянном запоминающем носителе, для наблюдения за пациентом на предмет острого повреждения легких (ALI).
По другому аспекту способ содержит: прием значений множества физиологических параметров для пациента в отделении интенсивной терапии (ОИТ) на электронном устройстве обработки данных, содержащем дисплей; приём информации (36) о введении лекарственных средств, относящейся к введению одного или более лекарственных средств пациенту; с использованием электронного устройства обработки данных, вычисление значения индикатора ALI на основании по меньшей мере принятых значений множества физиологических параметров для пациента и принятой информации о введении лекарственных средств с использованием алгоритма логического вывода, обученного на обучающем наборе, содержащем эталонных пациентов, для различения эталонных пациентов, которые имеют ALI, и эталонных пациентов, которые не имеют ALI; и отображение представления вычисляемого значения индикатора на дисплее электронного устройства обработки данных.
Одно преимущество заключается в обеспечении оценки ALI с использованием своевременных и доступных данных, не полагаясь только на радиографические данные (например, рентгеновские лучи) или лабораторные тесты (например, анализ газов артериальной крови, ABG).
Другое преимущество заключается в обеспечении оценки ALI, которая учитывает влияние лекарственных средств или лекарств, вводимых пациенту.
Другое преимущество заключается в обеспечении оценки ALI, которую легко интегрировать с существующими мониторами пациента, широко используемыми в обстановки интенсивной терапии и сортировки.
Многие дополнительные преимущества и эффекты будут видны специалистам в данной области после прочтения следующего подробного описания.
Изобретение может принимать форму различных компонентов и конфигураций компонентов, а также различных операций способа и последовательностей операций способа. Рисунки приведены только для иллюстрации предпочтительных вариантов осуществления и их не следует толковать в качестве ограничения изобретения.
На фиг. 1 схематически представлен пациент в отделении интенсивной терапии (ОИТ), за которым осуществляют наблюдение на предмет острого повреждения легких (ALI) на прикроватном мониторе и на сестринском посту, в последнем случае наряду с другими пациентами в ОИТ.
На фиг. 2-4 проиллюстрирован подход к обнаружению ALI, в котором используют показатель сложности Лемпела-Зива, вычисляемый для отслеживаемых показателей жизнедеятельности.
На фиг. 5 проиллюстрированы экспериментальные результаты для подхода на основе логистической регрессии для обнаружения ALI.
На фиг. 6-7 проиллюстрирован подход на основе логарифмического отношения правдоподобия (LLR) для обнаружения ALI.
На фиг. 8 представлен подход общего агрегирования для вычисления индикатора для медицинского состояния в виде агрегирования составляющих алгоритмов индикаторов.
На фиг. 9-15 проиллюстрировано применение подхода агрегирования с фиг. 8 к набору составляющих алгоритмов индикаторов ALI для формирования агрегированного индикатора ALI.
На фиг. 16-19 проиллюстрированы дисплеи во время различных фаз работы по наблюдению за несколькими пациентами с использованием обзорного дисплея (фиг. 16-17) и детализирующих дисплеев для выбранного пациента (фиг. 18-19).
Как показано на фиг. 1, наблюдение за пациентом 8 осуществляют посредством прикроватного монитора 10 пациента, который отображает данные о тенденциях для различных физиологических параметров пациента 8. (В настоящем документе такие термины, как «физиологические параметры», «показатели жизнедеятельности» или «жизненные показатели», используют взаимозаменяемо). Например, иллюстративные электрокардиографические (ECG) электроды 12 надлежащим образом отслеживают частоту сердечных сокращений и при необходимости формируют кривые ECG как функции от времени. По существу можно отслеживать какой-либо физиологический параметр, представляющий медицинский интерес, например, в качестве иллюстративного примера, одного или более из следующего: частота сердечных сокращений (HR); частота дыхания (RR); систолическое артериальное давление (SBP); диастолическое артериальное давление (DBP); фракция вдыхаемого кислорода (FiO2); парциальное давление кислорода в артериальной крови (PaO2); положительное давление в конце выдоха (PEEP); гемоглобин крови (Hgb); и так далее.
Монитор 10 пациента содержит дисплей 14, который предпочтительно представляет собой графический дисплей, на котором физиологические параметры и при необходимости другие данные пациента отображают с использованием числового представления, графического представления, линий тенденций или тому подобное. Монитор 10 пациента дополнительно содержит одно или более пользовательских устройств ввода, таких как иллюстративное средство 16 управления, установленное на корпусе монитора 10, набор программируемых клавиш 18, представленных на дисплее 14 (который в такой конфигурации, соответственно, представляет собой чувствительный к прикосновениям дисплей), выдвижная клавиатура, различные их сочетания или тому подобное. Пользовательское устройство(а) ввода позволяют медицинской сестре или другому медицинскому персоналу конфигурировать монитор 10 (например для того, чтобы выбирать физиологические параметры или другие данные пациента, подлежащие отслеживанию и/или отображению), чтобы задавать параметры тревоги или тому подобное. Несмотря на то, что не показано в явной форме, монитор 10 пациента может содержать другие признаки, такие как громкоговоритель для вывода звуковой тревоги, если уместно, один или более СИД или ламп других типов, чтобы выводить визуальную тревогу, и так далее.
Монитор 10 пациента представляет собой «интеллектуальный» монитор в том отношении, что он содержит или функционально соединен с мощностями для обработки данных, обеспечиваемой посредством микропроцессора, микроконтроллера или тому подобное, соединенного с подходящей памятью и другой вспомогательной электроникой (детали не проиллюстрированы). В некоторых вариантах осуществления монитор 10 пациента содержит внутренние мощности для обработки данных в форме встроенного компьютера, микропроцессора или тому подобное, так что монитор пациента может осуществлять автономную обработку отслеживаемых данных пациента. В других вариантах осуществления монитор пациента представляет собой «неинтеллектуальный терминал», который соединят с сервером или другим компьютером или устройством обработки данных, которое осуществляет обработку данных пациента. Также предусмотрено, что часть мощностей для обработки данных распределена среди взаимодействующих носимых на теле датчиков или устройств, установленных пациенту 8, например, в форме медицинской носимой сети (MBAN).
В иллюстративных примерах пациент 8 расположен в палате пациента отделения интенсивной терапии (ОИТ), которое, например, может представлять собой медицинское ОИТ (МОИТ), хирургическое ОИТ (ХОИТ), отделение кардиологической терапии (ОКТ), сортировочное ОИТ (СОИТ) или тому подобное. В таких условиях наблюдение за пациентом обычно осуществляют посредством прикроватного монитора 10 пациента, расположенного с пациентом (например, в больничной палате пациента), а также посредством электронного устройства 20 наблюдения с подходящим дисплеем 22 (например, специализированное устройство наблюдения или соответственно конфигурированный компьютер), расположенного на сестринском посту 24. Обычно ОИТ имеет один или более таких сестринских постов, причем каждый сестринский пост приписан к конкретному набору пациентов (который может представлять собой лишь одного пациента в предельной ситуации). Проводной или беспроводной канал связи (схематически обозначенный посредством изогнутой линии 26 с двумя стрелками) передает данные пациента, получаемые посредством прикроватного монитора 10 пациента, на электронное устройство 20 наблюдения на сестринском посту 24. Канал связи 26, например, может включать в себя проводной или беспроводной Ethernet (специализированный или часть больничной сети), соединение Bluetooth или тому подобное. Для канала связи 26 предусмотрена двусторонняя линия - т.е. данные также можно передавать с сестринского поста 24 на прикроватный монитор 10.
Прикроватный монитор 10 пациента выполнен с возможностью обнаруживать и показывать острое повреждение легких (ALI) посредством осуществления обработки данных, как описано в настоящем документе, по информации, содержащей по меньшей мере один или более физиологических параметров, отслеживаемых посредством монитора 10 пациента. В качестве дополнения или альтернативы, электронное устройство 20 наблюдения на сестринском посту 24 может быть выполнено с возможностью обнаружения и указания ALI посредством обработки данных, как описано в настоящем документе, по информации, содержащей по меньшей мере один или более физиологических параметров, отслеживаемых посредством монитора 10 пациента. Следует отметить, что термины ALI и синдром острой дыхательной недостаточности (ARDS) используют взаимозаменяемо в настоящем документе. Благоприятно, обнаружение ALI, как описано в настоящем документе, основано на таких физиологических параметрах, как HR, RR, SBP, DBP, FiO2, PEEP или тому подобное, отслеживаемых посредством монитора 10 пациента и которые, таким образом, доступны в реальном времени. Данные пациента с более длительным временем задержки получения, такие как радиографические отчеты и лабораторные находки (например, PaO2, Hgb и так далее), не используются или используются в качестве дополнительной информации для оценки, указано ли ALI.
В дальнейшем изложены различные варианты осуществления обнаружения ALI/ARDS.
Со ссылкой на фиг. 2-4 описан вариант осуществления, в котором используют обнаружение ALI на основе сложности Лемпела-Зива. Как схематично показано на фиг. 2, пациент 8 поступает в ОИТ (обозначено блоком 30). Могут иметь место сценарии, при которых различные лекарственные средства/лекарства (в настоящем документе «лекарственные средства» и «лекарства» используют взаимозаменяемо) можно вводить пациенту 8 для того, чтобы стабилизировать пациента (обозначено блоком 32). В иллюстративном подходе к обнаружению ALI на фиг. 2 используют иллюстративные потоки 34 данных о показателях жизнедеятельности, включающие в себя частоту сердечных сокращений (HR), артериальное систолическое и диастолическое артериальное давление (SBP и DBP) и частоту дыхательных движений (RR), наряду с дополнительным потоком 36 данных пациента, содержащем события введения 32 одного или более различных лекарственных средств пациенту 8. Поток 36 данных о введении лекарственных средств может принимать различные формы, такие как бинарный поток данных (например, значение «0» в виде функции (при необходимости дискретизованного) времени, кроме как во время события введения лекарственного средства, которое обозначают посредством значения «1». В случае лекарственного средства, введенного в течение временного интервала, например, внутривенное вливание, значение может составлять «0», когда вливание не вводят, и «1» (или некоторое другое значение) во время введения вливания. Также предусмотрены другие представления значения-времени, например, моделирование изменяющегося со временем значения ожидаемой динамической концентрации лекарственного средства у пациента (или в органе, представляющем интерес) по начальному введению, пока лекарственное средство не будет удалено из организма с помощью почек или другого механизма.
В блоке 40 показатель сложности Лемпела-Зива (см., например, A. Lempel and J. Ziv, «On the complexity of finite sequences», IEEE Trans. Inform. Theory, vol. IT-22, pp. 75-81, 1976) вычисляют для каждого из потоков данных о показателях жизнедеятельности 34 и для потока 36 данных о введении лекарственных средств. Это формирует показатель 44 сложности Лемпела-Зива, соответствующий каждому потоку 34 данных о показателе жизнедеятельности, и показатель 46 сложности Лемпела-Зива, соответствующий потоку 36 данных о введении лекарственных средств. Показатели 44, 46 сложности Лемпела-Зива комбинируют посредством добавления 50 (при необходимости при взвешивании потоков данных) или посредством другого оператора агрегирования для формирования аддитивного значения сложности, которое затем ограничивают посредством порогового средства 52 для формирования бинарного индикатора 54 ALI, который имеет положительное (или другое предусмотренное) значение, указывающее, что пациент проявляет ALI, или отрицательное (или другое предусмотренное) значение, указывающее, что пациент не проявляет ALI.
Со ссылкой на фиг. 3 дополнительно описана работа блока 40 вычисления показателя сложности Лемпела-Зива. Сложность Лемпела-Зива используют для количественного определения сложности различных временных последовательностей сигналов, таких как электроэнцефалография (ЭЭГ), частота сердечных сокращений, артериальное давление и так далее. В системе на фиг. 2, ввод представляет собой поток 34 данных о показателе жизнедеятельности или поток 36 данных о введении лекарственных средств. Сложность Лемпела-Зива (LZ) основана на огрублении потока данных, т.е. дискретизации потока данных во времени (если уже не получен в виде дискретных образцов) и величин значений. На иллюстративной фиг. 3, поток данных принимают как уже полученный в виде образцов, дискретных по времени, и значение огрубляют посредством преобразования числовых данных в бинарные значения, например, «0», если значение ниже порогового значения Td, или «1», если значение выше порогового значения Td. Предусмотрены другие подходы к огрублению, например, дискретизация до более детальной последовательности (0, 1, 2, N) с использованием множества пороговых значений. Выводом из этой операции является огрубленный, например, бинарный, поток 60 данных.
Сложность LZ представляет собой меру количества отличающихся паттернов, доступных в последовательности, или, более конкретно, в пределах временного интервала или временного окна n последовательности. Для того чтобы получать сложность LZ, бинарную последовательность 60 сканируют слева направо через окно n и счетчик сложности увеличивают на одну единицу каждый раз, когда встречается новая (под)последовательность последовательных символов. В иллюстративном примере на фиг. 3 четыре подпоследовательности 62 идентифицируют в окне n и, таким образом, мера 44, 46 сложности Лемпела-Зива в этом случае составляет c(n)=4. При необходимости можно применять некоторую нормализацию, например, для выражения меры сложности Лемпела-Зива c(n) в единицах встречаемости новых паттернов на единицу времени. Следует принимать во внимание, что обработку, представленную схематически на фиг. 3, можно повторять для последовательных (и при необходимости частично перекрывающихся) временных окон n, чтобы представить меру сложности Лемпела-Зива c(n) как функцию от (дискретизированного) времени.
Вновь обращаясь фиг. 2 и используя указания, используемые на фиг. 3, сумматор 50 представляет собой, соответственно, cHR(n)+cSBP(n)+cDBP(n)+cRR(n)+cDrugs(n). В качестве альтернативы, если используют взвешивание, вывод можно записать как wHRcHR(n)+wSBPcSBP(n)+wDBPcDBP (n)+wRRcRR(n)+wDrugscDrugs(n), где члены w представляют собой скалярные весовые коэффициенты.
Анализ рабочих характеристик приемника (ROC) соответственно используют для получения оптимального порогового значения Td обнаружения для использования при вычислении меры сложности Лемпела-Зива (LZ) на фиг. 3. В фактически выполненном примере ROC анализ для LZ осуществляли на 506 пациентах ОИТ (обучающие массивы данных), из которых 206 были ALI-положительными (т.е. проявляли ALI) и 300 представляли собой контроли (т.е. ALI-отрицательные, не проявляли ALI). На фиг. 4 представлены результаты для обучающей популяции, где площадь под кривой ROC составляет 0,73 и оптимальное пороговое значение составляет 5,92 (чувствительность: 63% и специфичность: 75%). Оптимальное пороговое значение отмечено черным квадратом на фиг. 4. Для проверки подхода после этого ROC анализ осуществляли на 6881 пациенте ОИТ (незнакомые тестовые данные). Из них 138 были ALI-положительными и 6743 представляли собой контроли. Пороговое значение 5,92, полученное с использованием обучающей популяции, располагали на ROC кривой тестовых массивов данных (также нанесенной на фиг. 4). Предложенный подход достигал более высокой чувствительности (67%) и более высокой специфичности (76%) на тестовых массивах данных. В этих фактически выполненных примерах, суммирование 50 не взвешивали (или, что эквивалентно, все весовые коэффициенты составляли w=1). Если использованию подлежат ненулевые весовые коэффициенты, их также можно оптимизировать во время процесса обучения.
Со ссылкой на фиг. 5 описан вариант осуществления, в котором используют обнаружение ALI на основе логистической регрессии. Этот иллюстративный подход влечет отбор признаков исследования, подгонку модели к обучающему или производному массиву данных из данных пациента ОИТ, и тестирование модели на валидационном массиве данных, предпочтительно, том, который отражает истинную ALI в популяции ОИТ, представляющей интерес.
Модель логистической регрессии включает в себя нелинейное отображение независимых или прогностических переменных, таких как частота сердечных сокращений (HR), частота дыхательных движений (RR), неинвазивное измерение артериального давления (NIBP-m), или тому подобное, в зависимую переменную или переменную отклика (например, ALI или контроль в иллюстративных примерах) через функцию логистической регрессии или логит-преобразования. Подходящая запись представляет собой , где p обозначает вероятность ALI, β0 представляет собой постоянную, а β1…βi представляют собой коэффициенты предикторов x1…xi (например, HR, RR, NIBP-m и так далее). В соответствующем подходе модель логистической регрессии подгоняют с использованием функции вероятности , где β0 также представляет собой постоянную, представляет собой вектор коэффициентов предикторов, p также представляет собой вероятность ALI, а y представляет собой истинное присутствие/отсутствие ALI. Коэффициенты вычисляют с использованием способов минимизации, таких как обычный способ наименьших квадратов (OLS) или функция оценки максимальной вероятности (MLE).
В фактически выполненном примере в модели логистической регрессии использовали три признака в качестве ввода: HR, RR и HR/NIBP-m, чтобы получать вероятность развития ALI. В фазе обучения постоянную β0 и коэффициенты получали из массива данных 600 пациентов, содержащего 300 контролей и 300 пациентов с ALI, с использованием приведенных выше уравнений. Модель применяли непрерывно (другими словами, применяли в каждый уникальный момент времени для пациента) и кривую рабочей характеристики приемника (ROC) строили для того, чтобы определять пороговое значение, обеспечивающее желаемый уровень чувствительности и специфичности. Затем в фазе испытания модель применяли таким же непрерывным образом к валидационному набору незнакомых данных пациента, содержащему 6690 контролей и 326 пациентов с ALI. ROC кривую снова строили и чувствительность и специфичность при заданном пороговом значении сравнивали с таковыми, полученными из производного массива данных.
На фиг. 5 представлены результаты. Эффективность модели логистической регрессии на обучающих данных вела к чувствительности 71,00% и специфичности 74,33%. С использованием того же порогового значения эффективность модели на валидационных данных вела к чувствительности 63,19% и специфичности 81,05%.
Фактически выполненный пример является лишь иллюстративным. В целом, более высоко- или низкочастотные данные можно использовать при обучении, тестировании и реализации модели логистической регрессии. Другие варианты осуществления при необходимости включают в себя дополнительные признаки, такие как демографическая информация и информация о базовом уровне здоровья, в той степени, в которой такие данные доступны через электронные медицинские записи (EMR) или другие источники.
Со ссылкой на фиг. 6 и 7 описан вариант осуществления, в котором используют обнаружение ALI на основе логарифмического отношения правдоподобия (LLR). Обращаясь конкретно к фиг. 6, представлена блок-схема обнаружения ALI на основе подходящего логарифмического отношения правдоподобия. Пусть N представляет собой общее число пациентов в производном (т.е. обучающем) наборе данных, из которых N1 имеют заболевание (ALI в иллюстративном примере) и N0 не имеют заболевания. Состояние заболевания обозначают как D, то есть D=1 обозначает ALI-положительных, а D=0 обозначает отсутствие ALI (т.е. ALI-отрицательных). Пусть d=[d1 d2… dL] обозначает вектор данных пациента, которые доступны для постановки диагноза. На иллюстративной фиг. 6 эти L параметров включают в себя показатели 70 жизнедеятельности, например, RR, HR, FiO2 (фракция вдыхаемого кислорода), PaO2 (парциальное давление кислорода в артериальной крови), PEEP (положительное давление в конце выдоха) или тому подобное, и результаты 72 лабораторных тестов, например, pH, Hgb (результат теста на гемоглобин крови) или тому подобное. В качестве другого примера (не проиллюстрировано), L параметров могут в качестве дополнения или альтернативы включать в себя данные о том, имеет ли пациент одно или более острых или хронических состояний, таких как пневмония, диабет или тому подобное. Тогда логарифмическое отношение правдоподобия определяют как ,
где p(d/D=1) представляет собой функцию распределения суммарной вероятности d, учитывая, что D=1, и p(d/D=0) представляет собой функцию распределения суммарной вероятности d, учитывая, что D=0. При допущении, что L параметров независимы, логарифмическое отношение правдоподобия можно записывать следующим образом:
Таким образом, суммарное логарифмическое отношение правдоподобия всех параметров представляет собой сумму логарифма вероятности индивидуальных параметров.
На фиг. 6 представлена фаза тестирования. Логарифмическое отношение правдоподобия LLR(d) вычисляют в операции 74 для пациента с вектором d входных данных пациента, элементы которого [d1 d2 … dL] хранят данные пациента для тестируемого пациента. Затем обнаружение ALI продолжается с использованием пороговой операции 76 следующим образом:
То есть, если LLR(d)>T, то результат 78 теста считают ALI-положительным (D=1), тогда как если LLR(d)<T, то результат теста 78 считают ALI-отрицательным (D=0). В этих выражениях T представляет собой оптимальное пороговое значение обнаружения, определяемое по обучающему набору данных.
Со ссылкой на фиг. 7 изложены результаты фактически выполненного теста ALI на основе логарифмического отношения правдоподобия. ROC анализ используют для того, чтобы получать оптимальное пороговое значение T для пороговой операции 76. ROC анализ для LLR осуществляли на 506 пациентах ОИТ (обучающий массив данных), из которых 206 обладали ALI и 300 являлись контролями. Результаты для обучающей популяции приведены на фиг. 7. Площадь под ROC кривой составляет 0,88, а оптимальное пороговое значение составляет 2,6 (чувствительность: 86% и специфичность: 77%). При получении дополнительных наборов данных для обучения пороговые значения и эффективности могут изменяться. Оптимальное пороговое значение отмечено черным квадратом на графике. Для проверки подхода осуществляли ROC анализ для 6881 пациента ОИТ (незнакомые тестовые данные). Из них 138 имели ALI и 6743 являлись контролями. Пороговое значение, полученное на обучающих данных, также представлено на фиг. 7 в соответствующем ему местоположении на ROC кривой, сформированной на тестовых данных. Подход достигал специфичности (84%) и чувствительности (72%) в тестовых массивах данных. Местоположение рабочей точки (обучающее пороговое значение T) слегка изменялось на тестовых массивах данных при увеличенной чувствительности и сниженной специфичности. Однако принимая во внимание увеличенную специфичность, пороговое значение является достаточно устойчивым. Подход также имеет площадь под ROC кривой (0,86) для тестовых массивов данных, очень близкую к таковой обучающих массивов данных (0,87), которая благоприятна для надежного обнаружения ALI.
Подходы к обнаружению ALI/ARDS с использованием показателя сложности Лемпела-Зива (LZ, описан со ссылкой на фиг. 2-4), подход на основе логистической регрессии (LR, описан со ссылкой на фиг. 5) и подход на основе логарифмического отношения правдоподобия (LLR, описан со ссылкой на фиг. 7) представляют собой иллюстративные примеры, и предусмотрены другие алгоритмы логического вывода. Такие алгоритмы логического вывода могут включать в себя, среди прочего, систему нечеткого логического вывода, байесовскую сеть и машину с конечными состояниями.
Как показано на фиг. 8-15, также предусмотрено использование различных агрегирований алгоритмов логического вывода и при необходимости другой информации, при обнаружении присутствия ALI (т. е. логическом выводе о нем) у пациента. Агрегирование таких способов выгодно использует сделанное в настоящем документе наблюдение о том, что каждый алгоритм распознает паттерны в данных по-разному, с тем, чтобы ожидать, что объединяющий (например, агрегирующий) подход с использованием комплементарной информации из различных уникальных алгоритмов в комбинации давал более высокую эффективность, чем какой-либо один из индивидуальных алгоритмов, действующих отдельно.
Обращаясь конкретно к фиг. 8, раскрыт общий каркас объединяющего подхода. Выходные данные набора из N алгоритмов 80, обозначаемые в настоящем документе без потери универсальности как алгоритм 1, алгоритм 2, алгоритм 3, алгоритм N, агрегируют в агрегирующем блоке 82 для формирования индикатор 84 состояния органа, который соответственно отображают и/или тенденцию которого отслеживают как функцию от времени на прикроватном мониторе 10, устройстве 20 наблюдения сестринского поста, (см. фиг. 1) или тому подобном. Общий каркас на фиг. 8 не обладает специфичностью к заболеванию.
Со ссылкой на фиг. 9 показано применение общего каркаса агрегирования с фиг. 8 к обнаружению ALI. В этом применении N алгоритмов 80 включают в себя шесть алгоритмов (т.е. N=6), как изложено в дальнейшем.
Первый алгоритм основан на выжимке из врачебной экспертизы. На иллюстративной фиг. 9 это реализовано в виде нечеткого алгоритма 90 логического вывода, который строят по лингвистической (или нечеткой) информации о зависимостях переменных и запускают с использованием набора правил 92 принятия решений, сконструированного на основе клинической информации 94, собранной при обсуждениях с врачами. Нечеткий алгоритм 90 логического вывода может, например, составлять компонент клинической системы поддержки принятия решений (CDSS).
Второй алгоритм основан на выжимке из релевантной клинической литературы. На иллюстративной фиг. 9 это реализовано в виде байесовской сети 100, которая структурирована из вероятностей 102, вычисленных на основе клинического исследования 104. Например, клиническое исследование может показывать, что статистически комбинация параметров указывает на ALI с вероятностью P.
Третий алгоритм основан на перевод патофизиологии в термины причинно-следственных связей между переменными (такими как RR, HR и т.д.). Потенциальные причины развития ALI могут быть механическими, химическими или биологическими по природе. Например, механические причины ALI включают в себя быстрое/глубокое дыхание и/или параметры вентиляции. Примеры механических условий представляют собой:
Условие 1: Параметр вентиляции положительное давление в конце выдоха (PEEP)<5
Условие 2: PEEP>10
Условие 3: давление на плато>35 см H2O.
На иллюстративной фиг. 9 это реализовано в виде машины 110 состояний, реализующей логическую последовательность 112, количественно определяющую клиническое определение 114. В данном случае, если ни одно из условий 1, 2 или 3 не выполнено, то машина 110 состояний выводит ALI-отрицательный, тогда как если какое-либо из этих условий выполнено, то машина 110 состояний выводит ALI-положительный.
Эти первые три алгоритма основаны на знаниях, и, соответственно, эффективно используют клиническую информацию, опубликованные клинические исследования и клинические определения. Четвертый, пятый и шестой алгоритмы основаны на данных, и на иллюстративной фиг. 9 соответствуют LLR алгоритму 120, LZ алгоритму 130 и LR алгоритму 140, соответственно, описанным в настоящем документе со ссылкой на фиг. 2-7. Эти алгоритмы 120, 130, 140 основаны на ОИТ данных 142, таких как жизненные показатели, лабораторные показатели и вмешательства (например, события введения лекарственных средств), и при необходимости также основаны на пред-ОИТ данных 144, таких как демографические данные и/или известные хронические заболевания или состояния пациента. (Следует отметить, что термин «пред-ОИТ» указывает на то, что такую информацию о пациенте обычно собирают перед поступлением пациента в ОИТ в виде части процедуры поступления; однако, пред-ОИТ данные 144 можно в некоторых случаях формировать, целиком или частично, после того, как пациент попадает в ОИТ).
Агрегирующий блок 82 можно реализовать различными способами. В иллюстративном ALI применении на фиг. 9, агрегирующий блок 82 реализуют посредством линейного дискриминантного анализа (LDA) или посредством системы голосования (SOFALI). Эти иллюстративные подходы к агрегированию описаны в свою очередь в дальнейшем.
Линейную дискриминантную функцию для каждого класса k можно представлять как:
,
где x представляют собой прогностические переменные (например, различные алгоритмы обнаружения ALI), pk представляют собой априорные вероятности классов k, а C представляет собой ковариационную матрицу, объединенную по классам. Для иллюстративного применения обнаружения ALI коэффициенты LDA получают для различных прогностических переменных (т.е., различных алгоритмов) на обучающем наборе данных. Затем коэффициенты LDA соответствующим образом пропускают через многопеременное логистическое преобразование для того, чтобы преобразовать коэффициенты в вероятности pk в соответствии с:
Агрегатор системы голосования, соответственно, реализуют следующим образом. Пороговые значения для подходов на основе знаний и на основе данных получают на обучающем наборе данных. Затем эти индивидуальные пороговые значения используют для обнаружения ALI на основе мажоритарной системы (на основе множества алгоритмов, обнаруживающих ALI). В таблице 1 представлена иллюстративная мажоритарная система (SOFALI), которую используют для объединения шести различных алгоритмов на иллюстративной фиг. 9.
| Таблица 1Мажоритарная система для объединения различных алгоритмов обнаружения ALI | |
| Число алгоритмов, обнаруживающих ALI | Голоса (SOFALI) |
| Любой один или ни одного | 0 |
| 2 | 1 |
| 3 | 2 |
| 4 | 3 |
| 5 или 6 | 4 |
Другие варианты осуществления могут включать в себя масштаб от 0 до 1, где число голосов нормализуют к общему числу присутствующих алгоритм