Препарат для стимуляции фолликулогенеза и способ его применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается препарата для стимуляции фолликулогенеза, содержащего суспензию химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в рафинированном растительном масле с добавлением апирогенной воды для инъекций. Группа изобретений также касается способа стимуляции фолликулогенеза, предусматривающего двукратную подкожную инъекцию указанного препарата. Группа изобретений обеспечивает стимуляцию соматостатинсодержащим препаратом фолликулогенеза. 2 н. и 4 з.п. ф-лы, 1 пр., 14 ил., 8 табл.
Реферат
Область использования
Изобретение относится к биотехнологии и фармакологии, а конкретно к препарату для стимуляции фолликулогенеза и способу его применения.
Известный уровень
Характерной чертой современной цивилизации является увеличение доли бесплодных супружеских пар и возрастающая потребность во вспомогательных репродуктивных технологиях. Международные исследования, проводившиеся среди населения развитых стран, показали, что проблема бесплодия актуальна для пятнадцати-двадцати процентов супружеских пар. Во всем мире диагноз бесплодия можно поставить примерно миллиарду человек.
Десять лет назад в РФ частота бесплодных браков составляла 18,5%, в 2014 году этот показатель приблизился к 25%. Согласно данным статистики в России диагноз бесплодие в 2014 году поставлен шести миллионам женщин и четырем миллионам мужчин. С каждым годом их количество возрастает - примерно на двести пятьдесят тысяч человек.
В США с 1996 по 2004 годы количество детей, родившихся при реализации программ экстракорпорального оплодотворения (ЭКО), выросло вдвое, причем, в 2004 году их было уже около 1% от общего количества детей, появившихся на свет (Бесплодный брак. Современные подходы к диагностике и лечению. Под ред. В.И. Кулакова. - ГЭОТАР-Медиа, 2006 г.).
Наиболее частой причиной отсутствия беременности при ЭКО являются неэффективность проводимой гормональной терапии, развитие у женщин постгормонального синдрома гиперстимуляции яичников. Для стимуляции процессов фолликулогенеза у женщин в программе подготовки к ЭКО применяют производные эстрадиола, антагонисты гонадотропин рилизинг гормона, препараты человеческого хорионического гогадотропина, прогестерона (Мартынова М.В., Мишиева Н.Г., Левков Л.А. и др. Акушерство и гинекология, 2015, №11, С. 46-52; Стрельченко Д.А., Перминова С.Г., Донников А.Е., Акушерство и гинекология, 2015, №10, С. 19-26; Галлямова Е.М., Перминова С.Г., Митюрина Е.В., Стрельченко Д.А., Акушерство и гинекология, 2015, №7, С. 48-55).
Частота синдрома гиперстимуляции яичников (СГЯ), патогенез которого до сих пор до конца не ясен, колеблется по разным оценкам в широких пределах: доля больных со средней степенью развития СГЯ составляет до 33%, с тяжелой (вплоть до летальных исходов) - до 10%. СГЯ негативно сказывается и на последующем течении беременности, повышая риск самопроизвольного аборта. По данным Российского национального регистра, при использовании ЭКО частота СГЯ тяжелой степени в 2004 г. составила 5,6% и не имеет тенденции к снижению (Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии. Под ред. В.И. Кулакова, Б.В. Леонова, Л.Н. Кузьмичева. М. 2005; Новорожденные высокого риска. Новые диагностические и лечебные технологии. Под ред. В.И. Кулакова, Ю.И. Барашнева. М., 2006; Основы перинатологии. Учебник. Под ред. Н.П. Шабалова и Ю.В. Цвелева, М, 2004).
Одной из причин неудачных попыток ЭКО и развития СГЯ является резкие и значительные изменения гормонального фона женщин вследствие применения экзогенных гормональных препаратов, сложность регуляции межгормонального взаимодействия и невозможности вычленения из «гормонального ансамбля» только линии половых гормонов.
Иной метод стимуляции фолликулогенеза основан на повышении в организме концентрации эндогенного соматотропного гормона за счет индукции синтеза антисоматостатиновых антител.
Результаты исследований, проведенных в последние годы, показали, что гормон роста (СТГ) оказывает регулирующее влияние на репродуктивные процессы самок, самцов и на развитие эмбрионов млекопитающих. В середине восьмидесятых годов прошлого века ученые обнаружили, что концентрация гормона роста в плазме спермы быков значительно выше (приблизительно в 3 раза), чем в сыворотке крови (The relationship between immunosuppressive activity and immunoregulatory cytokines in seminal plasma: influence of sperm autoimmunity and seminal leukocytes / R. , A.E. O'Connor, J.J. Hirst, H.W. Gordon, D.M. Baker de Kretser, M.P. Hedger // Journal of Reproductive Immunology. - 2006. - Vol. 71. - №1. - P. 57-74).
Гормон роста у лососевых рыб оказывает стимулирующее влияние на интерстициальные и первичные половые клетки. Инъекции экзогенного гормона роста кабанам приводят к 2,5-кратному увеличению удельного веса сперматид и сперматоцитов (Kemal, Duru N. Effects of hydrogen peroxide on DNA and plasma membrane integrity of human spermatozoa / N. Kemal Duru, M. Morshedi, S. Oehninger // Fertility and Sterility. - Vol. 74. - P. 1200-1207).
Введение бычкам экзогенного СТГ способствовало повышению содержания в организме инсулиноподобного фактора роста и увеличению концентрации сперматозоидов в эякулятах (Maegava, М. A repertoire of cytokines in human seminal plasma / M. Maegava, M. Kamada, M. Irahara // Journal of Reproductive Immunology. - 2002. - Vol. 54. - P. 3-42).
Увеличение содержания соматотропина в питательных средах для выращивания эмбрионов (5-15 нг/мл) оказывает стимулирующее влияние на созревание ооцитов и культивирование ранних зародышей животных (Роль соматотропного гормона в составе сред для получения эмбрионов in vitro В.П. Симоненко, А.И. Ганджа, Л.Л. Леткевич и др. Розведення i генетика тварин. 2015. №50, С. 212-219).
Также из уровня техники известно (патент РФ 2428604 (ГУЖОН Ален (FR), ЛУМЕ Эрнест (FR)) о применении соматостатина (гормон-антагонист соматотропина) или одного из его аналогов-агонистов для приготовления лекарственного средства, которое предназначено для ингибирования роста покоящихся фолликулов в ткани яичника.
Механизм действия соматостатин-содержащей пептидной субстанции в форме водно-масляной суспензии (далее препарат Сат-Сом) основан на временном связывании эндогенного соматостатина-14 специфическими антисоматостатиновыми антителами и увеличении в организме концентрации эндогенного соматотропного гормона в физиологических пределах. В терапевтической практике генно-инженерный (рекомбинантный) гормон роста применяют при гипофизарном нанизме, синдромах Прадера-Вилли, Шерешевского-Тернера, при заместительной терапии выраженного дефицита эндогенного соматотропного гормона (СТГ) у взрослых. В специальной литературе имеются сообщения об использовании соматотропина для симптоматического лечения следующих заболеваний (показания не утверждены): квашиоркор, остеопороз, кахексия или значительная потеря массы тела у больных СПИДом.
Однако применение рекомбинантного гормона роста в качестве лекарственного средства при подготовке супружеских пар к экстракорпоральному оплодотворению или терапии гипофункциональных состояний яичников и нарушений сперматогенеза в настоящее время не рассматривается. Более того, существуют клинические данные, свидетельствующие о неблагоприятном влиянии повышенного содержания СТГ в крови женщин при патологии гипофизарной области на процессы оплодотворения и раннего эмбриогенеза (К.А. Яворовская, Т.Ю. Иванец, В.Г. Колодько. Особенности фолликулогенеза, раннего эмбриогенеза и беременности раннего срока у женщин с исходной гиперпродукцией СТГ в программе ЭКО - Проблемы репродукции, 2011, №5. С. 72-74).
В то же время, исходя из изученных (известных) свойств химерного соматостатинсодержащего препарата, его способность активизировать фолликулогенез априорно и однозначно не следует и до настоящего времени не было известно о том, что данный лекарственный препарат проявляет фолликулостимулирующую активность, что впервые было показано авторами данного изобретения.
Метод антисоматостатиновой иммунизации животных с использованием указанного химерного соматостатинсодержащего белка используется в промышленном животноводстве (RU 2034457 С1, МПК A01K 67/02, 1995), а также для стимуляции сперматогенеза сельскохозяйственных животных и человека (RU 2493873 С1, МПК A61K 39/385, 2013; RU 2526571 С1, МПК A61K 39/385, 2014).
Сущность изобретения
Технический результат настоящего изобретения заключается в стимуляции соматостатинсодержащим препаратом фолликулогенеза за счет увеличения активности половых гормонов (тестостерон, прогестерон, эстрадиол) в сыворотке крови и индукции комплексных перестроек адаптивного генеза, выражающихся в структурных преобразованиях органов репродуктивной системы и направленных на стимуляцию воспроизводительного потенциала, при использовании препарата для инъекций с низкой реактогенностью адъюванта, позволяющего осуществлять инъекции без болезненных ощущений.
Достижение результата обеспечивает препарат для стимуляции фолликулогенеза, содержащий суспензию химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в рафинированном растительном масле с добавлением апирогенной воды для инъекций.
В наилучшем варианте осуществления изобретения препарат содержит химерный белок с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC из расчета 100-250 мг указанного химерного белка на 100 мл рафинированного растительного масла, включающего 5,0-10,0 мас. % апирогенной воды для инъекций. Предпочтительно использование в препарате рафинированного хлопкового масла или рафинированного арахисового масла.
Способ стимуляции фолликулогенеза, предусматривающий двукратную подкожную инъекцию препарата, содержащего суспензию химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в рафинированном растительном масле с добавлением апирогенной воды для инъекций, из расчета 25-50 мкг указанного химерного белка на 1 кг живой массы тела с межинъекционным интервалом 14 суток.
В наилучшем варианте осуществления изобретения используют препарат в виде водно-масляной суспензии химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в количестве из расчета 100-250 мг указанного химерного белка на 100 мл рафинированного растительного масла, включающего 5,0-10,0 мас. % апирогенной воды для инъекций. Предпочтительно использование препарата, который содержит рафинированное хлопковое масло или рафинированное арахисовое масло.
Осуществление изобретения и эффективность препарата
Возможность осуществления изобретения поясняется примером получения препарата для стимуляции фолликулогенеза.
Полученный и очищенный от примесей препарат белка растворяют в буфере 0,2 М трис-HCL рН 8,0, содержащем 6 М гуанидинхлорид и 2 М МЭДТА (M-EDTA). Добавляют 50-кратный молярный избыток β-меркаптоэтанола в расчете на количество S-S групп химерного белка и раствор быстро разбавляют 10-кратным объемом буфера без гуанидинхлорида. Образовавшийся преципитат гибридного белка отделяют центрифугированием в течение 15 минут при 12000 g и температуре 4°С и лиофильно высушивают для последующего хранения или приготовления водно-масляной суспензии.
Для приготовления готовой формы инъекционного препарата используют рафинированное растительное масло и апирогенную воду для инъекций. В растительное масло добавляют воду из расчета 5-10%. Затем добавляют навеску сухого белка из расчета 100-250 мг на 100 мл водно-масляной суспензии. Суспензию гомогенизируют в течение 1-2 минут и передают на разливочное оборудование. Готовую суспензию препарата расфасовывают в тару (например, шприцы одноразовые). Готовую лекарственную форму препарата стерилизуют ионизирующим облучением при суммарной дозе облучения порядка 6 кГр.
При иной концентрации компонентов инъекционный препарат приготавливается аналогично. Предпочтительными являются следующие содержания компонентов на 95 мл рафинированного растительного масла: 100 мг химерного белка - 5,0 мас. % апирогеннной воды для инъекций; 250 мг химерного белка - 10 мас. % апирогенной воды для инъекций.
Использование в качестве адъюванта для такого рода препарата растительного масла, полностью метаболизирующегося в организме, позволяет в значительной степени снизить уровень реактогенности адъюванта и создает необходимые условия для постепенного поступления действующего вещества в организм человека («депо» препарата). Могут использоваться хлопковое и арахисовое масла. Наличие апирогенной воды в конечной прописи препарата обосновано необходимостью получения водно-масляной суспензии препарата.
Эффективность применения инъекционного препарата для стимуляции фолликулогенеза иллюстрируется следующими примерами.
Для экспериментов использовали белых беспородных крыс. Животные ранее не участвовали в опытах и были выдержаны в течение 14 суток с целью карантина и адаптации. Во время карантинного периода у животных контролировали клинические показатели состояния здоровья. Животных содержали в помещениях с естественно-искусственным освещением и контролируемым микроклиматом. Распределение животных в группы проводили произвольно методом «случайных чисел», используя в качестве критерия массу тела. Индивидуальные значения массы тела не отклонялись от среднего значения в группе более чем на 10%.
Животные были распределены на три группы: I (контрольная) группа - интактные животные, II группа - животные, которым вводили подкожно препарат в форме водно-масляной суспензии в дозе 25 мкг белка Сат-Сом на 1 кг массы тела дважды с интервалом между инъекциями, равным 14 суткам, III группа - животные, которым подкожно инъецировали препарат в форме водно-масляной суспензии в дозе 50 мкг белка Сат-Сом на 1 кг массы тела дважды с интервалом между инъекциями, равным 14 суткам. Общий срок наблюдения за животными составлял 56 суток, в течение которого учитывали прием корма и воды, внешний вид животных, реакцию на внешние раздражители, возможную гибель.
В конце опыта животных из каждой группы подвергали эвтаназии путем декапитации и отбирали пробы крови. Проводили макроскопический анализ матки и яичников, которые взвешивали на аналитических весах HTR 220СЕ. Образцы яичников и матки для гистологических исследований фиксировали в 10%-м растворе формалина в течение суток. После промывки в проточной воде материал дегидратировали в спиртах возрастающей концентрации и осуществляли заливку в парафин по общепринятой методике на универсальном автоматизированном микротоме «НМ-360» («Mikron», Германия).
Для статистической обработки экспериментальных данных использовали метод вариационной статистики с помощью простого сравнения средних по двухстороннему t-критерию Стьюдента. Различия определяли при 0,05 уровне значимости. Статистический анализ выполняли с помощью программы «Student-200». Схема эксперимента отражена в таблице 1.
Изучение общей морфологической картины препарированных органов проводили при помощи светового микроскопа «Nikon» (Япония) после окраски гистологических срезов гематоксилином и эозином. Микрофотосъемку и микроскопическую морфометрию со статистической обработкой осуществляли с помощью микроскопа, совмещенного с сертифицированной программой анализа микроскопического изображения ImageScope С.
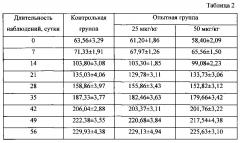
В таблице 2 приведены результаты мониторинга динамики прироста массы тела у крыс опытных групп в сравнении с аналогичным показателем у животных контрольной группы (при подкожном введении соматостатинсодержащий препарата Сат-Сом в форме водно-масляной суспензии (n=10, p≥0,5)).
При двукратном введении препарата Сат-Сом в дозах 25 мкг белка на 1 кг массы тела и 50 мкг белка на 1 кг массы тела видимых отклонений в состоянии и поведении опытных животных от крыс контрольной группы не отмечали. Все животные охотно потребляли корм и воду, шерсть была гладкой и блестящей. На протяжении всего эксперимента гибели животных в группах не регистрировали. Введение препарата крысам в дозе 50 мкг белка на 1 кг массы тела привело к некоторому статистически недостоверному снижению массы тела по сравнению с аналогичными показателями у животных контрольной и первой опытной групп. Введение препарата в дозе 25 мкг белка на 1 кг массы тела не отразилось статистически значимым образом на текущих значениях привесов.
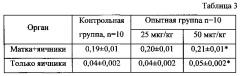
Доказательством влияния лекарственных препаратов на органы-мишени является показатели относительной массы этих органов. Результаты этого параметра приведены в таблице 3 (относительная масса органов крыс, %; * - р≤0,05).
Как следует из представленных в таблице 3 данных, двукратное подкожное введение негормонального препарата Сат-Сом в форме водно-масляной суспензии в дозе 25 мкг белка на 1 кг массы тела с межинъекционным интервалом 14 суток не привело к изменению массовых коэффициентов репродуктивных органов по отношению к аналогичному показателю в контрольной группе. Однако у крыс, получавших дозу препарата, равной 50 мкг белка на 1 кг массы тела с межинъекционным интервалом 14 суток, относительная масса яичников возросла в сравнении с аналогичным показателем в контрольной группе животных и составила 0,05±0,002% против аналогичных показателей в контрольной группе, равных 0,04±0,002%. В абсолютных значениях масса яичников крыс контрольной группы составила 0,09±0,00018 г, у крыс второй опытной группы этот показатель был равен 0,11±0,00022 г.
При макроскопическом исследовании матки и яичников крыс опытных и контрольной групп отмечено следующее.
У животных контрольной группы матка и яичники без видимых изменений, соответствуют норме (Фото на Фиг. 1). В группе животных, получавших препарат в дозе 25 мкг белка на 1 кг массы тела, у некоторых самок стенки рогов матки и яичники гиперемированы (Фото - матка и яичники на Фиг. 2 контрольной группы крыс и на Фиг. 3 опытной группы крыс).
У крыс, получивших препарат Сат-Сом в дозе 50 мкг белка на 1 кг массы тела, гиперемия рогов матки и яичников у всех крыс выражена ярче. Яичники увеличены в размерах (фото на Фиг. 4 - Матка и яичники контрольной группы крыс; фото на Фиг. 5 - матка и яичники опытной группы крыс).
Результаты морфологических исследований яичника и матки у контрольной группы животных
Светооптически яичник животных контрольной группы характеризуется общими чертами его структурной организации и представлен корковым и мозговым веществом с наличием первичных, вторичных, атрезирующих фолликулов и желтых тел (фото на Фиг. 6 - контрольная группа крыс; фото на Фиг. 7 - опытная группа крыс). Фиг. 6: 1 - первичный фолликул, 2 - вторичный фолликул, 3 - атрезирующий фолликул, 4 - желтое тело. Гематоксилин и эозин, об. 4, ок. 10. Фиг. 7: 5 - примордиальный фолликул, 1 - первичный фолликул, 2 - вторичный фолликул, 3 - атрезирующий фолликул, 4 - желтое тело, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов. Гематоксилин и эозин, об. 20, ок. 10.
Мозговое вещество яичников крыс контрольной группы представлено рыхлой волокнистой неоформленной соединительной тканью, с большим содержанием эластических волокон и небольшим количеством гладких миоцитов, а также артерий, нервов и многочисленных венозных сплетений.
При гистологическом исследовании установлено, что стенка матки у крыс контрольной группы состоит из трех оболочек: слизистой (эндометрия), мышечной (миометрия) и серозной (периметрия). Периметрий представлен плотной волокнистой соединительной тканью, покрытой мезотелием. При определении его толщины во всех экспериментальных группах, отличий по данному показателю не выявлено. См. фото на Фиг. 8: 8 - эндометрий, 9 - миометрий, 10 - периметрий, 11 - маточные железы, 12 - маточный эпителий, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов. Гематоксилин и эозин, об. 10, ок. 10.
В рогах и теле миометрий состоит из трех слоев - внутреннего (подслизистого), образованного циркулярно ориентированными миоцитами; среднего (сосудистого) с небольшим количеством гладких миоцитов, косопоперечного направления; наружного (надсосудистого) с клетками косопродольной ориентации. Участок слияния тканевых составляющих характеризуется объединением наружной оболочки - периметрия и части миометрия, а именно, его надсосудистого и сосудистого слоев.
Эндометрий состоит из однослойного эпителия, состоящего из реснитчатых и секреторных столбчатых клеток, а также собственной пластинки, которая содержит простые трубчатые железы, иногда разветвляющиеся вблизи миометрия. Важно отметить, что эпителий маточных желез микроморфологически сходен с поверхностным эпителием. Соединительная ткань собственной пластинки представлена большим количеством фибробластов, в межклеточном веществе матрикс преобладает над волокнами (Фото на Фиг. 8).
Результаты морфологических исследований яичников и матки у опытных групп животных
По результатам микроморфологического анализа у животных опытных групп по сравнению с микроморфологическим анализом органов крыс контрольной группы, выявлен комплекс структурных преобразований, проявляющихся в увеличении размеров всех групп фолликулов и количества образующихся после овуляции желтых тел, утолщении гранулезы и усилении васкуляризации соединительно-тканной оболочки вторичных фолликулов, что может свидетельствовать о регулирующем влиянии негормонального препарата Сат-Сом на фолликулогенез и на репродуктивные характеристики крыс. Примордиальные фолликулы у крыс опытных групп по сравнению с примордиальными фолликулами интактных животных, увеличены в размерах, при этом лидируют по этому показателю яичники крыс 2 опытной группы, которым вводили препарата в дозе 50 мкг/кг (увеличение на 58%), опережая при этом аналогичный показатель у крыс 1 опытной группы, в которой различие с размерами примордиальных фолликулов группы контроля составляет 38%. Количественные характеристики примордиальных фолликулов существенно не различаются у крыс 1, 2 опытных групп, превосходя по этому показателю аналогичные характеристики примордиальных фолликулов у крыс контрольной группы (Фото на Фиг. 9, 10, 12, 13).
Фиг. 9: Структурная организация яичника в группе животных, получивших препарат 25 мкг/кг. 1 - первичный фолликул, 2 вторичный фолликул, 3 - атрезирующий фолликул, 4 - желтое тело, 13 - третичный фолликул (граафов пузырек). Гематоксилин и эозин, об. 4, ок. 10.
Фиг. 10: Структурная организация яичника в группе животных, получивших препарат 25 мкг/кг.5 - примордиальный фолликул, 1 - первичный фолликул, 2 -вторичный фолликул, 3 - атрезирующий фолликул, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов. Гематоксилин и эозин, об. 20, ок. 10.
Фиг. 12: Структурная организация яичника в группе животных, получивших препарат в дозе 50 мкг/кг. 1 - первичный фолликул, 2 - вторичный фолликул, 3 - атрезирующий фолликул, 4 - желтое тело. Гематоксилин и эозин, об. 4, ок. 10.
Фиг. 13: Микроморфология яичника в группе животных, получивших препарат в дозе 50 мкг/кг. 5 - примордиальный фолликул, 1 - первичный фолликул, 2 - вторичный фолликул, 3 - атрезирующий фолликул, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов, 4 - желтое тело. Гематоксилин и эозин, об. 10, ок. 10.
Размеры первичных фолликулов крыс опытных групп, по сравнению с аналогичным показателем у крыс контрольной группы, достоверно (р≤0,05) увеличены, при одновременном возрастании их количества у животных группы контроля по сравнению с аналогичным показателем в опытных группах.
Вторичные малые и крупные фолликулы характеризуются утолщением гранулезы и степенью васкуляризации теки у крыс опытных групп, при одновременном увеличении количества фолликулов и их морфометрических показателей. Аналогичная тенденция отмечена при исследовании микроморфологических количественных и качественных показателей желтых тел яичников животных опытных групп. Морфологическая характеристика атрезирующих фолликулов свидетельствует об изменении гормонального статуса в организме животных опытных групп, что подтверждается достоверным увеличением их количества и размеров.
При исследовании структурной организации матки у животных установлено, что у крыс опытных групп, по сравнению со структурной организацией матки у крыс контроля, толщина эндометрия и количество маточных желез увеличиваются. Более того, выявлено утолщение мышечной оболочки матки у крыс опытных групп, по сравнению с аналогичными показателями у животных контрольной группы (Фото на Фиг. 11, 14).
Фиг. 11: Структурная организация матки в группе животных, получивших препарат в дозе 25 мкг/кг. 8 - эндометрий, 9 - миометрий, 10 - периметрий, 11 - маточные железы, 12 - маточный эпителий, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов. Гематоксилин и эозин, об. 10, ок. 10.
Фиг. 14: Структурная организация матки в группе животных, получивших препарат в дозе 50 мкг. 8 - эндометрий, 9 - миометрий, 10 - периметрий, 11 - маточные железы, 12 - маточный эпителий, 6 - стрелками показана гранулеза вторичных фолликулов, 7 - стрелками показана тека вторичных фолликулов. Гематоксилин и эозин, об. 10, ок. 10.
В таблице 4 приведена сравнительная характеристика размеров яичников крыс контрольной и опытных групп по показателю толщины фолликулов, мкм (р≤0,05).
В таблице 5 приведены показатели толщины гранулезы вторичных фолликулов яичников крыс контрольной и опытных групп, мкм (р≤0,05).
В таблице 6 приведены сведения о степени васкуляризации вторичных фолликулов (антральных) яичников крыс контрольной и опытных групп по показателю толщины теки, мкм (р≤0,05).
В таблице 7 представлена сравнительная характеристика эндометрия и миометрия матки крыс контрольной и опытных групп по показателю толщины тканей, мкм (р≤0,05).
В таблице 8 приведены данные о содержании гормонов в сыворотке крови у крыс контрольной и 2 опытной групп.
Как следует из данных, представленных в таблице 8, содержание в сыворотке крови животных половых гормонов, которым вводили негормональный препарат Сат-Сом в дозе 50 мкг/кг массы тела дважды с межинъекционным интервалом 14 суток, достоверно отличается от аналогичных показателей в группе контроля. Экспериментальные данные, представленные в таблицах 4-8, убедительно доказывают опосредованное (через увеличение содержания в организме животных соматотропного гормона) стимулирующее влияние негормонального препарата Сат-Сом на процессы фолликулогенеза.
Реализация изобретения позволит предложить для клинической практики негормональный соматостатинсодержащий препарат для стимуляции фолликулогенеза за счет увеличения концентрации в сыворотке крови половых гормонов (тестостерон, прогестерон, эстрадиол) и индукции комплексных перестроек адаптивного генеза, выражающихся в структурных преобразованиях органов репродуктивной системы, и направленных на повышение женского воспроизводительного потенциала, при использовании препарата для инъекций с низкой реактогенностью адъюванта, позволяющего осуществлять инъекции без болезненных ощущений.
1. Препарат для стимуляции фолликулогенеза, содержащий суспензию химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в рафинированном растительном масле с добавлением апирогенной воды для инъекций.
2. Препарат по п. 1, отличающийся тем, что он содержит химерный белок с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC из расчета 100-250 мг указанного химерного белка на 100 мл рафинированного растительного масла, включающего 5,0-10,0 мас.% апирогенной воды для инъекций.
3. Препарат по п. 1 или 2, отличающийся тем, что используется рафинированное хлопковое масло или рафинированное арахисовое масло.
4. Способ стимуляции фолликулогенеза, предусматривающий двукратную подкожную инъекцию препарата, содержащего суспензию химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в рафинированном растительном масле с добавлением апирогенной воды для инъекций, из расчета 25-50 мкг указанного химерного белка на 1 кг живой массы тела с межинъекционным интервалом 14 суток.
5. Способ по п. 1, отличающийся тем, что используют препарат в виде водно-масляной суспензии химерного белка с водонерастворимой ферментативно неактивной хлорамфениколацетилтрансферазой без 10 С-терминальных аминокислот, аминокислотным спейсером (Sp)n, где n=1, 2, 4, 8, и соматостатином-14 с последовательностью аминокислот AGCFWKTFTSC в количестве из расчета 100-250 мг указанного химерного белка на 100 мл рафинированного растительного масла, включающего 5,0-10,0 мас.% апирогенной воды для инъекций.
6. Способ по любому из пп. 4 или 5, отличающийся тем, что используют препарат, содержащий рафинированное хлопковое масло или рафинированное арахисовое масло.