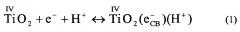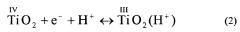Биосовместимый компонент
Иллюстрации
Показать всеНастоящее изобретение относится к области биосовместимых компонентов, предназначенных для контакта с живыми клетками и тканью, в частности к имплантатам, предназначенным для имплантации в живую ткань. Биосовместимый компонент, предназначенный для имплантации в живую ткань, который имеет поверхность, предназначенную для контакта с живой тканью, отличается тем, что поверхность содержит частицы оксида металла, при этом указанные частицы имеют средний размер частиц менее 25 нм, при этом частицы имеют распределение по размеру частиц, полученное с помощью сканирующего измерителя подвижности частиц с электрораспылением (ES-SMPS), до 40%, при этом частицы образуют нанопористый слой и частицы равномерно распределены по всему указанному слою. Биосовместимый компонент может индуцировать раннее образование зародышей кристаллизации гидроксиапатита in vivo и тем самым способствовать остеоинтеграции имплантата. 2 н. и 34 з.п. ф-лы, 5 пр., 6 табл., 16 ил.
Реферат
Область изобретения
Настоящее изобретение относится к области биосовместимых компонентов, предназначенных для контакта с живыми клетками или тканью, в частности к имплантатам, предназначенным для имплантации в живую ткань.
Предпосылки изобретения
Зубные имплантаты представляют собой медицинские изделия, применяемые для восстановления функции, связанной с утратой одного или нескольких зубов. Для обеспечения успешного выполнения своих функций в течение длительного периода зубные имплантаты нужно достаточно прочно закрепить в кости, чтобы они выдерживали нагрузку, вызванную, например, жеванием. Двумя важными показателями для обеспечения высокой прочности крепления являются i) химический состав материала и ii) конструкция имплантата во всех диапазонах длин. Особенности рельефа при разных диапазонах длин индуцируют, например, центры зародышеобразования коллагена и минералов, прикрепление клеток и биомеханическую стимуляцию, необходимую для предотвращения резорбции кости, и в конечном итоге для усиления кости.
Зубные имплантаты, которые сейчас широко используются, выполнены из титана или сплавов титана с винтообразной конструкцией и шероховатой поверхностью.
На сегодняшний день существует несколько способов обработки металлических имплантатов, таких как зубные имплантаты на основе титана, для обеспечения лучшего прикрепления имплантата, и, следовательно, для улучшения остеоинтеграции. Некоторые из них связаны с изменением морфологии имплантата, например, путем создания неровностей на поверхности имплантата для увеличения шероховатости поверхности по сравнению с необработанной поверхностью. Считается, что увеличение шероховатости поверхности, которое обеспечивает больший контакт и большую площадь прикрепления между имплантатом и костной тканью, обеспечивает большую механическую прочность и фиксацию между имплантатом и костью. В данной области хорошо известно, что, например, плазменное напыление, обдувка или травление кислотой могут обеспечить шероховатость поверхности.
Кроме того, известно, что остеобласты, т.е. костеобразующие клетки, воспринимают и реагируют на множество физико-химических свойств подстилающей поверхности. Для образования кости на поверхности имплантата необходима дифференциация клеток-предшественников в секреторные остеобласты с целью получения неминерализованного внеклеточного матрикса (ЕСМ) и последующей кальцификации этого матрикса, как описано, например в Anselme K, Osteoblast adhesion on biomaterials, Biomaterials 21, 667-681 (2000).
Изменение химических свойств поверхности имплантата часто использовали для обеспечения лучшей фиксации имплантата к костной ткани. Некоторые способы включают нанесение слоя керамического материала, такого как гидроксиапатит, на поверхность имплантата с целью улучшения прикрепления имплантата к кости, поскольку гидроксиапатит близок к кости по химическим свойствам.
Общий недостаток в случае покрытий, содержащих гидроксиапатит, заключается, тем не менее, в том, что они могут быть хрупкими и могут шелушиться или откалываться от поверхности имплантата из-за более сильной связи, образующейся между костью и покрытием, чем между покрытием и имплантатом, что может привести к окончательному разрушению имплантата. Что касается применения белковых покрытий, которые также были предложены, то существуют дополнительные аспекты, которые необходимо учитывать. Вследствие химической природы белков для поверхности с белковым покрытием может понадобиться особая стерилизация и условия хранения с целью поддержания его биологической активности. Кроме того, реакция ткани-хозяина (например, иммунная реакция) на биомолекулы, такие как белки, может быть непредсказуемой.
Хотя различные физико-химические свойства поверхностей имплантата, как правило, считаются решающим фактором для биосовместимости материалов, механизм образования новой кости на молекулярном уровне до сих пор не изучен.
Одним словом, несмотря на то что существует множество ранее разработанных способов повышения остеоинтеграции имплантата, существует потребность в имплантатах с улучшенными характеристиками в отношении остеоинтеграции и обеспечения прочного прикрепления имплантата к кости.
Краткое описание изобретения
Цель настоящего изобретения заключается по меньшей мере в частичном решении проблем существующих имплантатов, связанных с образованием новой ткани, в частности, кости и/или остеоинтеграции, а также в обеспечении биосовместимого компонента, например, части зубного имплантата, который обеспечивает лучшее прикрепление имплантат-ткань.
В соответствии с первым аспектом настоящего изобретения эта и другие цели достигаются посредством биосовместимого компонента, имеющего поверхность, предназначенную для контакта с живой тканью, где поверхность содержит частицы оксида металла, при этом указанные частицы имеют средний размер частиц менее 100 нм. В предпочтительных вариантах осуществления настоящего изобретения частицы имеют средний размер частиц менее 25 нм.
Автор настоящего изобретения обнаружил, что путем нанесения частиц оксида металла нанометрового размера на поверхность биосовместимого компонента биологическая активность биосовместимого компонента увеличилась в том плане, что она индуцировала раннее образование зародышей апатита in vitro по сравнению со стандартным образцом.
При имплантации имплантата в тело пациента поверхность имплантата вступает в контакт, например, с кровью. Ионы, находящиеся в крови, притягиваются к поверхности имплантата и начинают образовывать небольшие кристаллы гидроксиапатита, данный процесс называется образованием зародышей. Впоследствии кристаллы гидроксиапатита способствуют притяжению белков и клеток, таких как остеобласты, к поверхности имплантата и образованию структуры ткань-имплантат-кость. Полагают, что биосовместимый компонент в соответствии с настоящим, изобретением будет индуцировать раннее образование зародышей гидроксиапатита in vivo и тем самым способствовать остеоинтеграции путем повышения скорости регенерации ткани. Наблюдалось, что при погружении в жидкость, имитирующую жидкость организма, биосовместимые компоненты в соответствии с вариантами осуществления настоящего изобретения в течение 12 ч индуцировали образование кристаллов апатита с отношением Ca/P, составляющим 1,7, которое аналогично таковому для природного гидроксиапатита, находящегося в кости.
Путем нанесения тонкого, относительно однородного, слоя наночастиц на поверхность биосовместимого компонента достигаются различные свойства поверхности по сравнению с нанесением слоя или покрытия, не содержащих частиц, с таким же химическим составом и кристалличностью, для которого свойства материала подложки являются преобладающими. Например, было показано, что небольшие наночастицы несут более высокий поверхностный заряд по сравнению с более крупными аналогами (Zareen Abbas, Christophe Labbez, Sture Nordholm, and Elisabet Ahlberg., J. Phys. Chem. С 2008, 112, 5715-5723). Считается, что это может влиять на образование апатита, а также на адсорбцию белков и клеток на поверхности, покрытой такими частицами.
Наноразмерные частицы оксида металла могут образовать нанопористый слой на поверхности биосовместимого компонента. Частицы могут располагаться на поверхности с высокой плотностью, образуя слой с присущей ему пористостью в диапазоне от 0,225*R для монослоев или от 0,732*R для мультислоев, соответственно, при этом R представляет собой радиус наночастиц. Мультислой, т.е. слой, содержащий несколько частиц в направлении, перпендикулярном поверхности, в котором находятся частицы, может иметь более высокую пористость из-за несоответствия в упаковке наночастиц, которые являются сферическими. Пористый характер слоев обуславливает более выраженную поверхность раздела по сравнению с поверхностью без наночастиц. Кроме того, наночастицы также обеспечивают большую площадь электрохимически активной поверхности, поскольку электролит может проникать в пористую структуру. Таким образом, структура из наночастиц, которая образует наружную поверхность компонента, является более реакционноспособной и может обладать различными электронными свойствами по сравнению с поверхностью без частиц или поверхностью с покрытием из частиц большего размера, чем частицы, применяемые в настоящем изобретении. Также было обнаружено, что электронные свойства оксидной пленки, покрывающей поверхность костного имплантата, оказывают сильное влияние на присоединение клеток и образование зародышей апатита, нежели небольшое изменение в рельефе, а также то, что менее изолирующая оксидная пленка может быть более предпочтительной для титановых имплантатов. Кроме того, слой частиц, применяемый в вариантах осуществления настоящего изобретения, может обладать настолько низкой пористостью, что он не позволяет бактериям проникать и/или накапливаться в этом слое.
Кроме того, полагают, что большое число энергетических состояний в запрещенной зоне, установленной для поверхности, содержащей наночастицы, может иметь большое значение для адсорбции редокс-активных белков, таких как фибриноген.
В вариантах осуществления настоящего изобретения частицы имеют распределение по размеру частиц, взятое как отношение полной ширины на половине максимума (FWHM), разделенной на среднее значение размера частиц, полученное с помощью сканирующего измерителя подвижности частиц с электрораспылением (ES-SMPS), до 45%, предпочтительно 40%, и еще более предпочтительно до 35%. Таким образом, например, для частиц со средним диаметром 10 нм индивидуальный размер частиц будет равным 10±4,5 нм, предпочтительно 10±4,0 нм, а еще более предпочтительно 10±3,5 нм. В результате узкого распределения частиц по размеру достигается гладкая структура поверхности частиц со складкой исходя из размеров отдельных частиц.
Обычно частицы имеют, как правило, сферическую форму.
В вариантах осуществления настоящего изобретения оксид металла является по меньшей мере частично кристаллическим. Указанный оксид металла обычно содержит диоксид титана. В предпочтительных вариантах осуществления преобладающей формой указанного диоксида титана является анатаз. Например, указанный оксид титана может состоять в основном из анатаза (по меньшей мере из 50% анатаза).
Однако можно применять и другие оксиды металлов, как правило, в сочетании с диоксидом титана. В вариантах осуществления настоящего изобретения частицы могут включать i) частицы, состоящие фактически из диоксида титана, а также необязательно ii) частицы, состоящие фактически из одного или нескольких оксидов циркония, гафния, ванадия, ниобия, тантала, кобальта и иридия, при этом оксиды циркония и/или иридия, являются особенно предпочтительными. В результате смешивания частиц титана с частицами одного или нескольких вышеуказанных оксидов можно достичь различных свойств полученного слоя, например, относительно цвета, прочности и/или электронных свойств. Например, для повышения электронных свойств слоя можно использовать частицы оксида иридия в сочетании с частицами диоксида титана.
В вариантах осуществления настоящего изобретения частицы оксида металла образуют слой по меньшей мере на части поверхности биосовместимого компонента. Таким образом, поскольку поверхность биосовместимого компонента предназначена для контакта с живой тканью, то частицы предназначены для контакта с живой тканью, в частности, с костью.
В вариантах осуществления настоящего изобретения указанный слой, образованный указанными частицами, может иметь толщину в диапазоне от 8 нм до приблизительно 1 мкм, обычно от 50 до 500 нм, например, от 100 нм до 400 нм. Тонкие слои являются предпочтительными из-за лучшей адгезии к поверхности подложки. К тому же, в случае спеченного слоя (см. ниже) частиц, такие тонкие слои могут обладать более высокой прочностью, нежели более толстые слои. Указанный слой может представлять собой монослой указанных частиц. Таким образом, нижний предел толщины слоя приблизительно такой же, что и размер частиц. Тонкий слой наноразмерных частиц снижает шероховатость поверхности на субмикронном уровне, преимущественно сохраняя при этом шероховатость поверхности (уровень обдувки). Это имеет большое значение для длительной остеоинтеграции имплантата.
Данный слой может представлять собой сплошной слой указанных частиц, причем этот слой может покрывать по меньшей мере часть указанной поверхности. Под сплошным слоем понимается связанный слой, образующий единую область. В отличие от сплошного слоя прерывистый слой образуется из нескольких отдельных участков слоя. В вариантах осуществления настоящего изобретения частицы могут образовывать слой, который полностью покрывает поверхность биосовместимого компонента.
В вариантах осуществления настоящего изобретения частицы равномерно распределены по всему указанному слою.
В вариантах осуществления настоящего изобретения частицы могут спекать. Тщательное спекание слоя наноразмерных частиц может повышать прикрепление частиц к подложке. Спекание частиц может привести к образованию керамического или керамоподобного слоя. Тем не менее, частицы могут также быть неспеченными.
В вариантах осуществления настоящего изобретения указанная поверхность имеет относительную площадь активной поверхности Aaa (площадь электрохимически активной поверхности) по меньшей мере 1,5, предпочтительно по меньшей мере 1,8, по сравнению с соответствующим биосовместимым компонентом, в котором отсутствуют частицы, и который имеет поверхность, покрытую природным оксидом металла. Увеличение активной площади поверхности приводит к образованию более реакционноспособной поверхности, и вследствие этого она может адсорбировать ионы в большей степени и/или увеличить скорость осаждения апатита.
В вариантах осуществления настоящего изобретения слой указанных частиц может иметь среднюю толщину поверхности (Sa) в диапазоне от 5 нм до 70 нм, например от 5 до 15 нм.
В вариантах осуществления настоящего изобретения биосовместимый компонент содержит подложку с указанной поверхностью, при этом подложка содержит материал на основе металла. Обычно подложка содержит металлический каркас, выполненный из указанного материала на основе металла. Материал на основе металла могут выбирать из титана, циркония, гафния, ванадия, ниобия, тантала, кобальта и иридия, а также их сплавов. Поверхность подложки, которая контактирует с указанными частицами, может содержать оксид титана, в частности, в вариантах осуществления, где подложка содержит титан или выполнена из титана. В таких вариантах осуществления оксид титана может представлять собой природный оксид титана, который естественно и мгновенно образуется на поверхности титана при контакте с кислородом, например, на воздухе. В вариантах осуществления, в которых подложка содержит или выполнена из другого вышеуказанного материала на основе металла, ее поверхность, которая контактирует с указанными частицами, обычно содержит природный оксид соответствующего металла, указанного выше.
В других вариантах осуществления изобретения подложка может содержать неметаллический материал, такой как биосовместимый керамический материал, например диоксид циркония, или биосовместимый полимерный материал. Подходящие материалы известны специалистам в данной области. В таких вариантах осуществления подложку можно выполнить из керамической композиции или композиции полимерного материала.
Биосовместимый компонент в соответствии с настоящим изобретением, как правило, предназначен для имплантации в живую ткань, в частности, в костную ткань. В качестве альтернативы, компонент может предназначаться для имплантации в мягкую ткань. Например, биосовместимый компонент может представлять собой зубной имплантат или его часть, такую как зубной винтообразный имплантат. С другой стороны, биосовместимый компонент может представлять собой ортопедический имплантат или его часть.
Преимущественно в соответствии с вариантами осуществления настоящего изобретения биосовместимый компонент может индуцировать образование зародышей кристаллов гидроксиапатита в течение 12 часов при погружении в жидкость, имитирующую жидкость организма.
В другом аспекте настоящее изобретение предлагает способ получения биосовместимого компонента, включающий:
a) обеспечение подложки, имеющей поверхность;
b) обеспечение дисперсии частиц оксида металла, частицы которого имеют средний размер частиц менее 100 нм, частицы которого диспергированы в растворителе; и
c) нанесение указанной дисперсии частиц на поверхность указанной подложки.
При дисперсии на этапе b) частицы могут полностью диспергироваться. В таких вариантах осуществления на этапе c) каждую частицу в составе дисперсии наносят на поверхность по отдельности. Однако сразу после нанесения на поверхность подложки частицы плотно упаковываются вместе, образуя плотно упакованную структуру.
Как правило, указанные частицы имеют средний размер частиц менее 25 нм.
Растворитель может представлять собой водный растворитель, обычно деионизированную воду.
В вариантах осуществления настоящего изобретения указанную дисперсию частиц оксида металла можно получить путем:
b-i) осуществления контролируемого гидролиза TiCl4 в воде с получением коллоидной дисперсии и
b-ii) осуществления диализа указанной коллоидной дисперсии.
Этап b-i) обычно осуществляют путем медленного добавления TiCl4, предпочтительно по каплям, в деионизированную воду. Температура соединения TiCl4 может быть ниже 0°C, обычно ниже -10°C, а температура указанной воды может находиться в диапазоне от 0°C до 5°C, предпочтительно 0°C при перемешивании.
Дисперсию можно наносить на подложку любым подходящим способом, включая нанесение покрытия центрифугированием, нанесение покрытия распылением, окунанием, погружением, нанесение покрытия золь-гель способом, электрофоретическим осаждением и т.д.
В вариантах осуществления настоящего изобретения данный способ дополнительно включает испарение указанного растворителя после нанесения указанной дисперсии.
Необязательно способ может дополнительно включать этап спекания указанных частиц. В вариантах осуществления настоящего изобретения также можно использовать процедуру, состоящую из двух этапов, при которой наносят и спекают первый слой указанных частиц с последующим нанесением дополнительных частиц оксида металла, как описано в данном документе, которые не спекают. Таким образом, можно получить преимущества как спеченных, так и неспеченных частиц.
Как правило, подложка может содержать металл, выбранный из титана, циркония, гафния, ванадия, ниобия, тантала, кобальта и иридия, а также их сплавов, но предпочтительно содержит титан или его сплав. Поверхность подложки может содержать природный оксид металла, такой как природный оксид титана в случае титановой подложки.
В вариантах осуществления настоящего изобретения поверхность подложки может подвергаться обработке для придания ей шероховатости перед этапом c). Примеры обработки для придания шероховатости включают абразивную обдувку и химическое травление. Кроме того, подложку можно обточить или подвергнуть обработке для устранения шероховатости, например полировке.
Следует отметить, что настоящее изобретение относится ко всем возможным комбинациям характеристик, перечисленных в формуле изобретения.
Краткое описание графических материалов
На фиг.1 показана дифракция рентгеновских лучей наночастиц TiO2 в соответствии с вариантами осуществления настоящего изобретения.
На фиг.2a-c показаны изображения SEM с высоким разрешением поверхностей, содержащих частицы TiO2 диаметром 8 нм (фиг.2а) и 22 нм (фиг.2b, c), коммерческие частицы TiO2 (фиг.2d) и травленой дважды поверхности без частиц (фиг.2е).
На фиг.3 показаны вольтамперограммы, полученные в результате циклической вольтамперометрии, выполненной на поверхностях, содержащих наноразмерные частицы TiO2, и контрольной поверхности (TS).
На фиг.4 показаны кривые Мотта-Шоттки для различных поверхностей на основе титана (Ti), исследуемых в данном документе.
На фиг.5 показаны кривые Мотта-Шоттки для поверхности на основе золота, содержащей наноразмерные частицы TiO2.
На фиг.6 показана плотность состояний (DOS) поверхностей, содержащих наноразмерные частицы TiO2, и контрольной поверхности как функции от потенциала в отношении потенциала плоских зон.
Фиг.7 представляет собой график, на котором показана площадь покрытия на основе апатита на пяти различных поверхностях через 12 часов, 72 часа и 1 неделю, соответственно, после погружения в жидкость, имитирующую жидкость организма.
На фиг.8a-d показаны изображения SEM с высоким разрешением поверхностей на основе титана, содержащих частицы TiO2 диаметром 8 нм (фиг.8а), 22 нм (фиг.8b), коммерческие частицы TiO2 (фиг.2с) и контрольной поверхности без частиц (фиг.8d), через 12 часов после погружения в жидкость, имитирующую жидкость организма. На фиг.8е-h показаны спектры EDX и зафиксированная атомная концентрация отобранных элементов поверхностей фиг.8a-d.
Фиг.9а-с представляет собой изображения SEM, на которых показана поверхность на основе титана, содержащая частицы TiO2 диаметром 22 нм, через 12 ч (фиг.9а), 72 ч (фиг.9b) и 1 неделю (фиг.9с) после погружения в жидкость, имитирующую жидкость организма.
Фиг.10a-b представляет собой изображения SEM, на которых показаны поверхности на основе титана, покрытые наночастицами в соответствии с вариантами осуществления настоящего изобретения.
Фиг.11a-b представляет собой AFM изображения поверхностей, покрытых наночастицами, в соответствии с вариантами осуществления настоящего изобретения.
Фиг.12 представляет собой изображение FEG-SEM при увеличении в 250000 раз винтообразного имплантата на основе титана, покрытого наночастицами в соответствии с вариантами осуществления настоящего изобретения.
Фиг.13 представляет собой изображение FEG-SEM при увеличении в 100000 раз винтообразного имплантата из титана, покрытого наночастицами в соответствии с вариантами осуществления настоящего изобретения, после установки в малоберцовую кость и удаления из нее.
Фиг.14 представляет собой график, на котором показан уровень экспрессии гена cbfa, обнаруженного в остеобластах, выращенных на поверхностях в соответствии с вариантами осуществления настоящего изобретения.
Фиг.15 представляет собой график, на котором показан уровень экспрессии гена ВМР-2, обнаруженного в остеобластах, выращенных на поверхностях в соответствии с вариантами осуществления настоящего изобретения.
Фиг.16 представляет собой график, на котором показан уровень IL-6, секретируемого остеобластами, выращенными на поверхностях в соответствии с вариантами осуществления настоящего изобретения.
Подробное описание изобретения
Пример 1: получение и характеристика поверхностей, содержащих частицы
1.1 Получение и характеристика образца
1.1.1 Получение образца
Наночастицы диоксида титана (TiO2) синтезировали путем контролируемого гидролиза TiCl4 с получением чистых поверхностей частиц. Частицы TiO2 различных размеров получили путем синтеза при температуре 0°C, при этом диализ и хранение коллоидных дисперсий осуществляли при температуре 0°C для частиц диаметром 8 нм и 20°C для частиц диаметром 22 нм.
При обычном синтезе TiCl4 (99%) охлаждали при температуре -16°C и 5,2±0,05 мл этого раствора добавляли по каплям к 200 мл деионизированной (Milli-Q) воды при интенсивном перемешивании. В основном синтез осуществляли с применением объемного соотношения TiCl4:H2O 1:40 с получением концентрации TiO2 18 г/л. Частицы TiO2 различных размеров получают путем регулирования температуры реакции, времени/температуры диализа и времени/температуры хранения. Этап диализа важен для предотвращения агломерации, а полученные суспензии состоят, в основном, из отдельных наночастиц. Подробную информацию о синтезе можно найти в Z. Abbas, J. Perez Holmberg, A.-K. Hellström, M. Hagström, J. Bergenholtz, M. Hassellöv and E. Ahlberg, Colloids Surf. A: Physicochem. Eng. Aspects, 2011, doi: 10.1016/j.colsurfa.2011.03.064. Синтез приводит к дисперсии, при которой частицы являются практически монодисперсными (Perez Holmberg, Z. Abbas, E. Ahlberg, M. Hassellöv and J. Bergenholtz, J. Phys. Chem. C, 2011, принята к публикации).
Коммерческие частицы TiO2 (Degussa P25) с индивидуальным размером частиц в диапазоне 30-80 нм и отношением анатаза к рутилу 4:1 тщательно промыли с удалением поверхностных органических соединений и поместили в ультразвуковую баню для получения дисперсного раствора. Однако динамическое рассеяние света показало наличие более крупных агрегатов, и было невозможно полностью диспергировать систему. Частицы наносили в несколько этапов путем центрифугирования на диски из Ti (диски 4 класса с обточенной поверхностью, диаметром 1,1 см) или Au (отполированные с помощью бумаги SiC (4000), диаметр 0,6 см). После нанесения центрифугированием образцы промыли деионизированной водой и оставили высыхать перед применением. В качестве дополнения к поверхностям, содержащим наночастицы, в настоящее исследование включили наноструктурную поверхность TS+AT1 (обточенную поверхность, последовательно обработанную щавелевой кислотой и плавиковой кислотой).
1.1.2 Определение распределения частиц по размерам
Распределение по размерам синтезированных наночастиц TiO2 можно получить способом, при котором применяют сканирующий анализатор подвижности частиц с электрораспылением (ES-SMPS) и который описан в Z. Abbas, J. Perez Holmberg, A.-K. Hellström, M. Hagström, J. Bergenholtz, M. Hassellöv and E. Ahlberg, Colloids Surf. A: Physicochem. Eng. Aspects, 2011, doi: 10.1016/j.colsurfa.2011.03.064.
1.1.3 Рельеф поверхности
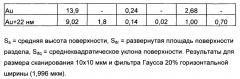
Изображения SEM с высоким разрешением получали с помощью Leo Ultra 55 FEG SEM, работающего при 1 кВ. Анализ шероховатости поверхности проводили с помощью атомно-силовой микроскопии (АРМ) (Nanoscope® Multimode IIIa, Digital Instruments). Измерения с помощью AFM в полуконтактном режиме осуществляли в трех точках для каждого образца и с тремя различными размерами сканирования, 10×10, 5×5 и 3×3 мкм (частота сканирования 0,8 Гц, 512 линий). Результаты AFM импортировали в программу MeX® 19 (Alicona Imaging GmbH), в которой проводили анализ шероховатости и вычисляли параметры шероховатости 3D поверхности. С помощью различных размеров сканирования и различных размеров фильтра Гаусса в программе MeX® получали информацию об особенностях рельефа в диапазоне от 10 мкм до 150 нм.
1.1.4 Анализ поверхностей
Для определения кристаллических фаз использовали порошковый дифрактометр Siemens D5000, в котором применяется излучение CuKα (λ=1,54056 Å). Дифракцию рентгеновского излучения измеряли при различных углах падения для того, чтобы получить информацию о различной толщине образцов. Для анализа XPS использовали квантовый сканирующий микроскоп 2000 ESCA (Physical Electronics, США) с применением источника рентгеновских лучей монохроматического AlKα.
1.1.5 Электрохимические измерения
Циклическую вольтамперометрию и измерения импеданса осуществляли с помощью потенциостата/гальваностата/ZRA Gamry Reference 600™. Электрохимические измерения проводили в специально сконструированных трех электродных ячейках, применяемых для стационарных условий. Образец помещали на дно элемента с обточенной поверхностью в сторону электролита. Большой противоэлектрод из Pt размещали концентрически вокруг образца для обеспечения оптимального распределения тока, а контрольный электрод помещали в центр элемента. Данная конфигурация ячейки применима для всех типов плоских образцов и демонстрирует хорошие технические характеристики при измерении импеданса. Все потенциалы сравнивали с контрольным электродом из Ag/AgCl (насыщ. KCl, Е=0,197 В по сравнению с she). Измерения электрохимического импеданса (EIS) проводили в деаэрированной 0,5 М H2SO4 и при проведении измерений импеданса поддерживали продувку газообразным N2 под низким давлением. Спектры импеданса записывали при постоянном потенциале в диапазоне частот от 1 кГц до 10 МГц, с 9 точек/декада и амплитудой 10 мВ rms. Потенциал усиливали на 50 мВ от +1 до -0,5 В со временем ожидания 300 с перед записью следующего спектра. Циклическую вольтамперометрию получали в 0,1 М KOH с частотой сканирования 50 мВс-1.
1.2. Результаты характеристики поверхностей
1.2.1 Распределение частиц по размерам
Распределения частиц по размерам, полученные через 1 и 3 недели хранения для дисперсий, которые хранили при температуре 0°C и при комнатной температуре, очень похожи. Предыдущие анализы (Z. Abbas, et al., Colloids Surf. A: Physicochem. Eng. Aspects, 2011, doi:10.1016/j.colsurfa.2011.03.064) показали, что можно получить коллоидные наночастицы TiO2 с узким распределением по размерам. Распределение измеряли как отношение полной ширины на половине максимума (FWHM), разделенное на среднее значение размера, и определили равным 35-40%.
1.2.2 XRD и XPS
На фигуре 1 показана дифракция рентгеновских лучей наночастиц в порошкообразной форме, полученной из суспензий, содержащих частицы диаметром 8 или 22 нм. Частицы сушили при 120°C в течение 16 часов до выполнения анализа. Основная фаза анатаз, но с небольшой долей брукита, как показало отражение при 2θ=30,8°. Широкие пики дифракции указывают на то, что частицы состоят из меньших кристаллитов (~4 нм) и исследования динамики роста показали, что частицы образуются путем медленной агрегации первоначально выпавших в осадок частиц данного размера. На вкладыше к фигуре 1 показана картина дифракции для частиц, прикрепленных к титану. Так как слой наночастиц тонкий, то сигнал очень слабый, но можно наблюдать основной пик анатаза. Это говорит о том, что фаза частиц сохраняется после осаждения и сушки. Частицы Р25, прикрепленные к титану, демонстрируют типичную картину дифракции при отношении анатаза к рутилу ~4/1. Для модификации TS+AT1 пики дифракции от оксида не наблюдаются, что указывает на то, что осажденный слой является аморфным или слишком тонким для обнаружения.
Анализ XPS, выполненный для слоев наночастиц, показывает чистый TiO2 со следами хлорида. Никакого сигнала для металла Ti не наблюдалось, что указывает на то, что пленки полностью покрывают поверхность. Ионы титана с меньшей валентностью не наблюдались. Сигнал углерода одинаковый для всех образцов и зависит от загрязнения поверхности.
1.2.3 Результаты рельефа поверхности
На фигуре 2 показаны изображения SEM с высоким разрешением поверхностей, содержащих частицы TiO2 диаметром 8 нм (TS+8 нм, фиг.2а) или 22 нм (TS+22 нм, фиг.2b; Au+22 нм, фиг.2с), соответственно. Все три поверхности выглядят довольно гладкими. По изображениям SEM данных поверхностей создается впечатление, что подложка полностью покрыта. Для двух других модификаций, используемых в настоящей работе, это не так. Суспензия Р25 содержала агломераты частиц и их переносили на поверхность Ti в ходе выполнения процедуры нанесения центрифугированием. В результате получали поверхность с высокой шероховатостью, но посередине видна обточенная поверхность, фигура 2d. Для поверхности TS+АТ1, последовательно протравленной в щавелевой кислотой и плавиковой кислотой, образовывались довольно крупные, выпадающие в осадок частицы с очень тонким слоем оксида между ними. В отличие от сферических наночастиц, выпавшие в осадок частицы на поверхности TS+AT1 можно рассматривать как стержни с высотой 0,45 мкм (определено из среднего значения максимальной высоты 5 пиков и впадин, S10z), см. фиг.2е.
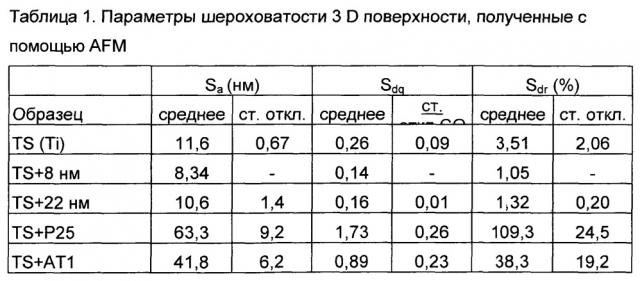
Анализ рельефа поверхностей осуществляли путем анализа AFM с помощью перекрывающихся размеров сканирования и различных размеров фильтра Гаусса с получением информации об особенностях поверхности в диапазоне от 10 до 0,150 мкм. Параметры шероховатости 3D поверхности вычисляли с помощью программного обеспечения MeX® и значения для трех различных параметров приведены в таблице 1.
Значение Sa (средняя высота) значительно больше для поверхностей TS+P25 и TS+AT1, чем для поверхностей, содержащих наночастицы, и обточенной поверхности. Оба эти способа обработки поверхности индуцировали появление дополнительных поверхностных структур на верхней части обточенной поверхности, не покрывая ее полностью, фигура 2d-e. Слои частиц диаметром 8 и 22 нм, соответственно, полностью покрывали частицами обточенную поверхность, что, в свою очередь, вызвало снижение шероховатости поверхности непосредственно после покрытия обтачиваемых канавок, см. фиг.2а-b и таблицу 1. Та же тенденция наблюдается и для подложки из золота (фиг.2с), где значение Sa уменьшается после нанесения слоя частиц диаметром 22 нм. Существует лишь небольшая разница между значениями Sa для поверхностей TS+8 нм и TS+22 нм, но нижнее значение, полученное для более мелких частиц, означает, что кривизна частиц отражается на шероховатости поверхности. Было показано, что среднеквадратическое значение уклона (Sdq) соотносится с прочностью на срез поверхности раздела и, таким образом, является важным параметром для изучения областей применения зубных имплантатов. С биомеханической точки зрения может потребоваться большое значение Sdq. Тенденция в случае значений Sdr (развернутая площадь поверхности раздела) соответствует той же тенденции, что и значения Sa и Sdq с наименьшими значениями, полученными для поверхностей, содержащих наночастицы.
1.3. Электрохимическая характеристика
1.3.1 Циклическая вольтамперометрия (CV)
На фигуре 3 приведены примеры вольтамперограмм для иллюстрации влияния диапазона сканирования и числа сканирований для одного типа электродов (фигура 3а), частиц различных размеров (фигура 3b), частично покрытых электродов (фигура 3c) и различных подложек (фигура 3d). Общие особенности вольтамперограмм, полученные с Ti в качестве подложки, аналогичны таким в случае с симметричным процессом при наиболее отрицательных потенциалах и пиком при менее отрицательных потенциалах. Процесс, наблюдаемый при наиболее отрицательных потенциалах, отнесли к накоплению заряда в зоне проводимости, реакция (1), или заполнению ловушек чуть ниже зоны проводимости, реакция (2). В обоих случаях происходила адсорбция протонов с получением баланса зарядов в растворе кислоты.
В щелочных растворах катион электролита, вероятно, представляет собой частицу, уравновешивающую заряд, т.е. в данном случае адсорбцию K+. Пик при менее отрицательных потенциалах был объяснен заполнением состояний поверхности ниже зоны проводимости, т.е. восстановлением Ti(IV) до Ti(III) в соответствии с (2). Для реакции (2) образование TiO(OH) также возможно в щелочном растворе. С другой стороны, пик при менее отрицательных потенциалах объясняется состояниями ловушек на границах зерен на пленке. Как правило, ток при наиболее отрицательных потенциалах возрастает экспоненциально и в конечном итоге в результате восстановления воды происходит выделение водорода. Для электродов, покрытых наночастицами, наблюдается симметрия между катодным и анодным зарядом, TS+8 нм и TS+22 нм, которая указывает на то, что фарадеевские процессы не вовлечены, если потенциал ограничен -1,8 В. Поляризация к более отрицательным потенциалам приводит к дополнительному усилению тока вследствие выделения водорода (не показано). В отличие от других исследований электродов, покрытых наночастицами, ток проходит через максимум на убывающем сканировании, до начала выделения водорода. Причина этого не известна, но это может быть связано с полным заполнением энергетических уровней чуть ниже зоны проводимости. Наличие пика при менее отрицательных потенциалах объяснили заполнением состояний поверхности или состояний ловушки на границах зерен на пленке, как уже упоминалось выше. В настоящем исследовании пленки не спекали, а количество границ зерен должно быть низким, и поэтому, скорее всего, из-за состояний поверхности появляется пик. Предельное значение положительного потенциала составило 0 В, но этого было не достаточно для полного освобождения поверхностных зон, заполняемых при убывающем сканировании. Это видно по гораздо меньшему пику, наблюдаемом