Способ очистки рекомбинантного белка, содержащего в своем составе последовательности миелопептидов
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине, а именно к способу выделения рекомбинантного белка, содержащего в своем составе последовательности миелопептидов и представленного последовательностью SEQ ID NO:1. Плазмидной ДНК pET-32a/REC-MP, несущей ген, представленный последовательностью SEQ ID NO:2, трансформируют компетентные бактериальные клетки штамма Escherichia coli BL21(DE3) для получения растворимой фракции слитого белка тиоредоксин/REC-MP. Далее на металл-аффинном сорбенте с применением носителя Ni-Sepharose осуществляют очистку слитого белка. Затем слитый белок гидролизуют ферментом энтерокиназой-F, инкубируя 1 час при 37°С. Осуществляют денатурацию примесей при нагревании до 74°С в течение 60 мин. Осуществляют FPLC очистку целевого рекомбинантного белка на ионообменном сорбенте с носителем SP-Sepharose и обратнофазовую HPLC очистку на колонке Kromasil 100С18. Изобретение позволяет повысить экспрессию целевого белка до 60-80% от общего объема клеточного лизата, а также повысить эффективность очистки белка, приводящей к однородности и практически к 100% хроматографической чистоте получаемого продукта. 10 ил., 3 табл., 6 пр.
Реферат
Изобретение относится к медицине, а именно, к способу очистки рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, для получения лекарственного средства для лечения вторичных иммунодефицитов.
Белки стали коммерчески важными в качестве лекарственных средств.
Современным и перспективным методом получения пептидов является использование генно-инженерных конструкций. Обычно, белки продуцируют в культурах клеток с использованием либо линий клеток млекопитающих, либо бактериальных клеточных линий, модифицированных методами генной инженерии для продукции целевого белка в результате введения рекомбинатной плазмиды, содержащей ген этого белка. Поскольку используемые клеточные линии представляют собой живые организмы, они должны получать питание из комплексной ростовой среды, содержащей сахара, аминокислоты и ростовые факторы, обычно с добавленными препаратами животной сыворотки. Выделение целевого белка из смеси соединений, достаточной для его использования в качестве терапевтического средства для применения у человека, представляет огромную проблему.
Поэтому одной из важнейших задач является развитие экономичных и эффективных способов для очистки белков в коммерческом масштабе.
Ближайшим аналоги изобретения является способ получения рекомбинантного белка, обладающего биологической активностью пептидов, входящих в состав миелопида (РФ патент №2601126, 27.10.2016 г.). Данный способ включает трансфекцию клеток Escherichia coli BL21 (DE3) плазмидной ДНК рЕТ30а, несущей ген, кодирующий рекомбинантный белок, культивирование полученного штамма с индукцией экспрессии белка добавлением IPTG, лизирование, включающее обработку клеток ультразвуковым дезинтегратором с получением супернатанта. Данный способ также включает очистку супернатанта на Q-Sepharose и SP-Sepharose, объединение фракций, содержащих целевой продукт. Высокая биологическая активность и низкая стоимость полученного препарата позволяют использовать препарат для лечения вторичных иммунодефицитов. Недостатком данного способа получения является низкая экспрессия рекомбинантного белка.
Целью изобретения является получение высокоочищенного рекомбинантного белка REC-MP, обладающего биологической активностью пептидов, входящих в состав миелопида, представленного последовательностью SEQ ID NO 1, с повышенным выходом целевого продукта.
Способ выделения целевого рекомбинантного белка, обладающего биологической активностью пептидов, входящих в состав миелопида, представленного последовательностью SEQ ID NO 1, включает следующие этапы:
1. Плазмидной ДНК pET-32a/REC-MP несущей ген, представленный последовательностью SEQ ID NO 2, трансформируют компетентные бактериальные клетки штамма Escherichia coli BL21(DE3) для получения растворимой фракции белка. Штамм BL21(DE3) (Invitrogen) предназначен для экспрессии рекомбинантных белков. Обозначение DE3 означает, что штамм содержит лизоген фага λ DE3, который несет ген для Т7 РНК-полимеразы под контролем lacUV5-промотора. Для индукции экспрессии Т7 РНК-полимеразы необходим IPTG (изопропил_β-D-1-тиогалактопиранозид). Штамм Escherichia coli BL21(DE3)/pET-32a/ REC-MP обеспечивает получение слитого белка тиоредоксин/REC-MP.
2. Хроматографическую очистку на металло-аффинном сорбенте с применением носителя Ni-Sepharose, с последующим гидролизом слитого белка тиоредоксин/ REC-MP ферментом энтерокиназой-F, инкубируя 1 час при 37°С и денатурацией примесей при нагревании до 74°С в течение 60 мин, FPLC очистку на ионообменном сорбенте с носителем SP-Sepharose, обратнофазовую HPLC очистку целевого рекомбинантного белка на колонке Kromasil 100С18.
Техническим результатом заявленного изобретения является повышении экспрессии белка REC-MP (повышение выхода целевого продукта), представленного последовательностью SEQ ID NO 1, а также повышение эффективности очистки белка, приводящей к однородности и практически к 100% хроматографической чистоте получаемого продукта, путем:
- Получения конструкции рЕТ-32а, несущей ген, кодирующий REC-MP, для экспрессии в клетках E.coli в виде слитого белка с белком-стабилизатором тиоредоксином;
- Одностадийной хроматографической очистки рекомбинантного белка из лизата клеток на металло-аффинном сорбенте;
- Подобранных условий гидролиза рекомбинантного белка ферментом энтерокиназой-F в течении одного часа при 37°С и денатурации нагревом примесей при 74°С в течении 60 мин, позволяющих значительно обогатить целевой продукт;
- Одноэтапной FPLC очистки рекомбинантного белка на ионообменном FPLC сорбенте;
- Обратнофазовой HPLC хроматографической очисткой рекомбинантного белка с колонки Kromasil 100С18.
Краткое описание чертежей.
Фиг. 1. Электрофорез лизата клеток, экспрессирующих рекомбинантный белок, содержащий в своем составе последовательности миелопептидов без белка стабилизатора (тиоредоксина).
Фиг. 2. Электрофорез лизата клеток, экспрессировавших рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, соединенный с белком-стабилизатором (тиоредоксином).
Фиг. 3. Хроматографический профиль элюции с Ni-Sepharose рекомбинантного белка. Фиг. 4. Электрофорез фракций, содержащих рекомбинантный белок после хроматографии на Ni-Sepharose.
Фиг. 5. Гидролиз белка предшественника, соединенного с белком стабилизатором (MW 19630 Da) ферментом энтерокиназой-F на рекомбинантный белок MP (MW 8323 Da) и белок-стабилизатор (тиоредоксин).
Фиг. 6. Электрофорез гидролизной смеси рекомбинантного белка и энтерокиназы в различные промежутки времени.
Фиг. 7. Электрофорез гидролизной смеси после нагрева. Целевой продукт - рекомбинантный белок, остается в растворе.
Фиг. 8. Хроматографический профиль элюции рекомбинантного белка с колонки HiPrep16/10 Q FF.
Фиг. 9. HPLC хроматографический профиль элюции рекомбинантного белка с колонки Kromasil 100С18.
Фиг. 10. Хроматограмма очищенного рекомбинантного белка на Kromasil 300-5С18
Подробное описание изобретения.
Пример 1
Экспрессия рекомбинантного белка на основе пептидов, входящих в состав миелопида.
Для выделения рекомбинантного белка, представленного последовательностью SEQ ID NO 1, была создана генетическая конструкция по стандартной методике (Maniatis Т., Fritsch E.F., 1982.) на основе коммерческой плазмиды рЕТ32а, которая содержит ген, кодирующий данный рекомбинантный белок, представленный последовательностью SEQ ID NO 2.
Последовательность ДНК (SEQ ID NO: 2), кодирующая рекомбинантный белок (SEQ ID NO: 1), синтезируют с помощью полимеразной цепной реакции (ПЦР).
Плазмидой трансфицировались клетки E.coli штамма BL21(DE3). После трансфекции клетки пересевали в культуральную колбу с бульоном LB и канамицином 25 мкг/мл. Культура выращивалась на шейкере при 280 об/мин при температуре 37°С до достижения оптической плотности значения OD585=0,8E. Индукция экспрессии белка проводилась добавлением IPTG до концентрации 1 mМ. Культура дополнительно культивировалась 4 часа, далее клетки осаждались центрифугированием при 5000g. Осадок клеток лизировали в 8 М мочевине и обрабатывали на ультразвуковом дезинтеграторе. Лизат клеток центрифугировали при 20000g 2 часа.
Экспрессия белка REC-MP30, полученного с использованием плазмиды рЕT30 (способ-прототип), была на низком уровне - 10-15% от общего объема клеточного лизата (фиг. 1). Стрелкой отмечено положение рекомбинантного белка, содержащего в своем составе последовательности миелопептидов в полиакриламидном геле.
Экспрессия полученного белка REC-MP32 при использовании плазмиды рЕT32 была на значительно более высоком уровне, а именно 60-80% от общего объема клеточного лизата, в зависимости от условий культивирования продуцента E.coli BL21 DE3 (фиг. 2).
Трек 1 - стандарты молекулярных весов;
трек 2 - лизат клеток;
Стрелкой отмечено положение рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором тиоредоксином, в полиакриламидном геле.
Таким образом, полученная конструкция рЕТ-32а, несущая ген, кодирующий REC-MP, для экспрессии в клетках E.coli в виде слитого белка с белком-стабилизатором тиоредоксином увеличивает уровень экспрессии и растворимость слитого белка. Тиоредоксин - низкомолекулярный шаперон, стабилизирующий всю рекомбинантную конструкцию посредством фолдинга и переводящий ее в растворимое состояние.
Схема рекомбинантного белка, соединенного с белком-стабилизатором:
Рекомбинантный белок - REC-MP
Ek - сайт расщепления ферментом энтерокиназой;
Белок-стабилизатор - тиоредоксин
6His - полигистидиновая последовательность;
В дальнейшем, самым сложным этапом получения целевого продукта является стадия ферментативного гидролиза слитого белка предшественника (MW 19630 Da) ферментом энтерокиназой-F. Белок предшественник гидролизуется на рекомбинантный белок MP (MW 8323 Da) и белок-стабилизатор (MW 11307 Da) (фиг. 5).
Пример 2
Хроматографическая очистка рекомбинантного белка REC-MP32, содержащего в своем составе последовательности миелопептидов, соединенных с белком - стабилизатором.
При выделении белка необходимо изучить режимы работы оборудования, условия градиента, состав и оптимальный объем растворителей, скорость потока, процесс сбора фракций.
Выделение белков лучше всего проводить методом ионообменной хроматографии. Методы позволяют выделять белки в мягких условиях, при этом емкость колонки позволяет сорбировать до 20 мг белка на 1 мл смолы, что удобно при масштабировании процесса. Выбор сорбента определяется значением изоэлектрической точки, PI для выделяемого белка (9,5), поэтому лучше всего его будет выделять на катионообменном сорбенте. Для стандартизации процесса и его воспроизводимости использовались колонки типа HiTrap. В работе использовалась хроматографическая колонка HiPrep16/10 SP FF, емкости которой хватило на весь объем выделяемого белка.
Хроматографическая очистка рекомбинантного белка, соединенного с белком-стабилизатором, проходит в один этап на металл-аффинном сорбенте. В качестве носителя использовалась Ni-Sepharose компании GE Helthcare. Для стандартизации процесса и его воспроизводимости использовались колонки типа HiTrap.Данные колонки преднабиты, но их можно собирать в каскад за счет последовательного соединения. В хроматографической очистке рекомбинантного белка, соединенного с белком-стабилизатором, использовался каскад из пяти колонок HisPrep FF 16/10 (17-5256-01, GE Helthcare).
Весь объем лизата клеток прогонялся через каскад колонок с Ni-Sepharose, предварительно уравновешенных 10 mM уксусной кислотой. За счет полигистидиновой последовательности рекомбинантный белок сорбируется на носителе колонки. Все иные компоненты клетки проходят через колонку. Наличие TRITON Х-100 в смеси позволило избежать неспецифической сорбции ряда белков за счет гидрофобных взаимодействий с миелопептидами. Это особенно важно, так как в миелопептидах содержится большое количество аминокислот типа триптофана и тирозина, имеющих тенденцию к образованию гидрофобных связей.
Целевой белок элюировали линейным градиентом кислоты:
Стартовый буфер: 10 mM уксусная кислота
Финальный буфер: 200 mM уксусная кислота.
Объем градиента 7500 мл. Элюат, поступающий с колонки фракционировали. Наличие белка во фракции определяли электрофорезом в ПААГ. Хроматографический профиль элюции с Ni-Sepharose рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором представлен на фиг. 3. Цифрами 1-5 отмечены фракции, отобранные для анализа. Электрофорез фракций, содержащих рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, соединенный с белком-стабилизатором после хроматографии на Ni-Sepharose представлен на фиг. 4.
Трек 1 - стандарты молекулярных весов;
Треки 2-6 - фракции №№1-5, содержащие целевой белок.
Стрелкой отмечено положение рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором в полиакриламидном геле.
Таким образом из клеточного лизата выделен и хроматографически очищен рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, соединенный с белком-стабилизатором Чистота рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором оценена электрофорезом в ПААГ.
Фракции, содержащий целевой белок на фоне небольшого количества примесей, объединяли и гидролизовали энтерокиназой.
Пример 3
Расщепление рекомбинантного белка, соединенного с белком-стабилизатором, специфической протеазой и выделение рекомбинантного белка.
Масштабирование ферментативного гидролиза всегда является одним из самых сложных процессов производства, так как не существует общих правил, каждый белок-субстрат индивидуален, открытость, доступность первичного сайта узнавания всегда различается для конкретных белков, тем более индивидуальны места неспецифического гидролиза, для каждой аминокислотной последовательности они свои. Наличие таких сайтов и определяет диапазон концентраций и времени реакции, когда основной мишенью фермента все еще служит первичный сайт. С уменьшением концентрации исходного субстрата автоматически повышаются концентрации вторичных и начинается гидролиз в конкурирующих точках. Были исследованы различные соотношения фермент-субстрат и время реакции.
Необходимо также было найти метод эффективного отделения продуктов реакции от фермента. Общеизвестные методы с использованием аффинной колонки с соевым ингибитором чрезвычайно затратные и были нами сразу исключены из рассмотрения. В итоге исследований нами впервые для интерферонов использовалась денатурация нагревом. Были подобраны такие условия нагрева, при которых примеси в виде энтерокиназы, а также некоторых бактериальных белков денатурировали и выпадали в осадок. Целевой продукт - рекомбинантный белок оставался в растворе.
Методика синтеза рекомбинантного белка включает в себя экспрессию промежуточного продукта, содержащего белок-стабилизатор и последующий гидролиз ферментом энтерокиназой, позволяющей получить целевой продукт. Конструкция плазмиды позволяет получить эффективный штамм-продуцент белка, уровень экспрессии оптимален. Избежать получения промежуточного продукта так же не представляется возможным, так как целевой белок имеет молекулярный вес ниже 10 кД. Хорошо известно, что такие короткие белки не экспрессируются в клетках E.coli в значимых количествах.
В дальнейшем, самым сложным этапом получения целевого продукта является стадия ферментативного гидролиза белка предшественника (MW 19630 Da) ферментом энтерокиназой-F. Белок предшественник гидролизуется на рекомбинантный белок MP (MW 8323 Da) и белок-стабилизатор (низкомолекулярный шаперон, стабилизирующий всю рекомбинантную конструкцию посредством фолдинга и переводящий ее в растворимое состояние, MW 11307 Da) (фиг. 5).
Используется чрезвычайно специфичный, но дорогой фермент-энтерокиназа. Задачей данного изобретения, в том числе, было усовершенствовать методику гидролиза белка-предшественника.
В разработанной нами ране методике гидролиза были подобраны концентрация фермента и белка-предшественника таким образом, чтобы реакция заканчивалась за 60 минут. Было решено исследовать возможность уменьшения соотношения фермент - белок путем подбора типа фермента и условий гидролиза. Известно, что энтеропептидаза из разных источников обладает различной скоростью гидролиза своего субстрата (оборотистость фермента). Обратной стороной увеличения скорости является уменьшение специфичности гидролиза. Разрабатываемый продукт особенно чувствителен к этому параметру, так как содержит два сайта узнавания пептидаз - тромбина и урокиназы. Эти ферменты, как и энтеропептидаза, относятся к сериновым протеазам и имеют перекрывание в атаке своих сайтов. В работе были взяты различные типы энтеропептидаз от различных поставщиков и подобраны условия гидролиза с установлением минимально возможного соотношения фермент - белок.
Первым этапом было определение специфичности исследуемых ферментов. Кинетические параметры нескольких энтеропептидаз были исследованы на модельном специфическом субстрате (смесь 5,5-дитиобис-2-нитробензойная кислоты, DTNB, тиобензил-бензоилокси-карбонил-L-лизин, Z-Lys-SBzl) и ряда неспецифических субстратов при комнатной температуре. Реакцию инициировали добавлением разной концентрации фермента и измеряли поглощение при 412 нм.
Как видно из таблицы 1, скоростные характеристики и специфичность различных ферментов отличаются на порядок.
На втором этапе выбранный фермент был изучен на оптимизацию условий гидролиза субстрата. В таблице 2 суммированы данные по зависимости активности фермента от параметров реакции.
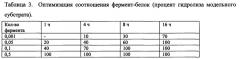
Таким образом, осталось оптимизировать соотношение фермент - белок. Разведенный фермент инкубировали с 20 мкг рекомбинантного белка, содержащего последовательности миелопептидов и соединенного с белком-стабилизатором в течении различного времени время реакции. Степень реакции оценивали по результатам ПААГ электрофореза. Условия реакции 0,15М NaCl, 0,05 М KCl, 10 mM CaCl2, Tris-HCl рН 7,5. В таблице 3 представлены данные оптимизации соотношения фермент-белок (процент гидролиза модельного субстрата).
Из таблицы 3 видно, что необходимо использовать только 0,05 ед. фермента энтерокиназы-F для гидролиза 20 мкг рекомбинантного белка, содержащего последовательности миелопептидов. Таким образом, усовершенствование методики синтеза белка позволяет значительно уменьшить количество используемого фермента.
Таким образом, 200 мг рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенный с белком стабилизатором, растворяют в 200 мл буфера 150 mM NaCL, 0,05 KCl, 10 mM CaCl2, 50 mM Tris-HCl, рН 7,5. Перемешивают до полной гомогенности и добавляют концентрат 500 ед. активности энтерокиназы-F. Смесь выдерживают 16 часов при 22°С.
Рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, соединенный с белком-стабилизатором, имеет в своем составе сайт расщепления ферментом энтерокиназой. Данный фермент позволяет расщепить белковый фрагмент таким образом, что на амино-конце образующейся молекулы нет аминокислот, оставшихся от вектора, что позволяет избежать появления дополнительных аминокислот в целевом белковом продукте, в нашем случае в молекуле рекомбинантного белка, содержащего в своем составе последовательности миелопептидов.
Коммерческие наборы, содержащие фермент энтерокиназу позволяют расщеплять одной единицей активности (1 unit) 20 микрограмм (μg) белка. Т.о. количество расходуемого фермента энтерокиназа будет пропорционально молекулярной массе белковой молекулы. Т.к. снизить молекулярный вес рекомбинантного белка, содержащего в своем составе последовательности миелопептидов соединенного с белком-стабилизатором не представляется возможным, то длительное время гидролиза энтерокиназой позволяет снизить его необходимое количество.
Был проведен предварительный эксперимент, показывающий эффективность гидролиза в зависимости от времени инкубации реакционной смеси. Электрофорез гидролизной смеси рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором и энтерокиназы в различные промежутки времени представлен на фиг. 6.
Трек 1 реакционная смесь в начале эксперимента (время Т=1 мин);
трек 2 реакционная смесь через 1 час после начала эксперимента;
трек 3 реакционная смесь через 16 часов после начала эксперимента;
трек 4 стандарты молекулярных весов;
Стрелками отмечены положение в геле:
(а) рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором;
(б) чистого белка стабилизатора;
(в) чистого рекомбинантного белка, содержащего в своем составе последовательности миелопептидов.
Показана эффективность продолжительного гидролиза (1 час). Через 16 часов происходит неспецифический аутолиз белка-стабилизатора и начальный гидролиз продукта, поэтому данное время инкубации было исключено.
Так же в качестве одного из этапов очистки использовалась денатурация нагревом. Были подобраны такие условия нагрева, при которых примеси в виде энтерокиназы, а так же некоторых бактериальных белков денатурировали и выпадали в осадок. Целевой продукт - рекомбинантный белок, содержащий в своем составе последовательности миелопептидов оставался в растворе. Оптимальной оказалась инкубация реакционной смеси при 74°С. Результаты эксперимента представлены на фиг. 7.
Трек 1 - реакционная смесь нагрев 64°С, 60 минут;
Трек 2 - реакционная смесь нагрев 74°С, 60 минут;
Стрелкой отмечено положение в геле рекомбинантного белка, содержащего в своем составе последовательности миелопептидов.
Процедура гидролиза рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором ферментом энтерокиназой сводится к следующим манипуляциям:
- фракции, содержащие рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, соединенный с белком-стабилизатором после металл-афинной хроматографии смешивают с раствором, содержащим энтерокиназу;
- реакционная смесь инкубируют 1 час при 37°С;
- реакционная смесь нагревают до 74°С и инкубируют 60 минут.
Таким образом, подобраны условия гидролиза рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, соединенного с белком-стабилизатором, ферментом энтерокиназой-F один час при 37°С. Подобраны условия денатурации нагревом примесей энтерокиназы, а также некоторых бактериальных белков при 74°С, позволяющие обогатить целевой продукт.
Пример 4
FPLC очистка рекомбинантного белка на колонке HiPrep16/10 Q FF.
Хроматографическая очистка рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, проходит в один этап на ионообменном FPLC сорбенте. В качестве носителя использовалась SP-Sepharose компании GE Helthcare. Для стандартизации процесса и его воспроизводимости использовались стандартные колонки типа HiTrap. В работе использовалась хроматографическая колонка HiPrep16/10 Q FF, емкости которой хватило на весь объем выделяемого белка.
Реакционная смесь после гидролиза и нагрева фильтруется через фильтр с порами 0,22 мкм от агрегатов денатурированных белков. Фильтрованная смесь наносится на колонку HiPrep16/10 Q FF, предварительно уравновешенную 25 mM NaCl. Целевой белок элюировали линейным градиентом NaCl.
Стартовый буфер: 25 mM NaCl, 20 mM NaAc рН 5,5;
Финальный буфер: 100 mM NaCl 20 mM NaAc рН 5,5.
Хроматографический профиль элюции рекомбинантного белка, содержащего в своем составе последовательности миелопептидов с колонки HiPrep16/10 Q FF представлена на рисунке 8. Наличие белка во фракции определяли электрофорезом в ПААГ.
Таким образом, рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, очищен методом FPLC на HiPrep16/10 Q FF. Фракции, содержащие целевой продукт использовали для HPLC хроматографии.
Пример 5
HPLC очистка рекомбинантного белка.
Аминокислотная последовательность миелопептидов содержит большое количество гидрофобных аминокислот (28% от общего числа остатков), способных прочно взаимодействовать с белками штамма-продуцента. Для их отделения от целевого белка необходима третья ступень очистки, при которой возможны сильные воздействия на белок органического растворителя, разрывающего гидрофобные взаимодействия.
Хроматографическая очистка рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, проходит на обратнофазовом HPLC сорбенте Kromasil 100С18.
Объединенные фракции после хроматографии на HiPrep16/10 Q FF, содержащие рекомбинантный белок, диализовали против раствора 0,1% этанола и наносили на колонку с Kromasil 100С18. Элюировали линейным градиетном:
Стартовый буфер: 0,1% этанола.
Финальный буфер: 25% этанола.
Рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, сходит с колонки при концентрации этанола 18-20%. Хроматографический профиль элюции рекомбинантного белка, содержащего в своем составе последовательности миелопептидов, с колонки Kromasil 100С18 представлен на фиг. 9.
После хроматографии раствор рекомбинантного белка, содержащий в своем составе последовательности миелопептидов был очищен от этанола на гельфильтрационной колонке XK 50*100 с Sephacryl S400, предварительно уравновешенной водой. Весь продукт с колонки является рекомбинантным белком, содержащим в своем составе последовательности миелопептидов.
Таким образом, получен препарат - раствор рекомбинантного белка rec-МР в воде. Произведена очистка рекомбинантного белка, содержащего в своем составе последовательности миелопептидов методом HPLC на Kromasil 100С18. Рекомбинантный белок, содержащий в своем составе последовательности миелопептидов, очищен от этанола на гельфильтрационной колонке.
Пример 6
Оценка качества рекомбинантного белка обратнофазовой HPLC на колонке Kromasil 300-5С18.
100 мкл рекомбинантного белка наносили на аналитическую колонку Kromasil 300-5С18. Элюировали линейным градиентом ацетонитрила:
Стартовый буфер 5% ацетонитрил;
Финишный буфер 60% ацетонитрил.
Хроматограмма очищенного рекомбинантного белка на колонке Kromasil 300-5С18 представлена на фиг. 10.
Полученный препарат химически чист и однороден, т.к. на хроматограмме виден один симметричный пик. Выход продукции на колонке Kromasil 300-5С18 отмечен в диапазоне концентраций ацетонитрила от 39% до 43%. Иных пиков на хроматограмме нет.
Таким образом, последовательная пятиступенчатая очистка рекомбинантного белка приводит практически к 100% хроматографической чистоте получаемого продукта, что видно при оценке качества рекомбинантного белка при обратнофазовой HPLC на колонке Kromasil 300-5С18. Полученный препарат химически чист и однороден, т.к. на хроматограмме виден только один симметричный пик.
Способ выделения целевого рекомбинантного белка, обладающего биологической активностью пептидов, входящих в состав миелопида, представленного последовательностью SEQ ID NO:1, включающий получение растворимой фракции белка из штамма-продуцента Escherichia coli BL21(DE3), трансфицированного плазмидной ДНК рЕТ-32а, несущей ген, представленный последовательностью SEQ ID NO:2, хроматографическую очистку на металл-аффинном сорбенте с применением Ni-Sepharose, с последующим гидролизом слитого рекомбинантного белка с тиоредоксином ферментом энтерокиназой-F, инкубируя 1 час при 37°C, и денатурацией примесей при нагревании до 74°C в течение 60 мин, FPLC очистку на ионообменном сорбенте SP-Sepharose, обратнофазовую HPLC очистку целевого рекомбинантного белка на колонке Kromasil 100С18.