Способ получения синтетической cg-богатой генетической последовательности и ее использование в растениях
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения синтетической CG-богатой генетической последовательности для синтеза гетерологичных белков. Изобретение позволяет получать более высокий уровень экспрессии мРНК репортерного гена. 8 ил., 1 пр.
Реферат
Область применения
Изобретение относится к области генной инженерии растений и биотехнологии, в частности к способу получения синтетической генетической последовательности, которая содержит характерные для 5'-областей генов растений CG-богатые мотивы и используется для увеличения уровня транскрипции гетерологичных генов в растениях.
Уровень техники
Использование технологии рекомбинантных ДНК и методов генной инженерии позволило сделать рутинной процедуру введения требуемых последовательностей ДНК в клетки растений и, таким образом, обеспечить экспрессию представляющих интерес белков. При этом получение требуемых показателей стабильности и ожидаемого уровня экспрессии в важнейших сельскохозяйственных культурах остается на сегодняшний день нерешенной задачей.
Одним из способов добиться экспрессии гетерологичных генов в сельскохозяйственных культурах на требуемом уровне является регуляция механизмов, определяющих уровень экспрессии в растениях. Как известно, экспрессия генов эукариот, в том числе и растений, регулируется на разных уровнях, включая ключевые уровни - транскрипцию и трансляцию. Таким образом, регулирование может быть транскрипционным или пост-транскрипционным, и при этом может включать в себя механизмы, определяющие повышение эффективности, терминацию или предотвращение инициации транскрипции ДНК, а также механизмы, которые влияют на стабильность или увеличение времени жизни мРНК после ее синтеза. В патенте РФ 2507736 предложен способ создания трансгенных растений с высоким уровнем экспрессии трансгенного белка, согласно которому выше промотора гена встраивается терминатор транскрипции, обладающий способностью эффективно обрывать геномные транскрипты в растительном геноме и, таким образом, эффективно защищать экспрессию трансгена в геноме растения от последующих репрессий, что позволяет создавать трансгенные линии растений, продуцирующие белок с высоким уровнем экспрессии.
В свою очередь, последовательности ДНК, участвующие в этих регуляторных процессах, могут быть расположены до (5'-область), после (3'-область) или внутри последовательностей ДНК, кодирующих белковый продукт гена (WO 2014028295 А2, ЕР 0429478 В1). В патенте ЕР 0429478 B1 показано увеличение трансгенной экспрессии при использовании экспрессионных кассет, содержащих 5'- и 3'-регуляторные последовательности.
Важную роль в регуляции экспрессии генов играют, как правило, некодирующие регуляторные последовательности. Известно, что первым ключевым регуляторным элементом, от которого зависит уровень транскрипции гена, является промотор - последовательность ДНК, инициирующая транскрипцию (Venters B.J., Pugh B.F. How eukaryotic genes are transcribed // Crit. Rev. Biochem. Mol. Biol. - 2009. - Vol. 44. - P. 117-141; Park S.H., Yi N.R., Kim Y.S. et al. Analysis of five novel putative constitutive gene promoters in transgenic rice plants // J. Exp. Bot. - 2010. - Vol. 61. - P. 2459-2467).
В патенте РФ 2197527 была изучена экспрессия промотора синтазы ацетооксикислот в интродуцированных генах и было показано, что введение в клетки растения нуклеотидной последовательности промотора из генов als1 и als2 кукурузы обеспечивает высокоуровневую экспрессию гетерологичного гена в растении. В качестве гетерологичного гена авторами предложен мутантный ген синтазы ацетооксикислот, использование которого позволяет получать растения, устойчивые к гербицидам, и в частности к имидазолинонам.
Для регуляции транскрипции в трансгенных растениях могут быть использованы различные типы промоторов, при этом в целом промоторы можно разделить на две категории: «конститутивные» промоторы, которые экспрессируются в большинстве тканей большую часть времени, и «регулируемые» промоторы, которые обычно экспрессируются только в определенных типах тканей или в определенное время развития. Гены, кодирующие белки домашнего хозяйства, в большинстве случаев экспрессируются под действием конститутивных промоторов.
Дополнительные успехи в повышении эффективности транскрипции могут быть достигнуты в трансгенных растениях посредством введения последовательности энхансера в 5'-область промотора. Элементы типа энхансеров представляют собой цис-действующие элементы, обуславливающие увеличение уровня транскрипции близлежащих генов. Такие последовательности были выделены из различных источников, в том числе вирусов, бактерий и растительных генов. Одним из примеров хорошо охарактеризованных последовательностей энхансера является последовательность октопинсинтазы - энхансерного элемента из аэробных почвенных бактерий Agrobacterium tumefaciens, наличие короткой последовательности (40 п.н.) которого может обуславливать значительное увеличение уровня экспрессии генов в двудольных и однодольных растениях (US 5837849 A1).
Транскрипционная активность генов может опосредоваться и другими дополнительными регуляторными последовательностями, например, так называемыми, CpG-островками. Эти регуляторные области часто ассоциированы с промоторами и/или первыми экзонами генов эукариот, в том числе и генов домашнего хозяйства. Было продемонстрировано двойное увеличение частоты динуклеотидов CpG в областях инициации транскрипции генов человека с высоким уровнем транскрипции (Krinner S., Heitzer А.Р., Diermeier S.D. et al. CpG domains downstream of TSSs promote high levels of gene expression // Nucl. Acids Res. - 2014. - Vol. 42. - P. 3551-3564).
Это свидетельствует о том, что 5'-области генов с высоким содержанием динуклеотидов CpG могут быть важными регуляторными элементами транскрипции, по крайней мере, в геноме человека (US 7632661 В2).
При этом использование только специфического промотора с введенной последовательностью энхансера или без добавления энхансерного элемента не гарантирует достижения желаемого уровня экспрессии генов в растениях. В связи с этим, помимо рассмотрения условий достижения ожидаемого уровня транскрипции, необходимо также рассматривать другие факторы, которые могут повлиять на стабильность и накопление мРНК и представляющего интерес белка, и, в первую очередь, эффективность следующего этапа - трансляции, которая также определяется большим числом компонентов, при этом сами мРНК также имеют многочисленные элементы, которые вовлечены в контроль трансляции. Большинство этих элементов локализованы в нетранслируемых областях и, в частности, в 5'-нетранслируемой области (5'-НТО). В настоящее время 5'-НТО и их влияние на эффективность экспрессии генов интенсивно изучается (Kanoria S., Burma Р.K. А 28 nt long synthetic 5'UTR (synJ) as an enhancer of transgene expression in dicotyledonous plants // BMC Biotechnol. - 2012. - Vol. 12. - P. 85; Pfeiffer B.D., Truman J.W., Rubin G.M. Using translational enhancers to increase transgene expression in Drosophila // PNAS. - 2012. - Vol. 109. - P. 6626-6631).
В основном это сравнительные исследования 5'-НТО разных генов с использованием репортеров (Ortega J.L., Wilson O.L., Sengupta-Gopalan С. The 5' untranslated region of the soybean cytosolic glutamine synthetase β(1) gene contains prokaryotic translation initiation signals and acts as a translational enhancer in plants // Mol. Genet. Genomics. - Vol. 287. - P. 881-893; Wever W., McCallum E. J., Chakravorty D. et al. The 5' untranslated region of the VR-ACS1 mRNA acts as a strong translational enhancer in plants // Transgenic Res. - 2010. - Vol. 19. - P. 667-674).
В таких исследованиях продемонстрировано, что нуклеотиды в 5'-НТО непосредственно до стартового кодона значительно влияют на уровень инициации трансляции у эукариот, включая растения (Kim Y., Lee G., Jeon Ε. et al. The immediate upstream region of the 5'-UTR from the AUG start codon has a pronounced effect on the translational efficiency in Arabidopsis thaliana // Nucl. Acids Res. - 2014. - Vol. 42. - P. 485-498).
Известно, что введение последовательности омега (Ω) TMV в 5'-НТО обуславливает значительное повышение уровня экспрессии репортерного гена, подтверждая ее функцию трансляционного энхансера (Wever W., McCallum Ε.J., Chakravorty D. et al. The 5' untranslated region of the VR-ACS1 mRNA acts as a strong translational enhancer in plants // Transgenic Res. - 2010. - Vol. 19. - P. 667-674).
В патенте KZ 26081 авторами предложен способ повышения уровня экспрессии рекомбинантных генов в прокариотических организмах с использованием 5'-нетранслируемой последовательности Y-вируса картофеля, согласно которому при конструировании рекомбинантных кассет, использующихся для экспрессии генов в прокариотических организмах in vivo, перед кодирующей областью гена помещают последовательность из 5'-НТО Y-вируса картофеля, состоящую из 185 н., для повышения уровня экспрессии целевых белков. Данная нуклеотидная последовательность, находясь в 5'-НТО гена целевого белка, способна повышать уровень экспрессии белка в 792 раза по сравнению с уровнем экспрессии при использовании исходной плазмиды, не содержащей энхансера перед последовательностью целевого гена.
Исследования, связанные с выяснением роли размера 5'-НТО на эффективность трансляции, показали, что чрезвычайно короткая 5'-НТО (менее 25 нуклеотидов) может ухудшить точность трансляции, и в некоторых случаях вызвать пропуск первого стартового ко дона при сканировании 40S субъединицей рибосомы. Более длинные 5'-НТО (более 175 нуклеотидов) могут ингибировать нагрузку рибосомы, чаще всего из-за образования шпилечных структур в мРНК с высокой энергией их образования. В целом размер 5'-НТО от 50 до 75 нуклеотидов обеспечивает оптимальную нагрузку мРНК рибосомами (Wever W., McCallum Ε.J., Chakravorty D. et al. The 5' untranslated region of the VR-ACS1 mRNA acts as a strong translational enhancer in plants // Transgenic Res. - 2010. - Vol. 19. - P. 667-674).
В отношении нуклеотидного состава 5'-НТО мРНК и его влияния на эффективность трансляции у растений известно немного. Так, в 5'-НТО обнаружены специфические мотивы, которые способны влиять на эффективность трансляции (Kim Y., Lee G., Jeon Ε. et al. The immediate upstream region of the 5'-UTR from the AUG start codon has a pronounced effect on the translational efficiency in Arabidopsis thaliana // Nucl. Acids Res. - 2014. - Vol. 42. - P. 485-498).
Важную роль в процессах регуляции экспрессии генов играют цис-элементы, которые локализованы выше промоторной области, т.е. в 5'-НТО мРНК или кодирующих областях генов, и которые выступают в роли эффективных регуляторных элементов транскрипции и/или трансляции. В настоящее время идентифицированы элементы, локализованные ниже точки старта транскрипции, которые могут контролировать транскрипцию (Krinner S., Heitzer А.Р., Diermeier S.D. et al. CpG domains downstream of TSSs promote high levels of gene expression // Nucl. Acids Res. - 2014. - Vol. 42. - P. 3551-3564).
Эти элементы могут контролировать трансляцию (Dmitriev S.E., Andreev D.E., Terenin I.M. et al. Efficient translation initiation directed by the 900-nucleotide-long and GC-rich 5' untranslated region of the human retrotransposon LINE-1 mRNA is strictly cap dependent rather than internal ribosome entry site mediated // Mol. Cell. Biol. - 2007. - Vol. 27 - P. 4685-4697). А также контролировать одновременно, и транскрипцию, и трансляцию (Elfakess R., Dikstein R.A. A translation initiation element specific to mRNAs with very short 5'UTR that also regulates transcription // PLoS ONE. - Vol. 3. - e3094).
Однако структура и состав, а также роль таких регуляторных последовательностей в контроле над экспрессией генов, в частности растений, остаются еще плохо изученными (Wever W., McCallum Ε.J., Chakravorty D. et al. The 5' untranslated region of the VR-ACS1 mRNA acts as a strong translational enhancer in plants // Transgenic Res. - 2010. - Vol. 19. - P. 667-674; Kawaguchi R., Bailey-Serres J. mRNA sequence features that contribute to translational regulation in Arabidopsis // Nucl. Acids Res. - 2005. - Vol. 33. - P. 955-965). Разнообразие функций и противоположных эффектов, в частности CpG динуклеотидов, в регуляторных и кодирующих областях генов эукариот, позволяет сделать предположение о том, что они могут играть ключевую роль в регуляции экспрессии генов (Krinner S., Heitzer А.Р., Diermeier S.D. et al. CpG domains downstream of TSSs promote high levels of gene expression // Nucl. Acids Res. - 2014. - Vol. 42. - P. 3551-3564; Dmitriev S.E., Andreev D.E., Terenin I.M. et al. Efficient translation initiation directed by the 900-nucleotide-long and GC-rich 5' untranslated region of the human retrotransposon LINE-1 mRNA is strictly cap dependent rather than internal ribosome entry site mediated // Mol. Cell. Biol. - 2007. - Vol. 27. - P. 4685-4697; Bugaut Α., Balasubramanian S. 5'-UTR RNA G-quadruplexes: translation regulation and targeting e9670 // Nucl. Acids Res. - 2012. - Vol. 40. - P. 4727-4741).
Задача изобретения
Задачей изобретения является конструирование синтетической генетической последовательности, которая содержит характерные для 5'-областей генов растений CG-богатые мотивы, и создание трансгенных растений с высоким уровнем экспрессии гетерологичного белка с использованием полученной CG-богатой последовательности.
Раскрытие изобретения.
Поставленная задача решается тем, что создан новый способ получения синтетической CG-богатой генетической последовательности и ее использования в растениях посредством введения в 5'- нетранслируемую область кодирующей последовательности мРНК или в 5'- область кодирующей последовательности гибридного гена, в котором синтетическая последовательность слита в рамке считывания с последовательностью гетерологичного гена, заключающийся: в in silico анализе 5'-областей генов растений и дизайне регуляторной последовательности, конструировании экспрессионных векторов для трансформации растений, получении и ПЦР-анализе трансгенных растений, отборе и анализе трансформантов растений, экспрессирующих репортерный ген термостабильной лихеназы, оценке влияния регуляторных последовательностей на эффективность экспрессии репортерного гена в полученных трансгенных растениях. Использование синтетической CG-богатой генетической последовательности необходимо для синтеза гетерологичных белков.
Сущностью изобретения является способ получения синтетической генетической последовательности, которая функционирует как 5'-НТО мРНК репортерного гена или как 5'-область кодирующей последовательности гибридного гена, в котором синтетическая последовательность слита в рамке считывания с последовательностью репортерного гена, и используется для увеличения уровня транскрипции гетерологичных генов в растениях.
На трансгенных растениях табака изучен вклад нуклеотидного состава 5'-области мРНК в эффективность экспрессии на уровне транскрипции и трансляции с использованием репортерного гена термостабильной лихеназы Clostridium thermocellum (лихеназа - 1,3-1,4-β-D-глюкан-4-глюканогидролаза - в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам, относится к КФ 3.2.1.73 согласно ГОСТ Ρ 53973-2010 «Ферментные препараты для пищевой промышленности. Методы определения β-глюканазной активности», входит в группу β-D-глюканаз эндодействия, катализирующих расщепление β-D-глюканов, и гидролизует β-1,4-гликозидные связи в β-D-глюканах, имеющих β-1,3- и β-1,4-связи).
Термостабильная лихеназа представляет собой небольшой белок (25 кДа), с температурным оптимумом ферментативной активности при +75°С и значительную устойчивость к инактивации при нагревании, действии детергентов и растительных протеаз (Пирузян Э.С., Голденкова И.В., Мусийчук К.А. и др. Новая репортерная система, основанная на высокой термостабильности лихеназы, для изучения регуляции экспрессии генов у растений // Физиология растений. - 2000. - Т. 47. - С. 382-389).
Это делает экспрессионно-репортерную систему на основе лихеназы высокоспецифичной и эффективной для мониторинга накопления рекомбинантных белков в растениях. Следует также отметить, что компактная пространственная структура каталитического домена лихеназы позволяет во многих случаях сохранить в неизменном виде активность слитой с лихеназой целевой последовательности (Stothard P. The Sequence Manipulation Suite: JavaScript programs for analyzing and formatting protein and DNA sequences // Biotechniques. - 2000. - Vol. 28. - P. 1102-1104).
Перечень и краткое описание графических изображений
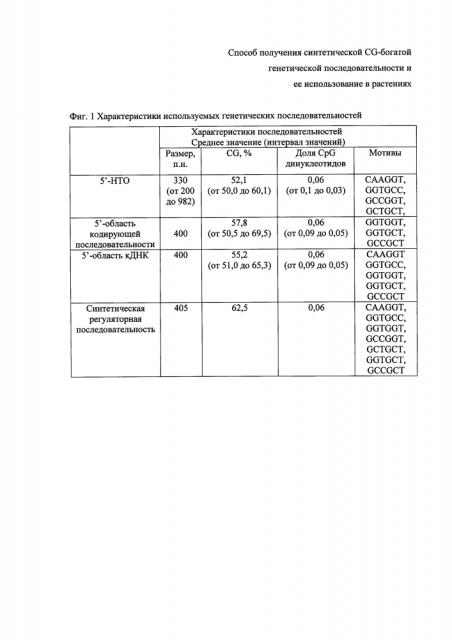
Фиг. 1 - характеристики выбранных последовательностей.
Характеристики 5'-областей генов Arabidopsis thaliana, использованных для поиска мотивов, и синтетической регуляторной последовательности. Долю CpG динуклеотидов рассчитывают в пересчете на длину последовательности в п.н.; в качестве 5'-области кодирующей последовательности проанализирована группа генов с отсутствием 5'-НТО, при этом для проведения анализа использовались первые 400 п.н. кодирующей последовательности; в качестве 5'-области кДНК проанализирована группа генов с 5'-НТО до 200 п.н., при этом для анализа используют первые 400 п.н. кДНК. В таблице указаны мотивы, которые встречались в 5'-области у 50% анализируемых последовательностей.
Фиг. 2 - схема целевой части Т-ДНК экспрессионных векторов серии A pVIG-T-LicB, pVIG-T-CG-LicB, pVIG-T-Ω-LicB и серии Б pVIG-T-Ω-CG-LicB для трансформации растений. Ρ 35 - промотор 35S РНК CaMV; LicB - последовательность репортерного гена термостабильной лихеназы; CG - синтетическая регуляторная последовательность, сконструированная из характерных для 5'-области растительных генов мотивов; Ω - трансляционный энхансер омега из TMV; ATG - стартовый кодон.
Фиг. 3 - Вторичная структура синтетической CG-богатой последовательности, которая содержит мотивы, характерные для 5'-области растительных генов, построенная с использованием CENTROIDFOLD (http://www.ncrna.org/centroidfold/). Градация от I до IV представляет вероятность спаривания оснований от 0 до 1. Вероятность спаривания оснований - это вероятность того, что между парами нуклеотидов возможно образование водородных связей и вторичной структуры.
Фиг. 4 - последовательности праймеров, которые были использованы для (А) конструирования экспрессионных растительных векторов, (Б) проверки первичных трансформантов растений методом мультиплексной ПЦР и (В) оценки экспрессии репортерного гена количественной RT-ПЦР.
Фиг. 5 - электрофореграммы продуктов амплификации участков геномной ДНК трансгенных линий табака (Nicotiana tabacum). Общие обозначения для А и Б: амплификация фрагмента гена актина (NtGA2) служит внутренним положительным контролем; отсутствие ампликона 432 п.н., соответствующего гену virD1 Agrobacterium tumefaciens указывает на отсутствие агробактериальной контаминации. Дорожка M - маркер размера ДНК. K- - отрицательный контроль, ПЦР без добавления геномной ДНК. Tnos - ампликоны терминатора Tnos. (А) 1-5 - ДНК трансгенных растений табака (Nicjtiana tabacum) линии CG-LicB; 6-8 - ДНК трансгенных растений Nicotiana tabacum линии Ω-LicB; 9-10 - ДНК трансгенных растений Nicotiana tabacum линии LicB. LicB - ампликоны репортерного гена термостабильной лихеназы; CG - ампликоны части синтетической CG-богатой последовательности и части репортерного гена. (Б) v - ДНК экспрессионного вектора; К - ДНК контрольного растения Nicotiana tabacum; pV - ДНК трансгенного растения Nicotiana tabacum, трансформированного пустым вектором; 1-11 - ДНК трансгенных растений Nicotiana tabacum линии Ω-CG-LicB. CG-LicB - ампликоны гибридного гена, кодирующего слияние синтетической CG-богатой последовательности с последовательностью репортерного гена термостабильной лихеназы.
Фиг. 6 - зимограмма белковых лизатов, полученных из трансгенных растений Nicotiana tabacum. Общее обозначение для А и Б: M - маркер молекулярной массы, кДа. (А) Размер белковых продуктов репортерного гена, синтезирующихся в трансгенных растениях линии LicB (1), линии CG-LicB (2) и линии Ω-LicB (3); (Б) Размер белковых продуктов репортерного (1) и гибридного (2) гена, синтезирующихся в трансгенных растениях (линия CG-LicB и линия Ω-CG-LicB соответственно); (3) - белковый экстракт трансгенного растения, трансформированного пустым вектором.
Фиг. 7 - диаграммы накопления репортерного белка термостабильной лихеназы (А, оценка уровня накопления по активности лехиназы) и мРНК репортерного гена (Б, определение относительного количества (RQ) транскрипта репортерного гена) в линиях трансгенных растений. Представлены средние значения для 7 (линия Ω-CG-LicB) и 8 (линии LicB; CG-LicB и Ω-LicB) независимых трансформантов в каждой линии растений. На диаграммах указаны стандартные отклонения результатов трех независимых измерений.
Фиг. 8 - синтетическая CG-богатая генетическая последовательность.
Заявляемый способ осуществляется следующим образом.
1) In silico анализе 5'-областей генов растений и дизайне регуляторной последовательности.
Для получения представлений о влиянии контекста 5'-области на экспрессию гетерологичного гена в растениях определяют критерии размера и нуклеотидного состава целевой регуляторной последовательности: (1) размер не менее 200 п.н. (минимальный размер CpG-островка); (2) GC содержание выше 50% (одна из характеристик CpG-островков); (3) наличие мотивов, характерных для 5'-областей мРНК генов Arabidopsis thaliana с GC содержанием не менее 50%; (4) нуклеотиды, окружающие стартовый кодон, в положении -3 и +4 согласно последовательности Козак (Kozak M. Circumstances and mechanisms of inhibition of translation by secondary structure in eucaryotic mRNAs // Mol. Cell. Biol. - 1989. - Vol. 9. - P. 5134-5142); (5) отсутствие альтернативных стартовых и терминирующих кодонов.
Для проведения анализа используют последовательности 5'-НТО мРНК
Arabidopsis thaliana, выборки которых получают с использованием публичной базы данных FlowGene (flowgene.az) и ее программного обеспечения. Выравнивание нуклеотидных последовательностей проводят с помощью программы Muscle (Edgar R.C. MUSCLE: multiple sequence alignment with high accuracy and high throughput // Nucl. Acids Res. - 2004. - Vol. 32. - P. 1792-1797).
Анализ нуклеотидных последовательностей, в том числе и предсказание CpG-островков, проводят с использованием ресурса Sequence Manipulation Suite (Stothard P. The Sequence Manipulation Suite: JavaScript programs for analyzing and formatting protein and DNA sequences // Biotechniques. - 2000. - Vol. 28. - P. 1102-1104).
Для оценки вторичной структуры мРНК используют алгоритм centroidfold (http://www.ncrna.org/centroidfold/), который дает лучшие результаты среди схожих методов (Sato K., Hamada M., Asai K., Mituyama Т. CENTROIDFOLD: a web server for RNA secondary structure prediction // Nucl. Acids Res. - 2009. - Vol. 37. - Web server issue W277-W280).
Для анализа выбирают последовательности как 5'-НТО, так и кодирующих областей мРНК, поскольку более 25% мРНК генов Arabidopsis thaliana не имеют 5'-НТО. Первоначально анализируют 5'-НТО мРНК генов Arabidopsis thaliana. Для этого из базы данных выбраны 1302 последовательности 5'-НТО, имеющие CG содержание выше 50%, из этой группы 69 последовательностей имели размер более 200 п.н. Далее из них были отобраны 35 последовательностей 5'-НТО, у которых на основе дополнительного анализа выявлены CpG островки. Другая анализируемая группа последовательностей - кодирующие области мРНК для генов Arabidopsis thaliana, у которых отсутствуют 5'-НТО. Из базы данных были выбраны 283 последовательности с GC содержанием выше 50% и размером не менее 400 п.н. Далее из них были отобраны 46 последовательностей, у которых были выявлены CpG островки. Третья группа последовательностей, включенных в анализ in silico - это последовательности, имеющие размер 5'-НТО от 1 до 200 п.н. (19013 генов), из этой группы были выбраны 1702 последовательности с размером 5'-области не менее 400 п.н., GC составом выше 50%, и у которых на основе дополнительного анализа были выявлены CpG островки. Характеристики выбранных последовательностей приведены на Фиг. 1.
Следующий этап in silico анализа проводят при помощи интернет-сервера Muscle: множественное выравнивание и филогения выбранных последовательностей позволяет сформировать последовательности в группы для попарного выравнивания. На основании результатов попарного выравнивания последовательностей в каждой группе, находят мотивы, которые встречаются в 5'-области у 50% последовательностей: CAAGGT, GGTGCC, GGTGGT, GCCGGT, GCTGCT, GGTGCT, и GCCGCT. Эти мотивы с учетом их окружения и локализации (up или downstream) в 5'-области Arabidopsis thaliana включают в дизайн синтетической последовательности. Характеристика целевой последовательности представлена на Фиг. 2.
При дизайне регуляторной последовательности учитывают пять критериев, описанных выше, а также вторичную структуру, которая будет непосредственно прилегать к началу стартового AUG кодона. Анализ синтетической регуляторной последовательности алгоритмом centroidfold (Sato K., Hamada M., Asai K., Mituyama T. CENTROIDFOLD: a web server for RNA secondary structure prediction // Nucl. Acids Res. - 2009. - Vol. 37. - Web server issue W277-W280) не показал наличия стабильной вторичной структуры (Фиг. 3). Основные вторичные структуры в синтетической регуляторной последовательности представляют собой небольшие шпилечные структуры длиной от 3 до 12 п.н. с невысокой энергией их образования (DG=-37,64 Kcal/mol).
2) Конструирование экспрессионных векторов для трансформации растений
Для выяснения функциональной роли синтезированной последовательности в регуляции экспрессии генов у растений конструируют две серии экспрессионных векторов. Серия векторов А включает вектор pVIG-T-LicB, в котором экспрессия репортерного гена термостабильной лихеназы контролировалась 35S РНК CaMV промотором, а также вектора pVIG-T-CG-LicB и pVIG-T-Ω-LicB, в которых между последовательностью 35S РНК CaMV промотора и стартовым кодонов трансляции (ATG) репортерного гена были интегрированы: синтетическая CG-богатая последовательность (405 п.н.) и последовательность омега (Ω) TMV соответственно, которые в векторах будут функционировать в качестве 5'-НТО мРНК репортерного гена (Фиг. 2). Последовательность омега (Ω) TMV используют в качестве контрольной, поскольку ее функция как трансляционного энхансера убедительно доказана (Wever W., McCallum Ε.J., Chakravorty D. et al. The 5' untranslated region of the VR-ACS1 mRNA acts as a strong translational enhancer in plants // Transgenic Res. - 2010. - Vol. 19. - P. 667-674).
Серия Б включает вектор pVIG-T-Ω-CG-LicB, который содержит гибридный ген, кодирующий слияние синтетической CG-богатой последовательности (405 п.н.) с последовательностью репортерного гена термостабильной лихеназы за счет введения в 5'-область гибридных генов стартовых ATG кодонов (Фиг. 2). В этой серии векторов последовательность омега (Ω) TMV функционирует в качестве 5'-НТО гибридных генов, а синтетическая CG-богатая последовательность - как 5'-область кодирующей последовательности гибридного гена.
Для получения растительных экспрессионных векторов используют стандартные процедуры молекулярного клонирования и протоколы ПЦР (Maniatis T., Frisch E.F., Sambrook J. Molecular Cloning: A Laboratory Manual - Cold Spring Harbor: Cold Spring Harbor Lab., 1982. - 545 p).
Растительные экспрессионные вектора, несущие репортерный ген термостабильной лихеназы слитый в 5'-концевой области с синтезированными последовательностями 5'-НТО, получают в несколько этапов. Первоначально методом ПЦР получают последовательность репортерного гена термостабильной лихеназы, используя pQE-licBM3 в качестве матрицы прямой и обратный праймеры с введенными сайтами рестрикции BamHI и SmaI (Вячеславова А.О., Мустафаев О.Н., Тюрин А.А. и др. Серия модульных векторов для стабильной и транзиентной экспрессии гетерологичных генов в растениях // Генетика. - 2012. - Т. 48. - С. 1046-1056). Праймеры и их последовательности представлены на Фиг. 4. Продукт амплификации клонируют как BamHI-SmaI фрагмент в вектор pPGG, с образованием промежуточного вектора pPGG-LicB.
Последовательность нуклеотидов с высоким содержанием CpG динуклеотидов (CG) и лидерную омега (Ω) последовательность вируса мозаики табака (TMV) синтезируют из олигонуклеотидов методом ПЦР (ЗАО «Евроген», Россия) и далее клонируют в вектор pPGG-LicB с образованием промежуточных векторов pPGG-CG-LicB и pPGG-Ω-LicB, в которых синтезированные последовательности (CG - 405 п.н. и Ω - 78 п.н.) клонируют между промотором 35S РНК CaMV и репортерным геном термостабильной лихеназы. Корректность последовательностей подтверждают секвенированием (ЗАО «Евроген», Россия).
Далее ApaI-XhoI фрагменты векторов pPGG-LicB, pPGG-CG-LicB и pPGG-Ω-LicB клонируют в вектор pVIG-T (Вячеславова А.О., Мустафаев О.Н., Тюрин А.А. и др. Серия модульных векторов для стабильной и транзиентной экспрессии гетерологичных генов в растениях // Генетика. - 2012. - Т. 48. - С. 1046-1056), предварительно гидролизованный эндонуклеазами рестрикции ApaI и XhoI, с образованием растительных экспрессионных векторов pVIG-T-LicB, pVIG-T-CG-LicB и pVIG-T-Ω-LicB (Фиг. 2). Конструирование растительного экспрессионного вектора pVIG-T-Ω-CG-LicB проводят в несколько этапов. Первоначально, для клонирования кассет, включающих транскрипционно-трансляционное слияние последовательности CG с репортерным геном термостабильной лихеназы, в 5'-область прямого праймера вводят сайт рестрикции SacI и триплет ATG (как стартового ко дона трансляции) и в 5'-область обратного праймера сайт рестрикции SmaI. Продукты амплификации последовательностей клонируют как SacI-SmaI фрагменты в вектор pPGG-Ω-LicB, предварительно гидролизованный эндонуклеазами рестрикции SacI и SmaI, с образованием промежуточного вектора pPGG-Ω-CG-LicB, в котором последовательность 5'-НТО омега (Ω) TMV была локализована между промотором 35S РНК CaMV и репортерным геном термостабильной лихеназы, слитой в 5'-области с CG последовательностью. Далее ApaI-XhoI фрагмент вектора pPGG-Ω-CG-LicB клонируют в вектор pVIG-T (Вячеславова А.О., Мустафаев О.Н., Тюрин А.А. и др. Серия модульных векторов для стабильной и транзиентной экспрессии гетерологичных генов в растениях // Генетика. - 2012 - Т. 48 - С. 1046-1056), предварительно гидролизованный эндонуклеазами рестрикции ApaI и XhoI, с образованием растительного экспрессионного вектора pVIG-T-Ω-CG-LicB (Фиг. 2).
3) Получение и ПЦР-анализ трансгенных растений
С использованием сконструированных экспрессионных векторов методом Agrobacterium-опосредованной трансформации получают трансгенные растения табака (Nicotiana tabacum). Трансформацию растений табака Nicotiana tabacum (сорт Petit Habana) проводят методом кокультивирования листовых дисков с суспензией агробактерий, несущих соответствующие векторы по методу (Герасименко И.М., Сахно Л.А., Кирпа Т.Н. и др. Характеристика растений табака Nicotiana tabacum, экспрессирующих гибридные гены Δ9- или Δ12-ацил-липидных десатураз цианобактерий и термостабильной лихеназы // Физиология растений. - 2015. - Т. 62. - С. 307-316).
Регенерацию растений проводят на среде Мурасиге-Скуга (MS), содержащей 20 г/л сахарозы, 1 мг/л БАП (Sigma), 0,1 мг/л НУК (Sigma), 500 мг/л цефотаксима, а также 100 мг/л сульфата канамицина в качестве селективного агента. Регенерированные растения переносят на среду MS, содержавшую 20 г/л сахарозы и 100 мг/л сульфата канамицина, поддерживают in vitro при 25±1°С, 16-ч фотопериоде, освещенности 100 мкмоль квантов/(м2с). Для молекулярного и биохимического анализа используют растения, которые культивируют in vitro 4-5 недель. Линии регенерантов-растений, полученных с векторами pVIG-T-LicB, pVIG-T-CG-LicB, pVIG-T-Ω-LicB и pVIG-T-Ω-CG-LicB, обозначают как LicB, CG-LicB, Ω-LicB и Ω-CG-LicB соответственно.
Присутствие последовательностей целевого гетерологичного гена в геноме трансформантов растений табака подтверждают методом мультиплексной ПЦР по аналогии с работой (Герасименко И.М., Сахно Л.А., Кирпа Т.Н. и др. Характеристика растений табака (Nicotiana tabacum), экспрессирующих гибридные гены Δ9- или Δ12-ацил-липидньгх десатураз цианобактерий и термостабильной лихеназы // Физиология растений. - 2015. - Т. 62. - С. 307-316) с заменой пары праймеров для генов десатуразы на праймеры для CG последовательности (Фиг. 4). С использованием данного метода анализируют регенерированные растения, полученные с серией векторов А и устойчивые к селективному агенту канамицину, с целью подтверждения присутствия репортерного гена licBM3 и исследуемой регуляторной последовательности CG (по наличию ампликонов размером 642 и 455 п.н. соответственно), а также присутствия терминатора Tnos, который входит в состав экспрессионных векторов (по наличию ампликона размером 188 п.н.) (Фиг. 5А). Регенерированные растения, полученные с вектором серии Б и устойчивые к селективному агенту канамицину, также анализируют методом мультиплексной ПЦР, в результате чего было обнаружено присутствие репортерного гена licBM3 слитого с исследуемой последовательностью CG (по наличию ампликона размером 682 п.н.), и терминатора Tnos, который входит в состав экспрессионных векторов (по наличию ампликона размером 188 п.н.) (Фиг. 5Б). Качество ДНК оценивают в экспериментах по амплификации фрагмента гена актина (795 п.н.), а отсутствие ампликона гена virD1 (432 п.н.) свидетельствовало о полной элиминации агробактерий после генетической трансформации (Фиг. 5А и Б). В результате анализа для каждой линии трансгенных растений отбирают 8-12 независимых трансформантов растений табака (Nicotianum tabacum).
4) Отбор и анализ трансформантов растений, экспрессирующих репортерный ген термостабильной лихеназы
Трансгенные линии табака (Nicotianum tabacum), для которых наличие перенесенных генов было доказано методом мультиплексной ПЦР, анализируют с помощью качественного теста активности лихеназы. Предварительно проводят экстракцию суммарных растворимых белков путем растирания замороженной жидким азотом растительной ткани с 50 мМ Tris-HCl (рН=8.0) буфером (для экстракции 1 г ткани используют 2-4 мл буфера). Экстракт центрифугируют при 10000 g в течение 10 мин и отбирают надосадочную жидкость. Далее определяют активность лихеназы, используя лихенан (Megazyme, Ирландия) в качестве субстрата, время инкубации 10 мин. В результате анализа отбирают по 8 трансгенных растений, полученных с векторами серии А, и 7 трансгенных растений, полученных с вектором серии Б.
Размер белковых продуктов, синтезирующихся в трансгенных растениях, подтверждают методом зимограмм (Фиг. 6). Количество белка в препаратах определяют по методу Bradford (Berdichevets I.N., Shimshilashvili H.R., Gerasymenko I.M. et al. Multiplex PCR assay for detection of recombinant genes encoding fatty acid desaturases fused with lichenase reporter protein in GM plants // Anal. Bioanal. Chem. - 2010. - Vol. 397. - P. 2289-2293), используя Bio-Rad dye reagent (BioRad, США) и БСА (Sigma, США) для построения калибровочной кривой. Электрофорез препаратов белков проводят по методу Laemmli (Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. - 1970. - Vol. 227. - P. 680-685) в денатурирующих условиях в полиакриламидном геле (ПААГ). Энзимограммы получают после разделения белков посредством окрашивания геля, содержащего лихенан, по аналогии с работой (Герасименко И.М., Сахно Л.А., Кирпа Т.Н. и др. Характеристика растений табака (Nicotiana tabacum), экспрессирующих гибридные гены Δ9- или Δ12-ацил-липидных десатураз цианобактерий и термостабильной лихеназы // Физиология растений. - 2015. - Т. 62. - С. 307-316). Электрофорез проводят в 12%-ном ПААГ в присутствии Ds-Na. Лихенан (0,1%) добавляют в разделяющий гель до полимеризации. Растительные экстракты (0,1-20 мкг суммарного белка), уравновешенные по активности лихеназы, наносят на гель после предварительного прогревания в буфере для нанесения образцов в течение 8 мин в кипящей водяной бане.
Из представленных на Фиг. 6 результатов следует, что в растениях происходит синтез белковых продуктов с молекулярной массой, соответствующей теоретически рассчитанной - около 25 кДа - для термостабильной лихеназы и около 36 кДА - для гибридного белка, в котором лихеназа слита с CG-богатой последовательностью.
5) Оценка влияния регуляторных последовательностей на эффективность экспрессии репортерного гена в трансгенных растениях
Для оценки эффективности экспрессии репортерного гена за счет введения синтетической регуляторной последовательности определяют уровни накопления репортерного белка и мРНК репортерного гена у трансгенных растений. Уровень накопления репортерного белка и гибридных белков, сконструированных на основе репортерного белка, рассчитывают по активности термостабильной лихеназы в экстрактах, полученных из трансгенных растений (Фиг. 7А). Полученные результаты показывают, что в линии CG-LicB уровень накопления белка увеличился в 14,1 раз, в линии Ω-CG-LicB - в 19,5 раз и в линии Ω-LicB - в 5 раз соответственно, по сравнению с уровнем накопления лихеназы в линии растений LicB. Эти данные свидетельствуют о положительном функциональном вкладе CG-богатой последовательности, локализованной в 5'-области репортерного гена, в эффективность его экспрессии.
Для оценки уровня транскрипции репортерного гена в полученных линиях трансгенных растениях определяют уровень мРНК методом количественной ПЦР в реальном времени. Экстракцию суммарной РНК проводят с использованием коммерческого набора реагентов «RNeasy Mini Kit (50)» (Qiagen, USA) из 5-недельных контрольных и трансгенных растений табака, выращенных в условиях in vitro. Полученные образцы суммарной РНК дополнительно очищают, используя коммерческий набор QIAGEN RNeasy MinElute Cleanup Kit (Qiagen, USA). Качество препаратов суммарной РНК определяют спектрофотометрически (Nanodrop ND-1000, LabTech International, ES, UK) и методом электрофореза в 1,0% агарозном геле, содержащем формальдегид. кДНК библиотеки получают с помощью набора для синтеза кДНК Mint (ЗАО Евроген, Россия). Количественную ПЦР (RT-qPCR) проводят, используя StepOnePlus Real-Time PCR System (Applied Biosystems, USA) и SYBR Green как флуоресцентный краситель согласно протоколу производителя. Реакционная смесь (20 мкл) содержит 4 мкл qPCRmix-HS SYBR+ROX (Евроген, Россия), 0,3 μΜ каждого праймера и 100 нг матрицы кДНК. Используют следующие условия амплификации: +95°С - 10 мин, далее 40 циклов +95°С - 15 с., +58°С - 20 с. и +72°С - 30 с. Для количественной оценки уровня транскрипции используют три повторности qPCR и значения Ct. Отрицательный контроль для каждой пары праймеров содержит все компоненты ПЦР, за исключением матрицы кДНК. Результаты амплификации обрабатывают с использованием метода ΔCt. Значения Ct для репортерного гена были нормализованы на референсный ген (актин). Ct значения конвертируют в значения относительного количества (RQ) с использованием следующей формулы: RQ=2-ΔCt, где ΔCt равно среднему Ct значению репортерного гена минус Ct значение референсного гена (для каждой матрицы кДНК). Статистическую обработку результатов проводят с использованием программ «Statistica for Windows 9.0» (применяют t-критерий Стьюдента для независимых выборок, p=0,05) и «Microsoft Office Excel 2007». В экспериментах используют 8-12-кратную аналитическую повторность измерений.
На Фиг. 7 приведены средние арифметические значения (А) активности репортерного белка термостабильной лехиназы и (Б) относительных количеств мРНК репортерного гена в линиях трансгенных растений Ω-CG-LicB, CG-LicB, Ω-LicB и LicB, а также их стандартные ошибки. Из полученных результатов следует, что относительное количество (RQ) транскрипта репортерного гена дост