Гибридные белки-носители пептидов в качестве вакцин от аллергии
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к полипептидам для лечения или предотвращения аллергий на аллергены пыльцы трав Ph1P1, пыльцы березы Betv1 и клеща домашней пыли Derp2, что может быть использовано в медицине. Полученные рекомбинантным путем полипептиды с SEQ ID NO: 14-19 и 149-152 используют в вакцинных композициях, предназначенных для лечения или предотвращения аллергии на соответствующий аллерген. Изобретение позволяет уменьшить количество побочных эффектов при вакцинации аллергенами Ph1P1, Betv1 и Derp2. 15 н. и 18 з.п. ф-лы, 20 ил., 7 табл., 27 пр.
Реферат
Настоящее изобретение имеет отношение к новым полипептидам и их применению.
Аллергия I типа представляет собой опосредованное IgE состояние гиперчувствительности, поражающее почти 25% популяции. Она основывается на распознавании неопасных, присутствующих в воздухе или пищевых аллергенов, аллергенов насекомых и ядов животного происхождения, а также антигенов контактных аллергенов, происходящих по существу от безопасных источников антигенов, таких как пыльца, белки насекомых, грибов и животных, специфическим иммуноглобулином. Сшивание эффекторных связанных с клетками IgE антител приводит к высвобождению медиаторов воспаления (например, гистамина, лейкотриенов) и таким образом к симптомам, непосредственно связанным с аллергией (например, риноконъюнктивит, астма, дерматит, анафилактическая реакция). Активация Т-клеток через IgE-зависимый, а также IgE-независимый механизмы способствует хроническому аллергическому воспалению.
Единственным возможным видом лечения аллергии является аллерген-специфическая иммунотерапия, которая основывается на повторном введении увеличивающихся количеств экстрактов аллергенов в случае большинства источников. Многочисленные клинические исследования документально подтвердили клиническую эффективность инъекционной иммунотерапии, и имеются данные, указывающие на некоторые иммунологические механизмы, лежащие в основе этого лечения. Вследствие трудности приготовления экстрактов аллергенов высокого качества для некоторых источников аллергенов и того факта, что введение аллергенов пациентам может вызвать тяжелые побочные эффекты, аллерген-специфическая иммунотерапия может быть рекомендована только для некоторых групп пациентов и при определенных проявлениях болезни. Особенно трудно лечить пациентов с одновременной сенсибилизацией к нескольким разным источникам аллергенов и пациентов, страдающих от тяжелых проявлений болезни, таких как аллергическая астма. Аллергическая астма является одним из наиболее сильных проявлений аллергии, поскольку она существенно влияет на качество повседневной жизни, является частой причиной госпитализации и может проявляться в серьезных, угрожающих жизни формах, требующих интенсивного лечения пациентов.
Экстракты аллергенов, полученные из природных источников аллергенов являются неочищенными по природе, и нет возможности влиять на качество и количества отдельных аллергенов в таких препаратах с помощью технических средств. Они также содержат многочисленные неидентифицированные неаллергенные компоненты, причем некоторые последние исследования показывают плохое качество таких экстрактов и подтверждают их большую неоднородность.
За последнее десятилетие были получены колоссальные успехи в области молекулярной характеристики аллергенов с использованием метода рекомбинантных ДНК. Большое количество наиболее важных, вызывающих болезнь аллергенов охарактеризовано вплоть до молекулярного уровня, и были получены рекомбинантные аллергены, имитирующие эпитопную сложность экстрактов природных аллергенов. Более того, некоторые группы исследователей использовали знания относительно структур аллергенов для разработки новых вакцин от аллергии. Для уменьшения аллергической активности новых вакцин и, таким образом, величины вызванных лечением побочных эффектов, используется генная инженерия, синтетическая химия пептидов и конъюгация аллергенов с иммуностимулирующими ДНК-последовательностями. Были проведены первые обнадеживающие клинические исследования с такими производными аллергенов. Интересно заметить, что хотя IgE-реактивность генетически созданных рекомбинантных аллергенов и происходящих из аллергенов синтетических, содержащих Т-клеточный эпитоп пептидов могла быть сильно снижена или даже устранена, эти производные все еще могли вызывать системные побочные эффекты, появляющиеся через несколько часов после инъекции. Например, сообщалось, что содержащие Т-клеточный эпитоп пептиды основного кошачьего аллергена, Fel d 1, вызывали астму и гиперреактивность бронхов через несколько часов после подкожной инъекции, причем существует строгое доказательство, что этот эффект опосредуется Т-клетками и ограничивается МНС.
Эти результаты показывают, что устранение IgE-реактивности уменьшает побочные эффекты, опосредованные IgE, так как не было зарегистрировано аллергических реакций немедленного типа в ходе этих иммунотерапевтических исследований. Однако, аллерген-специфические Т-клеточные эпитопы, сохранившиеся в рекомбинантных производных аллергена, а также в пептидных смесях, являются ответственными за поздние побочные эффекты (например, очень проблематичный или атопический дерматит, хронические аллергические проявления на коже, опосредованные Т-клетками). Побочные эффекты, вызванные в случае рекомбинантных производных аллергенов, были относительно слабыми, и в случае Т-клеточных пептидных вакцин могут преодолеваться путем соответствующего подбора дозы. Соответственно, оба этих новых подхода кажутся весьма перспективными для иммунотерапии аллергических риноконъюнктивитов, но могут иметь ограничения, когда дело доходит до лечения некоторых форм аллергической астмы, поскольку индукция поздних побочных эффектов в легких может быть весьма проблематичной.
Для введения и соответственно для возбуждения эффективного иммунного ответа против пептидов, полипептидов и белков регулярно используют адъюванты (вспомогательные вещества) и/или носители. Например, одним из наиболее доступных адъювантов является полный адъювант Фрейнда (CFA). Существует необходимость в вакцинных композициях, способных вызывать сильные иммунные ответы против пептидов и полипептидов, происходящих от аллергенов и, разумеется, от других антигенов с применением или без применения полного адъюванта Фрейнда. В дополнение к этому, в то время как BSA успешно используется в качестве носителя на животных моделях, он может не подходить для применения в вакцинных композициях для человека из-за риска побочных реакций, таких как риск передачи прионной болезни (вариантная болезнь Крейтцфельдта-Якоба). Дополнительной проблемой для разработки эффективной вакцины против аллергенов является необходимость в иммунном ответе, способном быстро понижать аллергены у индивидуума или животного. Следовательно, необходимы высокие концентрации в крови аллерген-специфических антител, которые представляют собой в основном подтип IgG. На слизистых поверхностях также очень важными являются IgA антитела.
Холерный токсин, известный в данной области техники белок-носитель, также регулярно используется в качестве адъюванта. Однако, холерный токсин увеличивает уровень общих и специфических IgE антител и приводит к воспалительным реакциям, связанным с IgE.
Вследствие побочных эффектов, вызываемых большой частью белков-носителей, используемых для вакцинации, существует необходимость в системах-носителях, способных возбуждать иммунные ответы против аллергенов или других антигенов без использования токсических адъювантов, без использования плохо переносимых белков-носителей и в некоторых ситуациях без стимулирования потенциально патологических иммунных ответов. Новые системы-носители, соответствующие этим требованиям, могут использоваться с целью формирования новых конъюгатов и композиций, подходящих для лечения или предотвращения болезней, подобных аллергическим заболеваниям.
В работе Bohle В. et al. (J. Immunol. 172 (11) (2004): 6642-6648) описан рекомбинантный гибридный белок, содержащий фрагмент белка S-слоя и фрагмент Bet v 1. Эта молекула содержит нативный Bet v 1 аллерген, включающий Bet v 1-специфические Т-клеточные эпитопы.
WO 2004/004761 имеет отношение к вирусоподобным частицам, которые соединены с иммуногеном и могут использоваться для иммунизации.
В работе WO 2004/003143 раскрывается использование гибридных белков, содержащих вирусоподобную частицу и аллергенную молекулу в качестве иммуногена для вакцинации.
В WO 2007/140505 и Edlmayr et al. (J. Immunol. 182 (10) (2009) 6298-6306) описано использование гибридных белков, содержащих различные молекулы-носители, соединенные с полученными от аллергенов пептидами, для индуцирования аллерген-специфических IgG антител, однако, эти конструкты не проявляют иммуномодулирующего эффекта, который может считаться благоприятным для пациентов с аллергией, такого как индукция IL-10 или Th1-иммунитета. Фиг.4 (Edlmayr et al) показывает, что KLH-слитые пептиды индуцируют Th2 цитокин IL-5, a VP1 гибридные белки не индуцируют IL-10 или IFN-гамма.
В Niespodziana et al (J. Allergy Clin. Immunol. 127 (6) (2011) 1562-1570) описано использование гибридных белков, каждый из которых содержит PreS, происходящий от вируса гепатита В, и два пептида, полученные от основного кошачьего аллергена Fel d 1, для индуцирования аллерген-специфических IgG антител. Однако, не описан режим, подходящий для вакцинации людей, и пептиды, содержащие аллерген-специфические Т-клеточные эпитопы.
Цель настоящего изобретения - предоставить медикаменты и носители, которые преодолевают вышеупомянутые проблемы и дают возможность проведения вакцинации аллергеном с уменьшенными побочными эффектами.
Следовательно, настоящее изобретение имеет отношение к полипептиду, содержащему, по меньшей мере, три пептидных фрагмента, состоящих из 10-50 последовательных аминокислотных остатков, по меньшей мере, одного аллергена дикого типа, соединенного с N- и С-концами поверхностного полипептида вируса семейства гепаднавирусов или, по меньшей мере, одним фрагментом указанного поверхностного полипептида, или содержащему поверхностный полипептид вируса семейства гепаднавирусов или, по меньшей мере, один его фрагмент, соединенный на N- и/или С-концах, по меньшей мере, с тремя пептидами, полученными, по меньшей мере, от одного аллергена дикого типа.
Для того чтобы вызвать повышенный иммунный ответ против молекулы, в частности против аллергенной или гипоаллергенной молекулы, согласно настоящему изобретению, по меньшей мере, три пептидных фрагмента, полученные, по меньшей мере, от одного аллергена дикого типа, соединяются (с помощью генной инженерии) с поверхностным полипептидом вируса из семейства гепаднавирусов, предпочтительно вируса гепатита В, более предпочтительно полипептидом PreS гепатита В, или, по меньшей мере, одним его фрагментом. Неожиданно оказалось, что в противоположность обычно и постоянно используемым белкам-носителям, подобным KLH (гемоцианин лимфы морского брюхоногого моллюска), поверхностный полипептид вируса семейства гепаднавирусов, предпочтительно вируса гепатита В, более предпочтительно полипептид PreS гепатита В, или его фрагменты приводят к повышенному образованию антител, направленных на эти пептиды и связывающихся с ними.
Более того, оказалось, что аллерген-специфические IgG антитела, индуцированные иммунизацией более, чем тремя, соответствующим образом подобранными, происходящими от аллергена пептидными фрагментами, соединенными с полипептидом PreS гепатита В, лучше нацеливаются на IgE эпитопы аллергена, в то время как иммунизация аллергеном дикого типа дает в результате IgG, направленный на все части аллергена - также и те, которые не являются IgE-реактивными. В эксперименте, нормализованном относительно титров IgG, это приводит к лучшей блокирующей способности PreS/пептида, индуцированного IgG, по сравнению с индуцированным аллергеном дикого типа (фиг. 12).
Также очень неожиданно оказалось, что в культурах человеческих РВМС гибридные белки из пептидных фрагментов, полученных от аллергена, с полипептидом PreS гепатита В сильно индуцировали цитокины IL-10 и IFN-гамма, которые относятся к положительным индикаторам успешной иммунотерапии аллергии. В противоположность этому, индукция IL-10 и IFN-гамма была значительно ниже при использовании аллергена дикого типа, отдельных пептидных фрагментов, полученных от аллергена, или PreS в отдельности (фиг. 10).
"Соединенный с N- и С-концом", при использовании в описании, означает, что, по меньшей мере, один пептид соединяется с N-концом поверхностного полипептида вируса из семейства гепаднавирусов, или, по меньшей мере, одним фрагментом указанного поверхностного полипептида, и, по меньшей мере, один пептид соединяется с С-концом поверхностного полипептида вируса из семейства гепаднавирусов или, по меньшей мере, одним фрагментом указанного поверхностного полипептида. В наиболее простом варианте осуществления настоящего изобретения поверхностный полипептид вируса из семейства гепаднавирусов или, по меньшей мере, один фрагмент указанного поверхностного полипептида, может содержать на N-конце один пептид и на С-конце два пептида или наоборот.
Полипептид настоящего изобретения предпочтительно содержит, по меньшей мере, четыре, более предпочтительно, по меньшей мере, пять, даже более предпочтительно, по меньшей мере, шесть пептидных фрагментов, предпочтительно связывающих В-клетки пептидов, происходящих от аллергена, при этом четыре пептида являются наиболее предпочтительными.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения белок-носитель является полипептидом PreS гепатита В со следующей последовательностью аминокислот (SEQ ID No. 21):
Возможно использование фрагментов PreSl гепатита В или PreS2 гепатита В полипептида PreS гепатита В. Фрагмент полипептида PreS гепатита В предпочтительно содержит или состоит, по меньшей мере, из 30, предпочтительно, по меньшей мере, 40, более предпочтительно, по меньшей мере, 50, последовательных аминокислотных остатков SEQ ID No. 21.
Использованный в описании термин "гипоаллергенный" относится к молекулам с пониженным аллергенным потенциалом или без него (т.е. IgE-реактивностью, определенной с помощью анализа связывания IgE, известного в данной области техники). Такие молекулы обладают пониженной способностью вызывать аллергические реакции у индивидуума по сравнению с белком дикого типа, от которого получены эти молекулы.
По меньшей мере, три, предпочтительно, по меньшей мере, четыре, более предпочтительно, по меньшей мере, пять, даже более предпочтительно, по меньшей мере, шесть пептидных фрагментов, соединенных с N- и С-концом поверхностного полипептида вируса семейства гепаднавирусов, или, по меньшей мере, один фрагмент указанного поверхностного полипептида состоит из или содержит 10-50 последовательных аминокислот, более предпочтительно от 15 до 50 последовательных аминокислот, в частности, 20-50 последовательных аминокислот, по меньшей мере, одного аллергена дикого типа и демонстрирует предпочтительно пониженную IgE-реактивность по сравнению с аллергеном дикого типа, из которого получены данные пептидные фрагменты. Эти пептидные фрагменты предпочтительно создаются так, чтобы исключить аллерген-специфические Т-клеточные эпитопы, которые могут вызвать опосредованные Т-клетками побочные эффекты. Т-клеточные эпитопы и молекулы, демонстрирующие уменьшенный Т-клеточный ответ, могут быть определены и идентифицированы с помощью методов, известных специалистам в данной области техники (например, Bercovici N. et al. Clin Diagn Lab Immunol. (2000) 7:859-864).
По меньшей мере, три пептидных фрагмента, состоящие из или содержащие от 10 до 50 последовательных аминокислот, более предпочтительно от 15 до 50 последовательных аминокислот, в частности 20-50 последовательных аминокислот, по меньшей мере, одного аллергена дикого типа, могут быть получены от одного и того же аллергена. Если два или более фрагментов происходят от одного и того же аллергена, эти два или более фрагментов не являются расположенными рядом (по соседству) в аллергене дикого типа и/или имеют порядок в полипептиде настоящего изобретения, который не соответствует порядку в аллергене дикого типа.
Использованный в описании термин "пептидный фрагмент" означает часть/фрагмент гипоаллергенного полипептида или гибридного белка изобретения, который происходит из первичной структуры аллергена дикого типа и содержит или состоит из 10-50 последовательных аминокислот, более предпочтительно 15-50 последовательных аминокислот, в частности 20-50 последовательных аминокислот, этого аллергена дикого типа.
Использованные в описании термины "происходящий от (полученный из) аллергена" и "происходящий от (полученный из), по меньшей мере, одного аллергена дикого типа" означают, что пептидные фрагменты согласно настоящему изобретению получают непосредственно из аллергена путем фрагментации или укорачивания. Аминокислотная последовательность этих пептидных фрагментов является предпочтительно, по меньшей мере, на 80% идентичной, более предпочтительно, по меньшей мере, на 90% идентичной, наиболее предпочтительно, по меньшей мере, на 95% идентичной, в частности, на 100% идентичной, с аминокислотным фрагментом аллергена дикого типа, из которого получены данные пептидные фрагменты. Однако, пептиды, не являющиеся на 100% идентичными фрагментам аллергена дикого типа, должны быть способны к связыванию, по меньшей мере, с 60%, предпочтительно, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80%, наиболее предпочтительно, по меньшей мере, 90% силой с антителом или антителами, предпочтительно IgG антителами, направленными на указанные фрагменты аллергена дикого типа. "По меньшей мере, один аллерген дикого типа" означает, что полипептид настоящего изобретения может содержать пептиды, связывающие В-клетки, более чем одного, предпочтительно двух, более предпочтительно трех, разных аллергенов дикого типа (т.е. источников) (например, один пептид, полученный от Bet v 1, один от Amb а 1 и один от Phl p 1 или два пептида, полученных от Bet v 1, и один от Amb a 1).
Степень идентичности первой аминокислотной последовательности со второй аминокислотной последовательностью может определяться путем прямого сравнения между обеими аминокислотными последовательностями с использованием определенных алгоритмов. Например, такие алгоритмы включены в различные компьютерные программы (например, "BLAST 2 SEQUENCES (blastp)" (Tatusova et al. (1999) FEMS Microbiol. Lett. 174:247-25; Corpet F, Nucl. Acids Res. (1988) 16:10881-10890).
Полипептиды настоящего изобретения могут быть получены рекомбинатными методами или с помощью химического синтеза. Альтернативно, также возможно получение молекул путем ферментативного или химического расщепления аллергена дикого типа или в виде полипептида/белка «укрывающего» (несущего) представляющую интерес молекулу.
Неожиданно было обнаружено, что гибридные белки-носители пептидов с улучшенными свойствами могут быть получены путем использования поверхностных белков от вирусов класса гепаднавирусов, конкретнее, вируса гепатита В человека. От одного до 20, предпочтительно от 3 или 4 до 20, более предпочтительно от 3 или 4 до 15, даже более предпочтительно от 3 или 4 до 10 (т.е. 3, 4, 5, 6, 7, 8, 9, 10), пептидных фрагментов, предпочтительно гипоаллергенных пептидных фрагментов, может быть соединено с С-концом и N-концом поверхностного полипептида вируса семейства гепаднавирусов, или, по меньшей мере, одним фрагментом указанного поверхностного полипептида. Предпочтительным вариантом осуществления текущего изобретения являются, следовательно, гибридные белки, состоящие, по меньшей мере, из 3-6 гипоаллергенных пептидных фрагментов, с белком-носителем, полученным из поверхностных антигенов вируса гепатита В человека. Согласно особенно предпочтительному варианту осуществления настоящего изобретения такие гибридные белки используют preS белок в качестве носителя. Наиболее предпочтительным вариантом осуществления этого изобретения являются гибридные белки, в которых 4 гипоаллергенных пептидных фрагмента соединены с preS белком-носителем или его фрагментом. (Гипоаллергенные) пептидные фрагменты могут быть одинаковыми или разными и могут происходить от одного или нескольких аллергенных белков, а местоположением пептидов в гибридном белке является С-конец и N-конец белка-носителя. От одного до трех (гипоаллергенных) пептидных фрагментов может быть соединено с каждым из С-конца и N-конца, так что сумма (гипоаллергенных) пептидных фрагментов, будет составлять, например, от трех или четырех до шести. Термины "слитый" или "гибридный белок" относятся к предпочтительному варианту осуществления изобретения, означая, что неаллергенный белок-носитель и (гипоаллергенные) пептидные фрагменты на С- и N-концах носителя экспрессируются и изготавливаются (получаются) в виде одной отдельной цепи рекомбинантного полипептида.
Наиболее предпочтительным вариантом осуществления текущего изобретения являются гибридные белки preS-белка вируса гепатита В, которые несут (гипоаллергенные) пептидные фрагменты, полученные от специфического аллергена, так что один или два, предпочтительно два, пептидных фрагмента соединяются (каждый) с С-концом и N-концом носителя. Для иллюстрации, предпочтительные полипептиды текущего изобретения могут иметь общую молекулярную структуру, представленную следующими типичными структурами:
Структура 1. Общий принцип создания предпочтительных вариантов осуществления
Структура 2. Общий принцип построения предпочтительных вариантов осуществления
Структура 3. Общий принцип построения предпочтительных вариантов осуществления
Понятно, что пептиды А, В, С и D могут быть одинаковыми или разными и могут быть получены от одного и того же аллергена для каждого отдельного гибридного белка или от различных антигенов.
Пептиды (гипоаллергенные) для соединения с N- и С-концом поверхностного полипептида вируса семейства гепаднавирусов или, меньшей мере, одним фрагментом указанного поверхностного полипептида, предпочтительно preS-белка или его фрагмента, предпочтительно выбирают из группы, состоящей из основных аллергенов березовой пыльцы, в частности Bet v 1 и Bet v 4, основных аллергенов пыльцы тимофеевки, в частности Phl р 1, Phl р 2, Phl р 5, Phl р 6 и Phl р 7, основных аллергенов клещей домашней пыли, в частности Der р 1, Der р 2, Der р 5, Der р 7, Der р 21 и Der р 23, основного кошачьего аллергена Fel d 1, основного аллергена амброзии Amb а 1, основных аллергенов криптомерии японской Cry j 1 и Cry j 2, основных аллергенов пчел, основных аллергенов ос, профилинов, в частности, Phl p 7, Phl р 12.
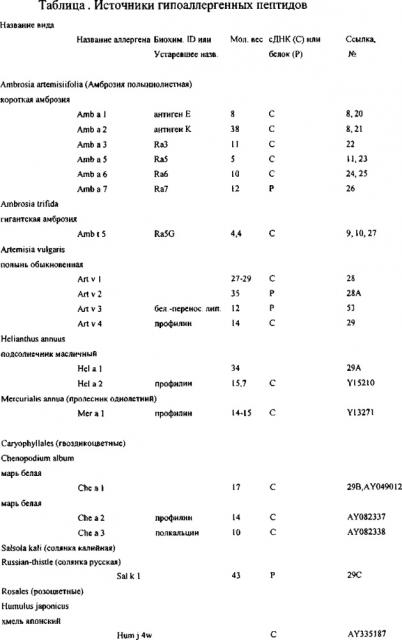
Другие подходящие для использования согласно настоящему изобретению аллергены могут быть получены из следующей таблицы, без ограничения указанной таблицей.
1 Marsh, D.G., и L.R. Freidhoff. 1992. ALBE, an allergen database. IUIS, Baltimore, MD, Edition 1.0.
2 Marsh, D.G. et al. 1986. Allergen nomenclature. Bull WHO 64:767-770.
3 King, T.P. et al. 1964. Biochemistry 3:458-468.
4 Lowenstein, H. 1980. Allergy 35:188-191.
5 Aukrust, L. 1980. Allergy 35:206-207.
6 Demerec, M. et al. 1966. Genetics 54:61-75.
7 Bodmer, J. G. et al. 1991. Immunogenetics 33:301-309.
8 Griffith, I. J. et al. 1991. Int. Arch. Allergy Appl. Immunol. 96:296-304.
9 Roebber, M. et al. 1985. J. Immunol. 134:3062-3069.
10 Metzler, W. J. et al. 1992. Biochemistry 31:5117-5127.
11 Metzler, W. J. et al. 1992. Biochemistry 31:8697-8705.
12 Goodfriend, L. et al. 1979. Fed. Proc. 38:1415.
13 Ekramoddoullah, А. K. M. et al. 1982. Mol. Immunol. 19:1527-1534.
14 Ansari, A. A. et al. 1987. J. Allergy Clin. Immunol. 80:229-235.
15 Morgenstern, J.P. et al. 1991. Proc. Natl. Acad. Sci. USA 88:9690-9694.
16 Griffith, I.J. et al. 1992. Gene 113:263-268.
17 Weber, A. et al. 1986. Biochem. Physiol. 83B:321-324.
18 Weber, A. et al. 1987. Allergy 42:464-470.
19 Stanworth, D. R. et al. 1990. Bulletin WHO 68:109-111.
20 Rafnar, T. et al. 1991. J. Biol. Chem. 266: 1229-1236.
21 Rogers, B.L. et al. 1991. J. Immunol. 147:2547-2552.
22 Klapper, D.G. et al. 1980. Biochemistry 19:5729-5734.
23 Ghosh, B. et al. 1993. J. Immunol. 150:5391-5399.
24 Roebber, M. et al. 1983. J. Immunol. 131:706-711.
25 Lubahn, В., и D.G. Klapper. 1993. J. Allergy Clin. Immunol. 91:338.
26 Roebber, M., и D.G. Marsh. 1991. J. Allergy Clin. Immunol. 87:324.
27 Goodfriend L. et al. Mol Immunol 22: 899-906, 1985.
28 Himly M. et al. FASEB J 17: 106-108, 2003.
28A Nilsen, B. M. et al. 1991. J. Biol. Chem. 266:2660-2668.
29 Wopfner N. et al. Biol Chem 383: 1779-1789, 2002.
29A Jimenez A. et al. 1994. Int Arch Allergy Immunol 105:297-307.
29B Barderas R. et al. Int Arch Allergy Immunol 127: 47-54, 2002.
29C J. et al. Allergy 56, Supplement 68: 274, 2001.
29D Giuliani A. et al. Allergy 42: 434-440, 1987.
30 Smith,P.M. et al. 1996. J. Allergy Clin. Immunol. 98:331-343.
31 Suphioglu,C. et al. 1997. FEBS Lett. 402:167-172.
31a Asturias J.A. et al. 1997. Clin Exp Allergy 27:1307-1313.
32 Mecheri, S. et al. 1985. Allergy Appl. Immunol. 78:283-289.
33 Roberts, A.M. et al. 1993. Allergy 48:615-623.
33a Guerin-Marchand,C. et al. 1996. Mol. Immunol. 33:797-806.
34 Klysner, S. et al. 1992. Clin. Exp.Allergy 22: 491-497.
35 Perez, M. et al. 1990. J. Biol. Chem. 265:16210-16215.
36 Griffith, I. J. et al. 1991. FEBS Letters 279:210-215.
37 Ansari, A. A. et al. 1989. J. Biol. Chem. 264:11181-11185.
37a Sidoli,A. etal. 1993. J. Biol. Chem. 268:21819-21825.
38 Ansari, A. A. et al. 1989. Biochemistry 28:8665-8670.
39 Singh, M. B. et al. 1991. Proc. Natl. Acad. Sci. 88:1384-1388.
39a van Ree R. et al. 1995. J Allergy Clin Immunol 95:970-978.
40 Suphioglu, C. и Singh, M.B. 1995. Clin. Exp.Allergy 25:853-865.
41 Dolecek, C. et al. 1993. FEBS Lett. 335:299-304.
41A Fischer S. et al. 1996. J Allergy Clin Immunol 98:189-198.
42 Matthiesen, F., и H. Lowenstein. 1991. Clin. Exp.Allergy 21:297-307.
43 Petersen, A. et al. 1995. Int. Arch. Allergy Immunol. 108:55-59.
43A Marknell De Witt A. et al. Clin Exp Allergy 32: 1329-1340, 2002.
44 Valenta, R. et al. 1994. Biochem. Biophys. Res. Commun. 199:106-118.
46 Esch, R. E., и D. G. Klapper. 1989. Mol. Immunol. 26:557-561.
47 Olsen, E. et al. 1991. J. Immunol. 147:205-211.
48 Avjioglu, A. et al. 1993. J. Allergy Clin. Immunol. 91:340.
52 Kos T. et al. 1993. Biochem Biophys Res Commun 196:1086-92.
53 Diaz-Perales A. et al. 2000. Clin Exp Allergy 30:1403-1410.
54 Ipsen, H., и O.C. Hansen. 1991. Mol. Immunol. 28: 1279-1288.
55 Taniai, M. et al. 1988. FEBS Lett. 239:329-332.
56 Griffith, I.J. etal. 1993. J. Allergy Clin. Immunol. 91:339.
57 Sakaguchi, M. et al. Allergy 45: 309-312, 1990.
57A Yokoyama M. et al. Biochem Biophys Res Commun 275: 195-202, 2000.
57B Midoro-Horiuti T. et al. J Immunol 164: 2188-2192, 2000.
57C Tinghino R. et al. J. Allergy Clin. Immunol. 101: 772-777, 1998.
58 Gross GN et al. Scand J Immunol 8: 437-441, 1978.
58A Obispo ТМ et al. Clin Exp Allergy 23: 311-316, 1993.
58B Midoro-Horiuti T. et al. Clin Exp Allergy 31: 771-778, 2001.
59 Lombardero M. et al. Clin. Exp.Allergy 24: 765-770, 1994.
60 Villalba, M. et al. Eur. J. Biochem. 216: 863-869, 1993.
60A Asturias JA et al. J Allergy Clin Immunol 100: 365-372, 1997.
60B Batanero Ε. et al. Eur J Biochem 241: 772-778, 1996.
60C Batanero Ε. et al. FEBS Lett. 410: 293-296, 1997.
60D Tejera ML et al. J Allergy Clin Immunol 104: 797-802, 1999.
60E Ledesma A. et al. FEBS Lett 466: 192-196, 2000.
60F Barral P. et al. J Immunol 172: 3644-3651, 2004.
61 Yi FC et al. Clin Exp Allergy 32: 1203-1210, 2002.
61A Ramos JD et al. Int Arch Allergy Immunol 126: 286-293, 2001.
62 Chua, K. Y. et al. J. Exp. Med. 167: 175-182, 1988.
62A Chua, K. Y. et al. Int. Arch. Allergy Appl. Immunol. 91: 118-123, 1990.
62B Smith AM et al. Int Arch Allergy Immunol 124: 61-63, 2001.
62C Smith AM et al. J Allergy Clin Immunol 107: 977-984, 2001.
63 Smith WA, Thomas WR. Int Arch Allergy Immunol 109: 133-140, 1996.
64 Lake, F.R. et al. J. Allergy Clin. Immunol. 87: 1035-1042, 1991.
65 Tovey, E. R. et al. J. Exp.Med. 170: 1457-1462, 1989.
66 Yasueda, H., T. Shida, T. Ando, S. Sugiyama, и H. Yamakawa. 1991. Allergenic и proteolytic properties of fourth allergens from Dermatophagoides mites. In: "Dust Mite Allergens и Asthma. Report of the 2nd international workshop" A. Todt, Ed., UCB Institute of Allergy, Brussels, Belgium, pp. 63-64.
67 Shen, H.-D. et al. Clin. Exp.Allergy 23: 934-940, 1993.
67A O'Neil GM et al. Biochim Biophys Acta,1219: 521-528, 1994.
67B King C. et al. J Allergy Clin Immunol 98: 739-747, 1996.
68 Lind P. et al. J. Immunol. 140: 4256-4262, 1988.
69 Dilworth, R. J. et al. Clin. Exp.Allergy 21: 25-32, 1991.
70 Nishiyama, C. et al. Int. Arch. Allergy Immunol. 101: 159-166, 1993.
70A Trudinger, M. et al. Clin. Exp.Allergy 21: 33-38, 1991.
71 Shen HD et al. Clin Exp Allergy 25: 1000-1006, 1995.
71A Tategaki A. et al. ACI International suppl. 1: 74-76, 2000.
72 Aki T. et al. J Allergy Clin Immunol 96: 74-83, 1995.
72A Tsai L. et al. Clin Exp Allergy 29: 1606-1613, 1999.
72B Gafvelin G. et al. J Allergy Clin Immunol 107: 511-518, 2001.
73 van Hage-Hamsten. et al. J. Allergy Clin. Immunol. 91:353, 1993.
74 Varela J. et al. Eur J Biochem 225: 93-98, 1994.
74A Schmidt M. et al. FEBS Lett 370: 11-14, 1995.
75 Eriksson TLJ et al. Eur. J. Biochem. 268: 287-294, 2001.
75A Saarne T. et al. Int Arch Allergy Immunol 130: 258-265, 2003.
75B Eriksson TL et al. Eur. J. Biochem. 251 (1-2), 443-447, 1998.
76 Rautiainen J, Rytkonen M, Pelkonen J, Pentikainen J, Perola O, Virtanen T, Zeiler T, Mantyjarvi R. BDA20, a major bovine dander allergen characterised at the sequence level is Bos d 2. Submitted.
77 Gjesing B, Lowenstein H. Ann Allergy 53:602, 1984.
78 de Groot, H. et al. J. Allergy Clin. Immunol. 87:1056-1065, 1991.
79 Konieczny, A. Personal communication; Immunologic Pharmaceutical Corp.
79A Bulone, V. Eur J Biochem 253: 202-211, 1998.
79B Swiss-Prot асе. P81216, P81217.
79C Dandeu J. P. et al. (1993). J. Chromatogr. 621:23-31.
79D Goubran Botros H. et al. 1998. J. Chromatogr. В 710:57-65.
79E Hilger C. et al. Allergy 52: 179-187; и Hilger С.et al. Gene 169:295-296, 1996.
79F Ichikawa K. et al. Clin Exp Allergy, In Press 2001.
80 Fahlbusch B. et al. Allergy 57: 417-422, 2002.
81 McDonald, B. et al. 1988. J. Allergy Clin. Immunol. 83:251.
81A Clarke, A. J. et al. 1984. EMBO J 3:1045-1052.
82 Longbottom, J. L. 1983. Characterisation of allergens from the urines of experimental animals. McMillan Press, London, pp. 525-529.
83 Laperche, Y. et al. 1983. Cell 32:453-460.
83A Bush RK et al. 1999. J Allergy Clin Immunol 104:665-671.
83B Aukrust L, Borch SM. 1979. Int Arch Allergy Appl Immunol 60:68-79.
83C Sward-Nordmo M. et al. 1988. Int Arch Allergy Appl Immunol 85:288-294.
84 Shen, et al. J. Allergy Clin. Immunol. 103:S157, 1999.
84A Crameri R. Epidemiology и molecular basis of the involvement of Aspergillus fumigatus allergic diseases. Contrib. Microbiol. Vol.2, Karger, Basel (in press).
84B Shen, et al. (manuscript submitted), 1999
84C Shen HD et al. Vacuolar serine proteinase: A major allergen of Aspergillus fumigatus. 10 International Congress of Immunology, Abstract, 1998.
85 Kumar A. et al. 1993. J. Allergy Clin. Immunol. 91:1024-1030.
85A Saxena S. et al. 2003. Clin Exp Immunol 134:86-91.
85В Baur X. et al. Allergy 57: 943-945, 2002.
86A Shen HD et al. 1996. Clin Exp Allergy 26:444-451.
86B Shen, et al. Abstract; The XVIII Congress of the European Academy of Allergology и Clinical Immunology, Brussels, Belgium, 3-7 July 1999.
87 Shen HD et al. Clin Exp Allergy 29: 642-651, 1999.
87A Shen HD et al. Clin Exp Allergy 25: 350-356, 1995.
87B Shen HD et al. J Lab Clin Med 137: 115-124, 2001.
88 Woodfolk JA et al. 1998. J Biol Chem 273:29489-96.
88A Deuell, B. et al. 1991. J. Immunol. 147:96-101.
89 Shen, H.D. et al. 1991. Clin. Exp.Allergy 21:675-681.
89A Horner WE et al. 1995. Int Arch Allergy Immunol 107:298-300.
89B Chang CY et al. J Biomed Sci 9: 645-655, 2002.
90 Yasueda H. et al. Biochem Biophys Res Commun 248: 240-244,1998. NB:strain TIMM2782 (Teikyo University Institute for Medical Mycology) equal to strain CBS 1878 (Central Bureau von Schimmelkulturen).
90A Onishi Y. et al. Eur J Biochem 261: 148-154, 1999. NB: strain TIMM2782 (Teikyo University Institute for Medical Mycology) equal to strain CBS 1878 (Central Bureau von Schimmelkulturen).
91 Schmidt M. et al. Eur J Biochem 246:181-185, 1997. NB: strain ATCC no. 42132 (American Type Culture Collection).
91A Rasool O. et al. Eur J Biochem 267: 4355-4361, 2000. NB: strain ATCC no. 42132 (American Type Culture Collection).
91B NB:; strain 4625 (Indian Agricultural Research Institute, PUSA; New Delhi, India).
92 Kuchler, K. et al. 1989. Eur. J. Biochem. 184:249-254.
93 Gmachl, M., и G. Kreil. 1993. Proc. Natl. Acad. Sci. USA 90:3569-3573.
93A Hoffman DR. 1977. J Allergy Clin. Immunol. 59:364-366.
94 Habermann, E. 1972. Science 177:314-322.
95 Hoffman DR, Jacobson RS. 1996. J. Allergy Clin. Immunol. 97:812-821.
95A Hoffman DR, El-Choufani AE, Smith MM, de Groot H. 2001. Occupational allergy to bumblebee venom: Allergens of Bombus terrestris. J Allergy Clin Immunol In press. 95B Helm R. et al. 1996. J Allerg Clin Immunol 98:172-180.
95C Pomes A. et al. 1998. J Biol Chem 273:30801-30807.
96 Arruda LK et al. J Biol Chem 270:19563-19568, 1995.
97 Arruda LK et al. J Biol Chem 270:31196-31201, 1995.
98 Arruda LK et al. Int Arch Allergy Immunol 107:295-297, 1995.
98А Wu CH et al. 1998. J Allergy Clin Immunol 101:832-840.
98B Melen E. et al. 1999. J Allergy Clin Immunol 103:859-64.
98C Wu CH et al. J Biol Chem 271:17937-17943, 1996.
98D Wu CH et al. Molecular Immunol 34:1-8, 1997.
98E Santos ABR et al. 1999. J Allergy Clin Immunol 104:329-337.
98F Asturias JA et al. 1999. J Immunol 162:4342-4348.
99 Mazur, G. et al. 1990. Monog. Allergy 28:121-137.
99A Moneo I. et al. Allergy 58: 34-37, 2003.
100 Soldatova, L. et al. 1993. FEBS Letters 320:145-149.
101 Lu, G. et al. 1994. J. Allergy Clin. Immunol. 93:224.
102 Fang, K. S. F. et al. 1988. Proc. Natl. Acad. Sci., USA 85:895-899.
103 King, T. P. et al. 1990. Prot. Seq. Data Anal. 3:263-266.
104 Lu, G. et al. 1993. J. Immunol. 150: 2823-2830.
105 King, T. P. и Lu, G. 1997. Unpublished data.
105A King TP et al. 1996. J. Allergy Clin. Immunol. 98:588-600.
106 Hoffman, D.R. 1993. J. Allergy Clin. Immunol. 92:707-716.
107 Hoffman DR. 1992. Unpublished data.
108 Hoffman DR. J. Allergy Clin. Immunol. 91:187, 1993.
109 Jacobson RS et al. J. Allergy Clin. Immunol. 89:292, 1992.
110 Hoffman DR. J. Allergy Clin. Immunol 91: 71-78, 1993.
111 Schmidt M. et al. FEBS Letters 319: 138-140, 1993.
111A Paddock CD et al. J Immunol 167: 2694-2699, 2001.
112 Elsayed S, Bennich H. Scand J Immunol 3: 683-686, 1974.
113 Elsayed S. et al. Immunochemistry 9: 647-661, 1972.
114 Hoffman, D. R. 1983. J. Allergy Clin. Immunol. 71: 481-486.
115 Langeland, T. 1983. Allergy 38:493-500.
116 Daul CB, Slattery M, Morgan JE, Lehrer SB. 1993. Common crustacea allergens: identification of В cell epitopes with the shrimp specific monoclonal antibodies. In: "Molecular Biology и Immunology of Allergens" (D. Kraft и A. Sehon, eds.). CRC Press, Boca Raton, pp. 291-293.
116A Shanti KN et al. J. Immunol. 151:5354-5363, 1993.
117 Yu CJ et al. J Immunol 170: 445-453, 2003.
117A Miyazawa M et al. J. Allergy Clin. Immunol. 98: 948-953, 1996.
117B Asturias JA et al. Int Arch Allergy Immunol 128: 90-96, 2002.
117C Lopata AL et al. J. Allergy Clin. Immunol. 100: 642-648, 1997.
117D Hoffmann-Sommergruber K. et al. Clin. Exp.Allergy 29: 840-847, 1999.
118 Monsalve RI et al. Biochem. J. 293: 625-632 1993.
118A. Monsalve RI et al. 1997. Clin Exp Allergy 27:833-841.
119 Mena, M. et al. Plant Molec. Biol. 20: 451-458, 1992.
119A Palosuo K. et al. J. Allergy Clin. Immunol. 108: 634-638, 2001.
119B Xu H. et al. Gene 164: 255-259, 1995.
119C Pastorello EA et al. J. Allergy Clin. Immunol. 94: 699-707, 1994.
119D Diaz-Perales A. et al. J Allergy Clin Immunol 110: 790-796, 2002.
119E Galleguillos F, Rodriguez JC. Clin Allergy 8: 21-24, 1978.
119F Baur X. Clin Allergy 9: 451-457, 1979.
119G Gailhofer G. et al. Clin Allergy 18: 445-450, 1988.
120 Menendez-Arias, L. et al. 1988. Eur. J. Biochem. 177:159-166.
120A Gonzalez R. et al. Lancet 346:48-49, 1995.
120B Kleine-Tebbe J. et al. J Allergy Clin Immunol 110: 797-804, 2002.
120C Sanchez-Monge R. et al. J. Allergy Clin. Immunol. 106: 955-961, 2000.
121 Gavrovic-Jankulovic M. et al. J Allergy Clin Immun ol 110: 805-810, 2002.
121A Pastorello EA et al. J. Chromatogr. В Biomed. Sci. Appl. 756: 85-93, 2001.
121B Moneo I. et al. J. Allergy Clin. Immunol. 106: 177-182, 2000.
121C Asturias JA et al. 2000. Allergy 55:898-890.
122 Christie, J. F. et al. 1990. Immunology 69:596-602.
122A Baur X. et al. Clin Allergy 12: 9-17, 1982.
122B Onisuka R. et al. Int Arch Allergy Immunol 125: 135-143, 2001.
123 Czuppon AB et al. J Allergy Clin Immunol 92:690-697, 1993.
124 Attanayaka DPSTG et al. 1991. Plant Mol Biol 16:1079-1081.
125 Chye ML, Cheung KY. 1995. Plant Mol Biol 26:397-402.
126 Alenius H. et al. 1993. Int Arch Allergy Immunol 102:61-66.
127 Yeang HY, Cheong KF, Sunderasan E, Hamzah S, Chew NP, Hamid S, Hamilton RG, Cardosa MJ. 1996. The 14.6 kD (REF, Hev b 1) и 24 kD (Hev b 3) rubber particle proteins are recognised by IgE from Spina Bifida пациентз with Latex allergy. J Allerg Clin Immunol in press.
128 Sunderasan E. et al. 1995. J nat Rubb Res 10:82-99.
129 Swoboda I. et al. 2002. J Immunol. 168:4576-84.
130 Vrtalaetal., 2007. J Immunol. 179:1731-1739.
131 Valenta и Niederberger, 2007. J Allergy Clin Immunol. 119(4):826-830.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, один, предпочтительно, по меньшей мере, два, более предпочтительно, по меньшей мере, три, в частности все, по меньшей мере, из трех пептидов полученных, по меньшей мере, из одного аллергена дикого типа, представляет собой пептид, связывающий В-клетки.
"Пептиды, связывающие В-клетки," пригодные для вакцинации против аллергии согласно изобретению, получают из или рядом с IgE-связывающими участками аллергенов, однако сами по себе они демонстрируют отсутствие или минимальную IgE-реактивность по сравнению с аллергеном дикого типа (Focke M et al. Clinical & Experimental Allergy 40(2010):385-397). Требованиями в отношении их получения и отбора являются знание первичной последовательности аллергена и рассмотрение IgE-связывающих участков. После иммунизации, пептиды, связывающие В-клетки, соединенные с подходящим иммуногенным носителем, способны индуцировать выработку аллерген-специфического IgG, который может препятствовать связыванию IgE с аллергеном. Может ли индуцированный с помощью гибридного белка IgG распознавать аллерген, можно определить, например, путем проверки IgG на реакционную способность с полным аллергеном. Подходящие способы включают ELISA, дот-блот-анализ или вестерн-блоттинг. Предпочтительными являются пептиды, которые индуцируют IgG, препятствующий связыванию IgE пациентов с аллергеном.
Настоящее изобретение показывает, что использование пептидов, связывающих В-клетки, в частности, когда три или более соединяются с подходящим носителем согласно настоящему изобретению, обеспечивает возможность индукции IgG ответов, которые лучше нацеливаются на IgE-эпитопы, чем ответы, вызванные иммунизацией даже полным аллергеном. Более того, изобретение показывает, что комбинация соответствующих пептидов и их количеств с подходящим носителем может направить аллерген-специфический иммунный ответ по направлению к благоприятному антиаллергическому иммунному ответу (отличающемуся индукцией преимущественно аллерген-специфического IgG-ответа и отсутствием IgE-ответа и толерогенных (вызывающих иммунную толерантность) (IL-10) и Th1 (интерферон гамма) цитокиновых ответов.
Более того, неожиданно оказалось, что (несмотря на то, что они утратили аллерген-специфические Т-клеточные эпитопы) полипептиды согласно изобретению, содержащие 3 или более пептидов, связывающих В-клетки, соединенные с иммуногенным носителем, являются способными уменьшить аллерген-специфические Т-клеточные реакции. Об этом свидетельствует тот факт, что наличие аллерген-специфического IgG, индуцированного терапевтической вакцинацией гипоаллергенными полипептидами настоящего изобретения, уменьшает аллерген-специфическую Т-клеточную активацию, вызванную IgE-облегченной презентацией антигена в РВМС (мононуклеарных клетках периферической крови), полученных от вакцинированных людей-аллергиков (фиг.16).
Согласно предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, один, по меньшей мере, из трех указанных пептидов демонстрирует отсутствие или уменьшенную IgE-связывающую способность по сравнению с аллергеном дикого типа.
Согласно другому предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, один, предпочтительно, по меньшей мере, два, более предпочтительно, по меньшей мере, три, из указанных, по меньшей мере, трех пептидов, связывающих В-клетки, демонстрирует отсутствие или в основном отсутствие Т-клеточной реактивности.
Наличие аллерген-специфических Т-клеточных эпитопов может вызывать нежелательные побочные эффекты, опосредованные Т-клетками. Поэтому, особенно предпочтительно использовать пептиды, демонстрирующие отсутствие или в основном отсутствие Т-клеточной реактивности, для того чтобы получить полипептиды настоящего