Способ культивирования клеток амниотической жидкости
Иллюстрации
Показать всеИзобретение относится к области медицинской диагностики. Изобретение представляет собой способ культивирования клеток амниотической жидкости, включающий добавление к клеткам амниотической жидкости питательной среды и инкубирование во флаконах, несколько смен питательной среды с последующей обработкой клеток колхицином, открепление клеток от дна флакона, гипотоническую обработку и обработку фиксатором, где в качестве питательной среды используют «Амниомакс» или питательную среду «Амниокар» в соотношении исходная проба : среда, равном 1,4:1, первую смену среды проводят через 5 дней от начала культивирования с предварительной обработкой клеток раствором Хенкса в соотношении 2,3:1, последующие смены среды осуществляют через каждые 2 дня, далее через 6-8 дней от начала культивирования проводят трипсинизацию с помощью 0,05% раствора трипсин-ЭДТА в течение 2-3 минут при 37°С, при этом первую трипсинизацию проводят в одном из флаконов на культуре клеток с самым активным ростом, на следующий день проводят трипсинизацию во втором флаконе со средним ростом, еще через сутки - в третьем флаконе с минимальным ростом, проводят обработку клеток колхицином с концентрацией 1 мкг/мл в течение 2,5 часов при 37°С в присутствии 5% СО2, открепление клеток от дна флакона осуществляют 0,05% раствором трипсин-ЭДТА в течение 2-3 минут при 37°С, гипотоническую обработку клеток проводят водным раствором эмбриональной телячьей сыворотки (2:1) в течение 20 минут при 37°С, а фиксацию клеток осуществляют раствором, содержащим этанол и ледяную уксусную кислоту в соотношении 3:1. Изобретение позволяет ускорить способ и повысить выход культивируемых клеток. 1 ил., 1 табл., 2 пр.
Реферат
Способ культивирования клеток амниотической жидкости.
Предлагаемое изобретение относится к области медицинской диагностики и касается культивирования клеток плода из амниотической жидкости, которые могут быть использованы затем в диагностических или научных целях, в частности, для выявления количественных и структурных аномалий хромосом у плода.
Хромосомные болезни занимают существенное место в структуре наследственной и врожденной патологии человека. Среднее число больных с хромосомными болезнями в России составляет около 400 тыс. человек. Учитывая тяжелое течение, инвалидизацию, а иногда и раннюю гибель больных с хромосомными нарушениями, первостепенное значение приобретает проблема профилактики данных заболеваний. Как известно, изменение нормального количества или структуры хромосом является одной из многочисленных причин нарушения нормального пренатального развития. Подсчитано, что частота хромосомных аномалий у детей с множественными врожденными пороками развития (МВПР) достигает 50%. В многочисленных исследованиях отечественных и зарубежных авторов показано, что 60-75% спонтанно абортированных эмбрионов имеют хромосомные аномалии. При этом около 0,6% новорожденных имеют хромосомные болезни [1]. Ввиду этого огромное значение приобретает пренатальная цитогенетическая диагностика, позволяющая предупредить хромосомные болезни путем элиминации плодов с нарушениями кариотипа.
Известно, что наиболее безопасным способом пренатальной цитогенетической диагностики по способу получения материала является амниоцентез [2]. Осажденные путем центрифугирования клетки амниотической жидкости подвергают размножению в присутствии стимуляторов клеточного роста в составе специальных питательных сред, блокируют митоз на стадии метафазы, после обработки клеток гипотоническим раствором и фиксации готовят препараты хромосом, затем проводят цитогенетический анализ. Следует отметить, что процент живых клеток в пробах амниотической жидкости (АЖ) составляет лишь 10-20% [3].
Основными недостатками известного способа являются значительная длительность культивирования (14-21 день), получение недостаточного количества материала для проведения полного анализа, наличие артефактного (обусловленного культивированием) мозаицизма, опасность инфицирования культуры, высокая стоимость реактивов и расходных материалов.
Известен способ культивирования клеток АЖ и фибробластов человека в среде «Амниокар», обеспечивающей эффективное прикрепление и пролиферацию клеточного материала в составе монослоя, отличающийся тем, что инкубирование первичных амниоцитов проводят в вентилируемых культуральных флаконах в атмосфере 5% СО2 и выдерживают в течение 11 дней с осуществлением полной смены среды через 72 ч после начала инкубации [4].
Недостатками известного способа являются:
1. Ранняя смена среды (через 72 ч после начала инкубации), приводящая к потере не успевших прикрепиться клеток, а также к дополнительному расходу дорогостоящей питательной среды.
2. Отсутствие перед первой сменой среды этапа обработки культуры раствором Хенкса, необходимого для максимального удаления погибших, неприкрепившихся клеток.
3. Отсутствие трипсинизации культуры для получения равномерного монослоя клеток с синхронизированным клеточным циклом. Колонии первичных амниоцитов, растущие во флаконе без трипсинизации, не синхронизированы, что не позволяет в дальнейшем получить достаточное для анализа количество метафазных пластинок.
4. Низкое качество получаемых метафазных пластинок, не удовлетворяющее необходимым критериям для проведения анализа [5].
Наиболее близким к заявляемому способу – прототипом- является способ культивирования клеток амниотической жидкости [6], заключающийся в следующем. Образцы АЖ, взятые методом амниоцентеза, в количестве 10-20 мл собирают в стерильные флаконы, разливают в 2-3 стерильные центрифужные пробирки и центрифугируют в течение 10 мин (1000 об/мин). В пробирке оставляют около 1,5 мл АЖ с осадком клеток, который ресуспендируют в эмбриональной телячьей сыворотке (ЭТС), добавляют по 3-5 мл питательной среды, состоящей из 80% среды RPMI-1640 (НЛП «ПанЭко», Россия), Ham's F-12 («Merck», Германия) и 20% ЭТС. В культуру добавляют антибиотики, флаконы с клетками помещают в СО2-инкубатор при +37°C на 72 ч, затем производят смену культуральной смеси. Последующие смены культуральной смеси производят каждые 3-5 дней. В конце 2-й - начале 3-й недели культивирования проводят первую фиксацию клеток, при этом готовность клеток оценивают под инвертированным микроскопом. Перед фиксацией за 24 ч проводят смену питательной среды. Затем во флакон вводят колхицин и помещают на 4-5 ч в термостат при +37°C, сливают питательную среду и добавляют 2-3 мл раствора трипсин-версена (1:1). Через 2 мин этот раствор вместе с частью открепившихся клеток сливают в центрифужную пробирку с 2 мл холодной среды Игла (НЛП «ПанЭко», Россия) для ингибирования действия трипсина. После повторения этой процедуры к клеточной суспензии добавляют холодную среду до объема 10-15 мл и пробирки центрифугируют 5 мин (1000 об/мин), супернатант удаляют, оставляя около 1 мл жидкости над осадком. После проведения гипотонической обработки в течение 40 мин при 37°C пробирки центрифугируют 5 мин, супернатант удаляют, к клеточной суспензии приливают 7-10 мл фиксатора I (метанол, ледяная уксусная кислота 2:1) и оставляют на 15 мин при +4°C. Смену фиксатора I осуществляют дважды на фиксатор II (метанол, ледяная уксусная кислота 3:1). После удаления надосадочной жидкости ресуспендированый осадок клеток раскапывают на чистые охлажденные предметные стекла и высушивают на воздухе. Продолжительность культивирования клеток АЖ составляет 14 и более дней.
Недостатками прототипа являются:
1. Ранняя смена среды (через 72 ч после начала инкубации), приводящая к потере не успевших прикрепиться клеток, а также к дополнительному расходу дорогостоящей питательной среды.
2. Отсутствие перед первой сменой среды этапа обработки культуры раствором Хенкса, необходимого для максимального удаления погибших, неприкрепившихся клеток.
3. Отсутствие трипсинизации культуры, необходимой для получения равномерного монослоя клеток с синхронизированным клеточным циклом.
4. Слишком длительная (4-5 часов) обработка клеток колхицином, что может приводить к недостаточному количеству на препаратах метафаз с длинными хромосомами, необходимыми для проведения детального структурного анализа кариотипа плода.
5. Обработка колхицином в термостате без поддержания необходимого для нормального роста клеток уровня углекислого газа (5%), что приводит к гибели части клеток.
6. Использование для фиксации клеток смеси метанола и этилового спирта, что создает угрозу здоровью персонала, так как метанол является ядом.
Техническим результатом изобретения является ускорение способа и повышение выхода культивируемых клеток.
Технический результат достигается предлагаемым способом, заключающимся в следующем.
Образцы АЖ, взятые методом амниоцентеза (21 мл), собирают в стерильные флаконы и доставляют в лабораторию. АЖ разделяют на три равные аликвоты, помещают в пробирки, центрифугируют, удаляют супернатант, осадок ресуспендируют в АЖ. Затем добавляют питательную среду «Амниомакс», либо «Амниокар» в соотношении исходная проба : среда, равном 1,4:1, и инкубируют в культуральных флаконах SPL при 37°C, 5% СО2. Первую смену среды проводят через 5 дней от начала культивирования с предварительной обработкой клеток раствором Хенкса в соотношении 2,3:1, последующие смены среды осуществляют через каждые 2 дня. Через 6-8 дней от начала культивирования для получения синхронизированной культуры клеток проводят трипсинизацию 0,05% раствором трипсин-ЭДТА (НЛП «ПанЭко», Россия) при температуре 37°C в течение 2-3 минут. Смену питательной среды проводят через 1-2 дня после трипсинизации, еще через 18-19 часов - фиксацию материала (по достижении клеточного монослоя достаточной плотности). Для блокирования митоза на стадии метафазы обрабатывают культуры раствором колхицина (конечная концентрация 1 мкг/мл) в течение 2,5 часов при 37°C, 5% СО2. Затем проводят гипотонию клеток путем обработки водным раствором эмбриональной телячьей сыворотки (2:1) в течение 20 мин при 37°C. После этого клетки фиксируют смесью 95% этанола и ледяной уксусной кислоты (3:1), готовят препараты, обрабатывают их готовым 0,25% раствором трипсина и окрашивают красителем Гимза по общепринятой методике [2].
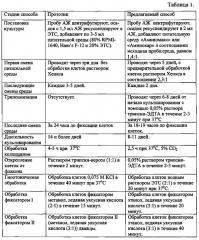
Предлагаемый способ позволяет сократить длительность культивирования клеток АЖ до 8-11 дней (14 и более дней - в прототипе), повысить выход культивируемых клеток, снизить вероятность контаминации культур и вероятность артефактного (связанного с культивированием) мозицизма, фиксировать клетки без использования метанола, являющегося ядом. Сопоставительный анализ заявляемого способа по сравнению с прототипом представлен в таблице 1.
Определяющими отличиями предлагаемого способа по сравнению с прототипом являются:
1. К пробе АЖ добавляют питательную среду «Амниомакс» или «Амниокар» в соотношении исходная проба : среда, равном 1,4:1, что позволяет повысить выход культивируемых клеток за счет повышения эффективности размножения пролиферативно малоактивных клеток.
2. Первую смену питательной среды проводят через 5 дней от начала культивирования с предварительной обработкой клеток раствором Хенкса, что позволяет повысить выход целевых клеток за счет максимального удаления погибших, неприкрепившихся клеток, а последующие смены среды осуществляют через каждые 2 дня, что обеспечивает активный рост клеток.
3. Трипсинизацию, необходимую для синхронизации культуры клеток, проводят 0,05% раствором трипсин-ЭДТА через 6-8 дней от начала культивирования при температуре 37°C в течение 2-3 минут, что позволяет добиться отделения от флакона практически всех колоний, но при этом сохранить максимальное количество жизнеспособных клеток.
Преимущественно первую трипсинизацию проводят в одном из флаконов на культуре клеток с самым активным ростом, на следующий день проводят трипсинизацию во втором флаконе (со средним ростом), еще через сутки - в третьем (с минимальным из трех флаконов ростом), что обеспечивает разнесение во времени процесса фиксации клеток, культивируемых в трех флаконах, а также позволяет избежать при трипсинизации и фиксации неудач, затрагивающих одновременно более одного флакона.
4. Для блокирования митоза на стадии метафазы культуры преимущественно используют колхицин с конечной концентрацией 1 мкг/мл в течение 2,5 часов при 37°C, 5% CO2, что позволяет получить достаточное для анализа количество метафазных пластинок и получить хромосомы достаточной для анализа длины.
5. Для фиксации клеток преимущественно используют этанол, который в отличие от метанола не ядовит.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1
Амниотическую жидкость (20 нед. беременности) отбирали в количестве 21 мл в операционной, помещали в стерильный пластиковый культуральный флакон SPL (25 см2, вентилируемая крышка с фильтром), транспортировали в лабораторию. Амниотическую жидкость разделяли на три равные аликвоты (по 7 мл) в стерильные пластиковые конические пробирки объемом 15 мл. Центрифугировали 7 мин при 1,5 тыс. об/мин, супернатант удаляли. В пробирке оставляли 2 мл амниотической жидкости с осадком клеток, который ресуспендировали, добавляли 5 мл питательной среды «Амниомакс» (Gibco® AmnioMAX™ С-100 Complete Medium, «Invitrogen», США) и инкубировали в культуральных флаконах SPL 5 дней при 37°C, 5% CO2. После удаления среды из флаконов клетки промывали 3 мл раствора Хенкса (обработку проводили дважды). Затем добавляли по 5 мл питательной среды в каждый флакон. Далее контроль роста клеточных культур проводили ежедневно. Количество и плотность колоний в каждом флаконе заносили в лабораторный журнал. Трипсинизацию проводили готовым 0,05% раствором трипсин-ЭДТА в первом флаконе через 6 дней от начала культивирования, во втором - через 7 дней, в третьем - через 8 дней. Для этого после сливания питательной среды во флакон добавляли теплый (37°C) раствор трипсин-ЭДТА (3 мл), выдерживали 20 с, сливали раствор трипсин-ЭДТА. Обработку проводили дважды, затем флакон выдерживали 30 с, энергично встряхивали, отделение клеток от дна флакона контролировали под инвертированным микроскопом. Общее время обработки клеток трипсином-ЭДТА составляло 2-3 мин После отделения клеток во флакон добавляли питательную среду (5 мл). Далее проводили смену среды во всех флаконах через сутки после трипсинизации, еще через 19 часов - фиксацию. Обрабатывали культуры клеток раствором колхицина (конечная концентрация 1 мкг/мл) в течение 2,5 часов при 37°C, 5% CO2. Затем сливали среду из флакона в центрифужную пробирку. Культуральный флакон обрабатывали теплым (37°C) 0,05% раствором трипсин-ЭДТА (3 мл), встряхивали флакон, контролировали отделение клеток от дна флакона под микроскопом. Раствор трипсин-ЭДТА с отделившимися клетками сливали в ту же центрифужную пробирку. Обработку проводили дважды. Общее время обработки клеток 0,05% раствором трипсин-ЭДТА составляло 2-3 мин. После центрифугирования и удаления супернатанта добавляли в пробирку 10 мл теплого (37°C) гипотонического раствора (вода, эмбриональная телячья сыворотка 2:1) для наполнения клеток водой и лучшего распластывания хромосом при приготовлении препаратов, суспендировали, выдерживали 20 мин при 37°C.
Затем добавляли 5 капель фиксатора, суспендировали, центрифугировали, удаляли супернатант, добавляли 7 мл фиксатора (этанол, уксусная кислота 3:1) для фиксации клеток, суспендировали, выдерживали пробирку 20 мин при 4°C. Центрифугировали, удаляли супернатант, добавляли 10 мл фиксатора, суспендировали, выдерживали 40 мин при 4°C. Центрифугировали, удаляли супернатант, оставив 1 мл с осадком. Добавляли фиксатор до 2-2,5 мл (в зависимости от осадка), суспендировали. Суспензию раскапывали на обезжиренные, холодные, влажные предметные стекла. Полученные препараты высушивали в течение 20 мин под струей теплого воздуха, окрашивали по общепринятой методике [2]. Необходимый для анализа материал получили с первого флакона через 8 дней от начала культивирования, со второго флакона - через 9 дней, с третьего - через 10 дней.
Показатель митотического индекса определяли как отношение количества метафазных пластинок, приходящееся на общее количество в 1000 ядер, выраженное в процентах. Митотический индекс составил 6,6%.
Провели анализ 50 метафазных пластинок для исключения мозаицизма, поскольку в одной метафазе была обнаружена маркерная хромосома. Кариотип плода: 46, XY.
На фиг. 1 представлена микроскопическая картина группы метафазных пластинок, обладающих высоким качеством и удовлетворяющих необходимым критериям для проведения анализа.
Пример 2.
Амниотическую жидкость (16 нед. беременности) отбирали в количестве 21 мл в операционной, помещали в стерильный пластиковый культуральный флакон SPL, транспортировали в лабораторию. Амниотическую жидкость разделяли на три равные аликвоты (7 мл), помещали в стерильные пластиковые конические пробирки объемом 15 мл, центрифугировали 7 мин при 1,5 тыс.об./мин, супернатант удаляли. В пробирке оставляли 2 мл амниотической жидкости с осадком клеток, который ресуспендировали, добавляли 5 мл питательной среды «Амниокар» (НЛП «ПанЭко», Россия) и инкубировали в культуральных флаконах SPL 5 дней при 37°C, 5% CO2. После удаления среды из флаконов промывали клетки 3 мл раствора Хенкса (обработку проводили дважды). Затем добавляли по 5 мл питательной среды в каждый флакон. Далее контроль роста клеточных культур проводили ежедневно. Количество и плотность колоний в каждом флаконе заносили в лабораторный журнал. Трипсинизацию проводили готовым раствором трипсина-ЭДТА (0,05%) в первом флаконе через 7 дней от начала культивирования, во втором - через 8 дней, в третьем - через 9 дней. Для этого после сливания питательной среды во флакон добавляли теплый (37°C) раствор трипсин-ЭДТА (3 мл), выдерживали 20 с, сливали раствор трипсин-ЭДТА. Обработку проводили дважды, затем флакон выдерживали 30 с, энергично встряхивали, отделение клеток от дна флакона контролировали под инвертированным микроскопом. Общее время обработки клеток трипсином-ЭДТА составляло 2-3 мин. После отделения клеток во флакон добавляли питательную среду (5 мл). Проводили смену среды в первом и втором флаконах через два дня после трипсинизации, в третьем - через день после трипсинизации, через 18 часов проводили фиксацию материала. Обрабатывали культуры раствором колхицина (конечная концентрация 1 мкг/мл) в течение 2,5 часов при 37°C, 5% CO2. Затем сливали среду из флакона в центрифужную пробирку. Культуральный флакон обрабатывали теплым (37°C) 0,05% раствором трипсин-ЭДТА (3 мл), встряхивали флакон, контролировали отделение клеток от дна флакона под микроскопом. Раствор трипсин-ЭДТА с отделившимися клетками сливали в ту же центрифужную пробирку. Обработку проводили дважды. Общее время обработки клеток 0,05%) раствором трипсин-ЭДТА составляло 2-3 мин. После центрифугирования и удаления супернатанта добавляли в пробирку 10 мл теплого (37°C) гипотонического раствора (вода, эмбриональная телячья сыворотка 2:1) для наполнения клеток водой и лучшего распластывания хромосом при приготовлении препаратов, суспендировали, выдерживали 20 мин при 37°C.
Затем добавляли 5 капель фиксатора, суспендировали, центрифугировали, удаляли супернатант, добавляли 7 мл фиксатора (этанол, уксусная кислота 3:1) для фиксации клеток, суспендировали, выдерживали пробирку 20 мин при 4°C. Центрифугировали, удаляли супернатант, добавляли 10 мл фиксатора, суспендировали, выдерживали 40 мин при 4°C. Центрифугировали, удаляли супернатант, оставив 1 мл с осадком. Добавляли фиксатор до 2-2,5 мл (в зависимости от осадка), суспендировали. Суспензию раскапывали на обезжиренные, холодные, влажные предметные стекла. Полученные препараты высушивали в течение 20 мин под струей теплого воздуха, окрашивали по общепринятой методике [2]. Необходимый для анализа материал получили с первого флакона через 10 дней от начала культивирования, со второго и третьего флаконов - через 11 дней. Митотический индекс составил 4,4%.
Провели исследование 26 метафазных пластинок, использовали для анализа дополнительный вид окрашивания - С-окрашивание, поскольку при анализе G-окрашенных хромосом был обнаружен полиморфный вариант (9ph). С-окрашивание проводили по общепринятой методике [2]. Кариотип плода: 46,XX,9ph.
Предлагаемый способ позволяет получать с каждого флакона в течение 8-11 дней большое количество (2-2,5 мл) суспензии культивированных клеток плода из амниотической жидкости, которой достаточно для приготовления 24-35 препаратов (для анализа обычно используются 2-10 препаратов). Препараты, приготовленные из суспензии, отличаются высоким митотическим индексом (4-6,9). Количество и качество метафаз достаточно для проведения полного цитогенетического исследования (в случае подозрения на мозаицизм анализ до 100 метафазных пластинок, при необходимости применение дополнительных методов диагностики). Сокращение времени культивирования позволяет сэкономить дорогостоящие реактивы, расходные материалы и рабочее время. Кроме того, оптимизированный способ позволяет свести к минимуму вероятность возникновения артефактной патологии и контаминации культур за счет сокращения срока культивирования и однократной трипсинизации при ведении культуры.
Источники информации
1. B.C. Баранов, Т.В. Кузнецова, Т.Э. Иващенко; под ред. B.C. Баранова и Э.К. Айламазяна Современные алгоритмы пренатальной диагностики наследственных болезней: методические рекомендации. СПб Издательство Н-Л., 2009. 80 с.
2. Баранов B.C., Кузнецова Т.В. Цитогенетика эмбрионального развития человека. СПб Издательство Н-Л, 2007. 640 с.
3. Nelson М.М. Amniotic fluid cell culture and chromosomes studies. In: Antenatal Diagnosis of Genetic Disease. Edinburg-London: Williams a. Wilkins. 1973. P. 69-81.
4. Патент RU 2415929 C2, оп. 10.04.20115. Антоненко В.Г., Лильп И.Г. Рекомендации по обеспечению качества и надежности цитогенетических исследований. Европейские стандарты для цитогенетических исследований конститутивных и приобретенных хромосомных аномалий. Москва. 2007. 34 с.
6. Назаренко С.А., Васильева Е.О. Тест-система внешнего контроля качества цитогенетических исследований в учреждениях медико-генетической службы: пособие для врачей. Томск: «Печатная мануфактура». 2003. 34 с.
Способ культивирования клеток амниотической жидкости, включающий добавление к клеткам амниотической жидкости питательной среды и инкубирование во флаконах, несколько смен питательной среды с последующей обработкой клеток колхицином, открепление клеток от дна флакона, гипотоническую обработку и обработку фиксатором, отличающийся тем, что в качестве питательной среды используют «Амниомакс» или питательную среду «Амниокар» в соотношении исходная проба : среда, равном 1,4:1, первую смену среды проводят через 5 дней от начала культивирования с предварительной обработкой клеток раствором Хенкса в соотношении 2,3:1, последующие смены среды осуществляют через каждые 2 дня, далее через 6-8 дней от начала культивирования проводят трипсинизацию с помощью 0,05% раствора трипсин-ЭДТА в течение 2-3 минут при 37°С, при этом первую трипсинизацию проводят в одном из флаконов на культуре клеток с самым активным ростом, на следующий день проводят трипсинизацию во втором флаконе со средним ростом, еще через сутки - в третьем флаконе с минимальным ростом, проводят обработку клеток колхицином с концентрацией 1 мкг/мл в течение 2,5 часов при 37°С в присутствии 5% СО2, открепление клеток от дна флакона осуществляют 0,05% раствором трипсин-ЭДТА в течение 2-3 минут при 37°С, гипотоническую обработку клеток проводят водным раствором эмбриональной телячьей сыворотки (2:1) в течение 20 минут при 37°С, а фиксацию клеток осуществляют раствором, содержащим этанол и ледяную уксусную кислоту в соотношении 3:1.