Рекомбинантный штамм vv-gmcsf/lact-dgf вируса осповакцины, обладающий онколитической активностью и продуцирующий секретируемый химерный белок, состоящий из гранулоцитарно-макрофагального колониестимулирующего фактора человека и онкотоксического белка лактаптина
Иллюстрации
Показать всеПредставленный рекомбинантный штамм обладает адресной онколитической активностью и продуцирует секретируемый химерный белок, состоящий из ГМ-КСФ человека и лактаптина (GMCSF/lact). Штамм VV-GMCSF/lact-dGF сконструирован на основе штамма Л-ИВП вируса осповакцины, содержащего делеции фрагментов генов вирусной тимидинкиназы и ростового фактора. В район делеции гена тимидинкиназы встроен трансген химерного белка GMCSF/lact, в состав которого входит генный адьювант ГМ-КСФ, соединенный через гибкий линкер GlyGlyGlySer с онкотоксическим пептидом лактаптином. Заявленный штамм имеет сниженную более чем в 100 раз вирулентность по сравнению с исходным штаммом Л-ИВП, а также высокую адресную онколитическую активность в отношении клеток опухолей человека различного генеза. Штамм депонирован в Государственную коллекцию возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под регистрационным номером V-711 (18.04.2016). Изобретение обеспечивает дополнительную аттенуацию вируса VACV в отношении нормальных клеток и усиливает его литическую активность в отношении раковых клеток, а также может быть использовано в биотехнологии. 8 ил., 3 табл., 6 пр.
Реферат
Изобретение относится к рекомбинантному штамму вируса осповакцины (VACV), продуцирующему секретируемый химерный белок, состоящий из гранулоцитарно-макрофагального колониестимулирующего фактора человека (ГМ-КСФ) и онкотоксического белка лактаптина. Оба белка в химере сохраняют свои биологические свойства, а рекомбинантный штамм обладает онколитической активностью в отношении опухолей человека и может быть использован в биотехнологии, в частности, в генетической инженерии для разработки лекарственных средств нового поколения для борьбы с онкологическими заболеваниями, в частности раком молочной железы.
Адьювантные свойства ГМ-КСФ хорошо известны и широко используются при создании различных протективных и терапевтических вакцин (Weisbart, 1985; Fleischmann, 1986; Gaudernack, 1999; Warren, 2000; Morrissey, 1987; Yoon, 2006; Somasundaram, 2015 [1-7]). ГМ-КСФ эффективно стимулирует противоопухолевый иммунный ответ в комбинации с клеточными, вирусными и ДНК-вакцинными препаратами (Somasundaram, 2015; Lai, 2011; Hellerstein, 2012; Zhang, 2015; Chen, 2014; Fowler, 2012; Zheng, 2011 [7-13]). Показано, что ГМ-КСФ усиливает индукцию первичного иммунного ответа за счет активации и рекрутирования (chemo-attraction) антиген-презентирующих клеток (Weisbart, 1985; Fleischmann, 1986 [1-2]). ГМ-КСФ усиливает пролиферацию Т-клеток и индуцирует продукцию как Th1, так и Th2 (Morrissey, 1987; Yoon, 2006 [5-6]). ГМ-КСФ работает как генетический адьювант при совместном введении в клетку ДНК цитокина и антигена и увеличивает протективный иммунный ответ на 25-71% (Somasundaram, 2015; Wang, 2009; Hartoonian, 2009; Encke, 2006 [7, 14-16]).
Ген ГМ-КСФ широко используется в качестве трансгена при конструировании рекомбинантных онколитических вирусов (Кочнева, 2012 [17]). В частности, ген ГМ-КСФ человека был встроен в геном двух штаммов VACV: WR (JX-963) (Thorne, 2007 [18]) и Wyeth (JX-594) (Kirn, 2010 [19]) в район гена вирусной тимидинкиназы (tk-ген) под контролем синтетического ранне-позднего промотора VACV (Merchlinsky, 1997 [20]). Эти штаммы в настоящее время успешно проходят клинические испытания в качестве противоопухолевых препаратов (Breitbach, 2011 [21]).
На основе российского VACV штамма Л-ИВП (GenBank Acc. KP233807) нами сконструирован рекомбинантный штамм VV-GMCSF-S1/3, содержащий встройку гена ГМ-КСФ человека в центральной части tk-гена с одновременной его инактивацией (Кочнева, 2015 [22]). Ген ГМ-КСФ в составе рекомбинанта экспрессируется под контролем природного промотора VACV P7.5k и продуцирует секретируемую форму биологически активного ГМ-КСФ человека в клетках млекопитающих на уровне 1-40 мкг на мл культуральной среды (Гражданцева, 2015 [23]).
Представляется целесообразным использовать адьювантные свойства ГМ-КСФ с целью стабилизации структуры онкотоксических белков и усиления их противоопухолевой активности за счет индукции специфического иммунного ответа против раковых клеток. При этом наиболее перспективным является создание химерных конструкций, в которых ГМ-КСФ стоит в N-концевой части белка и через гибкий линкер соединяется с онкотоксическим белком. Такая конструкция обеспечит секрецию химерного белка в межклеточной пространство и, так называемый, «эффект соседа» (bystander effect) (Алексеенко, 2011 [24]) - проникновение онкотоксического белка в соседние раковые клетки и индукцию их гибели, что многократно усиливает терапевтический эффект.Кроме того, гибкий линкер позволяет сохранить биологические свойства обоих белков в химерной конструкции и, соответственно, индукцию специфического противоопухолевого иммунитета за счет экспрессии ГМ-КСФ.
В качестве онкотоксического белка нами использован лактаптин, который является фрагментом каппа-казеина молока человека (23-134 а.о.) и специфически индуцирует гибель клеток рака молочной железы человека in vitro и in vivo (Koval, 2014 [25]).
Для создания эффективного рекомбинантного онколитического вируса необходимо использовать репликативно-компетентные вектора, однако для повышения безопасности необходимо также удалять гены вирулентности, не существенные для репродукции вируса в быстро делящихся раковых клетках. Показано, что сочетанное подавление генов тимидинкиназы (tk-ген) и ростового фактора (virus growth factor, VGF) VACV приводит к практически полному отсутствию репликации вируса в неделящихся клетках (McCart, 2007 [26]). Таким образом, делеции в этих двух генах приводят не только к аттенуации вируса, но и к повышению его онкоселективности.
В качестве штамма-реципиента для создания онколитического вируса нами был использован сконструированный ранее на основе российского штамма VACV Л-ИВП рекомбинантный вариант VVdGF2/6 с делецией гена VGF (Кочнева, 2013 [27]). Химерная конструкция была введена в структурную часть tk-гена штамма VVdGF2/6 с одновременным удалением фрагмента tk-гена и, соответственно, его инактивацией. Химерная конструкция состоит из генов двух белков, ГМ-КСФ человека и лактаптина, соединенных гибким линкером GlyGlyGlySer.
Наиболее близким аналогом заявляемого изобретения (прототипом) является рекомбинантный штамм VV-GMCSF-S1/3 (Патент РФ №2565544, МПК C12N 15/27, опубл. 20.10.2015 г.[22]), сконструированный на основе штамма Л-ИВП вируса осповакцины, содержащий встройку гена ГМ-КСФ человека (GenBank Acc. M11220.1) в районе делеции фрагмента tk-гена между позициями 81277 и 81308 п.н. (GenBank Acc. KP233807.1); ген ГМ-КСФ человека экспрессируется под контролем природного промотора Р7.5k вируса осповакцины и продуцирует секретируемую форму биологически активного ГМ-КСФ человека в клетках млекопитающих на уровне 1-40 мкг на мл культуральной среды; штамм VV-GMCSF-S1/3 депонирован в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-631.
Однако рекомбинантный штамм-прототип не обеспечивает дополнительную аттенуацию (ослабление) вируса в отношении нормальных клеток вследствие отсутствия в его геноме делеции гена VGF и дополнительное усиление литической активности в отношении раковых клеток вследствие отсутствия в его конструкции цитотоксических генов, обеспечивающих специфическую гибель раковых клеток.
Техническим результатом заявляемого изобретения является обеспечение дополнительной аттенуации (ослабления) рекомбинантного онколитического вируса VACV в отношении нормальных клеток и усиление его литической активности в отношении раковых клеток.
Указанный технический результат достигается созданием двойного рекомбинантного штамма VV-GMCSF/lact-dGF, сконструированного на основе штамма Л-ИВП вируса осповакцины и содержащего делецию фрагмента tk-гена, в район которой между позициями 81277 и 81307 п.н. (GenBank Acc. KP233807.1) встроен оперон, состоящий из химерного транскрипта GMCSF/lact [см. Приложение], экспрессируемый под контролем природного промотора P7.5k VACV, включающий 276 п.н. и состоящий из генов ГМ-КСФ человека (GenBank Acc. M11220.1) и лактаптина - фрагмента гена каппа-казеина человека, кодирующего пептид размером 23-134 а.о., соединенных гибким линкером ggc gga ggc gga tca (GlyGlyGlySer). Штамм также содержит делецию в левом концевом районе вирусного генома, соответствующую позициям 7770-8071 п.н. (GenBank Acc. KP233807.1), включающую фрагмент гена VGF размером 170 п.н., соответствующую позициям 7801-8071 п.н. Штамм VV-GMCSF/lact-dGF имеет сниженную более, чем в 100 раз вирулентность по сравнению с исходным штаммом Л-ИВП (вирулентность оценивали по величине 50%-ной летальной дозы вирусов для 10-дневных куриных эмбрионов), а также более высокую онколитическую активность в отношении клеток опухолей человека различного генеза. Штамм VV-GMCSF/lact-dGF депонирован в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-711.
Штамм VV-GMCSF/lact-dGF образуется за счет одиночного кроссинговера между ДНК штамма VVdGF2/6 (Кочнева, 2013 [27]) и плазмидной ДНК pXJP-GMCSF/lact-PE/L-Pat (фиг. 1) в цитоплазме клеток CV-1, последующей селекции полученной нестабильной конструкции с добавлением в культуральную среду пуромицина за счет наличия в ней гена устойчивости к этому антибиотику (Pat) (Кочнева, 2013 [27]) и внутримолекулярной рекомбинации после снятия селективных условий.
Штамм VV-GMCSF/lact-dGF характеризуется следующими признаками. Морфологические признаки. Штамм обладает свойствами типичного представителя VACV, но в отличие от векторного вируса VVdGF2/6 с фенотипом TK+VGF- имеет фенотип ТК-ГМКСФ+VGF-Lact+ (фиг. 2А). Показано, что при заражении клеток CV-1 штамм VV-GMCSF/lact-dGF продуцирует секретируемый химерный белок GMCSF/lact (фиг. 3).
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного штамма VV-GMCSF/lact-dGF имеет длину около 200000 п.н. Наличие в его геноме встройки химерного гена GMCSF/lact и делеции гена VGF подтверждено методом ПЦР (фиг. 2Б) с использованием пар праймеров на область tk-гена, трансгенов ГМ-КСФ и лактаптина и гена VGF. Позиции праймеров указаны на фиг. 2А. Экспрессия химерного гена GMCSF/lact и секреция белка в культуральную среду подтверждена Вестерн-блот анализом лизатов и культуральной среды клеток CV-1, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF с использованием коммерческих антител против ГМ-КСФ как описано в (Гражданцева, 2015 [23]) (фиг. 3A). Для выявления лактаптина в составе химерного белка использовали моноклональные антитела anti-RL2 (Koval, 2014 [25]) (фиг. 3Б). Биологическая активность ГМ-КСФ в составе секретируемого химерного белка была оценена в культуре клеток эритролейкоза человека TF-1, которая является цитокин-зависимой и пролиферирует только в присутствии ГМ-КСФ и ряда других цитокинов человека как описано в (Гражданцева, 2015 [23]) (фиг. 4). Как следует из фиг. 4, 2-кратный пролиферативный эффект (200%) достигается при разведении культуральной среды, полученной при инфицировании клеток CV-1, в 1100 раз (1:1100), что соответствует концентрации ГМ-КСФ 1,65 мкг/мл по калибровочной кривой. Активность ГМ-КСФ в составе химерного белка несколько ниже, чем индивидуально экспрессированного ГМ-КСФ (4 мкг/мл среды) в культуральной среде тех же клеток CV-1 (Кочнева, 2015 [22]), однако эти различия недостоверны при Р<0,05. Биологическую активность лактаптина в составе химерного белка GMCSF/lact оценивали по его способности индуцировать гибель раковых клеток молочной железы человека ВТ-549 (фиг. 5). Процент гибели клеток рассчитывали в фотометрическом тесте с использованием субстрата для митохондриальных дегидрогеназ 2,3-бис-(2-метокси-4-нитро-5-сульфо-фенил)-2H-тетразолий-5-карбоксанилида (реагент XTT). Как следует из фиг. 5, 50%-ный цитотоксический эффект достигается при разведении культуральной среды, содержащей химерный белок GMCSF/lact, 1:3. Аналогичный эффект достигается при концентрации 0,23 мг/мл рекомбинантного аналога лактаптина, экспрессированного в системе E.coli, что соответствует ранее опубликованным данным для этого белка (Koval, 2014 [25]). Учитывая разведение культуральной среды 1:3, концентрация химерного белка должна составлять 0,69 мг/мл, что существенно превосходит концентрацию, измеренную по активности ГМ-КСФ (1,65 мкг/мл). Такое несогласование связано, по всей видимости, как с существенным различием систем оценки биологической активности и свойств самих белок, так и с усилением онкотоксичности лактаптина в химерной молекуле за счет стабилизирующей и адьювантной активности ГМ-КСФ. Эти данные подтверждаются дальнейшими экспериментами по оценке онколитической активности рекомбинантного штамма VV-GMCSF/lact-dGF.
Рекомбинантный штамм VV-GMCSF/lact-dGF обладает повышенной цитотоксической активностью не только в отношении клеток опухолей молочной железы человека, но также и в отношении опухолей другого генеза (фиг. 6), в частности:
А-549 - клетки карциномы легкого человека;
U87MG - клетки эпителиальной глиобластомы/астроцитомы человека;
Н1299 - клетки немелкоклеточного рака легкого человека;
ВТ-549 - клетки эстроген-независимой инвазивной дуктальной карциномы молочной железы, первичный узел;
ВТ-20 - клетки эстроген-независимой карциномы молочной железы, первичный узел;
А-431 - клетки эпидермоидной карциномы шейки матки.
Для оценки вклада лактаптина специально сконструировали рекомбинант VV-GMCSF-dGF, в котором имеется встройка гена ГМ-КСФ человека в районе tk-гена (аналогично VV-GMCSF-1/3) и делеция гена VGF (аналогично ранее описанному варианту VVdGF2/6 (Кочнева, 2013 [27]), но отсутствует встройка гена лактаптина. Штамм VV-GMCSF-dGF депонирован в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-712.
Как следует из фиг. 6, цитотоксическая активность в отношении клеток опухолей человека штамма VV-GMCSF/lact-dGF в 1,4-12,5 раз выше (ЦТД50 0,029-0,0005 БОЕ/кл.), чем штамма VV-GMCSF-dGF (ЦТД50 0,04-0,0037 БОЕ/кл.). Цифровые значения ЦТД50, соответствующие данным фиг.6, представлены в таблице 1.
Таблица 1. Цитотоксическая активность рекомбинантных штаммов VACV.
| Штамм вируса | ЦТД50 (БОЕ/кл) в культурах клеток | |||||||
| А-549 | U87MG | H1299 | BT-549 | BT-20 | A-431 | MCF10A | LECH-240 | |
| VV-GMCSF/lact-dGF | 0,029 | 0,0035 | 0,002 | 0,0005 | 0,016 | 0,004 | >10 | 1,2 |
| VV-GMCSF-dGF | 0,04 | 0,015 | 0,025 | 0,0037 | 0,04 | 0,018 | >10 | 1,53 |
Для оценки онкоспецифичности мы использовали две культуры клеток из нормальных тканей человека: MCF10A – культура клеток нормального эпителия молочной железы человека и LECH-240 – диплоидная культура клеток легкого эмбриона человека. Как следует из данных, представленных в таблице 1 и на фиг. 6, индекс онкоселективности, рассчитанный как отношение ЦТД50 в нормальных клетках к ЦТД50 в раковых клетках для каждого вирусного штамма, составляет более 30 для клеток LECH-240 и более 250 для клеток MCF10A. Различия в индексах селективности связаны с тем, что клетки эмбриона обладают достаточно высокой пролиферативной активностью, что, в определенной степени, роднит их с раковыми и повышает репликативную активность рекомбинантов вируса осповакцины. Таким образом, созданный нами рекомбинантный штамм VV-GMCSF/lact-dGF обладает онкоспецифичностью и лизирует опухолевые клетки в 30-250 раз эффективнее, чем нормальные клетки человека. Штамм VV-GMCSF/lact-dGF обладает повышенной литической активностью в отношении опухолевых клеток человека за счет введения лактаптина в состав химерного белка.
Инактивация генов тимидинкиназы и вирусного ростового фактора обеспечивает существенное снижение вирулентности рекомбинантного штамма VV-GMCSF/lact-dGF по сравнению с немодифицированным вакцинным штаммом Л-ИВП. Оценку вирулентности проводили путем определения величины 50%-ной летальной дозы (ЛД50) вирусов для 10-дневных куриных эмбрионов (КЭ). КЭ заражали 10-кратными разведениями вирусной суспензии с заранее определенным титром и оценивали гибель через 48 часов. Использовали одинаковые дозы заражения, также как и их диапазон, при сравнении вирулентности исходного (Л-ИВП) и рекомбинантного (VV-GMCSF/lact-dGF) вирусных штаммов. Исходный титр обоих вирусных штаммов составил 1,0*109 БОЕ/мл.
В качестве отрицательного контроля использовали буферный раствор 0,005 М Трис-HCl буфер, рН-8,0. Этот раствор применялся для получения очищенных препаратов вируса и подготовки разведений.
Для расчета ЛД50 диапазон разведений вирусных образцов подбирается так, чтобы в разведении с наибольшей концентрацией произошла гибель 100% КЭ, а в разведении с наименьшей концентрацией - 0% КЭ. Мы использовали диапазон разведений от 1:10 (-1) до 1:10000000 (-7) для рекомбинантного штамма и Л-ИВП, что соответствует диапазону доз 107-10 БОЕ/КЭ. Каждое разведение делали в 5-ти повторностях (5 КЭ), время инкубации зараженных КЭ составило 48 часов. Определение ЛД50 проводили по методу Кербера с использованием следующей схемы расчета:
1. Для каждого разведения вируса определяем количество мертвых эмбрионов (есть эффект, +) и количество живых (нет эффекта, –).
2. Считаем доли эмбрионов (Li), где зарегистрирован эффект, то есть мертвых.
3. Считаем сумму (Σ Li) этих долей от максимального разведения с Li=1 до минимального разведения с Li=0 (в таблицах выделены жирным шрифтом).
4. Разведение, вызывающее 50%-ную гибель эмбрионов, считается по формуле: ЛД50=Cmax⋅100,5–Σ Li
Результаты экспериментов представлены в таблицах 2 и 3.
В таблице 2 приведены данные о вирулентности штамма VV-GMCSF/lact-dGF для 10-дневных КЭ.
Таблица 2. Вирулентность штамма VV-GMCSF/lact-dGF
для 10-дневных КЭ.
| Штамм VV-GMCSF/lact-dGF | |||||
| Разведение | Кол-во живых (+) | Кол-во мертвых (–) | Доля (+), Li | ЛД50 | |
| 10-1 | 0 | 5 | 0 | C50=10-1⋅100,5-2,2==10-1⋅10-1,7=10-2,7 | |
| 10-2 | 3 | 2 | 0,6 | ||
| 10-3 | 3 | 2 | 0,6 | ||
| 10-4 | 5 | 0 | 1 | Так как объем заражения 100 мкл, то в пересчете на 1 мл получим:103,7 ЛД50/мл | |
| 10-5 | 5 | 0 | 1 | ||
| 10-6 | 5 | 0 | 1 | ||
| 10-7 | 5 | 0 | 1 | ||
| Σ Li=2,2 |
В таблице 3 представлены данные о вирулентности штамма Л-ИВП VACV для 10-дневных КЭ.
Таблица 3. Вирулентность штамма Л-ИВП VACV
для 10-дневных КЭ.
| Штамм Л-ИВП | |||||
| Разведение | Кол-во живых КЭ (+) | Кол-во мертвых КЭ (–) | Доля (+), Li | ЛД50 | |
| 10-1 | 0 | 5 | 0 | C50=10-4⋅100,5-1,4==10-4⋅10-0,9=10-4,9 | |
| 10-2 | 0 | 5 | 0 | ||
| 10-3 | 0 | 5 | 0 | ||
| 10-4 | 0 | 5 | 0 | Так как объем заражения 100 мкл, то в пересчете на 1 мл получим:105,9 ЛД50/мл | |
| 10-5 | 2 | 3 | 0,4 | ||
| 10-6 | 5 | 0 | 1 | ||
| 10-7 | 5 | 0 | 1 | ||
| Σ Li=1,4 |
Введение буферного раствора гибели КЭ не вызывало.
Уровень аттенуации рассчитывали как разность десятичных логарифмов титра в единицах ЛД50/мл для штамма Л-ИВП и рекомбинантного штамма VV-GMCSF/lact-dGF. В данном случае она составила 158 (105,9–3,7=2,2), то есть рекомбинантный штамм в 158 раз менее вирулентен, чем Л-ИВП.
Изобретение иллюстрируется следующими фигурами графических изображений:
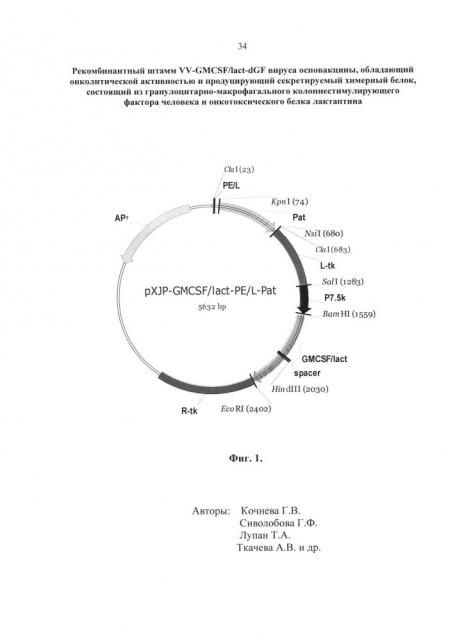
- Фиг. 1. Физическая и генетическая карта плазмиды pXJP-GMCSF/lact- PE/L-Pat. L-tk - фрагмент генома VACV штамма Л-ИВП размером 595 п.н., расположен в левой части гена тимидинкиназы и соответствует позициям 80682-81277 (GenBank, Accession KP233807); R-tk - фрагмент генома VACV штамма Л-ИВП размером 933 п.н., расположен в правой части tk-гена и соответствует позициям 81307-82251(GenBank, Accession KP233807); фланки расположены так, что образуется делеция размером 30 п.н. в центре tk-гена. В район делеции встроен оперон, состоящий из химерного гена GMCSF/lact под контролем природного промотора VACV P7.5k (276 п.н.). Spacer - гибкий линкер GlyGlyGlySer, связывающий ГМ-КСФ и лактаптин в химерной молекуле. Наличие фланков обеспечивает встройку оперона в район tk-гена. Наличие гена Pat под контролем синтетического промотора PE/L (Merchlinsky, 1997) обеспечивает селекцию рекомбинантных клонов.
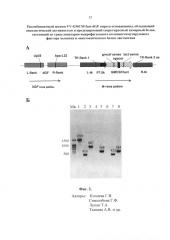
- Фиг. 2. Структура рекомбинантного штамма VV-GMCSF/lact-dGF. A – схема генома с указанием позиций праймеров, dGF - делеция VGF-гена, остальные подписи как на фиг. 1. Б – результаты ПЦР-анализа рекомбинантного штамма VV-GMCSF/lact-dGF в сравнении со штаммом-реципиентом VVdGF2/6 и исходным штаммом Л-ИВП с использованием трех пар праймеров (ТК-flank1 sense/ gmcsf sense/ lact sense × TK-flank 2 as) для подтверждения встройки химерного гена GMCSF/lact (дорожки 1-6) и пары праймеров (Up35×Apa-L22) для подтверждения делеции гена VGF (дорожки 7-8). Мв - маркеры молекулярных весов. 1 - рекомбинант VV-GMCSF/lact-dGF, праймеры ТК-flank1 sense×TK-flank 2 as (фрагмент 1503 п.н.), 2 - штамм Л-ИВП, праймеры ТК-flank1 sense×TK-flank 2 as (фрагмент 414 п.н.); 3 - рекомбинант VV-GMCSF/lact-dGF, праймеры gmcsf sense×TK-flank 2 as (фрагмент 867 п.н.), 4 – штамм Л-ИВП, праймеры gmcsf sense×TK-flank 2 as (нет фрагмента, поскольку праймер gmcsf sense лежит внутри встроенного гена ГМ-КСФ); 5 - рекомбинант VV-GMCSF/lact-dGF, праймеры lact sense ×TK-flank 2 as (фрагмент 568 п.н.), 6 – штамм Л-ИВП, праймеры lact sense×TK-flank 2 as (нет фрагмента, поскольку праймер lact sense лежит внутри встроенного гена Lact); 7 - рекомбинант VV-GMCSF/lact-dGF, праймеры Up35×Apa-L22 (фрагмент 423 п.н.), 8 - штамм Л-ИВП, праймеры Up35×Apa-L22 (фрагмент 584 п.н.).
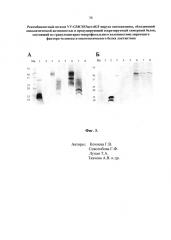
- Фиг. 3. Вестерн-блот анализ экспрессии химерного гена GMCSF/lact в составе рекомбинантного штамма VV-GMCSF/lact-dGF в культуре клеток почки африканской зеленой мартышки CV-1. A – в качестве первичных антител использовали коммерческие поликлональные антитела кролика против ГМ-КСФ человека (PerroTech), в качестве вторичных антител - антикроличьи IgG, коньюгированные в фосфатазой (Sigma). Б – для визуализации использовали моноклональные антитела к лактаптину, коньюгированные с пероксидазой хрена F14-HRP. Мв – контроль молекулярных весов. 1 – контроль, негликозилированный ГМ-КСФ человека, продуцированный в клетках E.coli (14.4 кДа); 2 - контроль, лактаптин, продуцированный в клетках E.coli (14 кДа); 3 – культуральная среда клеток, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF (полностью гликозилированная секретируемая форма химерного белка GMCSF/lact, 46 кДа); 4 – культуральная среда клеток, инфицированных рекомбинантным штаммом VV-GMCSF-S1/3 (Кочнева, 2015 [22]), продуцирующим ГМ-КСФ (гликозилированная секретируемая форма ГМ-КСФ, 25-32 кДа); 5 – отрицательный контроль, культуральная среда клеток, инфицированных исходным нерекомбинантным исходным штаммом Л-ИВП; 6 – лизат клеток, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF (внутриклеточная форма химерного белка GMCSF/lact с разной степенью гликозилирования, 28-46 кДа); 7-лизат клеток, инфицированных рекомбинантным штаммом VV-GMCSF-S1/3 (разная степень гликозилирования ГМ-КСФ, 18-32 кДа), 8 – отрицательный контроль, лизат клеток, инфицированных Л-ИВП.
- Фиг. 4. Анализ биологической активности ГМ-КСФ человека в составе химерного белка GMCSF/lact. Биологическую активность ГМ-КСФ человека в составе химерного белка GMCSF/lact, секретируемого из клеток CV-1, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF, оценивали по выраженному в процентах уровню стимуляции пролиферации ГМКСФ-зависимых клеток эритролейкоза человека TF-1 (ось Y). За 100% принимали количество живых клеток, выращенных с добавлением неразведенной культуральной среды клеток CV-1, инфицированных исходным штаммом VACV Л-ИВП (отрицательный контроль). На оси Х представлены разведения культуральной среды клеток CV-1, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF, и концентрации рекомбинантного очищенного препарата ГМ-КСФ, полученного в клетках E. coli (калибровочная кривая).
- Фиг. 5. Анализ биологической активности лактаптина, экспрессированного в составе химерного белка GMCSF/lact. Биологическую активность лактаптина в культуральной среде клеток CV-1, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF, оценивали по выраженному в процентах уровню цитотоксичности различных разведений культуральной среды для клеток рака молочной железы человека ВТ-549 (ось Y). За 100% принимали количество живых клеток, инкубированных с добавлением неразведенной культуральной среды клеток CV-1, инфицированных исходным штаммом VACV Л-ИВП (положительный контроль). На оси Х представлены разведения культуральной среды клеток CV-1, инфицированных рекомбинантным штаммом VV-GMCSF/lact-dGF, и концентрации рекомбинантного очищенного препарата лактаптина, полученного в клетках E. coli (калибровочная кривая).
- Фиг. 6. Сравнительная онколитическая активность рекомбинантных штаммов VACV в раковых клетках человека различного генеза. На оси Y представлены значения 50%-ной цитотоксической дозы в единицах БОЕ/клетка, логарифмическая шкала. На оси Х – культуры клеток. Использовали шесть раковых культур клеток: A-549; U87MG; H1299; BT-549, ВТ-20, А-431 и две нормальных культуры клеток человека: MCF10A и LECH-240. Клетки выращивали в 96-ти луночных планшетах, инфицировали 10-кратными разведениями вируса в диапазоне доз 0,0001–10 БОЕ на клетку и рассчитывали 50%-ную цитотоксическую дозу для каждого рекомбинантного штамма (ЦТД50) в фотометрическом тесте с использованием субстрата для митохондриальных дегидрогеназ 2,3-бис-(2-метокси-4-нитро-5-сульфо-фенил)-2H-тетразолий-5-карбоксанилида (реагент XTT).
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pXJP-GMCSF/lact-PE/L-Pat. Плазмида pXJP-GMCSF/lact-PE/L-Pat была получена на основе pXJP5.2 (Кочнева, 2015 [22]). На первом этапе в плазмиду pXJP5.2 по ClaI-сайту был встроен ген Pat под контролем синтетического промотора PE/L (Merchlinsky, 1997 [20]) для селекции рекомбинантных клонов VACV. Для этой цели были синтезированы два олигонуклеотида, которые содержали последовательность промотора PE/L и сайты узнавания ряда рестриктаз. При отжиге олигонуклеотиды образуют дуплекс следующей структуры:
ClaI KpnI SpeI Nsil ClaI
CGATGGCCAAAAATTGAAATTTTATTTTTTTTTTTTGGAATATAAAGGTACCACTAGTATGCATAT
TACCGGTTTTTAACTTTAAAATAAAAAAAAAAAACCTTATATTTCCATGGTGATCATACGTATAGC
После встройки этого дуплекса по ClaI-сайту в полученную плазмиду по KpnI – Nsil сайтам был встроен ген Pat. Фрагмент ДНК, содержащий ген Pat получали методом ПЦР на матрице pGEM-Puro-DS-Apo (Чумаков, 2013 [28]) с использованием пары праймеров, в состав которых введены сайты узнавания рестриктаз KpnI и Nsil:
KpnI
Puro Up 5´- GCATCGGTACCATGACCGAGTACAAGCCCACGG
Nsil
Puro Low 5´- GCATCATGCATTCAGGCACCGGGCTTGCGGGTCA
Полученная в результате лигирования плазмидная ДНК, обозначенная как pXJP5.2-PE/L-Pat, содержит ген Pat под контролем синтетического ранне-позднего промотора PE/L (для селекции рекомбинантных клонов VACV).
Для конструирования гена химерного белка GMCSF/lact в плазмиду pXJP5.2-PE/L-Pat были последовательно встроены ген GMCSF, лишенный стоп-кодона, но содержащий на С-конце нуклеотидную последовательность, кодирующую гибкий линкер Gly-Gly-Gly-Gly-Ser, и ген лактаптина со стоп-кодоном. На первом этапе в плазмиду pXJP5.2-PE/L-Pat был встроен ген лактаптина, полученный методом ПЦР на матрице плазмидной ДНК pGSDI/RL2 (Semenov, 2010 [29]) с использованием пары праймеров, содержащих сайты эндонуклеаз рестрикции HindIII, EcoRI:
HindIII
FR2 For: 5’ – AAATAAAGCTTATGAACCAGAAACAACCAGCA
EcoRI
FR2 Rev: 5’ –CTATCGAATTCTTAGTGATGGTGATGGTGATGTG
Полученный ПЦР-фрагмент встроен в плазмиду pXJP5.2-PE/L-Pat по HindIII - EcoRI и промежуточная плазмида была названа pXJP5.2-Lact-PE/L-Pat. На втором этапе в эту плазмиду по сайтам BamHI – HindIII, расположенным перед геном лактаптина, был встроен ген ГМ-КСФ, лишенный стоп-кодона, но содержащий на С-конце нуклеотидную последовательность, кодирующую гибкий линкер Gly-Gly-Gly-Ser. Ген GMCSF был получен из плазмиды pXJP5.2-GMCSF (Кочнева, 2015 [22]) методом ПЦР с использованием пары праймеров:
BamHI
ChimUp 5’- GCATCGGATCC GCTAAAGTTCTCTGGAGGATGTGGCTGCA
HindIII Ser Gly Gly Gly Gly
ChimLow 5’ - AAATAAAGCTTTGATCCGCCTCCGCCCTCCTGGACTGGCTCCCAGCAGT
Таким образом, полученная плазмидная ДНК pXJP-GMCSF/lact-PE/L-Pat (фиг. 1) содержит фрагмент ДНК VACV, соответствующий позициям нуклеотидов 80682-81277 генома штамма Л-ИВП (GenBank, Accession KP233807), разделенного на левый (595 п.н., позиции 80682-81277) и правый (933 п.н., позиции 81307-82251) фланки с делецией 30 п.н. в центре tk-гена. В район делеции встроен оперон, состоящий из химерного гена GMCSF/lact под контролем природного промотора VACV P7.5k (276 п.н.). Наличие фланков обеспечивает встройку оперона в район tk-гена. Наличие гена Pat под контролем синтетического промотора PE/L обеспечивает селекцию рекомбинантных клонов. Структура полученной плазмидной ДНК подтверждена секвенированием.
Пример 2. Трансфекция клеток CV-1 рекомбинантной плазмидой pXJP-GMCSF/lact-PE/L-Pat и получение рекомбинантного штамма VV-GMCSF/lact-dGF. Для проведения трансфекции ДНК плазмиды pXJP-GMCSF/lact-PE/L-Pat была наработана в препаративных количествах из 1000 мл среды Лурия-Бертани и выделена с использованием набора лабораторных реагентов для выделения плазмидной ДНК, очищенной от эндотоксинов «EndoFree Plasmid Maxi Kit» (Qiagen).
Рекомбинантные VACV получали с использованием реагента для трансфекции Lipofectamine™ LTX, 1 мл и реагент Plus (Invitrogen). Трансфекцию проводили на 90%-ном монослое клеток CV-1, выращенном в шести-луночных планшетах (Greiner). Клетки инфицировали штаммом-реципиентом VVdGF2/6 (Кочнева, 2013 [27]) с множественностью 0,05 БОЕ/клетка, и через 1 час инкубации при 37ºС добавляли смесь плазмидной ДНК (5 мгк) + липофектамин (20 мкл) + Реагент Plus в соответствии с рекомендацией производителя в 1 мл среды Opti-MEM (Invitrogen). Через 1 час инкубации при 37ºС в атмосфере 5% СО2 в лунки добавляли еще 2 мл среды Opti-MEM и инкубировали в тех же условиях еще 24-36 часов до развития цитопатического действия (ЦПД). Материал трижды замораживали-оттаивали и обрабатывали ультразвуком для получения гомогенной вирусной суспензии. Далее проводили селекцию рекомбинантов путем трех-кратного пассирования на монослое клеток CV-1 с добавлением пуромицина (Sigma) в концентрации 10 мкг/мл среды DMEM (Invitrogen). Вирус клонировали методом бляшек под твердым агаровым покрытием и анализировали на наличие встройки химерного гена GMCSF/lact методом ПЦР с использованием праймеров
TK-flank 1 sense 5´- CAGAATTAATTAGACGAGTTAGACG
TK-flank 2 as 5´- TCTCGGTTTCCTCACCCAAT.
Позиции праймеров указаны на фиг. 2А. Вирусную ДНК для проведения ПЦР выделяли с использованием наборов «ДНК-сорб-В» (ООО «АмплиПрайм»). Размер амплифицированного фрагмента ДНК рекомбинантного вируса со встройкой химерного гена GMCSF/lact составляет 1503 п.н. (дорожка 1, фиг. 2Б), а исходного не рекомбинантного штамма Л-ИВП (также как и штамма-реципиента VVdGF2/6) - 414 п.н. (дорожка 2, фиг. 2Б). Отобранные рекомбинантные клоны вируса далее анализировали методом ПЦР на правильность встроенной конструкции химерного гена с использованием внутренних праймеров на участок ГМ-КСФ (gmcsf sense 5´- CTGCTGAGATGAATGAAACAGTAGA) и участок лактаптина (lact sense 5´- AAGCTTATGAACCAGAAACAACCAGCA). Размер амплифицированного фрагмента ДНК рекомбинантного вируса со встройкой химерного гена GMCSF/lact с использованием в ПЦР пары праймеров gmcsf sense х TK-flank 2 as составляет 867 п.н. (дорожка 3, фиг. 2Б), а с использованием пары праймеров lact sense х TK-flank 2 as – 568 п.н. (дорожка 5, фиг. 2Б). В качестве отрицательного контроля в ПЦР использовали ДНК не рекомбинантного штамма Л-ИВП, в составе которой нет последовательностей, соответствующих праймерам gmcsf sense и lact sense, поэтому фрагменты в ПЦР с использованием этих пар праймеров не образуются (дорожки 4 и 6, фиг. 2Б).
Наличие делеции в гене VGF в составе полученного рекомбинанта подтверждали методом ПЦР вирусной ДНК с использованием пары праймеров на область гена VGF
Apa-L22 - 5’- CGAGCACAATACCGGGAGATGG
Up35 5’- GTAAGCAAAGAATATAAGAATGAAGCGGTAATG AT.
Позиции праймеров указаны на фиг.2А. Размер амплифицированного фрагмента ДНК рекомбинантного штамма с делецией фрагмента гена VGF составляет 423 п.н. (дорожка 7, фиг. 2Б), а штамма Л-ИВП без делеции – 584 п.н. (дорожка 8, фиг. 2Б). Таким образом, полученный рекомбинантный штамм VV-GMCSF/lact-dGF содержит встройку химерного гена GMCSF/lact в tk-гене вируса и делецию – в VGF гене. Отобранный рекомбинантный вариант VV-GMCSF/lact-dGF дважды реклонировали, чтобы избежать следовых примесей исходного вируса, нарабатывали на монослое клеток CV-1 и очищали центрифугированием в градиенте плотности сахарозы (25-40%). Титр вируса определяли методом бляшек на монослое клеток CV-1, окрашенном фиксирующим раствором кристаллического фиолетового (2 г/л кристаллический фиолетовый, 50 мл/л формальдегид, 100 мл/л этанол, вода). Очищенный рекомбинантный штамм VV-GMCSF/lact-dGF с титром 109 БОЕ/мл хранится в расфасованном виде при -80°С.
Пример 3. Оценка экспрессии химерного гена GMCSF/lact рекомбинантным штаммом VV-GMCSF/lact-dGF. ГМ-КСФ человека синтезируется в виде белка-предшественника (144 а.о.) с последующим отщеплением сигнального пептида (17 а.о.), таким образом, зрелый полипептид содержит 127 а.о. (14.4 кДа). Показано существование 16-ти изоформ ГМ-КСФ человека, продуцируемого в клетках эукариот. Эти изоформы, имеющие различный характер гликозилирования, обуславливают гетерогенность природного ГМ-КСФ и разброс молекулярных масс от 14.4 до 32 кДа. Лактаптин является фрагментом каппа-казеина человека с молекулярной массой 14 кДа, белок не гликозилируется в клетках эукариот. Таким образом, максимальная молекулярная масса химерного белка GMCSF/lact, в котором ГМ-КСФ полностью гликозилирован, должна составлять 46 кДа, а минимальная – 28,4 кДа.
Монослой клеток CV-1 (90% поверхности), выращенный в культуральном матрасе объемом 650 мл (Greiner), инфицировали рекомбинантными штаммами VV-GMCSF/lact-dGF, VV-GMCSF-S1/3 (положительный контроль, прототип) или исходным штаммом VACV Л-ИВП (отрицательный контроль) с множественностью 1 БОЕ/кл. Инкубировали 24 часа при 37°С в атмосфере 5% СО2, культуральную среду (DMEM) собирали, клетки разрушали лизирующим буфером (50mM TRIS-HClpH 7.5, 150mM NaCl, 1% Triton X-100, 5 mM MgCl2, proteases inhibitor cocktail) в объеме 7 мл, проводили 3 раунда замораживания-оттаивания, затем трехкратную обработку ультразвуком (20 сек при 200-300 W с 10-ти сек охлаждением после каждой обработки). Культуральную среду и лизаты клеток центрифугировали 14000 rpm, 30 мин, 4°C, супернатанты анализировали в Western blot анализе отдельно на присутствие ГМ-КСФ (фиг. 3А) и лактаптина (фиг. 3Б). Электрофоретическое разделение белков проводили в камере «BioRad» в 5% концентрирующем и 14% разделяющем акриламидном геле при V=100. Перенос белков с геля осуществляли в камере MiniTrans-Blot cell «BioRad» на мембраны Immun-Blot TMPVDF Membrane for Protein Blotting 0,2 μm при V=100 1 час 20 минут. Затем мембраны промывали буфером для переноса и помещали в блокирующий раствор - TBS pH 7,4 с 5% молоком (Skim Milk Powder, Biochemika, Fluka) на 1 час при комнатной температуре (КТ) на качалке. Отмывали мембраны 3 раза по 5 минут TBS pH 7,4 на качалке и анализировали со специфическими антителами.
При анализе ГМ-КСФ (фиг. 3А) в качестве первичных антител использовали кроличьи поликлональные антитела против ГМ-КСФ человека (PerroTech). В качестве вторичных антител – коньюгат ан