Композиции для реакции обратной транскрипции с горячим стартом или для полимеразной цепной реакции с обратной транскрипцией с горячим стартом
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описана группа изобретений, включающая композицию для реакции обратной транскрипции с горячим стартом, способ подготовки вышеуказанной композиции, композицию для ПЦР с обратной транскрипцией и горячим стартом, способ подготовки вышеуказанной композиции, набор для реакции обратной транскрипции с горячим стартом, который включает в себя композицию для реакции обратной транскрипции с горячим стартом и реакционную пробирку, набор для ПЦР с обратной транскрипцией и горячим стартом, способ обратной транскрипции РНК-матрицы, способ амплификации нуклеиновой кислоты, композицию ПЦР с обратной транскрипцией для диагностики злокачественного новообразования. Композиция для реакции обратной транскрипции содержит в своем составе ион Mg2+, четыре типа dNTP, обратную транскриптазу, пирофосфат и пирофосфатазу. Композиция для ПЦР помимо вышесказанного включает в себя ДНК-полимеразу. Изобретение расширяет арсенал средств, позволяющих проводить реакцию обратной транскрипции. 9 н. и 28 з.п. ф-лы, 13 ил., 3 табл., 13 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для реакции обратной транскрипции с горячим стартом или для полимеразной цепной реакции с обратной транскрипцией и горячим стартом.
Предшествующий уровень техники
Реакции обратной транскрипции делятся на реакции, в которых используются случайные праймеры, и реакции, в которых используются мишень-специфичные праймеры. В реакциях обратной транскрипции для детекции специфической мишени, таких как диагностические наборы для детекции PHK-вируса или чего-нибудь подобного, мишень-специфичные праймеры, в общем, используются из-за того, что они демонстрируют более высокую чувствительность. В таких реакциях обратной транскрипции специфичность и чувствительность определяются более высокой селективностью праймеров, которые специфически связываются с целевой последовательностью PHK. Однако из-за того, чтобы все компоненты необходимые для реакции обратной транскрипции смешивались при комнатной температуре, неспецифическая реакция обратной транскрипции обуславливается неспецифическим праймированием в этих условиях. Даже при комнатной температуре из-за высокой активности обратной транскриптазы происходит неспецифическое праймирование с получением ряда неспецифических кДНК, и таким образом этот процесс является основным фактором, который повышает уровень неспецифических реакций амплификации. Из-за таких неспецифических реакций обратной транскрипции потребляются праймеры, необходимые для последующих реакций ПЦР, и ограниченные концентрации других основных компонентов, и по этой причине неспецифические реакции обратной транскрипции действуют как конкурентные ингибиторы. Неспецифические реакции обратной транскрипции являются проблематичными при детекции PHK в низкой концентрации, и, в частности, мешают детекции целевой PHK, которая присутствует в очень малом количестве в растворе, который содержит большие количества PHK, экстрагированных из клеток или биологических жидкостей и имеют высокую сложность нуклеотидной последовательности. Таким образом, неспецифические реакции обратной транскрипции усложняют детекцию вируса или гена, присутствующего в низкой концентрации. Также в мультиплексных реакциях обратной транскрипции, которые осуществляют одновременно с использованием различных праймеров, неспецифические реакции обратной транскрипции снижают специфичность, усложняя множественную детекцию. На эту неспецифическую амплификацию более сильное влияние оказывают относительные количества целевой нуклеиновой кислоты и других нуклеиновых кислот, полученных из биологического образца, чем абсолютное количество целевой нуклеиновой кислоты. Это происходит из-за того, что неспецифическая гибридизация праймеров повышает уровень неспецифических реакций, когда в реакционной смеси присутствует множество PHK, отличных от искомой мишени.
Для снижения уровня таких неспецифических реакций и амплификаций были предприняты различные попытки. В частности, была попытка повысить порог обнаружения специфической мишени с помощью более сильно гибридизующихся с мишенью праймеров. Например, сообщалось о способе, в котором 5'-конец праймеров замещен LNA, так что праймер может более сильно гибридизоваться с мишенью, тем самым снижая неспецифическую амплификацию (Malgoyre A. et al., Biochem Biophys Res Commun. Mar 2, 2007; 354(1): 246-52). В качестве другого способа решения проблем с помощью структуры праймеров, также был разработан способ предотвращения образования димеров праймеров. Когда реакция обратной транскрипции осуществляется при низких температурах, полимеризация может протекать путем частичной гибридизации между праймерами с образованием димера, важный фактор, который быстро снижает чувствительность в реакции обратной транскрипции. Для решения этой проблемы было предложено использовать праймеры, образованные путем удлинения комплементарных нуклеотидных последовательностей, так чтобы пять нуклеотидов 5' концевой нуклеотидной последовательности праймеров могли образовать шпилечную структуру при низкой температуре (Ji Young Hong et al., Virol J. 2011; 8: 330. Опубликовано онлайн в 2011 году; Патент Республики Корея No. 10-0987352). Однако этот способ блокировки праймеров имеет недостатки, которые заключаются в том, что из-за того, что праймеры имеют высокую температуру гибридизации из-за нуклеотидной последовательности, добавленной к 5' концу, может индуцироваться неспецифическая гибридизация праймеров с неспецифическими мишенями, имеющими нуклеотидные последовательности, схожие с мишенями, в последующей реакции ПЦР, а эффективность гибридизации в стадии гибридизации снижается из-за шпилечной структуры праймеров.
Для решения таких проблем был разработан способ, в котором используются блокированные праймеры, которые частично комплементарны праймерам, и которые блокируются на 3'-конце. Быстрая ПЦР с обратной транскрипцией может быть осуществлена, поскольку такие блокированные праймеры имеют преимущество из-за того, что они блокированы на 3'-конце и не выполняют функцию праймеров в реакции полимеризации нуклеиновой кислоты, и из-за того, что они короткие и гибридизуются с праймерами только при комнатной температуре, предотвращая образования димеров праймеров, и из-за того, что они мгновенно отсоединяются от праймеров и не функционируют при повышении температуры в последующей реакции (Патентная Заявка Республики Корея No. 10-2011-0017226).
Кроме того, был разработан способ проведения реакции обратной транскрипции при высокой температуре для более специфической гибридизации целевой PHK. Сообщалось, что если кДНК синтезируется при высокой температуре, например, при 70°С, при использовании праймеров, которые гибридизуются при высокой температуре, и обратной транскриптазы, которая функционирует даже при высокой температуре, кДНК может быть амплифицирована более специфично (Fuchs В, Mol Biotechnol, 1999 Oct; 12(3): 237-40).
В мультиплексных ПЦР с обратной транскрипцией специфичность является более важной. Это является следствием того, что в реакциях используются несколько праймеров, и из-за неспецифической реакции в стадии реакции обратной транскрипции в последующей ПЦР может идти неспецифическая реакция. Для того чтобы избежать неспецифической реакции в мультиплексных ПЦР с обратной транскрипцией, вначале осуществляется реакция обратной транскрипции, а затем осуществляется реакция ПЦР, для осуществления более специфичной реакции. Однако в данном случае процесс открытия реакционной пробирки и добавления реакционного раствора в открытую реакционную пробирку является затруднительным, и вероятность контаминации в процессе открытия и взаимодействия с реакционной пробиркой является выше. По этой причине, как правило, предпочтительней последовательно осуществить реакцию обратной транскрипции и ПЦР в одной пробирке. Поэтому был разработан способ физически отдельных друг от друга реакций, при осуществлении ПЦР с обратной транскрипцией в одной пробирке без открытия пробирки, в котором реакционная смесь для обратной транскрипции находится в нижней части пробирки в ходе реакции, а реакционная смесь ПЦР подвешена на крышку. В данном способе, когда в пробирке идет реакция обратной транскрипции, реакционная смесь ПЦР подвешена на крышке и не реагирует, а после окончания реакции обратной транскрипции реакционную пробирку центрифугируют для того, чтобы раствор ПЦР подвешенный на крышке реакционной пробирки смешался с продуктом реакции обратной транскрипции, после чего осуществляется реакция ПЦР (Rodney Mark Ratcliff, et al., 2002 November; 40(11): 40914099. doi: 10.1128/JCM.40.11.4091-4099.2002).
В результате усилий, предпринятых для решения вышеописанных проблем, возникающих в обычных реакциях обратной транскрипции, была разработана «реакция обратной транскрипции с горячим стартом». Реакция обратной транскрипции с горячим стартом является способом детекции очень малого количества целевой PHK, в котором реакция обратной транскрипции может быть инициирована высокой температурой при которой праймирование может произойти только с PHK, имеющей нуклеотидную последовательность, полностью комплементарную праймерам, тем самым предотвращая неспецифическое праймирование, которое происходит при комнатной температуре, и предотвращая неспецифическую олигомеризацию праймеров, тем самым повышая специфичность реакции обратной транскрипции. Для реализации этого способа был разработан и в настоящее время используется способ, в котором используются термостойкая полимераза и аптамер. Набор «Light cycler RNA master kit» (Roche) является способом, в котором используется ДНК-полимераза Tth и аптамер. ДНК-полимераза Tth сочетает в себе функцию полимеризации ДНК с использованием PHK в качестве матрицы и функцию полимеризации ДНК с использованием ДНК в качестве матрицы. Аптамер, используемый в данном случае, прикреплен к реактивному сайту ДНК-полимеразы Tth, которая таким образом является неактивной при комнатной температуре. При повышении температуры реакционного раствора до высокой температуры, трехмерная структура аптамера модифицируется так, что аптамер отделяется от ДНК-полимеразы Tth, которая становится активной, после чего может быть осуществлена реакция обратной транскрипции специфически праймированной мишени PHK, а затем может быть проведена ПЦР. Кроме того, в наборе «GeneAmp AccuRT Hot Start RNA PCR kit» (Applied Biosystems) используется термоустойчивая полимераза, полученная из разновидности Thermus Z05, и с помощью этого набора может быть проведена реакция обратной транскрипции и ПЦР с использованием одного фермента, подобного ДНК-полимеразе Tth. Реакция также осуществляется с использованием аптамера, специфичного к ферменту. Такие продукты могут понизить неспецифическую амплификацию в ПЦР с обратной транскрипцией путем ингибирования ферментативной активности при комнатной температуре при использовании аптамера для снижения уровня неспецифических реакций обратной транскрипции. При этом при повышении температуры до высокой, трехмерная структура аптамера модифицируется, а при снижении температуры аптамер восстанавливает исходную структуру, ингибирующую ДНК-полимеразы. Другими словами с аптамерами связана проблема обратимого ингибирования ДНК-полимераз. Для набора «GeneAmp AccuRT Hot Start RNA PCR kit» указано, что аптамер остается все еще прикрепленным к ДНК-полимеразе даже при 55°С и полностью отделяется когда температура достигает 65°С. Таким образом в реакциях, в которых температура отжига праймеров, как правило, равна 55°С или ниже, существует проблема, которая заключается в ингибировании активности ДНК-полимеразы, что снижает эффективность ПЦР. По этой причине используется термоустойчивая ДНК-полимераза, такая как ДНК-полимераза Tth, которая обладает функцией обратной транскрипции. С такой термоустойчивой ДНК-полимеразой связана проблема, которая заключается в том, что полимераза осуществляет обратную транскрипцию в ходе последующего процесса ПЦР, в котором поддерживается ферментативная активность, и это вызывает непрерывную неспецифическую реакцию обратной транскрипции, которая приводит к неспецифической амплификации.
Способ реакции ПЦР с горячим стартом, в котором используются антитела, применим только к Taq ДНК-полимеразе (Enneth, G. et al., 1994, Biotechnology, 12; 506-509). Для проведения реакций обратной транскрипции с горячим стартом с использованием других типов обратных транскриптаз, должна быть использована термоустойчивая обратная транскриптаза, которая устойчива при высоких температурах, а для ПЦР с обратной транскрипцией требуются специфичное к обратной транскриптазе антитело, которое отделается при низкой температуре, и антитело, специфичное к ДНК-полимеразе, которое отделяется при высокой температуре. По этой причине должны быть разработаны антитела, специфичные к соответствующим термоустойчивым полимеразам, и, таким образом, есть техническое ограничение таких реакций обратной транскрипции с горячим стартом.
Авторы разработали способ ПЦР с горячим стартом, в котором используются пирофосфат (PPi) и термоустойчивая пирофосфатаза (PPase) (Патент Республики Корея No. 10-0292883). Данный способ основан на принципе, согласно которому PPi, который сильно связывается с ионами магния, необходимым для полимеризации ДНК, добавляется для ингибирования полимеразной реакции при комнатной температуре, а затем PPase вступает в реакцию при высокой температуре удаляя PPi. Обратная транскриптаза не может быть использована в способе с горячим стартом, в котором используется антитело, из-за ее низкотемпературной активации. Обычный способ ПЦР с горячим стартом, в котором используется антитело, представляет собой способ, в котором активность фермента ингибируется при связывании фермента с антителом при низкой температуре, и антитело теряет связывание с ферментом из-за снижения стабильности при достижении высокой температуры, в результате чего проходит реакция ПЦР. Обратная транскриптаза не обладает термоустойчивостью при высокой температуре, в отличие от ДНК-полимеразы. Когда антитело при достижении высокой температуры теряет связь с обратной транскриптазой, активность обратной транскриптазы ингибируется. Для решения данной проблемы был предложен способ реакции обратной транскрипции с горячим стартом, в котором используется PPi и PPase, обладающий преимуществами, которые заключаются в том, что данный способ, в общем, может быть применен вне зависимости от типа ДНК-полимеразы, и в том, что реакционную способность можно непрерывно поддерживать непрерывным удалением PPi, образующимся из dNTP в ходе ПЦР. Однако если изготовить мастер-микс раствор для ПЦР с горячим стартом с использованием данного способа, PPase будет медленно отделять PPi от ионов Mg2+, так что активность ДНК-полимеразы будет проявляться и в конечном счете искомый эффект реакции ПЦР с горячим стартом будет утрачен. Кроме того, у мастер-микс раствора реакции для обратной транскрипции, содержащего PPase, имеется недостаток, который заключается в том, что активность PPase при комнатной температуре или 4°С сохраняется только в течение коротких периодов времени, потому что PPase очень нестабильна. Поэтому была разработана смесь в сухой форме, имеющая повышенную стабильность (Патент Республики Корея No. 10-1098764). Поэтому для решения вышеуказанных проблем реакций обратной транскрипции с горячим стартом необходима технология для высокочувствительных обратной транскрипции с горячим стартом и ПЦР с обратной транскрипцией.
Область техники, к которой относится изобретение
Задача настоящего изобретения заключается в обеспечении композиции для реакции обратной транскрипции с горячим стартом или ПЦР с обратной транскрипцией и горячим стартом, которая содержит пирофосфат (PPi) и пирофосфататазу (PPase).
Для решения вышеуказанной задачи в настоящем изобретении предлагается композиция для реакции обратной транскрипции с горячим стартом, которая содержит ион Mg2+, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi) и пирофосфатазу (PPase).
В настоящем изобретении также предлагается композиция для ПЦР с обратной транскрипцией и горячим стартом, которая содержит ион Mg2+, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi) и пирофосфатазу (PPase), а также включает ДНК-полимеразу.
В настоящем изобретении также предлагается способ получения композиции для реакции обратной транскрипции с горячим стартом, который включает внесение вышеуказанной композиции для реакции обратной транскрипции с горячим стартом в отдельную реакционную пробирку.
В настоящем изобретении также предлагается набор для реакции обратной транскрипции с горячим стартом, которая включает вышеописанную композицию для реакции обратной транскрипции с горячим стартом.
В настоящем изобретении также предлагается способ амплификации нуклеиновой кислоты, который включает стадии: смешивания вышеописанной композиции для ПЦР с обратной транскрипцией и горячим стартом с образцом, содержащим PHK-матрицу, для получения реакционной смеси; проведения реакции для того, чтобы амплифицировать реакционную смесь с получением посредством этого продукта амплификации; и анализа продукта амплификации.
Краткое описание чертежей
На фиг. 1 продемонстрировано влияние пирофосфата (PPi) на ингибирование реакций обратной транскрипции:
Дорожки 1, 2, 3 и 4: результаты проведения реакций обратной транскрипции на 100 нг, 10 нг, 1 нг и 100 пг PHK, соответственно;
А: результаты положительного контроля, полученные при проведении реакции обратной транскрипции в отсутствие PPi, с последующей реакцией ПЦР;
В, С, D, Ε и F: результаты проведения реакций обратной транскрипции в присутствии различных концентраций PPi, с последующими реакциями ПЦР; и
Дорожка М: 100 п.о. маркер длин фрагментов ДНК (Bioneer, Корея) для определения размеров продуктов ПЦР.
На фиг. 2 продемонстрировано, что реакции обратной транскрипции активируются снова при добавлении пирофосфатазы (PPase), которая гидролизует PPi на два фосфата:
Дорожки 1, 2, 3 и 4: результаты проведения реакций обратной транскрипции на 100 нг, 10 нг, 1 нг и 100 пг PHK, соответственно;
А: результаты положительного контроля, полученные при проведении реакции обратной транскрипции в отсутствие PPi, с последующей реакцией ПЦР;
В, С, D, Ε и F: результаты, полученные добавлением различных концентраций PPi;
В-1, С-1, D-1, Е-1 и F-1: результаты проведения реакций обратной транскрипции в присутствии PPase, с последующим проведением реакций ПЦР;
Дорожка M: 1 т.н. маркер длин фрагментов ДНК.
На фиг. 3 продемонстрировано влияние добавления PPi и PPase на ПЦР в режиме реального времени с обратной транскрипцией:
Дорожки 1, 2, 3 и 4: результаты ПЦР в режиме реального времени с обратной транскрипцией с использованием 100 нг, 10 нг, 1 нг и 100 мкг общей PHK человека.
На фиг. 4 продемонстрированы результаты детекции PHK вируса гепатита С с помощью реакции обратной транскрипции с горячим стартом.
На фиг. 5а продемонстрировано влияние PPi и PPase на ингибирование неспецифических реакций в ПЦР в режиме реального времени с обратной транскрипцией:
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: Результаты, полученные с использованием реакционного раствора для обратной транскрипции с горячим стартом, включающим PPi и PPase; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
На фиг. 5b продемонстрированы результаты электрофореза продуктов ПЦР с обратной транскрипцией в реальном времени на 2% агарозном геле:
Дорожки 1, 2, 3, 4, 5 и 6: продукты, полученные из матричной PHK вируса гепатита С, имеющей число копий 106, 105, 104, 103, 102 и 10;
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: Результаты, полученные с использованием реакционного раствора для обратной транскрипции с горячим стартом, включающим PPi и PPase; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
На фиг. 6а приведено сравнение ингибирования неспецифических реакций в ПЦР с обратной транскрипцией в реальном времени между применением реакционного раствора для обратной транскрипции с горячим стартом и Taq-антителом:
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом, который содержит Taq-антитело, вместе с реакционным раствором для ПЦР с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: результаты, полученные при использовании реакционного раствора для обратной транскрипции с горячим стартом, который содержит PPi и PPase, вместе с реакционным раствором для ПЦР с горячим стартом; и
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток, в реакционный раствор «С».
На фиг. 6b приведены результаты электрофореза продуктов ПЦР в режиме реального времени с обратной транскрипцией на 2% агарозном геле:
Дорожки 1, 2, 3, 4, 5 и 6: продукты, полученные из матричной PHK вируса гепатита С, имеющей число копий 106, 105, 104, 103, 102 и 10;
А: результаты, полученные при использовании реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом, который содержит Taq-антитело, вместе с реакционным раствором для ПЦР с горячим стартом;
В: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «А»;
С: результаты, полученные при использовании реакционного раствора для обратной транскрипции с горячим стартом, который содержит PPi и PPase, вместе с реакционным раствором для ПЦР с горячим стартом;
D: результаты, полученные при добавлении 1 мкг общей PHK из человеческих клеток в реакционный раствор «С».
Фиг. 7а и 7с являются диаграммами ПЦР в режиме реального времени с обратной транскрипцией, которые являются демонстрацией того, что композиция обратной транскрипции/ПЦР в виде раствора и композиция обратной транскрипции/ПЦР в сухом виде демонстрируют равную эффективность в ПЦР в режиме реального времени с обратной транскрипцией (фиг. 7а: твердое состояние; фиг. 7с: сухое состояние).
Фиг. 7b и 7d являются стандартными диаграммами ПЦР в режиме реального времени с обратной транскрипцией, которые являются демонстрацией того, что композиция обратной транскрипции/ПЦР в виде раствора и композиция обратной транскрипции/ПЦР в сухом виде демонстрируют равную эффективность в ПЦР в режиме реального времени с обратной транскрипцией (фиг. 7b: твердое состояние; фиг. 7d: сухое состояние).
Фиг. 8а представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием смеси в жидком виде в качестве контроля для тестирования стабильности сухой композиции обратной транскрипции/ПЦР как функции периода хранения.
Фиг. 8b представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией, с использованием сухой смеси с однодневными интервалами для периода хранения в общей сложности 5 дней после хранения при 50°С для тестирования стабильности сухой смеси при хранении:
от 1 дня по 5 день: количество дней, в течение которых сухую смесь хранили при 50°С.
На фиг. 9а приведены результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием праймера, имеющего 6 несовпадающих нуклеотидов на 5' конце, а на фиг. 9b представлены результаты проведения ПЦР в режиме реального времени с обратной транскрипцией с использованием праймера, имеющего 6 несовпадающих нуклеотидов в середине. Также на фиг. 9а и 9b графически продемонстрированы результаты проведения обратной транскрипции в режиме реального времени для подтверждения ингибирования неспецифического связывания праймера с матрицей в реакционной смеси для ПЦР с обратной транскрипцией и горячим стартом.
Фиг. 10а и 10b являются графиками, демонстрирующими результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для анализа однонуклеотидного полиморфизма PHK с помощью ПЦР с обратной транскрипцией и горячим стартом:
«А» обозначает результат, полученный с помощью праймера, имеющего точно совпадающую нуклеоитидную последовательность, а «В» обозначает результат, полученный с помощью праймера, имеющего один несовпадающий нуклеотид.
Фиг. 11 графически демонстрирует результаты проведения обратной транскрипции в режиме реального времени для проверки ингибирования неспецифических реакций, являющиеся результатом самопраймирования PHK-PHK, обратной транскрипцией с горячим стартом:
«А» на фиг. 11 демонстрирует результаты проведения ПЦР в режиме реального времени с использованием PHK отдельно без реакции обратной транскрипции; а «В» демонстрирует результаты проведения реакции обратной транскрипции с использованием праймера, с последующим проведением ПЦР в режиме реального времени. «В-А» обозначает результат, полученный путем проведения реакции обратной транскрипции с использованием реакционного раствора для обратной транскрипции с горячим стартом, а «В-В» демонстрирует результат, полученный путем проведения реакции обратной транскрипции с использованием реакционного раствора, не обладающего функцией обратной транскрипции с горячим стартом. «С» демонстрирует результаты осуществления реакции обратной транскрипции с использованием PHK отдельно в реакционном растворе, не обладающем функцией обратной транскрипции с горячим стартом, с последующим проведением ПЦР в режиме реального времени. «D» демонстрирует результаты проведения реакции обратной транскрипции с использованием PHK отдельно в реакционном растворе для обратной транскрипции с горячим стартом, с последующим проведением ПЦР в режиме реального времени.
Фиг. 12 представляет собой графическую диаграмму, демонстрирующую результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для проверки, будет ли ингибироваться терминацией PHK самопраймирование PHK-PHK в реакции обратной транскрипции. «А» и «В» демонстрируют результат, полученный с помощью нетерминированной PHK, а «С» и «D» демонстрируют результаты, полученные с помощью терминированной PHK. Для «А» и «С», была проведена простая реакция обратной транскрипции, а для «В» и «D», была проведена реакция обратной транскрипции с горячим стартом.
На фиг. 13а приведены результаты снижения маркера злокачественных опухолей кератина-8 с использованием PHK, экстрагированной из клеток Hela. Для количественного анализа, экстрагированную PHK серийно 10-кратно разводили и подвергали ПЦР в режиме реального времени с обратной транскрипцией для получения стандартной кривой. Фиг. 13b, 13с, 13d и 13е представляют собой графики, демонстрирующие результаты проведения ПЦР в режиме реального времени с обратной транскрипцией для проверки, улучшает ли терминация PHK и ПЦР с обратной транскрипцией и горячим стартом порог обнаружения маркера злокачественной опухоли.
Лучший вариант осуществления изобретения
В одном аспекте настоящее изобретение направлено на композицию для реакции обратной транскрипции с горячим стартом, которая содержит ион Mg, четыре типа dNTP, обратную транскриптазу, пирофосфат (PPi), и пирофосфатазу (PPase).
Обратная транскриптаза, используемая в настоящем изобретении, может быть любой известной обратной транскриптазой. В частности, могут быть использованы коммерчески доступные AMV или MMLV.
В качестве пирофосфатазы (PPase) в настоящем изобретении может быть использована коммерчески доступная PPase без каких-либо ограничений. В частности, PPase, которая используется в настоящем изобретении предпочтительно может быть Tte-неорганической пирофосфотазой (SibEnzyme Ltd.) полученной из Е.coli, в которые клонировали ген неорганической пирофосфатазы, полученной из Thermus thermophilics В35, или Pto-неорганической пирофосфатазой (Bioneer corporation, Корея), полученной Е.coli, в которые клонировали неорганическую пирофосфатазу, полученную из Picrophilus torridus. 1 единица Pto-неорганической пирофосфатазы определяется как количество фермента, требуемое для выработки 40 ммоль фосфата из пирофосфата в течение 1 минуты. Реакцию проводят с использованием Tris-HCl (рН 7,5), 5 мМ MgCl2, и 2,0 мМ PPi с общим объемом реакции 0,5 мл при 70°С в течение 10 минут.
PPi, который содержится в композиции, может быть добавлен в концентрации 0,1-5,0 мМ, предпочтительно 0,2-3,0 мМ исходя из конечного реакционного раствора. Если концентрация PPi выше, чем 5,0 мМ, концентрацию используемой PPase необходимо пропорционально повысить, и в данном случае количество продукта реакции обратной транскрипции может снизится. Если концентрация PPi ниже, чем 0,1 мМ, способность захватывать ионы Mg в композиции для реакции обратной транскрипции будет снижена, и, таким образом, не может быть достигнут эффект ингибирования выработки неспецифических продуктов, вызванных неспецифическим праймированием (нецелевое праймирование). Когда концентрация PPi составляет 0,1-5 мМ, предпочтительно в реакционной смеси для обратной транскрипции содержится 0,005-0,25 Ед. PPase. PPase используется в количестве 0,005-0,25 Ед. на 0,1 мМ PPi. Если PPase используется в концентрации выше, чем 0,25 Ед. на 0,1 мМ PPi, результат может быть подтвержден при более высокой концентрации, когда используется матрица с более высоким числом копий, по сравнению с тем, когда используется матрица с низким числом копий, а реактивность обратной транскрипции может быть снижена, что приводит к значимому снижению количества реакционного продукта. Если концентрация PPase ниже, чем 0,005 Ед. на 0,1 мМ PPi, реакция обратной транскрипции может ингибироваться.
Раствор реакционного буфера, который используется в настоящем изобретении, предпочтительно является буфером (рН 9,0) содержащим 10 мМ Tris HCl и 40 мМ KCl, и четыре типа dNTP, а именно dATP, dTTP, dGTP и dCTP. При необходимости композиция может дополнительно включать вещества, необходимые для реакции обратной транскрипции, включая праймеры, нуклеотидную матрицу и т.п. Праймеры предпочтительно могут быть случайными праймерами, или праймерами, специфичными к нуклеотидной матрице, и нуклеотидная матрица предпочтительно является PHK, необходимой для реакции обратной транскрипции. Кроме того, композиция может содержать флуоресцентный краситель, который может быть выбран из группы, состоящей из SyBr Green, EtBr и HRdye.
Композиция для реакции обратной транскрипции по настоящему изобретению может дополнительно содержать праймеры для обратной транскрипции. Праймеры для обратной транскрипции, которые используются в настоящем изобретении, могут быть любыми праймерами, которые отжигаются на PHK-матрице для осуществления обратной транскрипции PHK. В частности, праймеры для обратной транскрипции могут быть поли-А праймерами, или праймерами, специфичными для PHK-матрицы.
При этом композиция для реакции обратной транскрипции по настоящему изобретению может включать краситель и/или полиол, который не реагирует с нуклеиновой кислотой, для удобства проведения экспериментов, предотвращения контаминации продуктами ПЦР, стабилизации ДНК-полимеразы и dNTP и улучшения реакционной способности.
«Инертный краситель» должен быть выбран из веществ, которые не оказывают влияния на реакции обратной транскрипции, и используется для анализа или идентификации реакций ПЦР с помощью продуктов реакции обратной транскрипции. Примеры веществ, которые удовлетворяют таким условиям, включают водорастворимый краситель, такой как родамин, тамра, лаке, бромфеноловьш синий, ксилен цианол, бромкрезоловый красный, и крезоловый красный. Из их числа предпочтительно используется ксиленцианол. Инертный краситель может содержаться в количестве 0,0001-0,01 масс.%, предпочтительно 0,001-0,005 масс.%, а более предпочтительно 0,001-0,003 масс.%, исходя из общей массы композиции. Если содержание инертного красителя в композиции меньше, чем 0,0001 масс.%, то из-за низкой концентрации красителя будет сложно визуально наблюдать миграцию образца в ходе гель-электрофореза в агарозе для анализа после реакции обратной транскрипции. Если содержание инертного красителя в композиции выше, чем 0,01 масс.%, то высокая концентрация водорастворимого красителя может действовать как ингибитор реакции в ходе реакции обратной транскрипции. Кроме того, этот краситель может мешать миграции образца в ходе гель-электрофореза в агарозе.
Также как вспомогательный стабилизатор для дополнительной стабилизации композиции настоящего изобретения может быть использован полиол, который может быть одним или несколькими соединениями, выбранными из группы, состоящей из глюкозы, глицерина, маннитола, галактитола, глюцитола и сорбитола. Содержание полиола в композиции может составлять 10-500 мМ, а предпочтительно 50-300 мМ. При содержании полиола выше, чем 500 мМ из-за растворимости водорастворимого полимера его может быть трудно растворить в водном растворе, из-за высокой вязкости его будет сложно смешать в достаточной степени, полиол будет повышать объем композиции до объема больше, чем требуется, и полиол будет с трудом растворяться в стерильной дисстиллированной воде и растворе гена перед реакцией обратной транскрипции. Кроме того, высокая концентрация водорастворимого полимера может действовать как реакционный ингибитор в ходе реакции обратной транскрипции. С другой стороны, если содержание полиолов в композиции меньше, чем 10 мМ, целевой фермент и поверхностные молекулы воды не могут быть в достаточной степени покрытыми, так что они не будут защищены, и, таким образом, эффект рационально стабилизированного фермента не может быть достигнут.Кроме того, раствор может быть размазан по всему дну пробирки из-за его низкой вязкости и не может быть высушен в идеальной форме, а фермент не может быть в достаточной степени защищен. В настоящем изобретении в дополнение к полиолу в качестве стабилизатора могут быть использованы желатин, бычий сывороточный альбумин, Thesit или PEG-8000.
Композиция настоящего изобретения предпочтительно является лиофилизированной или высушенной для повышения стабильности, удобства хранения и стабильности в ходе длительного хранения. Сушка может быть осуществлена известным способом сушки, таким как сушка при комнатной температуре, сушка при повышенной температуре, например, 40-60°С, лиофилизация или сушка при пониженном давлении. Кроме того, любой способ сушки может быть использован, при условии, что компонент композиции не будет утерян. Метод сушки, как описано выше, может быть применен в зависимости от типа и количества используемого фермента. В настоящем изобретении предпочтительно могут быть использованы способ замораживания-высушивания или способ с пониженным давлением, в котором используется вакуумное центрифугирование.
Композиция для ПЦР с обратной транскрипцией и горячим стартом может быть получена в стабильной форме путем введения реакционной смеси в отдельную реакционную пробирку, с последующим немедленным замораживанием и сушкой реакционной смеси.
При необходимости реакционная смесь может дополнительно включать праймер, зонд, нуклеотидную матрицу, флуоресцентный краситель, инертный краситель и/или полиол.
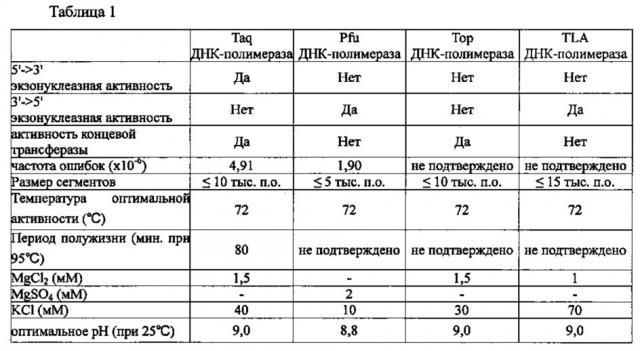
В качестве ДНК-полимеразы в настоящем изобретении можно использовать любую известную ДНК-полимеразу без каких-либо конкретных ограничений. Из числа этих полимераз могут быть использованы отдельно или в комбинации полимераза, обладающая 5'->3' экзонуклеазной активностью, полимераза, обладающая 3'->5' экзонуклеазной активностью, и полимераза, которая не обладает ни 5'->3' экзонуклеазной активностью, ни 3'->5' экзонуклеазной активностью. Примеры полимеразы, обладающей 5'->3' экзонуклеазной активностью, включают Taq ДНК-полимеразу, примеры полимеразы, обладающей 3'->5' экзонуклеазной активностью, включают Pfu ДНК-полимеразу или TLA ДНК-полимеразу (Bioneer), а примеры полимеразы, которая не обладает ни 5'->3' экзонуклеазной активностью, ни 3'->5' экзонуклеазной активностью, включают Тор ДНК-полимеразу (Bioneer). ДНК-полимераза может содержаться в композиции для ПЦР с обратной транскрипцией в концентрации 0,1-10 Ед. (единиц), предпочтительно, 0,5-2 Ед., а наиболее предпочтительно 1 Ед. Taq, Pfu, Тор и TLA ДНК-полимеразы обладают характеристиками, представленными в таблице 1 ниже.
Кроме того, композиция для ПЦР с обратной транскрипцией может быть использована, в дополнение к ПЦР с обратной транскрипцией, в любой реакции амплификации нуклеиновых кислот, такой как мультиплексные ПЦР с обратной транскрипцией, ПЦР в режиме реального времени с обратной транскрипцией, количественная ПЦР в режиме реального времени, или множественные ПЦР в режиме реального времени с обратной транскрипцией.
В настоящем изобретении композиция для ПЦР с обратной транскрипцией может дополнительно содержать вещество, которое демонстрирует эффект ПЦР с горячим стартом пу