Способ получения травопроста
Иллюстрации
Показать всеИзобретение относится к способу получения травопроста формулы (I), отличающемуся тем, что соединение формулы (II) стереоселективно восстанавливают восстановительным реагентом типа борана в присутствии хирального катализатора, полученное соединение формулы (III) при желании кристаллизуют, лактонную группу соединения формулы (III) восстанавливают диизобутилалюминийгидридом, п-фенилбензоильную защитную группу полученного таким образом соединения формулы (IV) удаляют путем метанолиза, полученный триол формулы (V) при желании после кристаллизации превращают по реакции Виттига в
кислоту формулы (VI), которую затем этерифицируют в растворителях типа циклического третичного амида изопропилйодидом. Способ имеет более высокую селективность и лучший выход.
(I) (II)
(III) (IV)
(V) (VI)
4 н. и 24 з.п. ф-лы, 7 ил., 6 пр.
Реферат
Объектом настоящего изобретения является новый способ получения травопроста.
Травопрост формулы (I):
| (I) |
является известным производным простагландина, применяющимся для лечения глаукомы и высокого внутриглазного давления (US 5510383).
Способы получения травопроста раскрыты, например, в EP 2143712, WO 2011/046569, WO 2011/055377.
Способ, соответствующий EP 2143712, представлен на фиг. 1.
Стереоселективность восстановления енон→енол составляет 88,7% (пример 10).
В соответствии со способом, раскрытым в WO 2011/046569, примесь 15-эпи удаляют путем защиты групп OH диола трет-бутилдиметилсилильной группой (TBDMS) и кристаллизации полученного таким образом защищенного диола.
В способе, описанном в WO 2011/055377, преобразование енон→енол проводят с помощью комплекса N,N-диэтиланилин/боран в качестве восстановительного реагента в присутствии катализатора Corey (CBS-оксазаборолидин). Продукт очищают с помощью препаративной ВЭЖХ.
Полный выход равен 7%.
Задачей настоящего изобретения является разработка способа, имеющего более высокую стереоселективность и лучший выход.
Объектом настоящего изобретения является получение травопроста формулы (I):
| (I) |
с помощью
стереоселективного восстановления соединения формулы (II):
| (II) |
восстановления лактонной группы полученного соединения формулы (III):
| (III) |
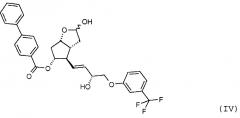
удаления п-фенилбензоильной защитной группы из полученного таким образом соединения формулы (IV):
| (IV) |
преобразования полученного триола формулы (V) по реакции Виттига:
| (V) |
в кислоту формулы (VI):
| (VI) |
которую затем этерифицируют.
Исходное соединение формулы (II) можно получить, например, путем окисления PPB-Corey-лактона формулы (XII):
| (XII) |
в альдегид, который затем превращают в фосфонат формулы (XIII):
| (XIII) |
по реакции HWE в безводной среде в присутствии твердого гидроксида калия и затем в соединение формулы (II).
В одном варианте осуществления способа, основанного на настоящем изобретении, PPB-Corey-лактон окисляют по реакции Pfitzner-Moffatt в альдегид (Pfitzner, K.E., Moffatt J.G.; J.Am.Chem.Soc. 1963, 85, 3027), затем меньшую цепь формируют по реакции Horner-Wadsworth-Emmons (HWE) (Wadsworth, W.; Org. React., 1977, 25, 73) - с использованием подходящего фосфоната - в безводной среде в присутствии твердого гидроксида калия. Для депротонирования фосфоната - вместо использования подробно описанных гидрида натрия, трет-бутилата калия, карбоната лития, DBU, галогенидов лития или магния, триэтиламина, гексаметилдисилазида калия (KHMDS) или краун-эфиров - оснований заявители настоящего изобретения использовали твердый гидроксид калия, который является экономичным и может безопасно использоваться в промышленном масштабе.
Реакцию HWE проводят в апротонном органическом растворителе при температуре в диапазоне от 40 до -50°C, предпочтительно при -10°C, с использованием в качестве растворителя ароматического углеводорода, такого как толуол, или простого эфира, такого как тетрагидрофуран, метилтетрагидрофуран, циклопентилметиловый эфир, диметоксиэтан, трет-бутилметиловый эфир, диизопропиловый эфир, диэтиловый эфир или их смеси.
В другом варианте осуществления настоящего изобретения селективное восстановление соединения формулы (II) проводят восстановительным реагентом типа борана.
В качестве восстановительного реагента типа борана можно использовать боран-диметилсульфид, (-)-В-хлордиизопинокамфенилборан (DIP-C1), катехолборан, предпочтительно катехолборан. В другом варианте осуществления способа восстановление соединения формулы (II) проводят в присутствии хирального катализатора. В качестве хирального катализатора можно использовать CBS-оксазаборолидин. Реакцию проводят в присутствии органического растворителя, при температуре от -10°C до -90°C, от 10°C до -80°C, предпочтительно от -10 до -20°C. В качестве растворителя можно использовать
толуол, гексан, гептан, пентан, тетрагидрофуран, метилтетрагидрофуран, циклопентилметиловый эфир, диметоксиэтан, трет-бутилметиловый эфир, диизопропиловый эфир, диэтиловый эфир или их смеси, в частности, используют смеси толуол/тетрагидрофуран.
Полученное соединение формулы (III) очищают с помощью кристаллизации, при которой количество нежелательного изомера в значительной степени уменьшается. Кристаллическая форма соединения формулы (III) ранее не была известна, она является новой формой. Кристаллизацию проводят в полярных или аполярных растворителях или в их смеси.
В одном варианте осуществления способа, предлагаемого в настоящем изобретении, кристаллизацию проводят при температуре от -20 до 70°C таким образом, что вещество растворяют в спирте при кипячении с обратным холодильником и кристаллизуют путем постепенного охлаждения. Затем кристаллы отфильтровывают, промывают и сушат.
Восстановление соединения формулы (III) можно провести диизобутилалюминийгидридом (DIBAL-H). В качестве растворителя можно использовать инертные апротонные растворители, такие как ТГФ, толуол, гексан и гептан. Реакцию проводят при температуре от -80 до -50°C, предпочтительно от -80 до -70°C.
Продукт восстановления с помощью DIBAL-H, промежуточное соединение формулы (IV), является новым соединением.
Защитную группу РРВ можно удалить по известным методикам путем метанолиза в щелочной среде, предпочтительно в присутствии карбоната калия.
В другом варианте осуществления способа полученное промежуточное соединение формулы (V) очищают с помощью кристаллизации, при которой количество нежелательного изомера уменьшается до необходимого ограниченного значения. Кристаллическая форма соединения формулы (V) ранее не была описана, она является новой формой. Кристаллизацию проводят в смеси полярных и аполярных растворителей. В качестве смеси полярных и аполярных растворителей можно использовать смесь этилацетат/гексан.
Превращение соединения формулы (V) в соединение формулы (VI) проводят по реакции Виттига, а этерификацию соединения формулы (VI) проводят изопропилйодидом.
В реакции этерификации в качестве растворителей используют циклические третичные амиды, такие как N-метилпирролидон и/или 1,3-диметилимидазолидинон. Этерификацию проводят при температуре от 20 до 90°C, предпочтительно в диапазоне от 40 до 50°C.
Другим объектом настоящего изобретения является новое соединение формулы (IV):
| (IV) |
и его применение для получения травопроста.
Кроме того, объектом настоящего изобретения является кристаллическое соединение формулы (III):
| (III) |
имеющее температуру плавления 129,5-134,5°C, и его применение для получения травопроста.
Кроме того, объектом настоящего изобретения является кристаллическое соединение формулы (V):
| (V) |
имеющее температуру плавления 85,4-86,6°C, и его применение для получения травопроста.
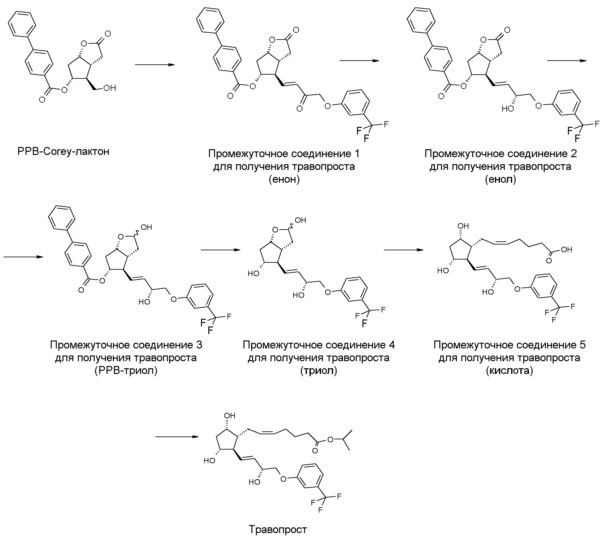
Один вариант осуществления полного синтеза травопроста, предлагаемого в настоящем изобретении, представлен ниже на схеме 1:
Схема 1
В одном варианте осуществления настоящего изобретения, который начинается с PPB-Corey-лактона, меньшую цепь формируют с помощью подходящего фосфоната по реакции Horner-Wadsworth-Emmons. Для депротонирования фосфоната используют недорогой и безопасно использующийся в промышленном масштабе твердый гидроксид калия. Восстановление полученного промежуточного соединения 1 для получения травопроста (енон - соединение формулы (II)) проводят в присутствии 2-метил-CBS-оксазаборолидинового катализатора восстановительным реагентом типа борана, таким как катехолборан, и обеспечивают стереоселективность, равную 90%. Полученное таким образом промежуточное соединение 2 для получения травопроста (енол - соединение формулы (III)) очищают с помощью кристаллизации и восстанавливают диизобутилалюминийгидридом (DIBAL-H). Из полученного промежуточного соединения 3 для получения травопроста (PPB-триол - соединение формулы (IV)) удаляют защитную группу PPB, и полученное таким образом промежуточное соединение 4 для получения травопроста (триол - соединение формулы (V)) очищают с помощью кристаллизации. Промежуточное соединение 5 для получения травопроста (кислота - соединение формулы (VI)) получают по реакции Виттига. В заключение проводят этерификацию изопропилйодидом в ДМИ (1,3-диметилимидазолидин-2-он) и получают эфир (травопрост - соединение формулы (I)).
Преимущества способа, предлагаемого в настоящем изобретении:
- В реакции HWE, для получения исходного соединения формулы (II) депротонирование фосфоната проводят недорогим и безопасно использующимся в промышленном масштабе твердым гидроксидом калия - вместо дорогого и огнеопасного гидрида натрия, который обычно и широко используется в современной практике.
- Применение CBS-оксазаборолидина и катехолборана для восстановления 15-оксогруппы при синтезе травопроста является новым подходом, не использовавшимся ранее, с помощью которого можно обеспечить диастереоизомерный избыток (ДИ), даже превышающий 90-92%. В способе, описанном в EP 2143712, при использовании DIP-Cl селективность составляет ДИ(S)=88,7%. В способе, раскрытом в WO 2011/055377 A1, кроме катализатора CBS, используют комплекс N,N-диэтиланилинборана, но степень стереоселективности не указана.
- Методика очистка является совершенно новой, поскольку удаление примеси 15-эпи проводят путем кристаллизации, без хроматографии, с высоким выходом, в отличие от методик MPLC (методика очистки с помощью хроматографии среднего давления) (WO 2011/046569 A1) или препаративной ВЭЖХ (WO 2011/055377 A1), известных в литературе.
- Кристаллическая форма соединения формулы (III) и форма соединения формулы (V) ранее не описаны в литературе. В способе, предлагаемом в настоящем изобретении, кристаллическая форма также используется для очистки промежуточных соединений и удаления нежелательного изомера.
- На стадии этерификации в качестве нового растворителя используют 1,3-диметилимидазолидинон (ДМИ), который не сильно токсичен в отличие от обычно использующегося диметилформамида (EP 2143712 A1, WO 2011/046569 A1). ДМИ является растворителем, использующимся в косметической промышленности. Дополнительным преимуществом является то, что при использовании ДМИ не образуются содержащие формил примеси, которые образуются из широко использующегося растворителя диметилформамида. Реакцию этерификации можно провести с очень высокой степенью превращения без образования новых примесей (приблизительно 100%).
- Полный выход нового способа является очень высоким, 16%, что более чем вдвое больше выхода, описанного в WO 2011/055377 A1 (7%).
- В приведенных ниже примерах приведено дополнительное подробное описание настоящего изобретения, но оно не ограничивается приведенными ниже примерами.
Примеры
1. Формирование меньшей цепи (окисление и реакция HWE)
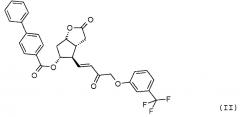
Получение (3aR,4R,5R,6aS)-гексагидро-2-оксо-4-[(1E)-3-оксо-4-[3-(трифторметил)фенокси]-1-бутен-1-ил]-2H-циклопента[b]фуран-5-илового эфира [1,1'-бифенил]-4-карбоновой кислоты (соединения формулы (II))
1069 г PPB-Corey-лактона суспендируют в инертной атмосфере в 11,1 л безводного толуола. К этой суспензии добавляют 1,4 л диизопропилкарбодиимида и затем 0,855 л диметилсульфоксида в фосфорной кислоте. Реакционную смесь нагревают до 50°C и порциями добавляют еще 0,34 л диметилсульфоксида в фосфорной кислоте. После завершения реакции окисления смесь охлаждают до -10°C и, поддерживая это значение температуры, добавляют 316 г гидроксида калия и затем 1,45 кг раствора фосфоната травопроста в толуоле. После завершения реакции HWE, реакционную смесь выливают в 1 M раствор хлористоводородной кислоты, и смесь перемешивают. Осадившиеся кристаллы отфильтровывают и промывают. Фазы фильтрата разделяют, органическую фазу промывают 1 M раствором гидрокарбоната натрия и затем разбавляют раствором хлористоводородной кислоты. Органическую фазу выпаривают и очищают с помощью хроматографии на колонке с силикагелем (элюент: смесь толуол/этилацетат). Главную фракцию выпаривают и кристаллизуют из смеси этилацетат/гексан.
Выход: 915 г, 55%.
Температура плавления: 112,5-114,5°C.
ИК-спектр промежуточного соединения 1 для получения травопроста приведен на фиг. 2.
| Данные 1H-, 13C- и 19F-ЯМР промежуточного соединения 1 для получения травопроста:Промежуточное соединение 1 для получения травопроста (енон формулы (II)): | |||||
| Нумерация | 13C/19F(м.д.) | 1H(м.д.) | Количество 1H | Мультиплетность | Константа взаимодействия(Гц)(±0,2 Гц) |
| 6 | 176,56 | - | - | ||
| 7 | 34,46 | β: 2,96*α: 2,55 | 11 | м (дд)д | Jgem=17,3; J7β,8=10,2 |
| 8 | 42,17 | 3,00* | 1 | м (дддд) | |
| 9 | 83,32 | 5,13 | 1 | тд | J8,9=J9,10β=6,4; J9,10α=1,3 |
| 10 | 37,50 | β: 2,63α: 2,14 | 11 | дтдд | Jgem=15,2; J10β,11=6,4 J10α,11=3,6 |
| 11 | 78,95 | 5,35 | 1 | дт | J11,12=5,6 |
| 12 | 53,66 | 3,10 | 1 | м (ддд) | J8,12=5,0 |
| 13 | 146,19 | 6,99 | 1 | дд | J13,14=16,0; J12,13=8,1 |
| 14 | 127,24 | 6,44 | 1 | д | |
| 15 | 194,08 | - | - | - | |
| 16 | 71,12 | 5,17 | 2 | с | |
| 17 | 158,14 | - | - | - | |
| 18 | 111,16 (кв.) | 7,22** | 1 | широкий | 3JC-18,F=3,8; J18,20=1,5; J18,22=2,5 |
| 19 | 130,24 (кв.) | - | - | - | 2JC-19,F=31,7 |
| 20 | 117,50 (кв.) | 7,285 | 1 | м (д) | 3JC-20,F=3,8; J20,21=7,8; J20,22=0,8; |
| 21 | 130,63 | 7,495*** | 1 | м (дд) | J21,22=8,2 |
| 22 | 118,75 | 7,20** | 1 | м (дд) | |
| 23 | 123,95 (кв.) | - | - | - | 1JC-23,F=272,5 |
| 23-F | -61,10 (с, 3) | - | - | - |
| 24 | 164,94 | - | - | - | |
| 25 | 128,16 | - | - | - | |
| 26, 26' | 129,95 | 8,015 | 2 | м | J26,27=8,5 |
| 27, 27' | 126,87 | 7,81 | 2 | м | |
| 28 | 144,93 | - | - | - | |
| 29 | 138,77 | - | - | - | |
| 30, 30' | 127,01 | 7,74 | 2 | м (дд) | J30,31=7,4 |
| 31, 31' | 129,10 | 7,51*** | 2 | м (т) | J31,32=7,4 |
| 32 | 128,46 | 7,43 | 1 | м (тт) | J30,32~1,6 |
| *, **, ***: Перекрывающиеся сигналы 1H-ЯМР. |
2. Восстановление 15-оксогруппы (стереоселективное восстановление)
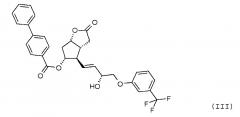
Получение (3aR,4R,5R,6aS)-гексагидро-4-[(1E,3R)-3-гидрокси-4-[3-(трифторметил)фенокси]-1-бутен-1-ил]-2-оксо-2H-циклопента[b]фуран-5-илового эфира [1,1'-бифенил]-4-карбоновой кислоты (соединения формулы (III))
279 мл катехолборана растворяют в 4,6 л тетрагидрофурана (ТГФ) и к нему добавляют 549 мл 1 M раствора R-(+)-2-метил-CBS-оксазаборолидина в толуоле. Смесь охлаждают до -10°C и, поддерживая это значение температуры, добавляют 915 г промежуточного соединения 1 для получения травопроста (енон - соединение формулы (II)) в 6,9 л ТГФ. После завершения реакции смесь разлагают путем перемешивания с 13 л 1 M раствора NaHSO4. Затем добавляют этилацетат, и фазы разделяют. Органическую фазу промывают раствором NaOH и затем раствором хлористоводородной кислоты. Органическую фазу сушат над сульфатом натрия, фильтруют, выпаривают и для удаления нежелательного изомера кристаллизуют сначала из смеси гексан/ацетон, затем из метанола ДИ(S)92% - >ДИ(S)98%.
(ДИ означает: диастереоизомерный избыток)
Выход: 701 г, 55% ДИ(S): 98%.
Температура плавления: 129,5-134,5°C.
ИК-спектр промежуточного соединения 2 для получения травопроста приведен на фиг. 3.
| Данные 1H-, 13C- и 19F-ЯМР промежуточного соединения 2 для получения травопроста: | |||||
| Нумерация | 13C/19F(м.д.) | 1H(м.д.) | Количество 1H | Мультиплетность | Константа взаимодействия(Гц)(±0,2 Гц) |
| 6 | 176,76 | - | - | - | |
| 7 | 34,53 | β: 2,93α: 2,46 | 11 | дддд | Jgem=17,8; J7β,8=10,0J7α,8=0,9 |
| 8 | 42,14 | 2,85* | 1 | м (дддд) | |
| 9 | 83,28 | 5,09 | 1 | тд | J8,9=J9,10β=6,5; J9,10α=1,4 |
| 10 | 37,20 | β: 2,55α: 2,05 | 11 | дтм (дд) | Jgem=15,2; J10β,11=6,4J10α,11=4,6 |
| 11 | 79,58 | 5,20 | 1 | м (ддд/дт) | J11,12~5,5 |
| 12 | 53,49 | 2,83* | 1 | м (ддд) | |
| 13 | 129,87$ | 5,76** | 1 | м | |
| 14 | 132,18 | 5,76** | 1 | м | |
| 15 | 68,83 | 4,34 | 1 | м (широкий) | |
| 15-OH | 5,26 | 1 | д | J15,OH=4,9 | |
| 16 | 72,18 | a: 3,95b: 3,90 | 11 | дддд | Jgem=9,8; J15,16a=4,6J15,16b=6,7 |
| 17 | 158,88 | - | - | - | |
| 18 | 111,08 (кв.) | 7,195*** | 1 | м | 3JC-18,F=3,7 |
| 19 | 130,25 (кв.) | - | - | - | 2JC-19,F=31,5 |
| 20 | 117,04 (кв.) | 7,25 | 1 | д | 3JC-20,F=3,7; J20,21=7,7; J18,20=1,4; J20,22=1,0 |
| 21 | 130,63 | 7,47# | 1 | м (т/дд) | J21,22=8,2 |
| 22 | 118,80 | 7,20*** | 1 | м | J18,22=2,5; |
| 23 | 123,98 (кв.) | - | - | - | 1JC-23,F=272,4 |
| 23-F | -61,16 (с, 3) | - | - | - | |
| 24 | 165,02 | - | - | - |
| 25 | 128,33 | - | - | - | |
| 26, 26' | 129,87$ | 7,99 | 2 | д | J26,27=8,4 |
| 27, 27' | 126,80 | 7,77 | 2 | д | |
| 28 | 144,81 | - | - | - | |
| 29 | 138,77 | - | - | - | |
| 30, 30' | 126,97 | 7,72 | 2 | д | J30,31=7,4 |
| 31, 31' | 129,07 | 7,50# | 2 | м (т) | J31,32=7,4 |
| 32 | 128,42 | 7,43# | 1 | м (тт) | |
| *, **, ***, #, ##: перекрывающиеся сигналы 1H-ЯМР. $: перекрывающиеся сигналы 13C-ЯМР. |
3. Восстановление лактона (получение лактола)
Получение (3aR,4R,5R,6aS)-гексагидро-4-[(1E,3R)-3-гидрокси-4-[3-(трифторметил)фенокси]-1-бутен-1-ил]-2-гидроксициклопента[b]фуран-5-илового эфира [1,1'-бифенил]-4-карбоновой кислоты (соединения формулы (IV))
В многогорлую колбу в атмосфере азота помещают 701 г енола, который затем при комнатной температуре растворяют в 6,8 л ТГФ. Прозрачный раствор охлаждают до -75°C, и к нему в течение примерно 30 мин добавляют предварительно охлажденный (-75°C) 1 M раствор 2921 мл диизобутилалюминийгидрида (DIBAL-H) в гексане. Реакционную смесь перемешивают при -75°C до завершения реакции. После достижения подходящей степени превращения реакционную смесь выливают в смесь раствора NaHSO4 и этилацетата. Фазы разделяют, водную фазу экстрагируют этилацетатом, объединенную органическую фазу промывают раствором NaHCO3 и разбавленным раствором хлористоводородной кислоты и затем выпаривают, добавив к ней триэтиламин (ТЭА). Получают 639,5 г масла.
Выход: 639,5 г, 91%.
ИК-спектр промежуточного соединения 3 для получения травопроста приведен на фиг. 4.
| Данные 1H-, 13C- и 19F-ЯМР промежуточного соединения 3 для получения травопроста:А)В) |
| Промежуточное соединение 3 для получения травопроста, диастереоизомер A | |||||
| Нумерация | 13C/19F(м.д.) | 1H(м.д.) | Количество 1H | Мультиплетность | Константа взаимодействия (Гц)(±0,2 Гц) |
| 6 | 98,78 | 5,53 | 1 | тд | J6,OH=4,6; J6,7=2,2 и 4,6 |
| 6-OH | 6,02 | 1 | д | ||
| 7 | 39,31$ | a: 1,93*b: 1,89* | 11 | мм | |
| 8 | 45,28 | 2,565** | 1 | м | |
| 9 | 79,43 | 4,565 | 1 | тд | J8,9=6,2; J9,10=2,7 и 6,2 |
| 10 | 37,21 | β: 2,51 α: 1,74*** | 11 | мм (ддд) | Jgem~14,0J10α,11=6,9 |
| 11 | 79,72 | 5,08 | 1 | м (кв./дт) | J10β,11=J11,12=6,9 |
| 12 | 53,23 | 2,575** | 1 | м | |
| 13 | 130,60 | 5,75+ | 1 | дд | J13,14=15,6; J12,13=6,5 |
| 14 | 131,71 | 5,70+ | 1 | дд | J14,15=4,5 |
| 15 | 68,79 | 4,32++ | 1 | м (дддд) | |
| 15-OH | 5,23+++ | 1 | м (д) | J15,OH=5,0 |
| 16 | 72,23$$ | a: 3,91#b: 3,87# | 11 | м (дд)м (дд) | Jgem=9,7; J15,16a=4,8;J15,16b=6,7 |
| 17 | 158,88$$ | - | - | - | |
| 18 | 111,09 (кв.) | 7,16## | 1 | м | 3JC-18,F=3,6; J18,20~J18,22~1,3 |
| 19 | 130,24$$ (кв.) | - | - | - | 2JC-19,F=31,7 |
| 20 | 117,01$$ (кв.) | 7,22### | 1 | м | 3JC-20,F=3,8; J20,21=7,8 |
| 21 | 130,56 | 7,44& | 1 | м (т/дд) | J21,22=7,8 |
| 22 | 118,73 | 7,15## | 1 | м | |
| 23 | 123,97$$ (кв.) | - | - | - | 1JC-23,F=272,4 |
| 23-F | -61,19(с, 3) | - | - | - | |
| 24 | 165,16 | - | - | - | |
| 25 | 128,61 | - | - | - | |
| 26, 26' | 129,75$$ | 7,985&& | 2 | д | J26,27=8,4 |
| 27, 27' | 126,90$$ | 7,77 | 2 | д | |
| 28 | 144,71$$ | - | - | - | |
| 29 | 138,84$$ | - | - | - |