Селективные ингибиторы циклооксигеназы и способ их получения
Иллюстрации
Показать всеИзобретение относится к селективным ингибиторам фермента циклооксигеназы-2 (СОХ-2) класса замещенных 3(2Н)-фуранонов общей формулы (I) и (II) и замещенных фенантро[9,10-b]фуран-3(2Н)-онов общей формулы (III), а также фармацевтической композиции на их основе. Данные соединения являются эффективными селективными ингибиторами циклооксигеназы-2 (IC50 до 0.004 мкг/мл, SI до 690) и могут быть использованы в лечении заболеваний, ассоциированных с развитием воспаления и гиперэкспрессией фермента СОХ-2, таких как хронические формы артрита, мигрени, травмы, заболевания кожи, а также для ингибирования ангиогенеза и замедления роста клеток некоторых видов рака, таких как нейробластома, рак молочной железы, желудка, легких и толстого кишечника. 4 н. и 11 з.п. ф-лы, 4 табл., 9 пр., 14 ил.
Реферат
Область техники
Данное изобретение относится к химии органических соединений, фармакологии и медицине и касается новых химических соединений, обладающих высокой эффективностью и селективностью в ингибировании фермента СОХ-2. Данные соединения могут быть использованы в терапии заболеваний, ассоциированных с развитием воспаления, а также заболеваний, опосредованных избыточной секрецией СОХ-2.
Уровень техники
Простагландины (PG), продуцируемые из арахидоновой кислоты посредством фермента циклооксигеназы (СОХ), играют важную роль в развитии воспалительных реакций у человека и животных. Ингибирование фермента циклооксигеназы позволяет остановить биосинтез таких простагландинов, как PGE2, PGG2 и PGH2 и нивелировать симптомы воспаления (отек, боль, гиперемию), связанные с их действием. Известны как минимум две разновидности фермента циклооксигеназы: СОХ-1 и СОХ-2, из которых за развитие воспалительного процесса отвечает только СОХ-2, тогда как СОХ-1 участвует в жизненно важной регуляции секреции в желудочно-кишечном тракте и почках (ЖКТ). Структурно эти ферменты чрезвычайно схожи, и их избирательное ингибирование затруднительно [1]. Длительное ингибирование функций фермента СОХ-1, например, при применении неселективных нестероидных противовоспалительных препаратов (НПВС) таких как аспирин, ибупрофен, диклофенак, индометацин, напроксен и других, часто приводит к развитию желудочно-кишечных язв, кровотечений, деструкции клеточной стенки ЖКТ, может спровоцировать перфорацию органов пищеварения и развитие раковых опухолей [2, 3].
В начале 2000-х годов на фармацевтический рынок были выведены НПВС второго поколения, относящихся к классу селективных ингибиторов фермента СОХ-2 (коксибы). Типичные примеры таких НПВС человека: рофекоксиб ("Vioxx", Merck), целекоксиб ("Celebrex", Pfizer), вальдекоксиб ("Bextra", G.D. Searle & Company), эторикоксиб ("Arcoxia", Merck), и животных: фирококсиб ("Previcox"), деракоксиб ("Deramaxx", Novartis), капрофен ("Rimadyl"). Данный класс препаратов объединяет строение молекулы действующего вещества - все они 1,2-диарилзамещенные гетероциклические соединения, содержащие в своем составе группы SO2NH2 или SO2Me, отвечающие за селективность ингибирования СОХ-2 [4]. Однако большинство из известных селективных ингибиторов СОХ-2 при длительном применении вызывают повышенный риск сердечнососудистых осложнений (испытания VIGOR [5], APPROVe [6]), инфаркта миокарда и инсульта, в результате чего, в 2004-2006 годах большая часть селективных ингибиторов СОХ-2 была отозвана с рынков и развитие данной области фармакологии было несколько затруднено. Таким образом, на сегодняшний день нет удовлетворительного решения проблемы длительной и безопасной противовоспалительной терапии различных заболеваний, в частности, терапии различных форм хронического артрита, остеоартрита, ревматоидного артрита и других заболеваний суставов.
Тем не менее, причина и степень выраженности осложнений со стороны сердечнососудистой системы достаточно широко варьируется в зависимости от строения ингибитора, так как влияние коксибов в каскаде арахидоновой кислоты распространяется не только на СОХ-пути, но и косвенно также на LOX и CYT-P450 траектории [7]. Широкомасштабные исследования сравнительной кардиоваскулярной безопасности НПВС, выполненные после запрещения рофекоксиба (2006-2012 г.), показали [7], что такие классические НПВС как ибупрофен, диклофенак, индометацин - часто превосходят селективные ингибиторы СОХ-2 по выраженности побочных эффектов. При этом анальгетическое действие более выражено у последних, степень опасности которых, в целом, является переоцененной [8-9]. В настоящее время, особое внимание уделяется также новым областям применения ингибиторов СОХ-2 - это терапия некоторых форм рака (2,5-диметил целекоксиб, априкоксиб, тилмакоксиб (JTE-522)) [10], а также психических [11] и нейродегенеративных заболеваний (болезнь Альцгеймера) [12].
Необходимо также отметить, что большинство (90%) известных гетероциклических cis-диарил коксибов имеют совершенно определенный порядок арильных заместителей -идрофобный арил соседствует с гидрофильной (и/или стерически объемной) группой или гетероатомом в гетероцикле. Перестановка положения SO2X-замещенного арила (т.е. гидрофильного арила) и гидрофильного арила (например, галоген-замещенного фенила) в ряде случаев приводит к полной утрате активности соединения по отношению к ферменту СОХ-2 [13]. Тем не менее, имеется ряд обратных примеров, когда перестановка арильных групп не ведет к утрате ингибирующей способности [14]. В этом случае, можно ожидать проявление каких-то новых свойств ингибитора, например, данная структурная особенность может повлиять на степень выраженности кардиоваскулярных побочных эффектов применения таких соединений.
В этой связи поиск новых высокоэффективных лекарственных препаратов, селективных ингибиторов циклооксигеназы-2, не вызывающих развития побочных эффектов, является одним из основных направлений создания новых фармакологических средств для лечения воспалительных заболеваний и острой боли, в том числе: суставного синдрома при ревматизме и обострении подагры, ревматоидного артрита, псориатического артрита, остеоартроза, радикулита, воспалительных процессов связок и сухожилий; воспалений, вызванных укусами ядовитых змей, скорпионов и других животных; воспалений, вызванных солнечными ожогами, повреждениями кожного покрова под действием ультрафиолетового света; воспалений, вызванных различными формами онкологических заболеваний, такими как рак кожных покровов, колоректальный рак, рак молочной железы, рак предстательной железы, и другими формами рака.
Раскрытие изобретения
Задачей настоящего изобретения является разработка и получение новых эффективных ингибиторов циклооксигеназы-2 (СОХ-2), являющихся перспективными для лечения заболеваний воспалительного генеза или заболеваний, ассоциированных с избыточной секрецией циклооксигеназы-2.
Техническим результатом данного изобретения является разработка и получение новых соединений, обладающих высокой ингибирующей активностью и селективностью по отношению к ферменту циклооксигеназе-2. Указанные соединения предпочтительно ингибируют циклооксигеназу-2 по сравнению с циклооксигеназой-1, что, в свою очередь, снижает вероятность возникновения побочных эффектов, связанных с деструктивными поражениями желудочно-кишечного тракта, почек и печени [2, 3]. Данные соединения являются перспективными для применения в терапии заболеваний воспалительного генеза и/или заболеваний, ассоциированных с избыточной секрецией циклооксигеназы-2, в частности, для лечения боли (как хронической, так и острой), лихорадки и воспаления при различных состояниях и заболеваниях.
Указанный технический результат достигается путем получения соединений общей формулы (I):
или их стереоизомеров, энантиомеров, фармацевтически приемлемых солей, сольватов или гидратов, где:
R1 представляет собой сульфонамидную группу -SO2NHAlk, где Alk выбирают из метила, этила, изопропила или н-пропила или незамещенную сульфонамидную (-SO2NH2) или сульфо (-SO2OH) группу;
R2 выбирается независимо и представляет собой галоген или водород, причем указанные заместители находятся в мета- или параположении по отношению к точке присоединения фенильной группы;
R3 и R4 выбираются независимо и представляют собой -С1-5-алкил или -С3-7-циклоалкилалкил, причем R3 и R4 совместно с атомом углерода, к которому они присоединены, могут образовывать насыщенный цикл, содержащий от 3 до 7 атомов.
В некоторых предпочтительных вариантах воплощения изобретения R2 выбирается независимо и представляет собой фтор или хлор.
Отдельный подкласс соединений, представляющих интерес, включает соединения формулы (I), выбранных из группы:
2,2-Диметил-4-[4'-(аминосульфонил)фенил]-5-фенилдигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(аминосульфонил)фенил]-5-(4'-фторфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(аминосульфонил)фенил]-5-(3'-фторфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(аминосульфонил)фенил]-5-(4'-хлорфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(аминосульфонил)фенил]-5-(3'-хлорфенил)дигидрофуран-3(2H)-он;
4-(5,5-диметил-4-оксо-2-фенил-4,5-дигидрофуран-3-ил)бензолсульфокислота;
4-(2-(4'-фторфенил)-5,5-диметил-4-оксо-4,5-дигидрофуран-3-ил)бензолсульфокислота;
4-(2-(4'-хлорфенил)-5,5-диметил-4-оксо-4,5-дигидрофуран-3-ил)бензолсульфокислота;
4-(2-(3'-фторфенил)-5,5-диметил-4-оксо-4,5-дигидрофуран-3-ил)бензолсульфокислота;
4-(2-(3'-хлорфенил)-5,5-диметил-4-оксо-4,5-дигидрофуран-3-ил)бензолсульфокислота;
Указанный технический результат также достигается путем получения соединений общий формулы (II):
или их стереоизомеров, энантиомеров, фармацевтически приемлемых солей, сольватов или гидратов, где:
R1 выбирается независимо и представляет собой C1-3-алкилсульфонил или C1-3-алкилсульфинил группу;
R2 выбирается независимо и представляет собой галоген;
R3 и R4 выбираются независимо и представляют собой -C1-5-алкил или -С3-7-циклоалкилалкил, причем R3 и R4 совместно с атомом углерода, к которому они присоединены, могут образовывать насыщенный цикл, содержащий от 3 до 7 атомов.
В некоторых предпочтительных вариантах воплощения изобретения R2 выбирается независимо и представляет собой фтор или хлор.
Еще один отдельный подкласс соединений, представляющих интерес, включает соединения формулы (II), выбранных из группы:
2,2-Диметил-4-[4'-(метилсульфинил)фенил]-5-(3'-фторфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(метилсульфонил)фенил]-5-(3'-фторфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(метилсульфинил)фенил]-5-(3'-хлорфенил)дигидрофуран-3(2H)-он;
2,2-Диметил-4-[4'-(метилсульфонил)фенил]-5-(3'-хлорфенил)дигидрофуран-3(2H)-он.
Кроме того, указанный технический результат также достигается путем получения соединений общий формулы (III):
или их стереоизомеров, энантиомеров, фармацевтически приемлемых солей, сольватов или гидратов, где:
R1 выбирается независимо и представляет собой C1-3-алкилсульфонил, C1-3-алкилсульфинил, замещенный сульфонамид (-SO2NHAlk, где Alk выбирают из метила, этила, изопропила или н-пропила) или незамещенный сульфонамид (-SO2NH2), сульфо (-SO2OH) группу, C1-3-алкилтио группу, водород или галоген, причем указанные заместители находятся в третьем или четвертом положении фенантренового фрагмента;
R2 выбирается независимо и представляет собой C1-3-алкилсульфонил, С1-3-алкилсульфинил, замещенный сульфонамид (-SO2NHAlk, где Alk выбирают из метила, этила, изопропила или н-пропила) или незамещенный сульфонамид (-SO2NH2), сульфо (-SO2OH) группу, C1-3-алкилтио группу, водород или галоген, причем указанные заместители находятся в пятом или шестом положении фенантренового фрагмента;
причем если R1 представляет собой водород, то R2 не может быть водородом и наоборот;
R3 и R4 выбираются независимо и представляют собой -С1-5-алкил или -С3-7-циклоалкилалкил, причем R3 и R4 совместно с атомом углерода, к которому они присоединены, могут образовывать насыщенный цикл, содержащий от 3 до 7 атомов.
В некоторых предпочтительных вариантах воплощения изобретения R1 и R2 выбираются независимо и представляют собой фтор или хлор.
Другой отдельный подкласс соединений, представляющих интерес, включает соединения формулы (III), выбранных из группы:
2',2'-Диметил-3-(метилтио)фенантро[9,10-b]фуран-3'(2'H)-он;
2',2'-Диметил-3-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
2',2'-Диметил-3-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
2',2'-Диметил-3-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он
2',2'-Диметил-6-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
2',2'-Диметил-6-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
2',2'-Диметил-6-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
6-фтор-2',2'-Диметил-3-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-фтор-2',2'-Диметил-3-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'H)-он;
6-фтор-2',2'-Диметил-3-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-фтор-2',2'-Диметил-3-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
3-фтор-2',2'-Диметил-6-(метилтио)фенантро[9,10-b]фуран-3'(2H)-он;
3-фтор-2',2'-Диметил-6-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'H)-он;
3-фтор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
3-фтор-2',2'-Диметил-6-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-хлор-2',2'-Диметил-3-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-хлор-2',2'-Диметил-3-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-хлор-2',2'-Диметил-3-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
6-хлор-2',2'-Диметил-3-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
3-хлор-2',2'-Диметил-6-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
3-хлор-2',2'-Диметил-6-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'H)-он;
3-хлор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
3-хлор-2',2'-Диметил-6-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
5-хлор-2',2'-Диметил-3-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
5-хлор-2',2'-Диметил-3-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
5-хлор-2',2'-Диметил-3-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
5-хлор-2',2'-Диметил-3-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
4-хлор-2',2'-Диметил-6-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
4-хлор-2',2'-Диметил-6-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
4-хлор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
4-хлор-2',2'-Диметил-6-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
5-фтор-2',2'-Диметил-3-(метилтио)фенантро[9,10-b]фуран-3'(2'Н)-он;
5-фтор-2',2'-Диметил-3-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'H)-он;
5-фтор-2',2'-Диметил-3-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
5-фтор-2',2'-Диметил-3-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'H)-он;
4-фтор-2',2'-Диметил-6-(метилтио)фенантро[9,10-b]фуран-3'(2H)-он;
4-фтор-2',2'-Диметил-6-(метилсульфинил)фенантро[9,10-b]фуран-3'(2'Н)-он;
4-фтор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он;
4-фтор-2',2'-Диметил-6-(аминосульфонил)фенантро[9,10-b]фуран-3'(2'Н)-он.
Данное изобретение также относится к применению соединений, являющихся предметом изобретения, в качестве ингибиторов фермента циклооксигеназы-2.
В некоторых вариантах воплощения изобретения соединения, являющиеся предметом настоящего изобретения и проявляющие свойства ингибиторов циклооксигеназы-2, могут быть использованы в качестве противовоспалительных, анальгетических, жаропонижающих, противоартритных, противоопухолевых средств [15, 16], средств, замедляющих ангиогенез новых сосудов раковых опухолей [17], средств, повышающих иммунную реакцию организма по отношению к раковым клеткам [18], средств, замедляющих пролиферацию раковых клеток [19, 20], а также для лечения болезни Альцгеймера.
Соединения по настоящему изобретению могут применяться для лечения боли (как хронической, так и острой), лихорадки и воспаления при различных состояниях и заболеваниях, в частности, таких заболеваниях как: артрит, суставной синдром при ревматизме и обострении подагры, ревматоидный артрит, псориатический артрит, остеоартроз, радикулит, болезни Альцгеймера, головной, зубной или менструальной боли воспалительные процессы связок, сухожилий, ишиас, люмбаго, воспаление, связанное с солнечными ожогами, повреждениями кожного покрова под действием ультрафиолетового света, различными формами онкологических заболеваний, в частности онкологических заболеваний кожного покрова.
Настоящее изобретение также относится к применению соединений, являющихся предметом изобретения, для получения фармацевтической композиции для лечения заболеваний воспалительного генеза или заболеваний, ассоциированных с избыточной секрецией фермента циклооксигеназы-2.
Кроме того, изобретение предусматривает фармацевтические композиции для лечения заболеваний воспалительного генеза или заболеваний, ассоциированных с избыточной секрецией фермента циклооксигеназы-2, содержащие эффективное количество, по меньшей мере, одного соединения, являющегося предметом настоящего изобретения, и, по меньшей мере, один фармацевтически приемлемый носитель и/или разбавитель. В некоторых частных вариантах воплощения изобретения, фармацевтическая композиция характеризуется тем, что содержит соединения по изобретению и его региоизомер относительно перестановки местами заместителей R1 и R2.
В некоторых вариантах воплощения изобретения фармацевтические композиции, являющиеся предметом настоящего изобретения, могут быть использованы в качестве противовоспалительных, анальгетических, жаропонижающих средств.
В некоторых других вариантах воплощения изобретения фармацевтические композиции по изобретению могут применяться для лечения заболеваний, представляющих собой артрит, кожное воспалительное заболевание, воспаление при сосудистых заболеваниях, легочное воспаление, тиреоидит, воспаление, вязанное с общим переохлаждением, гриппом или вирусной инфекцией. Кроме того, более конкретно артрит представляет собой ревматоидный артрит, остеоартрит, подагрический артрит, ювенильный артрит, спондилолистез, а кожное воспалительное заболевание представляет собой экзему, дерматит, псориаз.
Соединения по изобретению могут быть пригодны для лечения млекопитающих, предпочтительно человека, а также животных, включая, но не ограничиваясь, овец, собак, кошек, лошадей, свиней, крыс, мышей, кроликов и других.
Соединения по изобретению могут быть использованы в комбинации с, по меньшей мере, одним другим терапевтическим агентом.
Изобретение также включает получение соединений общих формул (I), (II) и (III).
Изобретение также относится к способу лечения заболеваний воспалительного генеза или заболеваний, ассоциированных с избыточной секрецией фермента циклооксигеназы-2 путем введения пациенту фармацевтически эффективного количества соединения по изобретению или фармацевтической композиции по изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В результате проведенных исследований было обнаружено, что соединения по изобретению избирательно и эффективно ингибируют СОХ-2. Указанные соединения полезны при лечении очень широкого спектра нарушений, опосредованных СОХ-2, включая, но не ограничиваясь, нарушениями, характеризующимися воспалением, болью и/или лихорадкой. Такие композиции особенно полезны в качестве противовоспалительных агентов, в частности, при лечении артрита, имея дополнительное преимущество, состоящее в проявлении значительно менее опасных побочных эффектов, чем известные из уровня техники нестероидные противовоспалительные препараты, которые обладают невысокой селективностью к СОХ-2 относительно СОХ-1. В частности, соединения по изобретению имеют сниженный потенциал желудочно-кишечной токсичности и раздражения желудочно-кишечного тракта, включая образование язвы в верхней части желудочно-кишечного тракта и кровотечение, сниженный потенциал почечных побочных эффектов. Поэтому соединения по изобретению, селективно ингибирующие СОХ-2, особенно полезны в качестве альтернативы общеизвестным нестероидным противовоспалительным препаратам, где такие препараты противопоказаны, например, у пациентов с язвами желудка, гастритом, регионарным энтеритом, язвенным колитом, дивертикулитом или с рецидивирующими желудочно-кишечными нарушениями; при желудочно-кишечном кровотечении, нарушениях свертываемости крови, включая анемию, такую как гипопротромбинемия, гемофилию или других проблемах, связанных с кровотечением; при болезни почек; или у пациентов перед хирургическим вмешательством, или у пациентов, принимающих антикоагулянты.
Такие соединения полезны при лечении боли, включая, но не ограничиваясь, болью после операции, зубной болью, мышечной болью и болью, возникающей при онкологическом заболевании. Такие композиции полезны, например, для ослабления боли, лихорадки и воспаления при различных состояниях, включая поясничную и шейную боль, дисменорею, головную боль, зубную боль, растяжения и деформации, миозит, невралгию, синовит, артрит, включая ревматоидный артрит, дегенеративные суставные заболевания (остеоартрит), подагру, бурсит, ожоги и травмы после хирургических и стоматологических вмешательств.
Определения и термины
Термин «алкил» в настоящем документе означает как неразветвленные, так и разветвленные алкилы. Кроме того, термин «алкил» в настоящем документе относится к группам, обычно имеющим от одного до трех атомов углерода. Например, термин -С1-3-алкил означает метил, этил, изопропил, н-пропил.
Термин «циклоалкил» в настоящем документе относится к группам, имеющим от трех до семи атомов углерода в моноциклической структуре. В качестве иллюстрации, циклоалкилы включают, но не ограничиваются, следующими радикалами: циклопропил, циклобутил, циклопентил, циклогексил.
Термин «арил» в настоящем документе означает группы, содержащие ароматический цикл, имеющий шесть атомов углерода. Примером арильных циклических групп является фенил.
Термин «галоген» сам по себе или в части другого термина относится к атому фтора, хлора, брома или йода.
Данное изобретение содержит только такие комбинации заместителей и производных, которые образуют стабильное или химически возможное соединение. Стабильным или химически возможным соединением называется такое соединение, стабильности которого достаточно для его синтеза и аналитического детектирования. Предпочтительные соединения данного изобретения являются достаточно стабильными и не разлагаются при температуре до 40°C в отсутствие химически активных условий, в течение, по крайней мере, одной недели.
Термин «заместитель» означает химический радикал, который присоединяется к молекулярному остову (фрагменту), например «заместитель алкильный», «заместитель циклической системы», значения которых определены в данном документе.
Если не указано иначе, изображенные здесь структуры также подразумевают и все стереоизомеры, то есть R- и S- изомеры для каждого ассиметричного центра. Кроме того, отдельные стереохимические изомеры, равно как и энантиомеры и диастереомерные смеси настоящих соединений, также являются предметом данного изобретения. Таким образом, данное изобретение охватывает каждый диастереомер или энантиомер, свободный в значительной степени от других изомеров (>90%, а предпочтительно >95% мольной чистоты), так же как и смесь таких изомеров.
Конкретный оптический изомер может быть получен разделением рацемической смеси в соответствии со стандартной процедурой, например путем получения диастереоизомерных солей путем обработки оптически активной кислотой или основанием с последующим разделением смеси диастереомеров кристаллизацией с последующим выделением оптически активных оснований из этих солей. Другая методика разделения оптических изомеров заключается в использовании хиральной хроматографической колонки.
Оптически активные соединения данного изобретения могут быть получены с использованием оптически активных исходных материалов. Такие изомеры могут находиться в форме свободной кислоты, свободного основания, эфира или соли.
Термин «региоизомер» охватывает в настоящем документе соединения, получающиеся перестановкой заместителей R1 и R2 в общих формулах (I), (II), или (III) вместе с их положениями в бензольном кольце, между собой. Так, например, региоизомерами, в данном документе, для соединений формул (I), (II), (III) будут соединения формулы (I*), (II*), (III*):
При этом, например, в формулах (II) и (II*) заместитель R1 сохраняет параположение, а заместитель R2 - сохраняет метаположение, в соответствии с данным определением.
Нумерация в фенантреновом фрагменте соединений общей формулы (III) в данном документе полагается жесткозакрепленной, постоянной и независящей от заместителей R1 и R2 так, как это показано на следующем рисунке:
Термин «пациент» охватывает все виды млекопитающих, предпочтительно человека.
Термины «лечение», «терапия» охватывают лечение патологических состояний у млекопитающих, предпочтительно у человека, и включают: а) блокирование (приостановку) течения заболевания, б) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания.
Термин «воспаление» - (лат. inflammatio) - это комплексный, местный и общий патологический процесс, возникающий в ответ на повреждение (alteratio) клеточных структур организма или действие патогенного раздражителя и проявляющийся в реакциях (exudatio и др.), направленных на устранение продуктов повреждения, а если возможно, то и агентов (раздражителей), а также приводящий к максимальному для данных условий восстановлению (proliferatio и др.) в зоне повреждения.
Термин «терапевтически эффективное количество» подразумевает такое количество соединения, которое при введении в качестве моно- или комбинированной терапии вызывает ингибирование фермента СОХ-2, достаточное для лечения заболевания млекопитающего, ассоциированного с развитием воспаления, а также заболевания, опосредованного избыточной секрецией СОХ-2. При применении соединений по изобретению в комбинированной терапии термин «терапевтически эффективное количество» относится к комбинации количеств активных ингредиентов, прием которых ведет к превентивному или терапевтическому эффекту при последовательном или одновременном приеме. Точное требуемое количество может меняться от субъекта к субъекту в зависимости от вида млекопитающего, возраста и общего состояния пациента, тяжести заболевания, методики введения препарата, комбинированного лечения с другими препаратами и т.п.
Термин «сольват» относится к ассоциации или комплексу из одной или нескольких молекул растворителя и соединения по изобретению. Примеры растворителей, образующих сольваты, включают, но ими не ограничиваются, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, где молекулами растворителя является вода.
Краткое описание чертежей
Рисунок 1. Значения нормализованных потенциальных энергий (ккал/моль) для аминокислот в составе фермента hCOX-2 после процедуры «отжига».
Рисунок 2. Значения нормализованных потенциальных энергий (ккал/моль) для аминокислот в составе фермента hCOX-1 после процедуры «отжига».
Рисунок 3. Аминокислоты в hCOX-1 с высокими значениями стресса (серые сферы), сайт связывания показан желтыми сферами.
Рисунок 4. Референсный набор известных ингибиторов hCOX-1 и hCOX-2. Соединения Е-8, Е-9, Е-13, Е-14 относятся к СОХ-ингибиторам с измененным порядком следования арильных групп относительно общепринятого.
Рисунок 5. Внутренняя валидация модели с использованием молекулы целекоксиба, активная конформация: оранжевый - данные рентгеноструктурного анализа, серый - докинг: а) hCOX-2 (скоринг: - 14.27 ккал/моль), RMSD=0.13 б) hCOX-1 (скоринг: - 13.39 ккал/моль); RMSD=0.21.
Рисунок 6. Общий вид трехцентрового фармакофора с молекулой целекоксиба. Фармакофор интегрирован в in silico модель (Acc - потенциальный акцептор водородной связи, Aro - ароматическая область).
Рисунок 7. QSAR модель для СОХ-2 в форме линейной аппроксимации.
Рисунок 8. QSAR модель для СОХ-1 в форме линейной аппроксимации.
Рисунок 9. Исследованные структуры ингибиторов СОХ-1 и СОХ-2 по изобретению.
Рисунок 10. Структуры некоторых известные ингибиторы циклооксигеназы:
а) Рофекоксиб: IC50 (СОХ-2)=0.06 мкг/мл, IC50 (СОХ-1)=100 мкг/мл, селективность 1700;
б) Целекоксиб: IC50 (СОХ-2)=0.02 мкг/мл, IC50 (СОХ-1)=1.9 мкг/мл, селективность 100;
в) Кетопрофен: IC50 (СОХ-2)=0.13 мкг/мл, IC50 (СОХ-1)=0.6 мкг/мл, селективность 4.6.
Рисунок 11. Докинг 2,2-диметил-4-[4'-(аминосульфонил)фенил]-5-(3'-хлорфенил)фуран-3(2H)-она (1u) в сайте связывания СОХ-2. Сравнение с целекоксибом (оранжевая структура). Скоринг: - 8.631 ккал/моль.
Рисунок 12. Докинг 2,2-диметил-4-[4'-(аминосульфонил)фенил]-5-(4'-хлорфенил)фуран-3(2H)-она (1v) в сайте связывания СОХ-2. Сравнение с целекоксибом (оранжевая структура). Скоринг: - 8.495 ккал/моль.
Рисунок 13. Докинг 3-хлор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-она (2е) в сайте связывания СОХ-2. Сравнение с целекоксибом (оранжевая структура). Скоринг: - 7.499 ккал/моль.
Рисунок 14. Докинг 4-фтор-2',2'-Диметил-6-(метилсульфонил)фенантро[9,10-b]фуран-3'(2'Н)-она (2h) в сайте связывания СОХ-2. Сравнение с целекоксибом (оранжевая структура). Скоринг: - 7.138 ккал/моль.
Осуществление изобретения
Обзор методов получения соединений изобретения
Соединения, являющиеся предметом настоящего изобретения, могут быть получены с использованием описанных ниже синтетических методов. Перечисленные методы не являются исчерпывающими и допускают введение разумных модификаций. Указанные реакции должны проводиться с использованием подходящих растворителей и материалов. При реализации данных общих методик для синтеза конкретных веществ необходимо учитывать присутствующие в веществах функциональные группы и их влияние на протекание реакции. Для получения некоторых веществ необходимо изменить порядок стадий либо отдать предпочтение одной из нескольких альтернативных схем синтеза. Следует понимать, что эти и все приведенные в материалах заявки примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения.
Спектры ЯМР 1Н (400 МГц) и 13С (100 МГц) регистрировали на спектрометре «Bruker 400 MHz Avance» в дейтерохлороформе, CHCl3 (реперный сигнал 7.26 м.д.). ИК спектры получены на спектрофотометре «Perkin-Elmer ВХII» в диапазоне 4000-400 см-1 в растворителе тетрахлоруглероде или в таблетке KBr. Для снятия масс-спектров использовали хромато-масс спектрометр «Bruker microTOF». Температуру плавления измеряли на приборе «Buchi В-540».
Реакции проводили в безводных растворителях, очищенных по стандартным методикам. Для препаративного разделения реакционных смесей использовали колоночную и флеш-хроматографию на силикагеле Silicagel L 40/100 мкм в градиентном режиме, а также препаративную ТСХ на пластинах Silufol UV-254 (Kavalier, ). Аналитическую ТСХ проводили на пластинах Silufol UV-254, элюенты - гексан, петролейный эфир, хлористый метилен, ацетон, этилацетат и смесь растворителей в различном соотношении.
Соединения, приведенные в описании без ссылок, приготовлены по стандартным лабораторным методикам либо являются коммерчески доступными веществами.
Промежуточные продукты для получения некоторых соединений по изобретению могут быть получены по нижеописанным методикам.
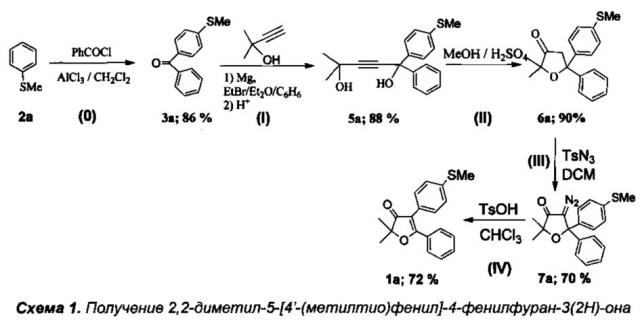
Получение интермедиата 2,2-диметил-4-[4'-(метилтио)фенил]-5-фенилфуран-3(2H)-она (Схема 1:1а)
Стадия 0. Получение 4'-(метилтио)фенил(фенил)метанона (3а).
К охлажденному до 5°C раствору 25 мл (25.5 г, 0.2 моль) тиоанизола (2а) в 200 мл хлористого метилена при перемешивании добавили 30 г безводного AlCl3. Затем в течение 1.5 ч при интенсивном охлаждении до 0-5°C по каплям добавили 23 мл (28 г, 0.2 моль) хлористого бензоила, при этом смесь приобрела оранжевый цвет и большую вязкость. После добавления всего хлористого бензоила смесь кипятили с обратным холодильником в течение 3.5 ч. По завершению реакции оранжевый осадок комплекса с хлоридом алюминия отфильтровали на фильтре Шотта, промыли дихлорметаном и гидролизовали: в начале холодной 7% HCl, а затем довели гидролиз до полного обесцвечивания продукта путем кипячения. Затвердевший при охлаждении кетон 3а был растворен в дихлорметане, промыт H2O и высушен над Na2SO4 в течение 12 часов. После отгонки растворителя получили 33.3 г 4'-(метилтио)фенил(фенил)метанона (3а). Темно-оранжевый маточный раствор комплекса в дихлорметане гидролизовали кипячением с 7% водным раствором HCl до полного обесцвечивания, затем органический слой отделили от водного, водный слой экстрагировали дихлорметаном (3×15 мл). Объединенные органические фракции были промыты водой и высушены над Na2SO4. После отгонки растворителя продукт был перекристаллизован из гексана и высушен на воздухе (1 сутки). Получили 5.95 г соединения 3a. Общий выход 39.2 г (86%), бесцветные кристаллы, т.пл. 79-80°C.
Спектр ЯМР 1Н (400 МГц, 32 мг в 0.8 мл CDCl3), δ, м.д.: 2.53 с (3Н, SCH3), 7.29 д (2H), 7.46 т (2H), 7.52-7.60 м (1Н), 7.73 д (2H), 7.75 д (2H).
Спектр ЯМР 13С (100 МГц, 32 мг в 0.8 мл CDCl3), δ, м.д.: 14.8 (SCH3), 124.8, 128.2, 129.7, 130.5, 132.1, 133.5, 137.7, 145.2 (все CArAr'), 195.8 (С=O).
ИК спектр (в CCl4), см-1: 836 ср., 920 ср., 936 ср., 1090 с., 1175 ср., 1282 с., 1315 с., 1400 ср., 1445 ср., 1589 с., 1658 с. (С=O), 2923 сл., 2990 сл., 3025 сл., 3062 сл., 3083 сл.
Масс-спектр HRMS, m/z найдено: 229.0689 [МН]+, вычислено: 229.0682.
Стадия I. Получение 2-метил-5-фенил-5-(4'-метилтиофенил)пент-3-ин-2,5-диола (5а).
К раствору EtMgBr, приготовленному из 5 г (0.21 моль) магния и 22.7 г (0.21 моль) этилбромида, в 60 мл абсолютного диэтилового эфира при охлаждении на ледяной бане медленно прибавили по каплям раствор 7.85 мл (0.081 моль) 2-метилбут-3-ин-2-ола в 50 мл абсолютного бензола. Смесь кипятили в течение 2 ч, затем при охлаждении добавили по каплям раствор 13 г (0.0575 моль) соединения 3а в 50 мл бензола и кипятили в течение 5 ч. Затем смесь охладили в водяной бане и осторожно гидролизовали при помощи 150 мл 5% холодного раствора соляной кислоты. Органический слой отделили от водного. Водный слой экстрагировали бензолом (3×20 мл). Объединенные органические фракции промыли раствором NaHCO3, водой и высушили над Na2SO4. После отгонки растворителя полученное желтое маслообразное вещество высушили в вакууме при давлении 0.01÷0.05 торр в течение 5 ч. Выход 5а 16.2 г (88%), бесцветное маслообразное вещество. Без дополнительной очистки полученное соединение использовали на следующей стадии.
Спектр ЯМР 1Н (400 МГц, 20 мг в 0.8 мл CDCl3), δ, м.д.: 1.57 с (6Н, 2СН3), 2.53 с (3Н, SCH3), 7.17 д (2H), 7.22-7.27 м (1Н), 7.31 т (2H), 7.48 д (2H), 7.52-7.58 м (2H).
Спектр ЯМР 13С (100 МГц, 20 мг в 0.8 мл CDCl3), δ, м.д.: 15.5 (SCH3), 31.3 (2СН3), 65.2 73.9, 84.7 91.8 125.8, 126.1, 126.4, 127.8, 128.4, 138.1, 141.8, 144.8.
ИК спектр (в CCl4), см-1: 700.9 сл., 908.5 сл., 951.7 сл., 999.6 сл., 1167.6 сл., 1325.6 сл., 1449.0 сл., 1490.0 сл., 2854.7 ср., 2926.6 с., 3606.5 сл.
Масс-спектр HRMS, m/z, рассчитано: 335.1077, найдено: 335.1087 [MNa]+.
Стадия II. Получение 2,2-диметил-5-[4'-(метилтио)фенил]-5-фенил-дигидрофуран-3(2H)-она (6а).
15.8 г (0.051 моль) соединения 5а растворили в 50 мл кипящего метанола и при перемешивании по каплям добавили 2.5 мл (0.045 моль) 98% серной кислоты, растворенной в 7.5 мл метанола. Смесь кипятили в течение 2 ч до окончания реакции (контроль по ТСХ). Затем смесь вылили в 100 мл воды и тщательно экстрагировали хлористым метиленом (3×50 мл). Органический слой высушили над Na2SO4, растворитель отогнали на роторе, а полученное вещество высушили от метанола и дихлорметана в вакууме при давлении 0.02÷0.05 торр в течение 5 ч. Полученное масло закристаллизовали с использованием затравки и повторно высушили в вакууме. Получено 14.2 г вещества (выход 90%) 6а, бесцветные кристаллы, т.пл. 64-65°C. Без дополнительной очистки полученное соединение использовали на следующей стадии.
Спектр ЯМР 1Н (400 МГц, 25 мг в 0.7 мл CDCl3), δ, м.д.: 1.21 д (6Н, 2СН3), 2.45 с (3Н, SCH3), 3.30 с (2Н, СН2), 7.17 д (2H), 7.21-7.26 м (1Н), 7.26-7.36 м (4Н), 7.40 д (2H).
Спектр ЯМР 13С (100 МГц, 25 мг в 0.7 мл CDCl3), δ, м.д.: 15.6 (SCH3), 25.3 (2СН3), 47.9 (СН2), 81.4 82.4, 125.9, 126.1, 126.6, 127.3, 128.3, 137.7, 142.8, 146.0, 216.9 (С=O).
ИК спектр (в CCl4), см-1: 961 сл., 994 сл., 1095 сл., 1133 сл., 1173 сл., 1281 сл., 1376 сл., 1447 сл., 1493 сл., 1599 сл., 1760 с., 2925 сл., 2984 сл., 3028 сл., 3064 сл.
Масс-спектр HRMS, m/z, рассчитано: 313.1257, найдено: 313.1259 [МН]+.
Стадия III. Получение 4-диазо-2,2-диметил-5-[4'-(метилтио)фенил]-5-фенил-дигидрофуран-3(2H)-она (7а).
К смеси 250 мг (0.8 ммоль) фуранона 6а и 195 мг (0.99 ммоль) паратолуолсульфонилазида в 15 мл дихлорметана добавили по каплям рас