Способ получения противоопухолевого средства против метастазов костей в виде конъюгата белка-цитокина и аминобисфосфоната
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для получения противоопухолевого средства против метастазов костей в виде конъюгата белка-цитокина и аминобисфосфоната. Для этого проводят реакцию конъюгации аминобисфосфоната и противоопухолевого компонента с использованием сшивающего агента. Затем отделяют продукт конъюгации от несвязавшихся компонентов реакционной смеси. При этом в качестве противоопухолевого компонента используют белок ФНО-альфа человека, в качестве аминобисфосфоната алендроновую кислоту, в качестве сшивающего агента используют глутаровый альдегид, или водорастворимый N-(3-диметиламинопропил)-N'-этилкарбодиимид, или сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (Sulfo-SCMM). Перед проведением реакции конъюгации алендроновую кислоту или белок ФНО-альфа предварительно адсорбируют на нерастворимом носителе гидроксилапатите. Компонент, адсорбированный на носителе, активируют сшивающим агентом с последующей отмывкой указанного агента. После образования конъюгата на носителе вначале элюируют несвязавшийся белок ФНО-альфа, а затем полученный конъюгат алендроновой кислоты с белком ФНО-альфа. Полученный конъюгат белка ФНО-альфа с алендроновой кислотой имеет стехиометрическое соотношение 1:1. Изобретение позволяет синтезировать конъюгат белка ФНО-альфа человека с алендроновой кислотой с контролируемой стехиометрией, который сохраняет противоопухолевую активность ФНО-альфа и направлен против опухолевых метастазов костной ткани. 3 з.п. ф-лы, 11 ил.,10 пр., 1 табл.
Реферат
Изобретение относится к способам синтеза производных белков, содержащих ковалентно связанные молекулы аминобисфосфонатов и, таким образом, таргетированных к костной ткани, и может быть использовано в биотехнологии, фармакологии и медицине.
Формирование и развитие метастазов опухоли в костную ткань вызывает прогрессивно развивающееся изменение структуры костей скелета и как следствие, ухудшение либо утрату опорно-двигательной функции костной системы. Известно, что патологический процесс, протекающий в кости, является результатом опосредованной индукции разрушения костной ткани под действием факторов, выделяемых злокачественными клетками.
Одной из главных проблем с точки зрения лечения метастазов костей является способ эффективной доставки этих веществ в опухоль. В настоящее время описаны различные стратегии получения препаратов адресного действия (target preparation) и средств доставки лекарств (в т.ч. липосомы, биодеградируемые полимерные каркасы, дендримеры, мицеллы, гидрогели, пептиды, антитела, вирусоподобные частицы). В качестве одного из таких перспективных векторов можно рассматривать бисфосфонаты (бифосфонаты). Бисфосфонаты - производные фосфоновых кислот, синтетические аналоги эндогенных пирофосфатов, участвующих в остеогенезе.
Механизм действия этих препаратов обусловлен сходством их структуры со структурой пирофосфатов. Однако в отличие от пирофосфатов, бисфосфонаты, имеющие связи Р-С-Р, устойчивы к действию гидролитических ферментов. Молекулы бисфосфонатов связываются с кальцием и накапливаются преимущественно в костях, что объясняет их высокую селективность к костной ткани. Доказанным свойством бисфосфонатов является быстрое и массированное накопление в кости (около 55% от введенной дозы после однократного внутривенного введения) [Caraglia М., Marra М., Naviglio S., Botti G., Addeo R., Abbruzzese A. Zoledronic acid: an unending tale for an antiresorptive agent // Expert. Opin. Pharmacother. - 2010. - Vol. 11, N. 1. - P. 141 -54].
Бисфосфонаты обладают способностью тормозить процесс резорбции кости путем ингибирования остеокластов. В процессе остеолизиса остеокласты поглощают фиксированные на поверхности кости бисфосфонаты, что приводит к нарушению их функции. Кроме того, бисфосфонаты могут влиять на остеокласты путем нарушения кооперации и ингибирования передачи сигнала от остеобластов к остеокластам [Garnero Р., Buchs N., Zekri J., Rizzoli R., Coleman R.E., Delmas P.D. Markers of bone turnover for the management of patients with bone metastases from prostate cancer // Br. J. Cancer. - 2000. - Vol. 82(4). - P. 858-864].
Применение бисфосфонатов, ингибирующих резорбцию кости, прогрессию костных метастазов и снижающих риск развития осложнений, обусловленных метастатическим поражением костей, в течение последних десятилетий стало общепринятым компонентом лечения [Жабина А.С. Роль бисфосфонатов для профилактики и лечения метастазов в кости // Практическая онкология. - 2011. - Т. 12. №3. - С. 124-131].
Сравнение эффективности связывания бисфосфонатов разных типов с гидроксилапатитом - аналогом минерального матрикса кости, показало, что аминоалкилбисфосфонаты, такие как паминдронат, алендронат и неридронат имеют наибольшую связывающую способность [Ebetino F.H., Hogan A.M., Sun S., et al. The relationship between the chemistry and biological activity of the bisphosphonates // Bone. - 2011. - Vol. 49. - P. 20-33]. Биодоступность алендроната зависит от способа его введения. При пероральном введении она составляет порядка 0,9-1,8%. В отличие от этого, при внутривенном введении женщинам радиоактивно меченой алендроновой кислоты от 40 до 60% вещества сохранялось в организме, преимущественно, в связанном со скелетом состоянии [Porras A.G., Holland S.D., Gertz B.J. Pharmacokinetics of alendronate // Clin Pharmacokinet. - 1999. - Vol. 36, N. 5. - P. 315-328].
Помимо повышенной тропности к костной ткани алендроновая кислота привлекательна наличием первичной аминогруппы, что позволяет достаточно просто получать ее конъюгаты с белками. При этом не затрагиваются фосфонатные группы, определяющие эффективность связывания бисфосфоната с костным матриксом [Ora М., Т., Florea-Wang D., Zinnen S., Karpeisky A., H. Bisphosphonate derivatives of nucleoside antimetabolites: hydrolytic stability and hydroxyapatite adsorption of 5'-beta,gamma-methylene and 5'-beta,gamma-(1-hydroxyethylidene) triphosphates of 5-fluorouridine and ara-cytidine // J. Org. Chem. - 2008. - Vol. 73, N. 11. - P. 4123-4130]. Так, показано, что конъюгирование с аминобисфосфонатом повышало доставку к костям бычьего сывороточного альбумина в 2,0-3,7 раза при однократном внутривенном введении молодым крысам и в 2,2-7,5 раза у животных с овариэктомией [Uludag H., Yang J. Targeting Systemically Administered Proteins to Bone by Bisphosphonate Conjugation // Biotechnol. Prog. - 2002. - Vol. 18. - P. 604-611].
Из информационных источников известны примеры различных методов синтеза конъюгатов аминобисфосфонатов с белками. Например, получение конъюгата белка через тиогруппу цистеина включает стадии: 1) инкубацию белка (бычьего сывороточного альбумина (БСА) с N-этилмалеимидом (NEM); 2) инкубацию с сульфосукцинимидил-4-(N-малеимидометил)-1-циклогексанкарбоксилатом (sulfoSMCC; сульфо-SMCC); 3) удаление непрореагировавших NEM и сульфо-SMCC диализом; 4) тиолирование аминобисфосфоната 2-иминотиоланом (2-IT); 5) сшивку тиолированного аминобисфосфоната и БСА-сульфо-SMCC; 6) удаление непрореагировавшего тиолированного аминобисфосфоната исчерпывающим диализом [Uludag Н., Gao Т., Worn G.R., Kantoci D., Zernicke R.F. Bone affinity of a bisphosphonate-conjugated protein in vivo // Biotechnol. Prog. - 2000. - Vol. 16, N. 6. - P. 1115-1118]. Проведение сшивки в растворе сопровождается образованием нескольких продуктов реакции. Так, было рассчитано, что при конъюгировании тиолированного аминобифосфоната с альбумином по описанному выше методу с молекулой белка связывалось 4,9 молекул бисфосфоната.
При использовании того же метода в работе [Uludag H., Yang J. Targeting Systemically Administered Proteins to Bone by Bisphosphonate Conjugation // Biotechnol. Prog. - 2002. - Vol. 18. - P. 604-611] была достигнута еще большая модификация белка -11 молекул аминобифосфоната на молекулу БСА, имеющего молекулярную массу 66 кДа. Конъюгат основного белка лизоцима, имеющего молекулярную массу 14 кДа, содержал 3,9 молекул аминобисфосфоната на молекулу белка.
Описаны примеры использования и других методов ковалентной сшивки аминобисфосфоната и белков, эффективность которых не всегда была высокой, а выход продукта зависел от выбора направления реакции. Так, в работе [Uludag H., Kousinioris N., Gao Т., Kantoci D. Bisphosphonate conjugation to proteins as a means to impart bone affinity // Biotechnol. Prog. - 2000. - Vol. 16, N2. - P. 258-267] указано, что применение водорастворимого карбодиимида для сшивки между активированной карбоксильной группой альбумина и аминогруппой бисфосфоната оказалось неудачным. Отрицательный результат авторы связывают со структурой аминобисфосфоната и образованием внутренней соли между его -NH3+ и -РО3-2 группами. Высокая плотность отрицательного заряда фосфоновой кислоты также являлась причиной невозможности активации аминогруппы аминобисфосфоната сульфо-SMCC. Положительный результат был получен при использовании стадий: 1) тиолирование аминобисфосфоната с использованием 2-иминотиолана; 2) дереватизация аминогрупп альбумина сульфо-SMCC; 3) реакция активированного альбумина с тиолированным аминобисфосфонатом. Таким образом достигалась пришивка к альбумину 1-4 молекул аминобисфосфоната. Конъюгаты проявляли высокое сродство к гидроксилапатиту, которое было пропорционально количеству пришитого аминобисфосфоната.
В то же время карбодиимидный метод оказался эффективен при изменении «направления» пришивки. В работе [Bansal G., Gittens S.А., Uludag Н. A Di (Bisphosphonic acid) for Protein Coupling and Targeting to Bone. // J. Pharmaceut. Sci. - 2004. - Vol. 931. - P. 2788-2799] в качестве бисфосфоната использовали 3,5-ди(этиламсино-2,2-бисфосфоно)бензойную кислоту - агент, содержащий два остатка бисфосфоната на молекулу, что должно было увеличить сродство к костной ткани без увеличения модификации белка. Карбоксигруппу бисфосфоната активировали карбодиимидом в присутствии N-гидроксисукцинимида. Полученное производное ковалентно сшивали с БСА и иммуноглобулинами по аминогруппам белков. Эффективность конъюгирования возрастала с повышением концентрации пары карбодииимид/N-гидроксисукцинимид в смеси и достигала величины 2,7 и 6,3 молекул 3,5-ди(этиламсино-2,2-бисфосфоно)бензойной кислоты на молекулу БСА и IgG, соответственно. Большей степени модификации белков авторы не добились из-за проблем с образованием межмолекулярных сшивок обоих белков.
Таким образом, реакции конъюгирования белков с аминобисфосфонатами, протекающие в растворе, характеризуются ковалентным связыванием с белком нескольких молекул аминобисфосфоната, происходящим по доступным в условиях реакции остаткам основных аминокислот и N-концевой аминокислоты белка, карбокси- или сульфгидрильных групп в зависимости от выбранного способа ковалентной сшивки. На выбор способа ковалентной сшивки большое влияние оказывают особенности пространственной структуры конъюгируемых белков и бисфосфонатов.
Многоточечность ковалентного связывания аминобисфосфоната может повлиять на структуру белка и привести к изменению его специфической активности или инактивации. Кроме того, влияние на структуру и активность конъюгируемого белка может оказывать присутствие в гомогенной среде активирующих агентов, например, карбодиимида или глутарового альдегида. Поэтому в данном изобретении предложен способ синтеза производных белков, содержащих ковалентно связанные молекулы содержащих аминогруппу бисфосфонатов, позволяющий получать продукт со стехиометрическим отношением близким 1:1, а также исключающим повреждающее действие избытка активирующих агентов на целевые белки. Возможно, в случае относительно коротких белков, таких как фактор некроза опухоли (ФНО-альфа), такое протекание реакции может быть критичным для сохранения специфической активности цитокинов.
Известен способ получения конъюгата алендроновой кислоты с LLP2A (заявка на патент США US 20140056855, опубл. 27.02.2014; международная заявка WO 2015051327, опубл. 09.04.2015). Активный компонент средства для лечения костных патологий, включая метастазы костей - пептидомиметик LLP2A является лигандом интегриновых рецепторов (α4β1 интегрин) и, как следствие, имеет повышенную аффинность к рецепторам мезенхимальных стволовых клеток. Алендроновая кислота, конъюгированная с LLP2A, играет роль направляющего вектора с повышенной тропностью к кости. В целом, данная конструкция призвана обеспечить направленную доставку в кость мезенхимальных стволовых клеток для увеличения числа и активации остеобластов, и как следствие, усиления восстановления костной ткани при различных костных патологиях, сопровождающихся нарушением метаболизма и костной резорбцией (остеопороз, артрит, болезнь Пэджета, метастазы костей и др.). LLP2A представляет собой полимер, полученный из неприродных аминокислот, соединенных линкерами и содержащий в виде концевой последовательности олигопептид из 3-20 аминокислот, из которых по крайней мере одна представляет собой неприродную аминокислоту или D-аминокислоту. В качестве примера приведен вариант конъюгирования LLP2A с алендроновой кислотой в результате связывания сульфгидрильной группы полимера LLP2A-Lys (D-Cys) и малеимида алендроната, полученного in situ в результате реакции алендроната натрия с сульфосукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилатом (SMCC). В этом случае ковалентное связывание LLP2A и алендроновой кислоты происходит по строго определенной группе пептидомиметика, которая по схеме синтеза последнего является единственно доступной для реакции. Данный метод в части реакции малеимида алендроната с сульфгидрильной группой белка может быть применим для получения конъюгатов алендроновой кислоты с белками, содержащими единичный или небольшое количество остатков цистеина для ограничения многоточечной модификации белка. Процесс конъюгирования требует дополнительной очистки продукта конъюгации.
Наиболее близким аналогом (прототипом) является способ получения средства для лечения и мониторинга заболеваний опухолевых метастазов костей (остеосаркома, метастазы рака простаты, молочной железы и др.), который представляет собой конъюгат сополимера гидроксипропилметакриламида (НРМА) с TNP-70 и алендроновой кислотой (патент US 20140212357, опубл. 31.07.2014). TNP-70 является синтетическим аналогом фумагиллина (антимикробный агент, выделенный из штамма Aspergillus fumigatus), обладает выраженной антиангиогенной активностью и как следствие, противоопухолевыми свойствами. Алендроновая кислота в конъюгате играет роль направляющей (векторной) молекулы. Ковалентная сшивка между алендроновой кислотой и мономером НМРА осуществляется с помощью короткого биодеградируемого олигопептидного линкера, имеющего структуру Gly-Gly-Pro-Nle (патент US 20140212357) либо Gly-Pro-Leu-Gly (патент US 20150328330). Для получения конъюгата линкера с алендроновой кислотой олигопептид и меркаптотиазолин растворяют в смеси 1,4-диоксана и тетрагидрофурана, затем капельно добавляется раствор N,N'-дициклогексилкарбодиимида в 1,4-диоксане при 4°C. После инкубации в течение ночи при 4°C реакционную смесь фильтруют для удаления дициклогексилмочевины, полученный фильтрат добавляют в водный раствор алендроновой кислоты (карбонатный буфер рН 7,4). На заключительной стадии продукт очищают от примесей экстракцией этилацетатом и HPLC. Преимуществом описанного метода конъюгирования является возможность контроля точки конъюгирования АЛН с олигопептидом и количества связавшейся АЛН.
Недостатками способа является то, что условия реакции, приведенные в прототипе, неприемлемы для проведения синтеза конъюгата АЛН с белками; кроме того, метод требует дополнительных процедур доочистки получившегося продукта.
Таким образом, технологии, используемые в известных наиболее близких аналогах, непригодны для получения конъюгатов природных белков с бифосфонатами в силу: 1) условий проведения реакций, которые могут способствовать нарушению вторичной структуры белка; 2) при проведении аналогичного синтеза конъюгатов АЛН с белками не представляется возможным обеспечить направленность конъюгирования в силу многоточечности возможного связывания. В связи с этим, нами было предложено описанное ниже техническое решение, которое позволяет получать конъюгаты выбранной стехиометрии, чистоты и активности.
Техническим результатом заявляемого изобретения является создание способа синтеза конъюгата белка ФНО-альфа человека с аминобисфосфонатами, в частности с алендроновой кислотой, с контролируемой стехиометрией компонентов (белка и аминобисфосфоната) в полученном конъюгате, с сохранением противоопухолевой активности ФНО-альфа и обеспечением свойств векторной молекулы, направленной против опухолевых метастазов костной ткани.
Указанный технический результат достигается тем, что в способе получения противоопухолевого средства против метастазов костей в виде конъюгата белка-цитокина и аминобисфосфоната, включающем проведение реакции конъюгации аминобисфосфоната и противоопухолевого компонента с использованием сшивающего агента и отделение продукта конъюгации от несвязавшихся компонентов реакционной смеси, согласно изобретения, в качестве противоопухолевого компонента используют белок ФНО-альфа человека, в качестве аминобисфосфоната - алендроновую кислоту, в качестве сшивающего агента при получении конъюгата алендроновой кислоты с белком используют глутаровый альдегид, или водорастворимый N-(3-диметиламинопропил)-N'-этилкарбодиимид, или сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (Sulfo-SCMM); перед проведением реакции конъюгации алендроновую кислоту или белок ФНО-альфа предварительно адсорбируют на нерастворимом носителе, предпочтительно на гидроксилапатите, компонент, адсорбированный на носителе, активируют сшивающим агентом с последующей отмывкой указанного агента, после образования конъюгата на носителе вначале элюируют несвязавшийся белок ФНО-альфа, а затем - полученный конъюгат алендроновой кислоты с белком ФНО-альфа, причем полученный конъюгат белка ФНО-альфа с алендроновой кислотой имеет стехиометрическое соотношение 1:1.
В первом варианте выполнения способа на нерастворимом носителе гидроксилапатите адсорбируют алендроновую кислоту, активируют ее глутаровым альдегидом, проводят реакцию с интактным белком ФНО-альфа с образованием конъюгата, в котором молекула алендроновой кислоты присоединена к белку ФНО-альфа по аминогруппе этого белка, а стехиометрическое соотношение компонентов реакции белок ФНО-альфа - глутаровый альдегид - алендроновая кислота составляет 1:1:1.
Во втором варианте выполнения способа на нерастворимом носителе гидроксилапатите адсорбируют алендроновую кислоту, активируют ее сшивающим агентом сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилатом (Sulfo-SCMM), проводят реакцию с интактным белком ФНО-альфа с образованием конъюгата, в котором молекула алендроновой кислоты присоединена к белку ФНО-альфа по сульфгидрильной группе этого белка, а стехиометрическое соотношение компонентов реакции белок ФНО-альфа - Sulfo-SCMM - алендроновая кислота составляет 1:1:1.
В третьем варианте выполнения способа на нерастворимом носителе гидроксилапатите адсорбируют белок ФНО-альфа, активируют его сшивающим агентом водорастворимым N-(3-диметиламинопропил)-N'-этилкарбодиимидом (КДИ), проводят реакцию с интактной алендроновой кислотой с образованием конъюгата, в котором молекула алендроновой кислоты присоединена к белку ФНО-альфа по карбоксигруппе этого белка, а стехиометрическое соотношение компонентов реакции белок ФНО-альфа - водорастворимый N-(3-диметиламинопропил)-N'-этилкарбодиимид - алендроновая кислота составляет 1:1:1.
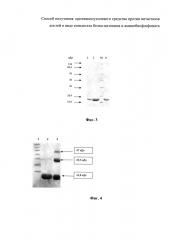
Фиксация одного из реагирующих веществ на твердом носителе как на стадии его активации, так и на стадии конъюгации, обеспечивает преодоление многоточечности ковалентного связывания. Использование этого приема позволяет зафиксировать продукт конъюгации на твердом носителе и вывести, таким образом, из реакции, что резко уменьшает образование побочных продуктов. На принципиальную возможность успешного проведения такой реакции указывают результаты работы [Ehrick R.S, Capaccio М., Puleo D.A., Bachas L.G. Ligand-modified aminobisphosphonate for linking proteins to hydroxyapatite and bone surface // Bioconjug. chem. - 2008. - Vol. - 19. - P. 315-321], в которой адсорбированный на гидроксилапатите биотинилированный аминометиленбисфосфонат количественно определялся антителами к биотину. Следовательно, активированная аминогруппа бисфосфоната, адсорбированного на носителе, может оставаться стерически доступной для взаимодействия с белками. Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 представлена электрофореграмма продуктов конъюгации ФНО-альфа и алендроновой кислоты в гомогенной среде в присутствии глутарового альдегида (в полностью денатурирующих условиях). Обозначения: 1 - интактный ФНО-альфа, 2 - продукты сшивки при стехиометрическом отношении белок-сшивающий агент-аминобисфосфонат 1:2:1, 3 - продукты сшивки при стехиометрическом отношении белок-сшивающий агент-аминобисфосфонат 1:1:1. На фиг. 2 изображен профиль элюции компонентов реакционной смеси с гидроксилапатита (А, стрелкой указано начало элюции 0,8М калий-фосфатным буфером, рН 7,0) и электрофоретический анализ полученных фракций в 15% полиакриламидном геле (ПААГ) в восстанавливающих условиях (Б). Обозначения: 1 - ФНО-альфа, 20 мкг; 2 - маркеры молекулярных масс (21-250 кДа); 3-7 - фракции конъюгата, полученные при элюции 0,8М калий-фосфатным буфером, рН 7,0. На фиг. 3 изображена электрофореграмма конъюгата ФНО-альфа с алендроновой кислотой, полученного с помощью глутарового альдегида на гидроксилапатите. Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250. Обозначения: 1 - конъюгат ФНО-альфа с АЛН - 10 мкг/лунка; 2 - конъюгат ФНО-альфа с АЛН - 40 мкг/лунка; М - маркеры молекулярных масс (14,4-116 кДа); К - интактный ФНО-альфа. Цифры возле стрелок обозначают молекулярные массы маркерных белков. На фиг. 4 представлена электрофореграмма продуктов сшивки ФНО-альфа и алендроновой кислоты в присутствии Sulfo-SCMM в растворе. Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250. Обозначения: 1 - маркеры молекулярных масс (14,4-250 кДа); 2 - ФНО-альфа, 20 мкг; 3 - конъюгат ФНО-альфа и алендроновой кислоты при молярном отношении белок-сшивающий агент-аминобисфосфонат 1:1:1. На фиг. 5 приведена электрофореграмма конъюгата ФНО-альфа с алендроновой кислотой, полученного с помощью Sulfo-SMCC на гидроксилапатите. Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250. Обозначение: М - маркеры молекулярных масс (14,4-116 кДа); 1 - ФНО-альфа, 20 мкг; 2 - конъюгат ФНО-альфа и алендроновой кислоты, полученный с использованием Sulfo-SMCC, 20 мкг. На фиг. 6 представлена электрофореграмма продуктов сшивки ФНО-альфа и алендроновой кислоты в присутствии КДИ в растворе. Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250. Обозначения: 1 - маркеры молекулярных масс (14,4-250 кДа); 2 - конъюгат ФНО-альфа и алендроновой кислоты при молярном отношении белок-сшивающий агент-аминобисфосфонат 1:1:1.
На фиг. 7 изображена электрофореграмма конъюгата ФНО-альфа с алендроновой кислотой, полученного с помощью водорастворимого карбодиимида (КДИ). Электрофорез в 15% ПААГ в восстанавливающих условиях, окрашивание Кумасси R-250. Обозначения: М - маркеры молекулярных масс (14,4-116 кДа); 1 - ФНО-альфа, 20 мкг; 2 - конъюгат ФНО-альфа с алендроновой кислотой, полученный с помощью карбодиимида, 20 мкг. На фиг. 8 представлены графики определения молекулярной массы конъюгатов ФНО-альфа с алендроновой кислотой, полученных с помощью глутарового альденгида (А), КДИ (Б) и Sulfo-SCMM (В) в сравнении с ФНО-альфа. На фиг. 9 приведены графики связывания конъюгатов ФНО-альфа и алендроновой кислоты с антителами к ФНО-альфа человека иммуноферментным методом. На фиг. 10 приведена кривая сорбции на гидроксилапатите (ГАП) свободного ФНО-альфа и ФНО-альфа в составе конъюгата, полученного с помощью Sulfo-SMCC. На фиг. 11 приведена кривая десорбции с ГАП свободного ФНО-альфа (a) и ФНО-альфа в составе конъюгата, полученного Sulfo-SMCC-методом (б). На оси ординат: оптическое поглощение раствора при 280 нм, о.е. (левая ось), концентрация элюирующего буфера, М (справа); на оси абсцисс - время элюции, мин.
Ниже приведены примеры 1-6 конкретного выполнения способа получения противоопухолевого средства в виде конъюгата против метастазов костей.
Пример 1. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии глутарового альдегида в гомогенной среде.
Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии глутарового альдегида проводили в 20 мМ калий-фосфатном буфере, рН 7,0, в стехиометрическом отношении белок-сшивающий агент-аминобисфосфонат 1:1:1 при 6°С в течение 12 ч. На фиг. 1 представлены результаты электрофоретического анализа продуктов реакции.
При внесении в реакционную среду, содержащую ФНО-альфа, глутарового альдегида и алендроновой кислоты в соотношении 1:1:1 в растворе регистрировали две белковые фракции, с молекулярной массой 16,7 кДа (что соответствует молекулярной массе ФНО-альфа) и 32 кДа (молекулярная масса димера) (фиг. 1). Таким образом, проведение реакции в гомогенной среде при стехиометрическом отношении 1:1:1 приводило к образованию побочного продукта, димера ФНО-альфа, в количестве, сопоставимом с содержанием мономерной формы белка. Двукратное увеличение содержания в среде глутарового альдегида приводило к получению продукта, который оставался преимущественно в карманах геля, что может свидетельствовать о наличии кросс-сшивки молекул ФНО-альфа с образованием высокополимерных продуктов.
Пример 2. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии глутарового альдегида в гетерогенной среде (на гидроксилапатите).
В ходе отработки условий ведения процесса, в котором использовали активацию сорбированного на гидроксилапатите) аминобисфосфоната глутаровым альдегидом, были проанализированы следующие параметры реакции конъюгации:
- время сорбции алендроновой кислоты (АЛН) на ГАП (5-60 мин), длительность реакции связывания АЛН и глутарового альдегида (0,5-7 час), длительность реакции связывания ФНО-альфа с аддуктом алендронат-глутаровый альдегид (1-12 час);
- влияние температуры на стадиях адсорбции алендроновой кислоты и связывания аминобисфосфоната с глутаровым альдегидом - комнатная; температура реакции с белком - 2-6°С;
- состав буфера для элюции несвязавшегося ФНО-альфа - 0,2 М калий-фосфатный буфер, рН 7,0; для элюции конъюгата ФНО-альфа-алендроновая кислота - калий-фосфатный буфер 0,8-1,0 М, рН 7,0.
Стехиометрическое отношение компонентов реакции белок-глутаровый альдегид-алендроновая кислота составляло 1:1:1. Для синтеза конъюгата использовали колонку с гидроксилапатитом, уравновешенную 20 мМ калий-фосфатным буфером, рН 7,0. Раствор алендроновой кислоты наносили на колонку с ГАП со скоростью потока 30 мл/ч. После нанесения колонку промывали 20 мМ калий-фосфатным буфером, рН 7,0, в объеме, соответствующем 1/3 объема колонки, и перекрывали выход раствора из колонки на 1 час для связывания алендроновой кислоты с ГАП. Наносили раствор глутарового альдегида с последующей промывкой колонки таким же объемом со скоростью потока 30 мл/ч. Связывание с глутаровым альдегидом проводили при циклическом прокачивании раствора в течение часа. После отмывки от непрореагировавшего глутарового альдегида на колонку наносили ФНО-альфа со скоростью потока 30 мл/ч, перекрывали выход раствора из колонки на 2 часа для синтеза. Несвязавшийся белок элюировали с колонки 0,2М калий-фосфатным буфером, рН 7,0, конъюгат элюировали 0,8М калий-фосфатом, рН 7,0. Хроматографические фракции диализовали против 3 смен физиологического раствора в течение 2 часов. Полученный препарат конъюгата стерильно разливали и замораживали при минус 20°С.
На фиг. 2 представлен профиль элюции конъюгата ФНО-альфа и АЛН с гидроксилапатита (3А) и результаты электрофоретического анализа полученных фракций (3Б). Количественное определение ФНО-альфа во фракциях показало, что 0,2М калий-фосфатом элюируется не более 10% белка, взятого в реакцию. Конъюгат элюируется с колонки в виде одного пика, дополнительные белковые фракции в составе образца отсутствуют. Промывка колонки после элюции конъюгата 1-2 М калий-фосфатным буфером, рН 7,0, не приводила к дополнительной десорбции белка.
Электрофоретический анализ экспериментального образца конъюгата показал, что чистота препарата составляет более 95% (фиг. 3).
Количественный анализ компонентов конъюгата показал, что содержание белка и алендроновой кислоты в диализованном растворе конъюгата составляло 0,74 мг/мл и 10 мкг/мл, соответственно, молярное отношение компонентов 1:0,89, близкое к заданному 1:1.
Пример 3. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии Sulfo-SCMM в гомогенной среде.
Сшивку ФНО-альфа с алендроновой кислотой в присутствии Sulfo-SCMM в гомогенной среде проводили в три этапа: 1) инкубация алендроновой кислоты с Sulfo-SCMM в стехиометрическом отношении 1:1 при 6°C в течение 7 ч; 2) инкубация полученного производного с ФНО-альфа при 6°C в течение ночи; 3) диализ против физиологического раствора. На фиг. 4 представлены результаты электрофоретического анализа продуктов реакции, демонстрирующие их гетерогенность, - в образце присутствуют дополнительные белковые фракции, скорее всего, продукты кросс-сшивок между молекулами белка.
Пример 4. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии Sulfo-SCMM в гетерогенной среде (на гидроксилапатите).
Техническое выполнение эксперимента аналогично описанному в примере 2. Адсорбцию алендроновой кислоты на гидроксилапатите проводили при 6°C в течение часа. В систему добавляли Sulfo-SCMM до молярного отношения 1:1 и инкубировали в течение 1 ч, затем добавляли ФНО-альфа и продолжали инкубацию еще 2 ч. Непрореагировавший белок элюировали с гидроксилапатита 0,2 М калий-фосфатом, рН 7,0, а продукты конъюгации - 1 М калий-фосфатом. Полученные фракции диализовали против 3 смен физиологического раствора. Полученный конъюгат имел высокую чистоту (более 95%), содержание примесных компонентов незначительно. На фиг. 5 представлены результаты электрофоретического анализа продуктов сшивки ФНО-альфа и алендроновой кислоты с использованием Sulfo-SCMM. Определение содержания в экспериментальном образце конъюгата белка и алендроновой кислоты показало, что концентрация компонентов составляла 1,4 мг/мл и 15,3 мкг/мл, соответственно, что соответствует заданному стехиометрическому соотношению 1:1.
Пример 5. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии водорастворимого карбодиимида в гомогенной среде.
Техническое выполнение эксперимента аналогично описанному в примере 3.
Электрофоретический анализ продуктов реакции конъюгации ФНО-альфа и алендроновой кислоты в растворе показал наличие в образце, помимо основной, дополнительной белковой фракции с молекулярной массой порядка 29,5 кДа (фиг. 6).
Пример 6. Конъюгирование ФНО-альфа с алендроновой кислотой в присутствии водорастворимого карбодиимида в гетерогенной среде (на гидроксилапатите).
Техническое выполнение эксперимента аналогично описанному в примере 2. В связи с тем, что первой стадией получения конъюгата в присутствии карбодиимида была активация карбоксильных групп белка, компонентом, адсорбируемым на гидроксилапатите, являлся ФНО-альфа. Адсорбцию на носителе проводили при пониженной температуре (2-6°C) в течение часа. Адсорбированный белок инкубировали с эквимолярным количеством водорастворимого N-(3-диметиламинопропил)-N'-этилкарбодиимида при 2-6°C в течение 2 ч, после чего на колонку с носителем подавали эквимолярное количество алендроновой кислоты. Инкубацию алендронорвой кислотой проводили 2 ч при циклическом прокачивании ее раствора через колонку. Несвязанный ковалентно с алендроновой кислотой белок элюировали с гидроксилапатита 0,2 М калий-фосфатом, рН 7,0, а продукты конъюгации - 1 М калий-фосфатом. Полученные фракции диализовали против 3 смен физиологического раствора. Полученный конъюгат имел высокую чистоту (более 95%), содержание примесных компонентов незначительно. На фиг. 7 представлены результаты электрофоретического анализа продуктов сшивки ФНО-альфа и алендроновой кислоты с использованием КДИ.
Определение содержания компонентов в конъюгате показало, что концентрация белка в препарате составила 0,73 мг/мл, алендроновой кислоты - 10 мкг/мл, что соответствует стехиометрическому отношению, близкому 1:1.
Таким образом, приведенные данные подтверждают тот факт, что в отличие от реакции конъюгирования в растворе, метод с использованием фиксации активных компонентов на твердой фазе позволяет получать конъюгаты стехиометрии, близкой к 1:1, и высокой степени гомогенности (более 95%).
Ниже в примерах 7-10 приведены экспериментальные данные по изучению свойств полученного конъюгата ФНО-альфа с алендроновой кислотой, в том числе, его специфической цитолитической активности и способности к накоплению в опухолевой ткани костных метастазов.
Пример 7. Исследование интактности структуры ФНО-альфа в составе конъюгатов, полученных синтезом на гидроксиапатите.
Сохранность структуры белка в составе конъюгатов оценивали по способности ФНО-альфа к образованию тримеров в физиологических условиях и к связыванию со специфическими антителами.
Способность ФНО-альфа в составе конъюгатов образовывать тримеры исследовали с помощью гель-фильтрации в нативных условиях на сорбенте Сефакрил S-200, как описано в [Скоупс Р. Методы очистки белков. М: Мир. 1985].
Изучение связывания ФНО-альфа в конъюгатах с антителами к ФНО-альфа проводили иммуноферментным методом с помощью набора реагентов «альфа-ФНО-ИФА-БЕСТ» (ЗАО «Вектор-БЕСТ», р.п. Кольцове, Новосибирская область). Для анализа ФНО-альфа и его конъюгатов с алендроновой кислотой препараты разводили физиологическим раствором до получения растворов с концентрациями в интервале от 12,5 до 250 пг/мл.
Анализ методом гель-фильтрации на Сефакриле S-200 показал, что молекулярная масса ФНО-альфа, конъюгированного с АЛН (53 кДа), была близка молекулярной массе ФНО-альфа в форме тримера (фиг. 8).
Следовательно, конъюгирование ФНО-альфа с алендроновой кислотой не приводило к утрате способности ФНО-альфа к тримеризации, что является критичным для сохранения биологической активности белка.
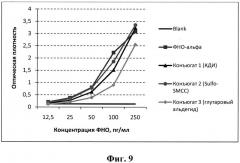
Кривые зависимости связывания ФНО-альфа в составе конъюгатов с алендроновой кислотой со специфическими антителами к ФНО-альфа, выраженной в оптической плотности растворов комплексов, от концентрации белка приведены на фиг. 9. Видно, что все три типа конъюгатов сохраняли способность связываться со специфическими антителами, хотя и с несколько разной эффективностью. Наиболее близки к кривой концентрационной зависимости исходного ФНО-альфа кривые конъюгатов, полученных с помощью КДИ и Sulfo-SMCC.
Полученные данные свидетельствуют о сохранении способности ФНО-альфа в составе конъюгатов с алендроновой кислотой к связыванию со специфическими антителами, что подтверждает интактность и доступность для связывания антигенных структур белка.
Пример 8. Оценка специфической цитолитической активности ФНО-альфа в составе конъюгатов, полученных синтезом на гидроксиапатите
Специфическую цитолитическую активность конъюгатов ФНО-альфа с алендроновой кислотой определяли в культуре мышиных фибробластов L929 в присутствии актиномицина D методом [Tracey K.J. / In: The Cytokine Handbook (A.W. Thompson, ed), 1994. - P. 289-304]. В качестве стандарта использовали Отраслевой стандартный образец активности рчФНО-альфа (ОСО 42-28-400-08), специфическая активность которого установлена относительно Международного стандартного образца рчФНО-альфа (rhTNF-альфа) фирмы "Селтех" (Англия, номер по каталогу 1740/58).
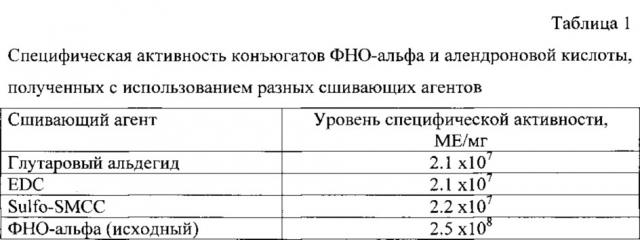
Результаты оценки специфической активности конъюгатов ФНО-альфа с алендроновой кислотой, определенной в цитотоксическом тесте в культуре клеток L929, приведены в таблице 1.
Из данных таблицы видно, что метод с использованием фиксации активных компонентов на твердой фазе позволяет получать конъюгаты с высокой специфической активностью (более 2,0×107 МЕ/мг), хотя и сниженной по сравнению с исходным белком. Существенных различий в уровне активности конъюгатов, полученных с помощью разных сшивающих агентов, не обнаружено.
Пример 9. Исследование связывания конъюгатов ФНО-альфа и алендроновой кислоты с гидроксилапатитом in vitro
В качестве экспериментальной модели для оценки возможности связывания конъюгатов ФНО-альфа с костной тканью был использован гидроксилапатит, близкий по своему составу и свойствам минеральному матриксу кости. Связывание конъюгатов ФНО-альфа и алендроновой кислоты с гидроксилапатитом оценивали методом хроматографии, как описано в [Скоупс Р. Методы очистки белков. М: Мир. 1985]. Десорбцию проводили линейный градиентом 0,1-1 М калий фосфатный буфер, рН 7,0.
Все три вида конъюгатов ФНО-альфа и алендроновой кислоты сорбировались на ГАП аналогично ФНО-альфа. Полное связывание конъюгата ФНО-альфа, полученного, например, с помощью Sulfo-SMCC, наблюдалось при нагрузке до 1,4 мг белка на 1 мл сорбента через 30 мин после нанесения, что соответствовало наблюдаемому для ФНО-альфа (фиг. 10).
Различия касались скорости связывания белка в свободной форме и в составе конъюгата. Если количество несвязавшегося с сорбентом ФНО-альфа через 10 и 20 мин после нанесения составляло, соответственно, 1,0 и 0,6 мг, то количество несорбированного конъюгированного ФНО-альфа в те же сроки было меньшим - 0,8 и 0,2 мг (фиг. 10).
Существенные различия были обнаружены и при исследовании процессов десорбции ФНО-альфа в составе конъюгата и свободного белка (фиг. 11). Было показано, что количественная десорбция свободного ФНО-альфа может быть достигнута с помощью элюирующего раствора калия фосфата с концентрацией соли 0,2±0,05 М. Для конъюгата ФНО-альфа с алендроновой кислотой эта концентрация была в 4 раза выше (0,8±0,05 М калия фосфата). Профили десорбции, представленные на рисунке, подтверждают факт более прочного удержания сорбентом конъюгата ФНО-альфа в сравнении с ФНО-альфа.
Полученные данные свидетельствуют о более высоком сродстве конъюгатов ФНО-альфа с алендроновой кислотой к ГАП - аналогу минерального матрикса кости, чем у исходного белка, что позволяет говорить о возможности накопления конъюгатов ФНО-альфа в костной ткани.
Пример 10. Исследование накопления конъюгатов ФНО-альфа и алендроновой кислоты в ткани экспериментальных ко