Наночастицы, легче проникающие в слизистую оболочку или вызывающие меньше воспаления
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к наночастицам для введения одного или более терапевтических, профилактических и/или диагностических средств, которые получают эмульгированием раствора одного или более биосовместимых полимеров, формирующих ядро наночастиц, одного или более полиэтиленгликолей (ПЭГ), формирующих покрытие наночастиц, одного или более терапевтических, профилактических и/или диагностических средств и одного или более низкомолекулярных эмульгаторов в органическом растворителе при перемешивании в течение по меньшей мере трех часов для испарения органического растворителя и диффундирования и сбора цепей ПЭГ на поверхности наночастиц, при этом покрытие наночастиц характеризуется отношением [Г/Г*] больше 2, где Г – это поверхностная плотность ПЭГ, характеризующая число молекул ПЭГ на 100 нм2 поверхности наночастицы, а Г* – это полное покрытие поверхности наночастицы, характеризующее теоретическое число свободно расположенных молекул ПЭГ, необходимое для полного покрытия 100 нм2 поверхности наночастицы; а также к способу их получения и фармацевтической композиции, содержащей такие наночастицы. Группа изобретений обеспечивает улучшение способности наночастиц проникать через слизь, не сорбируя при этом муцин. 5 н. и 21 з.п. ф-лы, 16 ил., 8 табл., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области наночастиц, в частности, наночастиц, которые быстро проникают в слизь, такую как слизь в организме человека, а также способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Локализованная доставка терапевтических препаратов при помощи биоразлагаемых наночастиц часто обладает преимуществами по сравнению с системным введением лекарственных средств, в том числе, менее выраженными системными побочными эффектами и контролируемыми уровнями лекарственного средства в целевых участках. Однако контролируемая доставка лекарственного средства на поверхности слизистых оболочек была ограничена наличием защитного слоя слизи.
Слизь представляет собой вязкоупругий гель, покрывающий все открытые эпителиальные поверхности, не покрытые кожей, например, дыхательные пути, желудочно-кишечный тракт, носоглотку и женский репродуктивный тракт, а также поверхность глаз. Слизь эффективно улавливает обычные системы доставки лекарственных средств в виде частиц за счет стерических и/или адгезивных взаимодействий. В результате функционального цикла слизи эффективность большинства терапевтических препаратов, доставляемых локально на поверхности слизистых оболочек, ограничена, вследствие плохого удержания и распределения. Биоразлагаемые наночастицы, которые проникают глубоко в слизистый барьер, способны обеспечивать лучшее распределение, удержание и эффективность лекарственного средства на поверхности слизистых оболочек.
Плотное покрытие из низкомолекулярного полиэтиленгликоля (ПЭГ) позволяет наночастицам быстро проникать через очень вязкоупругие слизистые выделения в организме человека. Гидрофильное и биоинертное ПЭГ покрытие эффективно минимизирует адгезионные взаимодействия между наночастицами и составляющими слизи. Биоразлагаемые проникающие в слизь частицы (MPPs) были получены путем физической адсорбции определенных плюроников, таких как F127, на готовые мукоадгезивные наночастицы. Кроме того, MPPs были получены путем нанопреципитации с использованием диблок-сополимеров поли(себациновой кислоты) и ПЭГ.
Однако область применения биоразлагаемых MPP, полученных путем нанопреципитации, ограничена, поскольку для этого необходимо растворение лекарственного средства и полимера в смешивающихся с водой растворителях. Для множества гидрофобных лекарственных средств может быть выгодной локальная доставка с помощью MPP из-за серьезных системных побочных эффектов, однако их плохая растворимость в смешивающихся с водой органических растворителях ограничивает эффективную инкапсуляцию в MPP за счет нанопреципитации.
Другие классы новых разрабатываемых лекарственных средств, включая нуклеиновые кислоты, пептиды и белки, обладают огромным потенциалом для лечения заболеваний в местах скопления слизи. Однако эти гидрофильные лекарственные средства невозможно легко сформулировать в MPP путем нанопреципитации. Выпаривание эмульсионного растворителя широко используют для эффективной инкапсуляции как гидрофильных лекарственных средств (двойная эмульсия вода-в-масле-в-воде), так и гидрофобных лекарственных средств (простая эмульсия масло-в-воде), в биоразлагаемые наночастицы, однако полученные частицы являются мукоадгезивными при использовании общепринятого эмульгатора, поливинилового спирта (ПВС) (PVA).
Существует потребность в новых способах получения проникающих в слизь частиц, которые позволяют инкапсулировать широкий ассортимент лекарственных средств в наночастицы без снижения их способности проникать в слизь, как описано выше. Существует также потребность в препаратах, которые вводят путем инъекции. Установлено, что покрытия, аналогичные тем, которые улучшают проникновение в слизь, также уменьшают воспаление, вызываемое частицами лекарственного средства.
Таким образом, целью настоящего изобретения является предложение способов получения частиц, а также полученных частиц, позволяющих инкапсулировать широкий ассортимент лекарственных средств в биоразлагаемые наночастицы без снижения их способности проникать в слизь или без усиления воспаления, вызываемого частицами, как описано выше.
Другой целью настоящего изобретения является предложение частиц, таких как наночастицы и микрочастицы, с высокой нагрузкой лекарственных средств и плотным покрытием из изменяющего свойства поверхности материала для обеспечения эффективной доставки лекарственного средства различными способами введения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Разработаны наночастицы, образованные путем эмульгирования одного или более полимерных заполнителей, одного или более изменяющих свойства поверхности материалов и одного или более низкомолекулярных эмульгаторов. Частицы получают путем растворения одного или более полимерных заполнителей в органическом растворителе, добавления раствора одного или более полимерных заполнителей в водный раствор или суспензию эмульгатора для образования эмульсии и последующего добавления эмульсии во второй раствор или суспензию эмульгатора для образования наночастиц. Полимерный заполнитель и эмульгатор могут быть раздельными, конъюгированными между собой или находиться в форме блок-сополимера, содержащего один или более блоков изменяющего свойства поверхности материала. В предпочтительном варианте осуществления изменяющий свойства поверхности материал представляет собой полиэтиленгликоль с молекулярной массой от примерно 1 кДа до примерно 10 кДа, предпочтительно от примерно 1 кДа до примерно 5 кДа, более предпочтительно примерно 5 кДа. В данном варианте осуществления плотность полиэтиленгликоля, измеренная методом 1H ЯМР, составляет от примерно 1 до примерно 100 цепей/нм2, предпочтительно от примерно 1 до примерно 50 цепей/нм2, более предпочтительно от примерно 5 до примерно 50 цепей/нм2, наиболее предпочтительно от примерно 5 до примерно 25 цепей/нм2.
Критичность молекулярной массы эмульгаторов продемонстрирована с помощью примеров. В предпочтительном варианте осуществления молекулярная масса одного или более эмульгаторов составляет менее чем 1500, 1300, 1200, 1000, 800, 600 или 500 а.е.м. Предпочтительные эмульгаторы включают натриевую соль холевой кислоты, диоктил сульфосукцинат натрия, гексадецилтриметиламмоний бромид, сапонин, твин® 20, твин® 80 и сложные эфиры сахаров. Изменяющие свойства поверхности материалы присутствуют в количестве, эффективном для того, чтобы сделать поверхностный заряд частиц нейтральным или практически нейтральным, когда один или более эмульгаторов несут заряд. Эмульгаторы обладают эмульгирующей способностью по меньшей мере примерно 50%, предпочтительно по меньшей мере 55, 60, 65, 70, 75, 80, 85, 90 или 95%.
Наночастицы особенно полезны для доставки терапевтических, профилактических, нутрицевтических или диагностических средств. Их можно вводить энтерально, парентерально или локально, предпочтительно на поверхность слизистой оболочки. В предпочтительном варианте осуществления частицы вводят внутривенной, подкожной, внутримышечной, внутрибрюшинной инъекцией или под конъюнктиву. В одном варианте осуществления частицы вводят в дыхательные пути, интраназально, интравагинально, ректально или буккально.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
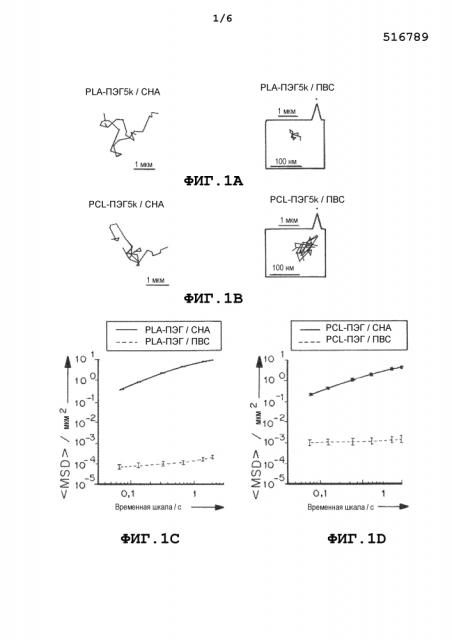
На фиг.1a и 1b представлены траектории наночастиц PLA-ПЭГ и PCL-ПЭГ, содержащих CHA и ПВС, полученных методом эмульгирования. На фиг.1c и 1d приведены графики, демонстрирующие усредненные по множеству геометрические среднеквадратичные смещения (<MSD>/мкм2), как функцию от времени (временная шкала/с). На фиг. 1e и 1f приведены графики, демонстрирующие распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. На фиг.1g и 1h приведены графики, демонстрирующие расчетную фракцию частиц, способных проникать в физиологический слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
На фиг. 2a и 2b представлен эффект ММ ПЭГ на скорость перемещения MPP в шеечно-влагалищной слизи человека: Фиг.2a представляет собой график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD/мкм2> как функцию от временной шкалы/с. Фиг.2b представляет собой график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. Частицы получали методом эмульгирования с использованием PLGA-ПЭГ (6 масс.% ПЭГ). Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
На фиг. 3a приведен график, демонстрирующий усредненное по множеству геометрическое среднеквадратичное смещение <MSD/мкм2> как функцию от временной шкалы. На фиг. 3b приведен график, демонстрирующий распределения логарифмов эффективных коэффициентов диффузии отдельных частиц (Dэфф) на временной шкале 1 с. На фиг.3c приведен график, демонстрирующий расчетную фракцию частиц, по прогнозам, способных проникать в слой слизи толщиной 30 мкм с течением времени. Данные представлены из трех независимых экспериментов с отслеживанием ≥120 наночастиц в каждом эксперименте. Планки погрешностей соответствуют S.E.M.
Фиг. 4a-c представляют собой схемы, иллюстрирующие влияние поверхностного ПЭГ покрытия ([Г/Г*]) на проникновение наночастиц в слизь. Фиг. 4a-c демонстрируют получение PLGA-ПЭГ наночастиц с поверхностным ПЭГ покрытием при увеличении покрытия. По мере увеличения поверхностного ПЭГ покрытия, порядок расположения ПЭГ меняется с грибовидного (соседние цепи ПЭГ не перекрываются, [Г/Г*]<1, Фиг. 4a) на щеточное (соседние цепи ПЭГ перекрываются, 1<[Г/Г*]<3, Фиг. 4b) и на густое щеточное ([Г/Г*]>3, Фиг. 4c). При низком покрытии ПЭГ ([Г/Г*]<1, Фиг. 4a) волокна муцина прочно прикрепляются к ядру наночастицы. При среднем покрытии ПЭГ (1<[Г/Г*]<3, Фиг. 4b) волокна муцина все еще могут частично абсорбироваться на ядре наночастицы. При высоком ([Г/Г*]>3, Фиг. 4c) покрытии ПЭГ ядра наночастиц были полностью экранированы короной из биоинертного ПЭГ, что приводило к отсутствию абсорбции муцина на наночастицах. Фиг. 4c демонстрирует, что наночастицы с низким покрытием ПЭГ иммобилизуются в слизи, наночастицы со средним покрытием ПЭГ движутся с затруднением и даже иммобилизуются в слизи, а наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать в слизь.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Используемый в настоящем документе термин «наночастица», в целом, относится к частице любой формы, имеющей диаметр от примерно 1 нм вплоть до, но, не включая, примерно 1 микрон, более предпочтительно от примерно 5 нм до примерно 500 нм, наиболее предпочтительно от примерно 5 нм до примерно 100 нм. Наночастицы, имеющие сферическую форму, как правило, называют «наносферы».
Используемый в настоящем документе термин «средний размер частиц», в целом, относится к статистическому среднему размеру частиц (диаметру) в популяции частиц. Диаметр практически сферической частицы можно называть физическим или гидродинамическим диаметром. Диаметр несферической частицы можно предпочтительно называть гидродинамическим диаметром. При использовании в настоящем документе, диаметр несферической частицы может означать наибольшее линейное расстояние между двумя точками на поверхности частицы. Средний размер частиц можно измерять с помощью методов, известных в данной области, таких как метод динамического рассеяния света.
Используемый в настоящем документе термин «средневзвешенный аэродинамический диаметр» (MMAD) относится к среднему аэродинамическому размеру множества частиц. «Аэродинамический диаметр» представляет собой диаметр единичной плотной сферы с той же скоростью оседания, как правило, в воздухе, что и у порошка, и, таким образом, является полезным способом охарактеризовать порошок в аэрозольном состоянии или другие диспергированные частицы, или препарат в виде частиц, в отношении его оседания. Аэродинамический диаметр охватывает форму, плотность частицы или корпускулы, а также физический размер частицы или корпускулы. MMAD можно экспериментально определять методами, известными в данной области, такими как метод каскадного импактора.
Используемый в настоящем документе термин «плотность утряски» относится к мере плотности порошка. Плотность утряски можно определять методом, описанным в «USP Bulk Density and Tapped Density», Фармакопейная конвенция США, Роквилл, Мэриленд, 10е приложение, 4950-4951, 1999. Особенности, которые могут способствовать низкой плотности утряски, включают неравномерную текстуру поверхности и пористую структуру.
Термины «монодисперсное» и «однородное распределение по размеру» используются в настоящем документе взаимозаменяемо и описывают множество наночастиц или микрочастиц, в котором частицы имеют одинаковый или почти одинаковый диаметр или аэродинамический диаметр. При использовании в настоящем документе, монодисперсное распределение означает распределение частиц, при котором 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95% или более распределения находится в пределах 5% от массового среднего диаметра или аэродинамического диаметра.
Используемый в настоящем документе термин «легочное введение» относится к введению фармацевтического препарата, содержащего активное средство, в легкие путем ингаляции. Используемый в настоящем документе термин «ингаляция» означает поступление воздуха в альвеолы. Воздух может поступать через рот или нос. Поступление воздуха может происходить путем самовведения препарата при вдыхании или путем введения через респиратор пациенту, пользующемуся респиратором.
Используемый в настоящем документе термин «фармацевтически приемлемый», относится к соединениям, материалам, композициям и/или лекарственным формам, которые с медицинской точки зрения подходят для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, с разумным соотношением польза/риск, в соответствии с руководящими принципами агентств, таких как Управление по контролю качества пищевых продуктов и лекарственных средств.
Используемые в настоящем документе термины «биосовместимый» и «биологически совместимый», в целом, относятся к материалам, которые, наряду с их любыми метаболитами или продуктами распада, как правило, являются нетоксичными для реципиента и не вызывают никаких существенных побочных эффектов у пациента. В общих чертах, биосовместимые материалы являются материалами, которые не вызывают существенные воспалительные или иммунные реакции при введении пациенту.
Используемый в настоящем документе термин «молекулярная масса», в целом, относится к относительной средней длине цепи блочного полимера, если не указано иначе. На практике, молекулярную массу можно оценивать или характеризовать с использованием различных методов, включая гельпроникающую хроматографию (ГПХ) (GPC) или капиллярную вискозиметрию. Определенную методом ГПХ молекулярную массу называют средневзвешенной молекулярной массой (Mw), в отличие от среднечисловой молекулярной массы (Mn). Метод капиллярной вискозиметрии позволяет оценивать молекулярную массу как характеристическую вязкость, определяемую в разбавленном растворе полимера с использованием определенного набора условий концентрации, температуры и растворителя.
Используемый в настоящем документе термин «гидрофильный» относится к свойству наличия сродства к воде. Например, гидрофильные полимеры (или гидрофильные полимерные сегменты) представляют собой полимеры (или полимерные сегменты), которые, прежде всего, растворимы в водных растворах и/или имеют тенденцию поглощать воду. Как правило, чем более гидрофильным является полимер, тем больше этот полимер имеет тенденцию растворяться, смешиваться или намокать в воде.
Используемый в настоящем документе термин «гидрофобный» относится к свойству отсутствия сродства, или даже отталкивания воды. Например, чем более гидрофобным является полимер (или полимерный сегмент), тем больше этот полимер (или полимерный сегмент) имеет тенденцию не растворяться, не смешиваться или не намокать в воде.
Используемый в настоящем документе термин «слизь» относится к вязкоупругому природному веществу, содержащему, главным образом, муциновые гликопротеины и другие материалы, которое защищает эпителиальную поверхность различных органов/тканей, включая дыхательную, носовую, шеечно-влагалищную, желудочно-кишечную, ректальную, зрительную и слуховую системы. Используемый в настоящем документе термин «мокрота» относится к очень вязкоупругим слизистым выделениям, состоящим из различных макромолекул, таких как ДНК, актины и другие продукты разрушения клеток, высвобождающихся из мертвых клеток, в дополнение к муциновым гликопротеинам. «Мокрота», как правило, присутствует в пораженных патогенами воздушных путях пациентов, страдающих от обструктивных заболеваний легких, включая, но не ограничиваясь ими, астму, COPD и КФ (CF). Используемые в настоящем документе термины «КФ слизь» и «КФ мокрота» относятся к слизи и мокроте, соответственно, от пациента, страдающего кистозным фиброзом.
Используемый в настоящем документе термин «разрушающее слизь средство» относится к веществу, которое увеличивает скорость клиренса слизи при введении пациенту. Разрушающие слизь средства известны в данной области. Смотри, например, Hanes, J. et al. «Gene Delivery to the Lung, in Pharmaceutical Inhalation Aerosol Technology», Marcel Dekker, Inc., New York: 489-539 (2003). Примеры разрушающих слизь средств включают N-ацетилцистеин (NAC), который расщепляет дисульфидные и сульфгидрильные связи, присутствующие в муцине. Другие разрушающие слизь средства включают полынь, бромелайн, папаин, клеродендрум, ацетилцистеин, бромгексин, карбоцистеин, эпразинон, месну, амброксол, собрерол, домиодол, денуфозол, летостеин, степронин, тиопронин, гелсолин, тимозин β4, нелтенексин, эрдостеин и различные ДНКзы, включая рчДНКазу.
Используемый в настоящем документе термин «устойчивая к КФ слизи/диффузионная частица» относится к частице, которая проявляет пониженную или низкую мукоадгезию в КФ слизи и которая, таким образом, проходит через КФ слизь с большей скоростью, чем другие частицы. Такие частицы могут быть охарактеризованы, как имеющие высокий коэффициент диффузии через КФ слизь. В некоторых вариантах осуществления устойчивая к КФ слизи/диффузионная частица обладает эффективным коэффициентом диффузии в КФ слизи более чем примерно 0,01 мкм2/с, более предпочтительно более чем примерно 0,5 мкм2/с, наиболее предпочтительно более чем примерно 1 мкм2/с. В предпочтительных вариантах осуществления популяция частиц может быть охарактеризована как «устойчивая к КФ слизи/диффузионная», если по меньшей мере 30%, более предпочтительно по меньшей мере 40%, наиболее предпочтительно по меньшей мере 50% популяции частиц диффундируют через слой КФ слизи толщиной 10 мкм в течение одного часа.
Используемый в настоящем документе термин «кистозный фиброз» (КФ) относится к наследственному генетическому заболеванию, возникающему в результате одной или более мутаций в гене, кодирующем кистозно-фиброзный трансмембранный регулятор проводимости (КФТР) (CFTR). У пациентов с кистозным фиброзом мутации в КФТР, эндогенно экспрессируемым в дыхательном эпителии, приводят к снижению секреции апикальных анионов, вызывая дисбаланс в транспорте ионов и жидкостей. Возникающее в результате снижение анионного транспорта способствует повышенному накоплению слизи в легких и сопутствующей микробной инфекции, которая в конечном итоге приводит к смерти пациентов с КФ. Помимо респираторного заболевания, пациенты с КФ, как правило, страдают от желудочно-кишечных проблем и недостаточности поджелудочной железы, которые, если их не лечить, приводят к смерти. Анализ последовательности гена КФТР в хромосомах больных КФ выявил различные вызывающие заболевания мутации. На сегодняшний день выявлено более 1000 вызывающих заболевание мутаций в гене КФ (http://www.genet.sickkids.on.ca/cftr/). Наиболее распространенной мутацией является делеция фенилаланина в положении 508 аминокислотной последовательности КФТР, и ее обычно называют ΔF508-КФТР. Эта мутация имеет место примерно в 70 процентах случаев кистозного фиброза и связана с тяжелой формой заболевания. Кистозным фиброзом страдает примерно один из каждых 2500 детей в Соединенных Штатах.
Используемый в настоящем документе термин «кистозно-фиброзный трансмембранный регулятор проводимости» (КФТР) относится к трансмембранному белку, играющему первостепенную роль в поддержании транспорта электролитов по всему телу, включая дыхательные и желудочно-кишечные ткани. КФТР состоит из примерно 1480 аминокислот, кодирующих белок, составленный из тандемного повтора трансмембранных доменов, каждый из которых содержит шесть трансмембранных спиралей, и нуклеотид-связывающего домена. Ген, кодирующий КФТР, был идентифицирован и секвенирован. Смотри Gregory, R. J. et al., Nature 347: 382-386 (1990); Rich, D. P. et al., Nature 347: 358-362 (1990) и Riordan, J. R. et al., Science 245: 1066-1073 (1989).
Используемый в настоящем документе термин «нуклеиновая кислота» относится к ДНК, РНК и молекулам нуклеиновых кислот, модифицированным с целью повышения стабильности для различных терапевтических задач. Одним из примеров является ген, кодирующий белок кистозно-фиброзный трансмембранный регулятор проводимости (КФТР) человека, его аналоги и варианты, которые могут экспрессироваться в организме людей, страдающих КФ, для коррекции, по меньшей мере частичной, некоторых симптомов, характерных для КФ. Сюда также относятся такие молекулы, как фрагменты ДНК, включающие области для внесения коррекций или модификаций в ген, например, ДНК, образующие тройные спирали, которые можно использовать для коррекции эндогенного гена КФ в генах по меньшей мере некоторых пациентов с КФ. Следует отметить, что этот термин не ограничен генами КФТР, но применим к каждому генетическому материалу, который можно использовать для лечения, диагностирования или исцеления заболевания.
Термины «парентеральное введение» и «введенный парентерально» являются признанными в данной области терминами и охватывают способы введения, отличные от энтерального и локального введения, такие как инъекции, и включают, но не ограничиваются ими, внутривенные, внутримышечные, интраплевральные, внутрисосудистые, интраперикардиальные, внутриартериальные, интратекальные, интракапсулярные, внутриглазничные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, подэпидермисные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, подконъюнктивные и интрастернальные инъекции и инфузии.
Используемый в настоящем документе термин «сурфактант» относится к средству, которое снижает поверхностное натяжение жидкости.
Термин «терапевтическое средство» относится к средству, которое можно вводить для предотвращения или лечения заболевания или нарушения. Терапевтические средства могут представлять собой нуклеиновую кислоту, аналог нуклеиновой кислоты, малую молекулу, пептидомиметик, белок, пептид, углевод или сахар, липид или сурфактант, или их сочетание.
Термин «лечение» или предотвращение развития заболевания, нарушения или состояния у животного, которое может быть предрасположено к заболеванию, нарушению и/или состоянию, но пока еще не диагностировано как имеющее его; включает подавление заболевания, нарушения или состояния, например, препятствование его прогрессированию; и облегчение заболевания, нарушения или состояния, например, вызывание ремиссии заболевания, нарушения и/или состояния. Лечение заболевания или состояния включает ослабление по меньшей мере одного симптома конкретного заболевания или состояния, даже если не затронуты лежащие в основе патофизиологические процессы, например, лечение боли у субъекта путем введения анальгетика, даже если такой препарат не лечит причину боли.
Используемый в настоящем документе термин «нацеливающий фрагмент» относится к фрагменту, который задает направление к или от конкретного участка. Фрагмент может быть, например, белком, нуклеиновой кислотой, аналогом нуклеиновой кислоты, углеводом или малой молекулой. Фрагмент может быть, например, терапевтическим соединением, таким как малая молекула, или диагностическим фрагментом, таким как детектируемая метка. Конкретный участок может быть тканью, клетками конкретного типа или субклеточным компартментом. В одном варианте осуществления нацеливающий фрагмент задает направление активному фрагменту. Активный фрагмент может быть малой молекулой, белком, полимером или металлом. Активный фрагмент может быть полезен для терапевтических, профилактических или диагностических целей.
Термин «терапевтически эффективное количество» относится к количеству терапевтического средства, которое, при встраивании в и/или на частицы, описанные в настоящем документе, производит некоторый желаемый эффект при разумном соотношении польза/риск, применяемом к любому медицинскому лечению. Эффективное количество может варьироваться в зависимости от таких факторов, как заболевание или состояние, которое лечат, конкретные нацеленные конструкции, которые вводят, размер субъекта или степень тяжести заболевания или состояния. Рядовой специалист в данной области может эмпирически определять эффективное количество конкретного соединения без необходимости проведения излишних экспериментов.
Термины «встроенный» и «инкапсулированный» относятся к встраиванию, формулированию или иному включению активного средства в и/или на композицию, что делает возможным высвобождение, например, замедленное высвобождение, такого средства при желаемом применении. Термины предполагают любой способ, при помощи которого терапевтическое средство или другой материал встраивают в полимерную матрицу, включая, например: присоединение к мономеру такого полимера (за счет ковалентных, ионных или других связывающих взаимодействий), физическое смешивание, оборачивание средства в покрывающий слой полимера, встраивание в полимер, распределение по полимерной матрице, присоединение к поверхности полимерной матрицы (за счет ковалентных или других связывающих взаимодействий), инкапсуляцию внутри полимерной матрицы и так далее. Термин «совместное встраивание» или «совместная инкапсуляция» относится к встраиванию терапевтического средства или другого материала и по меньшей мере одного другого терапевтического средства или другого материала в конкретную композицию.
II. Проникающие в слизь наночастицы (MPP)
A. Полимерный заполнитель
Любое количество биосовместимых полимеров можно использовать для получения наночастиц. В одном варианте осуществления биосовместимый полимер(ы) является биоразлагаемым. В другом варианте осуществления частицы являются не биоразлагаемыми. В других вариантах осуществления частицы представляют собой смесь разлагаемых и не разлагаемых частиц.
Иллюстративные полимеры включают, но не ограничиваются ими, циклодекстрин-содержащие полимеры, в частности, катионные циклодекстрин-содержащие полимеры, такие как те, которые описаны в патенте США № 6509323,
полимеры, полученные из лактонов, такие как поли(капролактон) (PCL),
полигидроксикислоты и их сополимеры, такие как поли(молочная кислота) (PLA), поли(L-молочная кислота) (PLLA), поли(гликолевая кислота) (PGA), поли(молочная-со-гликолевая кислота) (PLGA), поли(L-молочная-со-гликолевая кислота) (PLLGA), поли(D,L-лактид) (PDLA), поли(D,L-лактид-со-капролактон), поли(D,L-лактид-co-капролактон-co-гликолид), поли(D,L-лактид-co-PEO-co-D,L-лактид), поли(D,L-лактид-co-PPO-co-D,L-лактид) и их смеси,
полиалкилцианоакрилат,
полиуретаны,
полиаминокислоты, такие как поли-L-лизин (PLL), поли(валериановая кислота) и поли-L-глутаминовая кислота,
гидроксипропилметакрилат (HPMA),
полиангидриды,
сложные полиэфиры,
сложные полиортоэфиры,
сложные поли(эфирамиды),
полиамиды,
поли(эфиры сложных эфиров),
поликарбонаты,
полиалкилены, такие как полиэтилен и полипропилен,
полиалкиленгликоли, такие как поли(этиленгликоль) (ПЭГ), полиалкиленоксиды (PEO),
полиалкилентерефталаты, такие как поли(этилентерефталат), этиленвинилацетатный полимер (EVA),
поливиниловые спирты (ПВС),
поливиниловые эфиры,
поливиниловые сложные эфиры, такие как поли(винилацетат),
поливинилгалогениды, такие как поли(винилхлорид) (PVC), поливинилпирролидон,
полисилоксаны,
полистирол (PS),
целлюлозы, включая дериватизированные целлюлозы, такие как алкилцеллюлозы, гидроксиалкилцеллюлозы, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, гидроксипропилцеллюлоза и карбоксиметилцеллюлоза,
полимеры акриловых кислот, такие как поли(метил(мет)акрилат) (PMMA), поли(этил(мет)акрилат), поли(бутил(мет)акрилат), поли(изобутил(мет)акрилат), поли(гексил(мет)акрилат), поли(изодецил(мет)акрилат), поли(лаурил(мет)акрилат), поли(фенил(мет)акрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат), поли(октадецилакрилат) (совместно называемые в настоящем документе «полиакриловыми кислотами»),
полидиоксанон и его сополимеры,
полигидроксиалканоаты,
полипропиленфумарат,
полиоксиметилен,
полоксамеры,
поли(масляную кислоту),
триметиленкарбонат и
полифосфазены.
Сополимеры вышеперечисленных полимеров, такие как случайные, блок или привитые сополимеры, или смеси полимеров, перечисленных выше, также можно использовать.
Функциональные группы на полимере могут быть блокированы с целью изменения свойств полимера и/или модификации (например, уменьшения или увеличения) реакционной способности функциональных групп. Например, карбоксильный конец полимеров, содержащих карбоновую кислоту, таких как лактид- и гликолид-содержащих полимеров, может, необязательно, быть блокирован, например, путем эстерификации, и гидроксильный конец может, необязательно, быть блокирован, например, путем этерификации или эстерификации.
Сополимеры ПЭГ или его производных с любым из полимеров, описанных выше, можно использовать для получения полимерных частиц. В некоторых вариантах осуществления ПЭГ или его производные могут быть расположены на внутренних положениях сополимера. Альтернативно, ПЭГ или его производные могут располагаться вблизи или на концевых положениях сополимера. Например, один или более из полимеров, описанных выше, могут заканчиваться блоком полиэтиленгликоля. В некоторых вариантах осуществления полимерный заполнитель представляет собой смесь пегилированного полимера и непегилированного полимера, при этом основные полимеры являются одинаковыми (например, PLGA и PLGA-ПЭГ) или разными (например, PLGA-ПЭГ и PLA). В некоторых вариантах осуществления микрочастицы или наночастицы получают в условиях, позволяющих областям из ПЭГ разделяться по фазам или иным образом размещаться на поверхности частиц. Расположенные на поверхности области ПЭГ могут самостоятельно выполнять функцию изменяющего поверхность средства или содержать его. В конкретных вариантах осуществления частицы получают из одного или более полимеров, заканчивающихся блоками полиэтиленгликоля в качестве материала, изменяющего свойства поверхности.
Средневзвешенная молекулярная масса может варьироваться для конкретного полимера, но, как правило, составляет от примерно 1000 Дальтон до 1000000 Дальтон, от 1000 Дальтон до 500000 Дальтон, от 1000 Дальтон до 250000 Дальтон, от 1000 Дальтон до 100000 Дальтон, от 5000 Дальтон до 100000 Дальтон, от 5000 Дальтон до 75000 Дальтон, от 5000 Дальтон до 50000 Дальтон или от 5000 Дальтон до 25000 Дальтон.
Примеры предпочтительных природных полимеров включают белки, такие как альбумин, коллаген, желатин и проламины, например, зеин, а также полисахариды, такие как альгинат.
В некоторых вариантах осуществления частицы можно использовать в качестве наночастиц - носителей генов. В данных вариантах осуществления частицы могут быть образованы из одного или более поликатионных полимеров, образующих комплекс с одной или более нуклеиновыми кислотами, которые заряжены отрицательно.
Катионный полимер может быть любым синтетическим или природным полимером, несущим по меньшей мере два положительных заряда на молекулу и имеющим достаточную плотность заряда и размер молекулы, чтобы связываться с нуклеиновой кислотой в физиологических условиях (то есть, условиях pH и содержания соли, встречающихся в организме или в клетках). В некоторых вариантах осуществления поликатионный полимер содержит один или более остатков амина.
Подходящие катионные полимеры включают, например, полиэтиленимин (PEI), полиаллиламин, поливиниламин, поливинилпиридин, аминоацетилированный поли(виниловый спирт), акриловые или метакриловые полимеры (например, поли(N,N-диметиламиноэтилметакрилат)), несущие один или более остатков амина, полиаминокислоты, такие как полиорнитин, полиаргинин и полилизин, протамин, катионные полисахариды, такие как хитозан, ДЭАЭ-целлюлоза и ДЭАЭ-декстран, и полиамидоаминовые дендримеры (катионные дендримеры), а также их сополимеры и смеси. В предпочтительных вариантах осуществления поликатионный полимер представляет собой PEI.
Катионные полимеры могут быть либо линейными, либо разветвленными, могут быть или гомополимерами, или сополимерами, и, в случае содержания аминокислот, могут иметь либо L, либо D конфигурацию, а также могут иметь любое сочетание этих признаков. Предпочтительно, молекула катионного полимера является достаточно гибкой, чтобы иметь возможность образовывать компактный комплекс с одной или более молекулами нуклеиновой кислоты.
В некоторых вариантах осуществления поликатионный полимер имеет молекулярную массу от примерно 5000 Дальтон до примерно 100000 Дальтон, более предпочтительно от примерно 5000 до примерно 50000 Дальтон, наиболее предпочтительно от примерно 10000 до примерно 35000 Дальтон.
B. Материалы, которые способствуют диффузии через слизь
Наночастицы предпочтительно покрыты или содержат один или более средств или материалов, изменяющих свойства поверхности. Используемый в настоящем документе термин «средства, изменяющие свойства поверхности» относится к средству или материалу, которые модифицируют одно или более свойств поверхности частиц, включая, но не ограничиваясь ими, гидрофильность (например, делают частицы более или менее гидрофильными), поверхностный заряд (например, делают поверхность нейтральной или почти нейтральной, или более отрицательной или положительной), и/или увеличивают транспорт в, или через жидкости и/или ткани организма, например, слизь. В некоторых вариантах осуществления материал, изменяющий свойства поверхности, оказывает прямой терапевтический эффект, например, уменьшает воспаление.
Примеры средств, изменяющих свойства поверхности, включают, но не ограничиваются ими, белки, в том числе анионные белки (например, альбумин), сурфактанты, сахара или производные сахаров (например, циклодекстрин), терапевтические средства и полимеры. Предпочтительные полимеры включают гепарин, полиэтиленгликоль («ПЭГ») и полоксомеры (блок-сополимеры полиэтиленоксида). Наиболее предпочтительным материалом является ПЭГ.
Примеры сурфактантов включают, но не ограничиваются ими, L-α-фосфатидилхолин (PC), 1,2-дипальмитоилфосфатидилхолин (DPPC), олеиновую кислоту, сорбитантриолеат, сорбитанмоноолеат, сорбитанмонолаурат, полиоксиэтилен (20) сорбитанмонолаурат, полиоксиэтилен (20) сорбитанмоноолеат, натуральный лецитин, олеилполиоксиэтилен (2) эфир, стеарилполиоксиэтилен (2) эфир, лаурилполиоксиэтилен (4) эфир, блок-сополимеры оксиэтилена и оксипропилена, синтетический лецитин, диэтиленгликольдиолеат, тетрагидрофурфурилолеат, этилолеат, изопропилмиристат, глицерилмоноолеат, глицерилмоностеарат, глицерилмонорицинолеат, цетиловый спирт, стеариловый спирт, полиэтиленгликоль 400, цетилпиридиния хлорид, бензалкония хлорид, оливковое масло, глицерилмонолаурат, кукурузное масло, хлопковое масло и подсолнечное масло, лецитин, олеиновую кислоту и сорбит