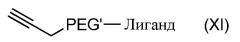Функциональные плг сополимеры, их наночастицы, их получение и применение для адресной доставки лекарственного средства и получения изображения
Иллюстрации
Показать всеНастоящее изобретение относится к области адресной доставки лекарственного средства и получения изображения. Описано соединение формулы (А) где: PLA является полилактидным остатком формулы: где: (3) является присоединением связи к PEG группе; и m является числом единиц и равно от 1 до 500; PEG является полиэтиленгликолевым остатком формулы:где: (4) является присоединением связи к -PLA; (5) является присоединением связи к атому азота и n является числом единиц и равно от 1 и 300; линкер PEG' является полиэтиленгликолевым остатком формулы: где: n' является числом единиц и равно от 1 до 10, (1) является присоединением связи к - (CH2)-триазольной группе; (2) является присоединением связи к лиганду; и Лиганд является остатком функционального лиганда, выбранным из лигандов, распознающих мембраны, агентов для диагностики/получения изображений. Также описаны наночастицы, имеющие средний диаметр от 10 нм до 900 нм, содержащие одно или более одинаковых или разных указанных выше соединений формулы (А). Описан способ получения указанного выше соединения формулы (А), включающий сочетание: соединения формулы (I)с соединением формулы (XI) где PLA, PEG, PEG' и Лиганд такие, как определены выше, методом клик-химии. Также описан способ получения указанных выше наночастиц. Описано лекарственное средство для адресной доставки лекарственного средства и получения изображения, которое содержит по меньшей мере одно указанное выше соединение формулы (А), необязательно в форме наночастиц. Описана фармацевтическая композиция для адресной доставки лекарственного средства и получения изображения, которая содержит в качестве активного ингредиента указанное выше соединение формулы (А), необязательно в форме наночастиц, и по меньшей мере один фармацевтически приемлемый наполнитель. 8 н. и 11 з.п. ф-лы, 4 ил., 12 табл., 11 пр.
Реферат
Данное изобретение относится к области адресной доставки лекарственного средства и получения изображения, и, в частности, доставки с помощью нековалентного инкапсулирования или конъюгирования лекарственного средства в поли(лактид-гликолидной) ((ПЛГ)(PEG-PLA)) наночастице.
Синтез ПЛГ наночастиц и их применение для доставки лекарственного средства описаны во множестве источников в литературе. В композиции ПЛГ, ПЛ (полилактид) (PLА)) является гидрофобным и ПЭГ (PEG) является гидрофильным. Из ПЛГ формируют наночастицы в водной среде, где ПЛ образует сердцевину и ПЭГ образует оболочку. Было показано, что при внутривенной инъекции оболочка ПЭГ в ПЛГ наночастицах защищает наночастицу от фагоцитоза ("эффект малозаметности цели") и, тем самым, минимизирует быстрый общий клиренс наночастиц, и, тем самым, повышает их системный период полужизни (в патенте США 5683723 описаны наночастицы на основе блоксополимера полиоксиэтилена и полимолочной кислоты). Более того, такие наночастицы аккумулируются в опухоли через описанный ранее эффект "увеличенной проницаемости и задержания" (УПЗ). В области рака, в частности, желательно специфичное к опухоли лечение из-за сильных побочных эффектов химиотерапии, и в этом контексте, полимерные наночастицы считаются многообещающими системами доставки лекарственного средства. При введении в ПЛГ наночастицы, лекарственные средства приобретают пролонгированную системную циркуляцию и потенциально более высокую концентрацию в опухоли благодаря эффекту УПЗ. Для доставки наночастицы с повышенной специфичностью к опухоли может применяться подход адресности ткани/аккумулирования с применением устройства самонаведения (Pulkkinen et al. Eur J Pharm Biopharm 70 (2008) 66-74, Zhan et al. J Control Rel 143 (2010) 136-142, Farokhzad et al. Cancer Res 64 (2004) 7668-7672, Gao et al. Biomaterials 27 (2006) 3482-3490).
Применение ПЛГ наночастиц далее функционализированных адресным лигандом исследовали авторы данного изобретения.
Применение клик-химии (сочетание Хьюсгена) описано в литературе для синтеза различных полимеров (Lv et al. J Colloid Interface Sci. 356 (2011) 16-23, Jubeli et al. J Polym Sci Part A: Polym Chem. 48 (2010) 3178-3187, Lecomte et al. Macromol Rapid Commun. 29 (2008) 982-997) или металлических наночастиц (Hanson et al. US2010/0260676 A1, 2010).
Клик-химия является особенно интересной, так как данный подход дает высокий выход, простые и масштабируемые условия реакции, так как реакция не чувствительна к кислороду и воде. Основа этой реакции хорошо известна, она включает небольшое количество катализатора и дает высокий совокупный выход.
Недавно Deshayes et al (Pharm. Res. (2011), 28, 1631-1642) описали конъюгирование циклопептида (применяемого в качестве лиганда, связывающегося специфично с нацеливанием на фактор роста эндотелия сосудов (ФРЭС), с наночастицами фторида поливинилидена-поли(акриловой кислоты) методами клик-химии. Клик-химия уже рассматривалась для синтеза макромолекул, содержащих ПЛ и ПЭГ полимеры. Tang et al, Macromolecules 2011, 44, 1491-1499 описывают сочетание ПЭГ-g-ПЛ-алкинильного промежуточного соединения с производным азидо (полиазидопропил-L-глутамата)). Далее, Yu et al. Macromolecules, 2011, 44(12), 4793-4800 недавно описали наночастицы, полученные из макромолекулы ПЛ-g-паклитаксел-ПЭГ, где паклитаксел является мостиком между ПЛ скелетом и ПЭГ боковыми цепями. Однако лекарственное средство физически не инкапсулировано в наночастицы и структура не содержит адресный лиганд. Lu et al Bioconjugate Chem 2009, 20, 87-94 также описывают макромолекулу, содержащую ПЛ и ПЭГ, полученную методами клик-химии, в которую присоединен пептид (RGD = аргинин-глицин-аспартат) для адресного достижения клеток. Структура макромолекулы включает синтез структурно сложных промежуточных соединений: азидного сополимера (поли(2-метил-2-карбокситриметиленкарбонат-со-D,L-лактид)-g-ПЭГ-азид) и алкин-модифицированных KGRGDS пептидов.
Доктор Zhang et al. (Mol. Pharmaceutics 2012, 9, 2228-2236) описывает наночастицы, полученные из макромолекул, содержащих ПЛ и ПЭГ, где поверхность конъюгирована с лигандами с применением методов клик-химии с получением лиганда, присоединенного непосредственно к триазольной группе. Xiao et al (International Journal of nanomedicine 5, 1, 2010, 1057-1065) в основном относится к ПЛГ-содержащим наночастицам. Arutselvan et al (Chemical Communications 7, 2007, 695-697), WO 2011/046946, Steinmetz et al Journal of the American Chemical Society 131, 47, 2009, 17093-17095) и Adibekian et al (Nature Chemical Biology 7, 2011, 469-479) описывают производные алкин-ПЭГ.
Поэтому существует необходимость в создании простого способа получения содержащих ПЛГ наночастиц, способных инкапсулировать лекарственное средство для сайт-специфической доставки, к которому желаемый функциональный лиганд может быть присоединен с применением клик-химии.
Таким образом, данное изобретение относится к получению ПЛГ наночастиц, содержащих легкую в получении ПЛГ цепь, ковалентно связанную с адресным лигандом через линкер, получаемых методами клик-химии.
Согласно данному изобретению, получение наночастиц включает синтез соединения ПЛГ-азида, который может действовать как кликабельная сополимерная платформа, с которой любой функциональный алкин-лиганд, например, устройство самонаведения, визуализирующее средство, отзывчивый на стимулы агент, соединяющий агент, агент, улучшающий проникновение в клетки, антитоксичный агент, лекарственное средство, может быть соединен с применением клик-химии с универсальным подходом.
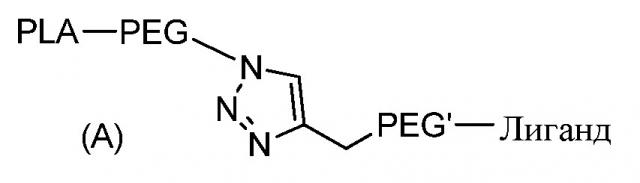
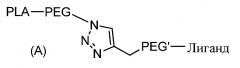
Согласно первому объекту, данное изобретение относится к соединению формулы (A)
,
где:
PLA является полилактидным остатком;
PEG является полиэтиленгликолидным остатком;
линкер PEG' является полиэтиленгликолидным остатком; и
Лиганд является остатком функционального лиганда.
В данном описании, термин "остаток" относится к двухвалентному или одновалентному радикалу, в зависимости от молекулы, из которой он получен, или его производному.
В общей формуле (A) выше, могут быть выделены следующие конкретные варианты или любое их сочетание:
- согласно одному варианту, ПЭГ' имеет формулу
,
где:
n' является числом единиц и равно от 1 до 10,
(1) является присоединением связи к -(CH2)-триазольной группе;
(2) является присоединением связи к лиганду.
- согласно одному из вариантов, ПЛ имеет формулу:
,
где:
(3) является присоединением связи к ПЭГ части; и
m является числом единиц и равно от 1 до 500, что соответствует молекулярной массе от 144 до 72000. В другом варианте, m в основном равно от 100 до 300, что соответствует молярной массе от около 14400 до 43200 г/моль.
- согласно одному из вариантов, ПЭГ имеет формулу:
,
где:
(4) является присоединением связи к -ПЛ;
(5) является присоединением связи к атому азота и
n является числом единиц и равно от 1 до 300, что соответствует молярной массе от около 44 до 13200 г/моль. В другом варианте, n равно от 20 до 70, что соответствует молярной массе от около 880 до 3080 г/моль.
Связывание между ПЛ и ПЭГ (ПЛГ) происходит путем образования сложной эфирной связи между концевой карбоксильной группой ПЛ части и концевой гидроксильной группой ПЭГ части.
Связывание между ПЭГ' и лигандом (ПЭГ'-Лиганд) не проиллюстрировано, но оно происходит путем образования амидной связи, образованной карбоксильной группой лиганда и аминогруппы, получаемой из концевой гидроксигруппы ПЭГ'.
В одном варианте лиганд может быть выбран из остатков устройства самонаведения, диагностического средства, визуализирующего средства, отзывчивого на стимулы агента, соединяющего агента, агента, улучшающего проникновение в клетки, антитоксичного агента, лекарственного средства. В конкретном варианте соединения формулы (A), лиганд может быть выбран из анизамида, фолиевой кислоты и флуорохромов, таких как FP-547.
В контексте данного изобретения:
- атом галогена включает фтор, хлор, бром или иод;
- (С1-С6)алкильная группа означает насыщенную алифатическую группу, которая содержит от 1 до 6 атомов углерода (преимущественно, от 1 до 4 атомов углерода) и которая является линейной или разветвленной. Примеры включают, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил и подобные.
Соединения формулы (A) могут быть в форме свободного основания или в форме аддитивных солей с кислотами, что также составляет часть данного изобретения.
Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, применяемыми, например, для очистки или для выделения соединений формулы (A), также являются частью данного изобретения.
Соединения формулы (A) могут образовывать наночастицы. Таким образом, согласно другому объекту, данное изобретение также относится к наночастице, содержащей одно или более идентичные или различные соединения формулы (A).
Выражение "идентичные или различные соединения" в данном описании означает, что указанные соединения могут иметь одинаковые или различные формулы в зависимости от определения их различных ПЭГ, ПЛ, ПЭГ', R, m, n и т.д.
Указанные наночастицы также могут содержать одно или более идентичных или различных соединений формулы (I’):
,
где PLA, PEG такие, как определены в формуле (A), и R является H или C1-C6 алкилом, таким как метил.
Указанные наночастицы могут необязательно содержать лекарственное средство.
Термин "лекарственное средство" в данном описании относится к терапевтическим веществам, которые могут вводиться пациенту, нуждающемуся в этом. Любое относящееся к теме целевое лекарственное средство (особенно не растворимые в воде лекарственные средства) может быть нековалентно инкапсулировано в наночастицу и/или ковалентно конъюгировано с наночастицей (необязательно, через линкер) для доставки в тело.
Лекарственным средством может быть, в частности, антибиотик, противораковый агент, противовирусный агент, противовоспалительный агент, антиген в вакцине или нутрицевтик.
В частности, лекарственным средством может быть цитотоксический агент, такой как таксоид и, более конкретно, доцетаксел.
Таким образом, в одном варианте, лекарственное средство нековалентно инкапсулировано (например, физически инкапсулировано) в наночастицы. В другом варианте, лекарственное средство ковалентно конъюгировано, необязательно, через линкер, с наночастицами, в частности, где лигандом является лекарственное средство.
В конкретном варианте, лиганд не является лекарственным средством, но лекарственное средство нековалентно инкапсулировано в наночастицу.
В данном описании, термин "наночастицы" относится к частицам, имеющим средний диаметр от 10 нм до 900 нм. В другом варианте, наночастицы в соответствии с данным изобретением имеют средний диаметр от 50 до 300 нм.
Они обычно имеют коэффициент полидисперсности (PdI) от 0,01 до 0,4, более конкретно, от 0,1 до 0,4, и имеют зета потенциал от -30 до + 30 мВ.
С катионным лигандом зета потенциал может быть от 1 до 30 мВ, с анионным лигандом, от -30 до -1 мВ.
Наночастицы в соответствии с данным изобретением показаны на фигурах 2-3.
В соответствии с данным изобретением, указанные наночастицы могут быть получены наноосаждением соединений формулы (A), необязательно в присутствии соединений формулы (I’) выше и/или необязательно с последующим нековалентным инкапсулированием или ковалентным конъюгированием лекарственного средства.
В данном описании, термин "наноосаждение" относится к процессу, включающему осаждение или эмульгирование и снижение размера одного или более соединений в форме наночастиц в суспензии.
Обычно указанный способ включает центрифугирование суспензии. Способ также может включать одну или более стадий, выбранных из:
- получения органической фазы соединений формулы (A) и, необязательно, (I’) в подходящем растворителе или смеси растворителей, таком как метиленхлорид, этилацетат, ацетон, этанол, тетрагидрофуран, и т.д.
- получения водной фазы, необязательно стабилизированной одним или более стабилизирующими агентами, такими как холат натрия, поливиниловый спирт (ПВС), полоксамер, фосфолипиды и т.д.;
- смешивания органической и водной фаз;
- снижения размера частиц суспензии (например, с применением обработки ультразвуком);
- удаления органической фазы, например, выпариванием в вакууме или в потоке воздуха;
- центрифугирования водной фазы, в частности, ультрацентрифугирования вплоть до 50000 g;
- сбора наночастиц; и/или
- повторного суспендирования полученных наночастиц в водной среде.
Обычно наночастицы в соответствии с данным изобретением получают с применением смешиваемого с водой органического растворителя (такого как ацетон) с осаждением органической фазы в водной фазе с необязательным применением стабилизирующего агента, или с применением дихлорметана или этилацетата в качестве органической фазы, содержащей ПВС или полоксамер или холат натрия в качестве стабилизирующего агента. Подходящие полоксамеры для применения для получения наночастиц доступны под торговой маркой Pluronic. Подходящим полоксамером является полоксамер 188 (доступный как Pluronic® F68 или Lutrol® F68, BASF).
В соответствии с данным изобретением, наночастицы, полученные из ПЛГ-функционального лиганда, могут применяться для различных целей, включая доставку терапевтических веществ (лекарственных средств) в тело человека. В одном варианте данного изобретения, наночастицы также содержат лекарственное средство. В этом случае, терапевтическое вещество нековалентно инкапсулировано (физическое инкапсулирование) в матрицу наночастиц, и лучше доставляется в целевую ткань.
В одном варианте, лекарственное средство может быть ковалентно конъюгировано с соединением формулы (A) например, вместо лиганда, необязательно через линкер. Ковалентное конъюгирование может быть интересно для сохранения связи лекарственного средства с носителем in vivo, для доставки лекарственного средства и получения изображений.
Смешиванием различных соединений формулы (A) с различными лигандами получают мультифункциональные наночастицы. Эти мультифункциональные наночастицы могут применяться для комбинированных областей применения (см. фигуру 3).
В соответствии с данным изобретением, наночастицы могут быть получены наноосаждением одного или более соединений формулы (A), и, необязательно, (I’), необязательно, в присутствии лекарственного средства или различных лекарственных средств (для комбинированной терапии).
Выражение "функциональный лиганд" в данном описании в соединении формулы (A) или наночастицах, полученных из него, относится к любому типу соединения, способного воздействовать или обеспечивать доставку лекарственного средства в тело человека, или самому лекарственному средству, в частности, где лекарственное средство является сайт-специфичным, такому как лекарственное средство, специфически связываемое с рецепторами. Функциональные лиганды могут быть, в частности, выбраны из:
- соединений, способных обеспечивать поглощение и распределение наночастиц в клетке, ткани, животном или пациенте, например, через образование метки, которая может давать изображение распределения наночастиц;
- химических или биологических агентов, включая лекарственные средства, которые обеспечивают желаемый конечный эффект наночастиц, такой как запуск смерти клеток или активация или ингибирование рецептора, фермента или гена;
- лигандов рецепторов, таких как антагонист рецептора эстрогена, антагонист рецептора андрогена, фолиевая кислота, анизамид, RGD пептид, антитела, векторы генов под воздействием пептидов, аптамеры и фактор некроза опухоли.
Функциональные лиганды могут включать устройство самонаведения, визуализирующее средство, отзывчивый на стимулы агент (термочувствительный агент, pH-чувствительный агент, фоточувствительный агент, и т.д.), соединяющий агент, агент, улучшающий проникновение в клетки, антитоксичный агент, лекарственное средство и т.д., в зависимости от предполагаемого применения.
Например, устройство наведения, которое распознает и связывается с определенным типом клетки/ткани, может применяться для наведения наночастиц, заполненных лекарственным средством, в целевой определенный орган/болезненную ткань, что также называют 'сайт-специфическим наведением лекарственного средства'. Ожидается, что ПЛГ-устройство наведения наночастиц улучшает доставку инкапсулированного лекарственного средства в целевое болезненное место, повышает местную концентрацию лекарственного средства в целевой ткани и, одновременно, способствует замедленному выделению лекарственного средства. Это дает улучшенное и пролонгированное воздействие лекарственного средства на болезненную ткань/клетки, и, следовательно, улучшенную терапевтическую пользу и пониженные побочные эффекты. Такие наводящие агенты могут быть, в частности, выбраны из мембранных распознающих лигандов, таких как анизамид (имеющий сродство к сигма рецепторам), фолиевая кислота (имеющая сродство к фолатным рецепторам, чрезмерно экспрессирующимся на поверхности некоторых колоний опухолевых клеток), антитела (такие как HER2, трансферрин, анти-РЭФР антитела и т.д.), способные распознавать соответствующий поверхностный антиген, RGD последовательность, которая связывается с ανβ3 интегринами, чрезмерно экспрессирующимися на ангиогенном эндотелии опухоли, гиалуроновая кислота, которая связывается с CD44 рецепторами, трансферрин, который связывается с трансферриновыми рецепторами, и т.д.
В другом примере, лиганды также включают такие, которые распознают и связываются с биологическими соединениями, растворимыми или циркулирующими в биологических жидкостях (например, фактор роста эндотелия сосудов (ФРЭС)), для терапии или детоксикации.
Если функциональным лигандом, сочетающимся с ПЛГ наночастицей, является агент для получения изображений/диагностический агент, то наночастицы могут применяться для получения изображений/диагностики заболевания или нарушения в теле. Такие агенты для получения изображений/диагностики могут быть, в частности, выбраны из оксида железа, комплексов гадолиния, индоцианина зеленого, около инфракрасными флуоресцентными пробами, излучателями позитронов (например, 18F, 68Ga, 64Cu).
Функциональные лиганды, такие как отзывчивые на стимулы агенты, могут применяться для направления ПЛГ наночастиц в предполагаемое место, например, внешнее магнитное поле, создающее местные отзывчивые на стимулы изменения, такие как тепло после излучения около инфракрасного света. Такие отзывчивые на стимулы вещества могут быть выбраны, в частности, из наночастиц оксида железа, наночастиц золота или любых активируемых излучением веществ.
Функциональные лиганды, такие как соединяющие агенты, могут применяться для соединения лекарственного средства (например, по принципу образования ионных пар) для защиты его от разложения и для доставки его в подходящее место тела. В качестве примера, доставка парентеральным путем олигонуклеотидов может быть более эффективной при их соединении с сопряженным с олигопептидом ПЛГ, где олигопептид несет электрический заряд, противоположный заряду олигонуклеотида. Такие соединяющие агенты могут быть, в частности, выбраны из олигопептидов (например, поли-лизина, поли(лейцин-лизина), поли(лейцин-лизин-лизин-лейцина)).
Функциональные лиганды, такие как агенты, улучшающие проникновение в клетку, могут применяться для улучшения поглощения клетками наночастиц и, следовательно, инкапсулированного в него лекарственного средства, что может привести к улучшению эффективности лекарственного средства. Такие агенты, улучшающие проникновение в клетку, могут быть, в частности, выбраны из последовательностей трансактиватора транскрипции (ТАТ), пенетратина, последовательностей полиаргинина, последовательностей белка VP22 и т.д.
Функциональные лиганды, такие как антитоксичный агент, могут применяться для исключения токсичных веществ из системного кровотока. Такие антитоксичные агенты могут быть, в частности, выбраны из множества веществ, например, хелатирующих агентов (для детоксикации металлов), кобаламина, кобинамида, фермента роданаза (для детоксикации цианида), фосфорорганического гидролизующего фермента (для детоксикации фосфорорганических соединений), налоксона, атропина (для детоксикации опиоида), антител/фрагментов антител, распознающих определенный токсин.
Следовательно, как указано выше, Лиганд может быть выбран из:
лигандов, распознающих мембраны, выбранных из антагониста рецептора эстрогена, антагониста рецептора андрогена, фолиевой кислоты, анизамида, антитела, способного распознавать соответствующий поверхностный антиген, такой как HER2, трансферрина или анти-РЭФР антител, RGD последовательности, которая связывается с ανβ3 интегринами, чрезмерно экспрессирующимися на ангиогенном эндотелии опухоли, гиалуроновой кислоты, которая связывается с CD44 рецепторами, трансферрина, который связывается с рецепторами трансферрина, наведенных на пептид векторов гена, аптамеров и агентов для диагностики/получения изображений фактора некроза опухоли, выбранных из оксида железа, комплексов гадолиния, индоцианина зеленого, около инфракрасных флуоресцентных проб или испускателей позитронов (например, 18F, 68Ga, 64Cu),
отзывчивых на стимулы веществ, выбранных из наночастиц оксида железа, наночастиц золота или любых активируемых облучением веществ,
соединяющих агентов, выбранных из олигопептидов (например, поли-лизина, поли(лейцин-лизина), поли(лейцин-лизин-лизин-лейцина),
агента, улучшающего проникновение в клетки, выбранного из последовательностей трансактиватора транскрипции (TAT), пенетратина, полиаргининовых последовательностей или последовательностей VP22 белка,
антитоксичного компонента, выбранного из кобаламина, кобинамида, фермента роданазы, фосфорорганического гидролизующего фермента, налоксона, атропина или антител/фрагментов антител, распознающих определенный токсин; или
лекарственного средства, выбранного из антибиотика, противоракового агента, противовирусного агента, противовоспалительного агента, антигена вакцины или нутрицевтика.
Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (A) выше.
Указанный способ получения соединения формулы (A) включает сочетание:
- соединения формулы (I):
с
- соединением формулы (XI):
,
где PLA, PEG, PEG' и Лиганд, такие как определены в формуле (A) выше.
Сочетание может быть проведено так называемой "клик-химией". Этот термин относится к любому способу, в котором соединение азида (N3) подвергают взаимодействию с алкиновой группой с получением 1,2,3-триазола.
Реакция сочетания клик-химии может проводиться с применением реакции Хьюсгена, применяя или адаптируя любую экспериментальную методику Хьюсгена, известную специалисту в данной области техники, в частности, с применением условий, описанных в Chem. Rev. 2008, 108, 2952-3015. Обычно указанную реакцию сочетания клик-химии проводят в соответствии с реакцией Хьюсгена в органических или водных условиях.
Соединения формулы (I) могут быть в форме раствора в органическом растворителе или в форме наночастиц в водной среде, необязательно содержащих соединение формулы (I’), такое, как определено ниже.
В органических условиях указанную реакцию сочетания клик-химии проводят в присутствии бромида меди(I) (CuBr) и Ν,Ν,Ν',Ν',Ν''-пентаметилдиэтилентриамина (PMDETA) (Chem. Rev. 2008, 108, 2952-3015). Эта реакция может быть проведена, кроме прочего, в органическом растворителе, таком как диметилформамид (ДМФА), тетрагидрофуран (ТГФ), толуол, диметилсульфоксид (ДМСО), при температуре от комнатной температуры до температуры кипения с обратным холодильником реакционной смеси, предпочтительно, в безводных условиях. Обычно применяют избыток соединения формулы (XI).
В водных условиях указанную реакцию сочетания клик-химии проводят в соответствии с Chem. Rev. 2008, 108, 2952-3015, в частности, в присутствии воды и производных меди, таких как CuSO4-5H2O. Присутствие восстанавливающего агента для катализатора, такого как аскорбат натрия, может быть предпочтительным. В общем, водные условия применяют, когда соединения формулы (I) имеют форму наночастиц, в частности, в водной суспензии.
В клик-реакции содержащие наночастицы соединения формулы (I) также могут содержать соединения формулы (I’):
,
где PLA и PEG такие, как определены в формуле (A) и R является H или C1-C6 алкилом, таким как метил.
Соединения формулы (I’), где R является метилом, например, описаны в US 5683723.
При необходимости, суспензия наночастиц также может включать стабилизирующий агент, такой как поливиниловый спирт (ПВС), Pluronic® (например, Pluronic® F68) или холат натрия.
Соединения формулы (I), применяемые в получении соединений формулы (A), являются другим отдельным объектом данного изобретения.
Данное изобретение также относится к соединению формулы (I):
,
где PLA и PEG такие, как определены для соединения формулы (A).
Соединения формулы (I) могут образовывать наночастицы, которые являются другим объектом данного изобретения.
Указанные наночастицы также могут содержать одно или более одинаковых или разных соединений формулы (I’):
,
как определено выше.
Указанные наночастицы показаны на фигуре 1.
Указанные наночастицы могут быть получены наноосаждением одного или более одинаковых или разных соединений формулы (I), как определены выше, необязательно в присутствии одного или более одинаковых или разных соединений формулы (I’).
Наноосаждение может проводиться способом, описанным выше для наночастиц, содержащих одно или более соединений формулы (A).
Наночастицы, содержащие соединения формулы (A), также могут быть получены взаимодействием наночастиц, содержащих одно или более соединений формулы (I) в соответствии с данным изобретением, как описаны ниже, с одним или более соединениями формулы (XI), как определены выше, необязательно с последующим нековалентным инкапсулированием или ковалентным конъюгированием лекарственного средства.
Способ в соответствии с данным изобретением является высоко универсальным в том, что он позволяет легко модифицировать функциональные группы наночастиц, полученные соединениями формулы (A).
Способ в соответствии с данным изобретением включает возможность изменения или корректировки, по желанию, плотности лигандов на поверхности наночастиц, смешиванием соединений формулы (I) с ПЛГ сополимером в различных соотношениях с получением наночастиц, содержащих соединения формулы (I) или (A) вместе с ПЛГ сополимерами, которые не функционализированы азидной группой (см. фигуру 1), где указанные наночастицы затем подвергают взаимодействию с соединениями формулы (XI).
Способ в соответствии с данным изобретением позволяет применять соединения формулы (I) или (A) с различными длинами цепей ПЭГ и ПЛ (см. фигуру 2) для различных областей применения. Например, терапевтические вещества, которые чувствительны к разложению в системной полости (например, олигонуклеотиды), могут сочетаться через соединяющий Лиганд с ПЛГ, имеющими короткую цепь ПЭГ, и затем смешиваться с ПЛГ сополимером, имеющим длинную цепь ПЭГ, так, чтобы длинноцепные ПЭГ образовывали кисточковидную поверхность, на которой маскируют терапевтическое вещество, тем самым защищая его от быстрого разложения в системном кровотоке.
Кроме того, способ в соответствии с данным изобретением позволяет сочетать различные типы ПЛГ-функциональных лигандов (например, ПЛГ-устройство наведения + ПЛГ-агент для получения изображений + ПЛГ-отзывчивое на стимул вещество) для образования мультифункциональных наночастиц для комбинированного применения (см. фигуру 3).
Соединения формулы (I) являются основными в соответствии с данным изобретением, так как они действуют как кликабельные биоразлагаемые сополимерные платформы, на которые может быть присоединен любой алкин-функциональный лиганд с применением клик-химии (с помощью соединений формулы (XI)), для множества областей применения в зависимости от типа функционального лиганда, таких как доставка лекарственного средства, получение изображения, детоксикация и т.д. Таким образом, преимущества данного изобретения включают, кроме прочего, гибкость синтеза различных сопряженных с функциональным лигандом сополимерных наночастиц, которые могут вводиться парентеральным путем. Кроме того, плотность функционального лиганда на поверхности наночастиц может быть скорректирована смешиванием подходящих соотношений соединений формулы (I) и соединений формулы (I’). Кроме того, наночастицы могут быть сконструированы так, чтобы иметь группы ПЭГ с различными длинами цепи, чтобы способствовать внутривенной доставке терапевтических веществ, которые являются химически чувствительными в системном кровотоке. Более того, клик-реакция сочетания функционального лиганда может проводиться либо до образования наночастиц, либо на предварительно полученных наночастицах, в зависимости от химической природы лиганда.
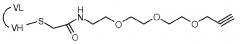
Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (I), включающему стадию взаимодействия соединения формулы (II):
,
где PEG такой, как определен в формуле (A), и X является азидной (N3) функциональной группой или галогеном, таким как атом Br, с соединением лактида формулы:
с последующим, если X является атомом галогена, взаимодействием полученного соединения формулы (III):
,
где PLA и PEG такие, как определены в формуле (A), и Hal является атомом галогена, таким как Br, с NaN3.
Эту реакцию с лактидом в основном проводят через полимеризацию с открытием кольца (ПОК). Обычно эту реакцию проводят в присутствии Sn(Oct)2. Она может быть проведена в массе, обычно при нагревании, или в подходящем органическом растворителе с высокой температурой кипения, таком как толуол или ксилол.
Обычно количество соединения лактида зависит от желаемого значения n в соединении формулы (I), зная, что реакция всегда может быть остановлена до завершения. Обычно молярное отношение ПЭГ макро-инициатора и катализатора Sn(Oct)2 составляет от 1 до 10.
Реакцию предпочтительно проводят в безводных условиях и/или при температуре от комнатной температуры до температуры кипения с обратным холодильником реакционной смеси.
Реакцию с NaN3 обычно проводят в апротонном органическом растворителе, таком как ДМФА, диметилацетамид (ДМА), ацетон и т.д., с избытком NaN3.
Соединение формулы (II):
может быть получено из соединения формулы (IV):
,
где Pg является защитной группой гидроксила, такой как бензил (фенил-CH2-), и PEG такой, как определен в формуле (A),
реакцией замещения с последующей реакцией снятия защиты.
Защитная группа Pg, как указано ниже, соответствует группе, которая позволяет, с одной стороны, защиту реакционноспособной функциональной группы, такой как гидрокси или амин во время стадии синтеза, и, с другой стороны, восстановление реакционноспособной функциональной группы в конце стадии синтеза. Примеры защитных групп, а также способы защиты и снятия защиты различных функциональных групп, даны в P. G. M. Wuts and T. W. Greene, Greene's Protective Groups in Organic Synthesis, 4. ed. (2007), John Wiley & Sons и в J. F. W. McOmie, Protective Groups in Organic Chemistry, Plenum Press, 1973.
Реакция замещения включает замещение OH группы атомом галогена или азидной группой, с помощью подходящего реагента, такого как N-галогенсукцинимид (например, N-бромсукцинимид (NBS)) или азид натрия, соответственно.
Если необходимо заместить галогеновую группу, эту реакцию обычно проводят с подходящим N-галогенсукцинимидным реагентом, с PPh3 в подходящем органическом растворителе, таком как дихлорметан.
Если необходимо защитить азидную группу, исходное замещение уходящей группой может быть проведено следующим образом:
1) замещение OH группы соединения формулы (IV) уходящей группой,
2) замещение уходящей группы полученного соединения на стадии 1) азидной (N3) группой.
В данном описании, "уходящая группа" соответствует группе, которая может быть легко отщеплена от молекулы через разрыв гетеролитической связи (т.е. связи, расщепление которой образует катион и анион), с отрывом электронной пары. Эта группа затем может быть легко замещена другой функциональной группой, во время реакции замещения, например. Такие уходящие группы могут состоять из атомов галогена или активированных гидроксигрупп, таких как мезилат, тозилат, трифлат или ацетильные группы, и т.д. Примеры уходящих групп, а также ссылки на их получение, даны в «Advances in Organic Chemistry», J. March, 3rd Edition, Wiley Interscience, pp.310-316.
Например, на стадии 1), уходящей группой является мезилат и, таким образом, замещение проводят в присутствии мезилхлорида (MsCl). Эту реакцию обычно проводят в присутствии ДМАП, в органическом растворителе, таком как дихлорметан.
Замещение уходящей группы азидной группой на стадии 2) может проводиться в присутствии азида натрия в подходящем органическом растворителе, таком как ДМФA.
Стадия снятия защиты включает гидролиз защитной группы Pg полученного замещенного галогенового или азидного соединения, с получением соединения формулы (II).
Гидролиз обычно проводят в кислых условиях, согласно известным методикам, в частности, с применением концентрированной HCl, если Pg- является фенил-CH2-.
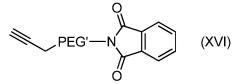
Согласно другому объекту, данное изобретение также относится к соединению формулы (XI):
,
где PEG' и Лиганд такие, как определены в формуле (A).
В частности, данное изобретение относится к соединениям формулы (XI), за исключением .
Согласно другому объекту, данное изобретение также относится к способу получения соединения формулы (XI):
,
включающему сочетание
- соединения формулы (XII):
с
- предшественником Лиганда,
где PEG' и Лиганд такие, как определены в формуле (A) выше.
"Предшественником Лиганда" является соединение, которое, при взаимодействии с -NH2 группой соединения формулы (XII) дает группу-лиганд, где Лигандом является остаток функционального лиганда, определенного в формуле (A).
Указанное сочетание может проводиться в присутствии пептидного сочетающего реагента, в присутствии основания.
Указанный пептидный сочетающий агент может быть выбран из известных пептидных сочетающих агентов, и более конкретно, из PyBOP (гексафторфосфат бензотиазол-1-илокситрипирролидинофосфония) или EDC/NHS (гидрохлорид (1-этил-3-[3-диметиламинопропил]карбодиимид/N-гидроксисульфосукцинимид).
Основанием может быть любое органическое или минеральное основание, более конкретно, минеральное основание, такие как триэтиламин (ТЭА) или Ν,Ν-диизопропилэтилендиамин (ДИПЭА).
Для конкретных сочетаний, в одном варианте, PyBOP (гексафторфосфат бензотиазол-1-илокситрипирролидинофосфония) применяют с N,N-диизопропилэтилендиамином (ДИПЭА) и, в другом варианте, EDC/NHS (гидрохлорид(1-этил-3-[3-диметиламинопропил]карбодиимид/N-гидроксисульфосукцинимид) применяют с триэтиламином.
Реакцию можно проводить в подходящем органическом растворителе, таком как дихлорметан, ДМФA или диметилсульфоксид (ДМСО).
Типовые предшественники Лиганда включают:
, который является предшественником анизамида, дающий Лиганд- =, котор