Композиции и способы ингибирования экспрессии генов аполипопротеина с-iii (арос3)
Иллюстрации
Показать всеИзобретение относится к биохимии. Описана двухцепочечная рибонуклеиновая кислота (дцРНК) для ингибирования экспрессии гена АРОС3, где указанная дцРНК содержит (а) смысловую цепь, состоящую из нуклеотидной последовательности GcuuAAAAGGGAcAGuAuudTsdT, и антисмысловую цепь, состоящую из нуклеотидной последовательности AAuACUGUCCCUUUuAAGCdTsdT; (b) смысловую цепь, состоящую из нуклеотидной последовательности GCUUAAAAGGGACAGUAUUdTsdT, и антисмысловую цепь, состоящую из нуклеотидной последовательности AAUACUGUCCCUUUUAAGCdTsdT, (c) смысловую цепь, состоящую из нуклеотидной последовательности GfcUfuAfaAfaGfgGfaCfaGfuAfuUfdTsdT, и антисмысловую цепь, состоящую из нуклеотидной последовательности aAfuAfcUfgUfcCfcUfuUfuAfaGfcdTsdT, или (d) смысловую цепь, состоящую из нуклеотидной последовательности GcuuAAAAGGGAcAGuAuudTsdT, и антисмысловую цепь, состоящую из нуклеотидной последовательности AAuACuGUCCCuuuuAagcdTsdT, где нуклеотиды, обозначенные строчными буквами, представляют собой 2'-О-метилнуклеотиды; Gf, Af, Uf и Cf представляют собой 2'-фторнуклеотиды; и s представляет собой фосфоротиоатную связь. Также описана фармацевтическая композиция для ингибирования экспрессии гена АРОС3, содержащая указанную дцРНК. Представлены способы ингибирования экспрессии АРОС3 в клетке и лечения нарушения, опосредованного экспрессией АРОС3, включающие использование указанной дцРНК. Изобретение расширяет арсенал средств, предназначенных для лечения нарушения, опосредованного экспрессией АРОС3. 4 н. и 8 з.п. ф-лы, 4 ил., 12 табл., 7 пр.
Реферат
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет предварительной патентной заявки №61/499620, поданной 23 июня 2011, которая включена в настоящее описание посредством ссылки во всей своей полноте.
Ссылка на список последовательностей
Данная заявка включает список последовательностей, поданный электронно в виде текстового файла, названного 11111US_sequencelisting.txt, созданного в XX месяца 201Х, с размером Х00000 байт. Данный список последовательностей включен посредством ссылки.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к двухцепочечной рибонуклеиновой кислоте (дцРНК), мишенью которой является ген APOC3, и способам применения данной дцРНК для ингибирования экспрессии APOC3.
Предпосылки создания настоящего изобретения
В США 30% взрослых людей имеют повышенные уровни триглицеридов (ТГ) >150 мг/дл. Распространенность взрослых людей с тяжелой гипертриглицеридемией (ТГ>500 мг/дл) составляет 1,7%. Современное лечение включает изменение образа жизни (рацион, упражнения и прекращение курения), назначение высококачественного рыбьего жира, фибратов и ниацина.
АроС3 представляет собой секретируемый белок печени, для которого показано, что он ингибирует липопротеинлипазы, которые гидролизуют ТГ до свободных жирных кислот; ингибирует АроЕ-опосредованное поглощение печенью ТГ-обогащенных липопротеинов посредством LDLR и LRP, а также независимого от рецептора эндоцитоза; и способствует секреции в печени VLDL. По меньшей мере, одна мутация в человеческом гене APOC3 связана с благоприятной липидограммой. (Pollin TI et al. (2008) A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 322(5908):1702-5).
Показано, что двухцепочечные молекулы РНК (дцРНК) блокируют генную экспрессию высококонсервативным регуляторным механизмом, известным как РНК-интерференция (РНКи). В WO 99/32619 (Fire et al.) описано применение дцРНК по меньшей мере из 25 нуклеотидов в длину для ингибирования экспрессии генов в С.elegans. Также показано, что дцРНК разрушает РНК-мишень в других организмах, включая растения (см., например, WO 99/53050, Waterhouse et al.; и WO 99/61631, Heifetz et al.), Drosophila (см., например, Yang, D., et al., Curr. Biol. (2000) 10:1191-1200), и млекопитающих (см. WO 00/44895, Limmer; и DE 10100586.5, Kreutzer et al.).
Сущность настоящего изобретения
Описанной в настоящем изобретении является двухцепочечная рибонуклеиновая кислота (дцРНК) для ингибирования экспрессии гена APOC3, где дцРНК содержит смысловую цепь и антисмысловую цепь, каждая из 30 нуклеотидов или менее в длину, где антисмысловая цепь содержит по меньшей мере 15 смежных нуклеотидов антисмысловой последовательности из таблицы 1, 2, 6, 7 или 10. В одном варианте осуществления дцРНК содержит смысловую цепь, состоящую из нуклеотидной последовательности SEQ ID NO:70, и антисмысловую цепь, состоящую из нуклеотидной последовательности SEQ ID NO:151 (AD-45149.1UM). В другом варианте осуществления последовательность смысловой цепи выбрана из таблицы 1, 2, 6, 7 или 10, и антисмысловая цепь выбрана из таблицы 1, 2, 6, 7 или 10.
В некоторых вариантах осуществления по меньшей мере один нуклеотид дцРНК представляет собой модифицированный нуклеотид, например, по меньшей мере один модифицированный нуклеотид, выбранный из группы, состоящей из: 2'-О-метил-модифицированного нуклеотида, нуклеотида, содержащего 5'-фосфоротиоатную группу, и концевого нуклеотида, соединенного с холестериновым производным или группой на основе бисдециламида додекановой кислоты, 2'-дезокси-2'-фтор-модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, замкнутого нуклеотида, нуклеотида, не содержащего основания, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинонуклеотида, фосфороамидата и нуклеотида, содержащего неприродное основание.
В некоторых вариантах осуществления по меньшей мере одна цепь содержит 3'-неспаренный конец по меньшей мере из 1 нуклеотида, или каждая цепь содержит 3'-неспаренный конец по меньшей мере из 2 нуклеотидов.
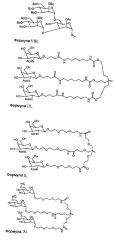
Любая дцРНК настоящего изобретения может дополнительно содержать лиганд, например, лиганд, который конъюгирован с 3'-концом смысловой цепи дцРНК. В некоторых вариантах осуществления дцРНК настоящего изобретения дополнительно содержит по меньшей мере один N-ацетилгалактозамин.
Кроме того, настоящее изобретение относится к клетке, содержащей любую дцРНК настоящего изобретения; вектору, кодирующему по меньшей мере одну цепь любой дцРНК настоящего изобретения, и клетке, содержащей вектор.
Также включенными в настоящее изобретение являются фармацевтические композиции для ингибирования экспрессии гена APOC3, содержащего любую дцРНК настоящего изобретения. Фармацевтическая композиция может содержать липидный состав, например, липидный состав, содержащий МС3.
Другой аспект настоящего изобретения представляет собой способ ингибирования экспрессии APOC3 в клетке, включающий: (а) приведение клетки в контакт с дцРНК APOC3 настоящего изобретения и (b) выдерживание клетки, полученной на стадии (а), в течение периода времени, достаточного для достижения разрушения мРНК транскрипта гена APOC3, посредством чего ингибируется экспрессия гена APOC3 в клетке. В некоторых вариантах осуществления экспрессия APOC3 ингибируется по меньшей мере на 30%.
Следующий аспект настоящего изобретения представляет собой способ лечения нарушения, опосредованного экспрессией APOC3, включающий введение человеку, нуждающемуся в данном лечении, терапевтически эффективного количества дцРНК APOC3 настоящего изобретения или фармацевтической композиции настоящего изобретения. Нарушение может представлять собой, например, повышенное содержание триглицеридов, например, уровень триглицеридов >150 мг/дл или >500 мг/дл. В некоторых вариантах осуществления введение вызывает увеличение активности липопротеинлипазы и/или липазы печени. дцРНК или фармацевтическую композицию можно вводить при дозе приблизительно от 0,01 мг/кг до приблизительно 10 мг/кг или приблизительно от 0,5 мг/кг до приблизительно 50 мг/кг.
Описание фигур
На фиг. 1 представлен график, показывающий воздействие на мРНК-мишени, уровни триглицеридов (ТГ) и суммарного холестерина у мышей после обработки киРНК, мишенью которой является APOC3 ("киРНК#1" и киРНК#2").
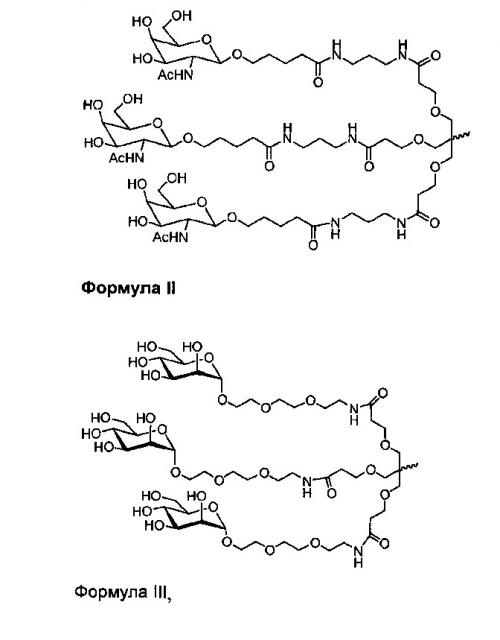
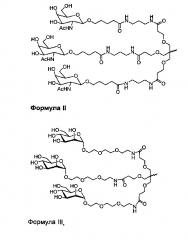
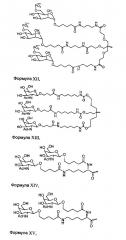
На фиг. 2 показана структура GalNAc.
На фиг. 3 показана структура киРНК, конъюгированной с Chol-п-(GalNAc)3 через фосфатную связь на 3'-конце.
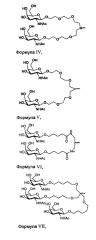
На фиг. 4 показана структура киРНК, конъюгированной с LCO(GalNAc)3 (a(GalNAc)3-3'-литохолевый-олеоиловый киРНК конъюгат).
Подробное описание настоящего изобретения
Подробности одного или более вариантов осуществления настоящего изобретения изложены в описании ниже. Другие признаки, цели и преимущества настоящего изобретения будут ясны из описания и фигур, и из формулы изобретения.
Настоящее изобретение относится к дцРНК и способам применения дцРНК для ингибирования экспрессии гена APOC3 в клетке или млекопитающем, где мишенью дцРНК является ген APOC3. Настоящее изобретение также относится к композициям и способам лечения патологических состояний и нарушений у млекопитающего, вызванных экспрессией гена APOC3. дцРНК APOC3 направлена на специфическое к последовательности разрушение мРНК APOC3.
Определения
Для удобства, значения определенных терминов и фраз, применяемых в описании, примерах и прилагаемой формуле изобретения, даны ниже. Если есть явное расхождение между применением термина в других частях данного описания и его определением, приведенном в данном параграфе, определение в данном параграфе будет иметь преимущество.
Каждый "G," "С," "А" и "U" обычно обозначает нуклеотид, который содержит гуанин, цитозин, аденин и урацил в качестве основания, соответственно. "Т" и "dT" применяют взаимозаменяемо в настоящем описании, и они относятся к дезоксирибонуклеотиду, в котором основанием нуклеотида является тимин, например, дезоксириботимин. Однако следует понимать, что термин "рибонуклеотид" или "нуклеотид", или "дезоксирибонуклеотид" может также относиться к модифицированному нуклеотиду, как дополнительно подробно описано ниже, или имитирующей заменяющей молекуле. Специалист в данной области техники хорошо осведомлен, что гуанин, цитозин, аденин и урацил может быть заменен другими молекулами по существу без изменения свойств спаривания оснований олигонуклеотида, содержащего нуклеотид, несущий данную заменяющую группу. Например, но без ограничения, нуклеотид, содержащий инозин в качестве его основания может образовывать пару с нуклеотидами, содержащими аденин, цитозин или урацил. Следовательно, нуклеотиды, содержащие урацил, гуанин или аденин можно заменять в нуклеотидных последовательностях настоящего изобретения нуклеотидом, содержащим, например, инозин. Последовательности, содержащие данные заменяющие группы, являются вариантами осуществления настоящего изобретения.
"APOC3" относится к гену аполипопротеина C-III. Согласно NCBI LM интернет-сайту, аполипопротеин C-III представляет собой белок липопротеина очень низкой плотности (VLDL). APOC3 ингибирует липопротеинлипазу и липазу печени; считают, что он задерживает катаболизм обогащенных триглицеридами частиц. Гены APOA1, APOC3 и APOA4 близко примыкают как в крысином, так и в человеческом геномах. Гены A-I и А-IV транскрибируются из одной цепи, тогда как гены A-I и C-III транскрибируются конвергентно. Увеличение уровня ароС-III вызывает развитие гипертриглицеридемии. Человеческая последовательность мРНК APOC3 представлена GenBank с номером доступа NM_000040.1, включенной в настоящее изобретение как SEQ ID NO:1. Последовательность мРНК ANGPTL3 макаки-крабоеда (Масаса fascicularis) представлена GenBank с номером доступа Х68359.1.
Как используется в настоящем описании, "последовательность - мишень" относится к смежной части нуклеотидной последовательности молекулы мРНК, образованной в процессе транскрипции гена APOC3, включая мРНК, которая представляет продукт процессинга РНК первичного продукта транскрипции.
Как используется в настоящем описании, термин "цепь, содержащая последовательность" относится к олигонуклеотиду, содержащему цепь нуклеотидов, которая описана последовательностью, приведенной с использованием стандартной нуклеотидной номенклатуры.
Как используется в настоящем описании и если не указано иное, термин комплементарная при применении для описания первой нуклеотидной последовательности относительно второй нуклеотидной последовательности, относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизоваться и образовывать дуплексную структуру в определенных условиях с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, как понятно специалисту в данной области техники.
Например, первую нуклеотидную последовательность можно описать как комплементарную второй нуклеотидной последовательности, когда две последовательности гибридизуются (например, подвергаются отжигу) в условиях строгой гибридизации. Условия гибдридизации включают температуру, ионную силу, рН и концентрацию органического растворителя для стадий отжига и/или промывки. Термин «условия строгой гибридизации» относится к условиям, в которых первая нуклеотидная последовательность будет предпочтительно гибридизоваться с ее последовательностью-мишенью, например, второй нуклеотидной последовательностью, и в меньшей степени или вообще не будет гибридизоваться с другими последовательностями. Условия строгой гибридизации зависимы от последовательности и являются разными при различных параметрах окружающей среды. Как правило, условия строгой гибридизации выбраны так, чтобы они составляли приблизительно на 5°С ниже термической температуры плавления (Tm) для нуклеотидной последовательности при определенной ионной силе и рН. Tm представляет собой температуру (при определенной ионной силе и рН), при которой 50% первых нуклеотидных последовательностей гибридизуются с идеально подходящей последовательностью-мишенью. Подробное руководство по гибридизации нуклеиновых кислот находится, например, в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nuckeic Acid Probes part I, chap. 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays," Elsevier, N.Y. ("Tijssen").
Можно применять другие условия, такие как физиологически значимые условия, которые могут быть внутри организма. Специалист в данной области техники сможет определить набор условий, наиболее подходящий для исследования на комплементарность двух последовательностей согласно конечному применению гибридизованных нуклеотидов.
Это включает спаривание оснований олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность по всей длине первой и второй нуклеотидной последовательности. Такие последовательности можно называть "полностью комплементарными" относительно друг друга в настоящем изобретении. Однако когда первую последовательность называют "по существу комплементарной" относительно второй последовательности в настоящем изобретении, две последовательности могут быть полностью комплементарными или они могут образовывать одно или более, но обычно не более 4, 3 или 2 пар оснований, спаренных вопреки принципу комплементарности, при гибдридизации, при этом сохраняя способность гибридизоваться в условиях, наиболее подходящих для их конечного применения. Однако когда два олигонуклеотида конструируют так, чтобы они образовывали при гибдридизации один или более одноцепочечных неспаренных концов, данные неспаренные концы не следует считать спариванием оснований вопреки принципу комплементарности относительно определения комплементарности. Например, дцРНК, содержащую первый олигонуклеотид, из 21 нуклеотида в длину, и второй олигонуклеотид, из 23 нуклеотидов в длину, в которой более длинный олигонуклеотид содержит последовательность в 21 нуклеотид, которая полностью комплементарна более короткому олигонуклеотиду, можно, тем не менее, называть "полностью комплементарной" для целей, описанных в настоящем изобретении.
"Комплементарные" последовательности, как используется в настоящем описании, могут также содержать или могут быть образованы полностью из пар оснований не по Уотсону-Крику и/или пар оснований, образованных неприродными и модифицированными нуклеотидами, поскольку удовлетворяют приведенным выше требованиям относительно их способности гибридизоваться. Данные пары оснований не по Уотсону-Крику включают, но не ограничивается ими, спаривание оснований G:U «качели» или по Хугстену.
Термины «комплементарная», «полностью комплементарная» и «по существу комплементарная» в настоящем изобретении можно использовать в отношении соответствия оснований между смысловой цепью и антисмысловой цепью дцРНК, или между антисмысловой цепью дцРНК и последовательностью-мишенью, как будет понятно из контекста их применения.
Как используется в настоящем описании, полинуклеотид, который является «по существу комплементарным по меньшей мере части матричной РНК (мРНК)» относится к полинуклеотиду, который является по существу комплементарным смежной части соответствующей мРНК (например, мРНК, кодирующей APOC3), содержащей 5' UTR, открытую рамку считывания (ORF) или 3' UTR. Например, полинуклеотид является комплементарным по меньшей мере части мРНК APOC3, если последовательность является по существу комплементарной непрерываемой части мРНК, кодирующей APOC3.
В одном варианте осуществления антисмысловая цепь дцРНК является достаточно комплементарной мРНК-мишени так, чтобы вызвать расщепление мРНК-мишени.
Термин «двухцепочечная РНК» или «дцРНК», как используется в настоящем описании, относится к комплексу молекул рибонуклеиновой кислоты, имеющему дуплексную структуру, содержащую две антипараллельные и по существу комплементарные, как определено выше, цепи нуклеиновых кислот. Как правило, большинство нуклеотидов каждой цепи представляют собой рибонуклеотиды, но, как описано подробно в настоящем изобретении, каждая или обе цепи могут также содержать по меньшей мере один нерибонуклеотид, например, дезоксирибонуклеотид и/или модифицированный нуклеотид. Кроме того, как используется в настоящем описании, «дцРНК» может содержать химические модификации рибонуклеотидов, включая значительные модификации при многочисленных нуклеотидах и включая все типы модификаций, описанные в настоящем изобретении или известные в данной области техники. Любые такие модификации, как использовано в молекуле типа киРНК, включены «дцРНК» для целей данного описания и формулы изобретения.
Две цепи, образующие дуплексную структуру, могут представлять собой различные части одной более длинной молекулы РНК или они могут представлять собой отдельные молекулы РНК. Когда две цепи являются частью одной более длинной молекулы и, следовательно, соединены непрерывной цепью нуклеотидов между 3'-концом одной цепи и 5'-концом соответствующей другой цепи, образующих дуплексную структуру, соединяющую цепь РНК, называют «петлей типа шпилька». Когда две цепи соединены ковалентно способом, отличным от непрерывной цепи нуклеотидов между 3'-концом одной цепи и 5'-концом соответствующей другой цепи, образующих дуплексную структуру, соединяющую структуру называют «линкером». Цепи РНК могут содержать одинаковое или различное количество нуклеотидов. Максимальное количество пар оснований является количеством нуклеотидов в самой короткой цепи дцРНК минус любые неспаренные концы, которые присутствуют в дуплексе. В добавление к дуплексной структуре, дцРНК может содержать один или более нуклеотидных неспаренных концов. Термин «киРНК» также используется в настоящем описании для обозначения дцРНК, как определено выше.
Как используется в настоящем описании, «нуклеотидный неспаренный конец» относится к неспаренному нуклеотиду или нуклеотидам, которые выступают из дуплексной структуры дцРНК, когда 3'-конец одной цепи дцРНК выходит за пределы 5'-конца другой цепи, или наоборот. «Тупой» или «тупой конец» означает то, что нет неспаренных нуклеотидов на данном конце дцРНК, т.е. нет нуклеотидного неспаренного конца. дцРНК «с тупыми концами» представляет собой дцРНК, которая является двухцепочечной по всей длине, т.е. нет нуклеотидного неспаренного конца на обоих концах молекулы.
Термин «антисмысловая цепь» относится к цепи дцРНК, которая содержит область, которая по существу комплементарна последовательности-мишени. Как используется в настоящем описании, термин «область комплементарности» относится к области в антисмысловой цепи, которая является по существу комплементарной последовательности, например, последовательности-мишени, как определено в настоящем изобретении. Когда область комплементарности является неполностью комплементарной последовательности-мишени, нарушение комплементарности наиболее допустимо в концевых областях и, если оно(и) присутствует, обычно в концевой области или областях, например, в пределах 6, 5, 4, 3 или 2 нуклеотидов 5'- и/или 3'-конца.
Термин «смысловая цепь», как используется в настоящем описании, относится к цепи дцРНК, которая содержит область, которая по существу комплементарна области антисмысловой цепи.
Как используется в настоящем описании, термин «липидно-нуклеиновая частица» включает термин «SNALP» и относится к везикуле липидов, покрывающей ограниченную водную внутреннюю часть, содержащую нуклеиновую кислоту, такую как дцРНК, или плазмиду, для которой транскрибируется дцРНК. Липидно-нуклеиновые частицы, например, SNALP, описаны, например, в опубликованных патентных заявках США №20060240093, 20070135372, и USSN 61/045228, поданной 15 апреля 2008. Данные заявки включены в настоящее описание посредством ссылки.
«Введение в клетку» при ссылке на дцРНК означает облегченное поглощение или абсорбцию в клетке, как будет понятно специалисту в данной области техники. Абсорбция или поглощение дцРНК может осуществляться диффузными способами без посторонней помощи или активными клеточными способами, или вспомогательными агентами или устройствами. Значение данного термина не ограничено клетками in vitro; дцРНК можно также «вводить в клетку», где клетка является частью живого организма. В данном случае, введение в клетку будет включать доставку в организм. Например, для in vivo доставки дцРНК можно вводить в место в ткани или вводить системно. In vitro введение в клетку включает способы, известные в данной области техники, такие как электропорация и липофекция. Дополнительные подходы описаны в настоящем описании или они являются известными в данной области техники.
Термины «сайленс», «ингибировать экспрессию», «понижающе регулировать экспрессию», «подавлять экспрессию» и подобные, когда они относятся к гену APOC3, в настоящем описании относятся по меньшей мере к частичному подавлению экспрессии гена APOC3, как проявляется снижением количества мРНК, которую можно выделить из первой клетки или группы клеток, в которых ген APOC3 транскрибируется, и которая обработана или которые обработаны так, что экспрессия гена APOC3 ингибирована, по сравнению со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но которая не обработана или которые не обработаны таким способом (контрольные клетки). Степень ингибирования обычно выражают в виде
Альтернативно, степень ингибирования может быть приведена в виде снижения параметра, который функционально связан с экспрессией гена APOC3, например, количества белка, кодируемого геном APOC3, который секретируется клеткой, или количества клеток, проявляющих определенный фенотип, например, апоптоз. В принципе, сайленс гена APOC3 можно определить в любой клетке, экспрессирующей мишень, или конститутивно или геномной инженерией, и любым подходящим анализом. Однако когда нужна ссылка для того, чтобы определить, ингибирует ли указанная дцРНК экспрессию гена APOC3 до определенной степени и, следовательно, включена в настоящее изобретение, анализы, приведенные в примерах ниже, будут служить в качестве данной ссылки.
Например, в некоторых случаях, экспрессия гена APOC3 подавлена по меньшей мере приблизительно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% введением двухцепочечного олигонуклеотида, приведенного в настоящем изобретении. В некоторых вариантах осуществления ген APOC3 подавлен по меньшей мере приблизительно на 60%, 70% или 80% введением двухцепочечного олигонуклеотида, приведенного в настоящем изобретении. В некоторых вариантах осуществления, ген APOC3 подавлен по меньшей мере на приблизительно 85%, 90% или 95% введением двухцепочечного олигонуклеотида, приведенного в настоящем изобретении.
Как используется в настоящем описании в контексте экспрессии APOC3, термины «лечить», «лечение» и подобные относятся к облегчению или ослаблению патологических процессов, опосредованных экспрессией APOC3. В контексте настоящего изобретения, когда они относятся к любому из других состояний, приведенных в настоящем описании ниже (отличным от патологических процессов, опосредованных экспрессией APOC3), термины «лечить», «лечение» и подобные означают облегчение или ослабление по меньшей мере одного симптома, связанного с данным состоянием, или замедление или обращение развития такого состояния.
Как используется в настоящем описании, фразы «эффективное количество» относится к количеству, которое приносит терапевтическую пользу при лечении, предотвращении или контролировании патологических процессов, опосредованных экспрессией APOC3, или явного симптома патологических процессов, опосредованных экспрессией APOC3. Конкретное количество, которое является эффективным, может легко определить практикующий врач, и оно может изменяться в зависимости от факторов, известных в данной области техники, таких как, например, тип патологических процессов, опосредованных экспрессией APOC3, история болезни и возраст пациента, стадия патологических процессов, опосредованных экспрессией APOC3, и введение других агентов против патологических процессов, опосредованных экспрессией APOC3.
Как используется в настоящем описании «фармацевтическая композиция» содержит фармацевтически эффективное количество дцРНК и фармацевтически приемлемый носитель. Как используется в настоящем описании, «фармацевтически эффективное количество», «терапевтически эффективное количество» или просто «эффективное количество» относится к количеству РНК, эффективному для обеспечения предполагаемого фармацевтического, терапевтического или превентивного результата. Например, если указанное клиническое лечение считают эффективным, когда имеется по меньшей мере 25% снижение измеримого параметра, связанного с заболеванием или нарушением, терапевтически эффективное количество лекарственного средства для лечения данного заболевания или нарушения представляет собой количество, необходимое для осуществления по меньшей мере 25% снижения данного параметра. Например, терапевтически эффективное количество дцРНК, мишенью которой является APOC3, может снижать уровень APOC3 в сыворотке по меньшей мере на 25%.
Термин «фармацевтически приемлемый носитель» относится к носителю для введения терапевтического агента. Данные носители включают, но без ограничения, физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, этанол и их комбинации. Термин, в частности, включает среду для клеточных культур. Что касается лекарственных средств, водимых перорально, фармацевтически приемлемые носители включают, но без ограничения, фармацевтически приемлемые эксципиенты, такие как разбавители, дезинтегранты, связующие, лубриканты, подсластители, ароматизаторы, красители и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как кукурузный крахмал и альгиновая кислота представляют собой подходящие дезинтегранты. Связующие включают крахмал и желатин, тогда как лубриканты, если они присутствуют, будут обычно представлять собой стеарат магния, стеариновую кислоту или тальк. При желании, таблетки можно покрывать материалом, таким как глицеринмоностеарат или глицериндистеарат, для замедления поглощения в желудочно-кишечном тракте.
Как используется в настоящем описании, «трансформированная клетка» представляет собой клетку, в которую введен вектор, из которого экспрессируется молекула дцРНК.
Двухцепочечная рибонуклеиновая кислота (дцРНК)
Как описано более подробно в настоящем описании, настоящее изобретение относится к молекулам двухцепочечной рибонуклеиновой кислоты (дцРНК) для ингибирования экспрессии гена APOC3 в клетке или млекопитающем, где дцРНК содержит антисмысловую цепь, содержащую область комплементарности, которая является комплементарной по меньшей мере части мРНК, образующейся при экспрессии гена APOC3, и где область комплементарности составляет менее чем 30 нуклеотидов в длину, обычно 19-24 нуклеотидов в длину, и где указанная дцРНК, при контакте с клеткой, экспрессирующей указанный ген APOC3, ингибирует экспрессию указанного гена APOC3 по меньшей мере на 30%, как оценено, например, ПЦР или способом гибридизации с использованием разветвленных ДНК (bDNA), или способом на основе белка, таким как вестерн-блоттинг. Экспрессию гена APOC3 можно снизить по меньшей мере на 30% при сравнении анализом, описанном в примерах ниже. Например, экспрессию гена APOC3 в клеточной культуре, такой как в Нер3В клетках, можно оценить измерением уровня мРНК APOC3, таким как bDNA или TaqMan анализом, или измерением концентрации белка, таким как ELISA анализ. дцРНК настоящего изобретения может дополнительно содержать один или более одноцепочечных нуклеотидных неспаренных концов.
дцРНК может быть синтезирована стандартными способами, известными в данной области техники, как дополнительно обсуждается ниже, например, использованием автоматизированного ДНК синтезатора, такого как коммерчески доступный, например, от Biosearch, Applied Biosystems, Inc. дцРНК содержит две цепи РНК, которые являются достаточно комплементарными для гибридизации, образуя дуплексную структуру. Одна цепь дцРНК (антисмысловая цепь) содержит область комплементарности, которая является по существу комплементарной и обычно полностью комплементарной последовательности-мишени, полученной из последовательности мРНК, образованной в процессе экспрессии гена APOC3, другая цепь (смысловая цепь) содержит область, которая комплементарна антисмысловой цепи, так что две цепи гибридизуются и образуют дуплексную структуру при смешивании в подходящих условиях. Как правило, дуплексная структура состоит из 15-30 или 25-30, или 18-25, или 19-24, или 19-21, или 19, 20 или 21 пар оснований в длину. В одном варианте осуществления дуплекс состоит из 19 пар оснований в длину. В другом варианте осуществления дуплекс состоит из 21 пары оснований в длину. Когда две различные киРНК используют в комбинации, длины дуплексов могут быть одинаковыми или могут отличаться.
Каждая цепь дцРНК настоящего изобретения обычно состоит из 15-30 или 18-25, или 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов в длину. В других вариантах осуществления каждая цепь состоит из 25-30 нуклеотидов в длину. Каждая цепь дуплекса может иметь одинаковую или различную длину. Когда две различные киРНК применяют в комбинации, длины каждой цепи каждой киРНК могут быть одинаковыми или могут отличаться.
дцРНК настоящего изобретения включают дцРНК, которые являются более длинными, чем 21-23 нуклеотида, например, дцРНК, которые являются достаточно длинными для обработки Dicer, являющимся РНКазным III ферментом, до киРНК 21-23 пар оснований в длину, которые затем встраиваются в RISC. Соответственно, дцРНК настоящего изобретения может состоять по меньшей мере из 25, 26, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90 или по меньшей мере 100 пар оснований в длину.
дцРНК настоящего изобретения может содержать один или более одноцепочечных неспаренных концов из одного или более нуклеотидов. В одном варианте осуществления по меньшей мере один конец дцРНК содержит одноцепочечный нуклеотидный неспаренный конец из 1-4, обычно 1 или 2 нуклеотидов. В другом варианте осуществления антисмысловая цепь дцРНК содержит неспаренные концы из 1-10 нуклеотидов, каждый на 3'-конце и 5'-конце в смысловой цепи. В следующих вариантах осуществления смысловая цепь дцРНК содержит неспаренные концы из 1-10 нуклеотидов, каждый на 3'-конце и 5'-конце в антисмысловой цепи.
дцРНК, имеющие по меньшей мере один нуклеотидный неспаренный конец, могут обладать неожиданно лучшими ингибирующими свойствами, чем копия с тупыми концами. В некоторых вариантах осуществления наличие только одного нуклеотидного неспаренного конца усиливает активность интерференции дцРНК, без воздействия на ее суммарную стабильность. Проверено, что дцРНК, содержащая только один неспаренный конец, является особенно стабильной и эффективной in vivo, а также в ряде клеток, средах для клеточных культур, крови и сыворотке. Как правило, одноцепочечный неспаренный конец расположен на 3'-конце антисмысловой цепи или, альтернативно, на 3'-конце смысловой цепи. дцРНК может также содержать тупой конец, обычно расположенный на 5'-конце антисмысловой цепи. Такие дцРНК могут обладать повышенной стабильностью и ингибирующей активностью, таким образом, обеспечивая введение при низких дозах, т.е. менее чем 5 мг/кг массы тела реципиента в день. Как правило, антисмысловая цепь дцРНК содержит нуклеотидный неспаренный конец на 3'-конце, и 5'-конец является тупым. В другом варианте осуществления один или более нуклеотидов на неспаренном конце заменен нуклеозидтиофосфатом.
В одном варианте осуществления ген APOC3 представляет собой ген humAPOC3. В конкретных вариантах осуществления смысловая цепь дцРНК представляет собой одну из смысловых последовательностей из таблиц 1, 2, 6, 7, 11 или 12, и антисмысловая цепь представляет собой одну из антисмысловых последовательностей таблиц 1, 2, 6, 7, 11 или 12. Альтернативные антисмысловые агенты, мишенью которых являются другие области в последовательности-мишени, приведенные в таблицах 1, 2, 6, 7, 11 или 12, можно легко определить, используя последовательность-мишень и фланкирующую APOC3 последовательность.
Специалисту в данной области техники хорошо известно, что дцРНК, имеющие дуплексную структуру 20-23, но конкретно 21 пару оснований, известны как особенно эффективные для индукции РНК интерференции (Elbashir et al., EMBO 2001, 2 0:6877-6888). Однако обнаружено, что другие дцРНК, которые являются более короткими или более длинными дцРНК, могут быть также эффективными. В вариантах осуществления, описанных выше, в соответствии с типом олигонуклеотидных последовательностей, приведенных в таблицах 1, 2, 6, 7, 11 или 12, дцРНК, представленные в настоящем изобретении, могут содержать по меньшей мере одну цепь длины, описанной в настоящем описании. Обосновано ожидать, что более короткие дцРНК, содержащие одну из последовательностей таблиц 1, 2, 6, 7, 11 или 12, минус только несколько нуклеотидов на одном или обоих концах могут быть аналогично эффективными при сравнении с дцРНК, описанными выше. Следовательно, дцРНК, содержащие частичную последовательность по меньшей мере из 15, 16, 17, 18, 19, 20 или более смежных нуклеотидов из одной из последовательностей таблиц 1, 2, 6, 7, 11 или 12, и отличающиеся по их способности ингибировать экспрессию гена APOC3 в анализе, как описано в настоящем описании ниже, не более чем на 5, 10, 15, 20, 25 или 30% ингибирования от дцРНК, содержащей полную последовательность, охватываются настоящим изобретением. Кроме того, дцРНК, которые расщепляют требуемую APOC3 последовательность-мишень, можно легко получить, используя соответствующую антисмысловую последовательность и комплементарную смысловую последовательность APOC3.
Кроме того, дцРНК, приведенные в таблицах 1, 2, 6, 7, 11 или 12, определяют место в APOC3, которое подвержено расщеплению на основе РНКи. Как таковое, настоящее изобретение дополнительно относится к дцРНК, мишенью которых является последовательность, являющаяся мишенью одного из агентов настоящего изобретения. Как используется в настоящем описании, считают, что вторая дцРНК направлена на последовательность первой дцРНК, если вторая дцРНК расщепляет единицу генетического кода где-нибудь в пределах мРНК, которая является комплементарной антисмысловой цепи первой дцРНК. Такая вторая дцРНК будет обычно состоять по меньшей мере из 15 смежных нуклеотидов первой из последовательностей, приведенных в таблицах 1, 2, 6, 7, 11 или 12, соединенных с дополнительными нуклеотидными последовательностями, взятыми из области, смежной выбранной последовательности в гене APOC3.
Расщепление РНК мишени можно определить обычно гель-электрофорезом и, при необходимости, связанными с ним способами гибдридизации нуклеиновых кислот, известными в данной области техники. Участок расщепления в мРНК мишени дцРНК можно определить, применяя способы, обычно известные специалисту в данной области техники, например, способом 5'-RACE, описанным в Soutschek et al., Nature; 2004, volume 432, p. 173-178 (которая включена в настоящее описание посредством ссылки для всех целей).
дцРНК, представленная в настоящем изобретении, может содержать одно или более нарушений комплементарности с последовательностью-мишенью. В одном варианте осуществления дцРНК, представленная в настоящем изобретении, содержит не более 3 нарушений комплементарности. Если антисмысловая цепь дцРНК содержит нарушение комплементарности с последовательностью-мишенью, предпочтительно, чтобы участок нарушения комплементарности не располагался в области комплементарности. Если антисмысловая цепь дцРНК содержит нарушение комплементарности с последовательностью-мишенью, предпочтительно, чтобы нарушение комплементарности было ограничено 5 нуклеотидами с каждого из концов, например, 5, 4, 3, 2 или 1 нуклеотидом с каждого из 5'- или 3'-концов области комплементарности. Например, для 23 нуклеотидной дцРНК цепи, которая является комплементарной области гена APOC3, дцРНК обычно не содержит какого-либо нарушения комплементарности в пределах центральных 13 нуклеотидов. Способы, описанные в настоящем изобретении, можно применять для определения является ли дцРНК, содержащая нарушение комплементарности с последовательностью-мишенью, эффективной для