Новый вариант расслаивания в системе антипирин (ап) - вода - сульфат натрия
Иллюстрации
Показать всеИзобретение относится к аналитической химии, в частности, к способам извлечения солей металлов из водных растворов без органического растворителя с помощью расслаивающейся системы антипирин (АП)-вода-сульфат натрия. Расслаивающаяся система для выделения ионов металлов из водных растворов, содержащая производное из группы пиразолонов, воду и высаливатель, где в качестве фазообразователя выступает сульфат натрия, а гидратированная форма антипирина является экстрагентом. Технический результат - получение экстрагента без применения токсичных и горючих органических растворителей, обладающего большой экстракционной емкостью при минимальном количестве компонентов в системе. 1 ил., 1 табл.
Реферат
Изобретение относится к аналитической химии, в частности, к способам извлечения солей металлов из водных растворов без органического растворителя с помощью расслаивающейся системы антипирин (АП)-вода-сульфат натрия.
Чаще всего встречаются экстракционные системы, расслоение которых кроется в ограниченной растворимости жидкостей. Обычно, в качестве двух несмешивающихся фаз используются водные растворы и органические растворители. Известна экстракция без органического растворителя, например: расслаивание водного раствора, содержащего растворимый полимер, при введении неорганической соли в систему [Зварова Т.И., Шкинев В.М., Спиваков Б.Я., Золотов Ю.А. Жидкостная экстракция в системе водный раствор соли - водный раствор полиэтиленгликоля // Докл. АН СССР. - 1983. - Т. 273, №1. - С. 107-110]. В качестве фазообразователя часто применяют сульфат аммония. Недостатком способа является низкая экстракционная емкость, необходимость использования фракции водорастворимого полиэтиленгликоля (ПЭГ) со строго определенной молекулярной массой от 1000 до 5000 у.е.
Наиболее близким по технической сущности является экстракция ионов металлов антипирином. Образующиеся комплексы обладают малой растворимостью, характерной окраской, способностью извлекаться не смешивающимися с водой органическими растворителями. [Бусев А.И., Акимов В.К., Гусев С.И. Производные пиразолона как аналитические реагенты // Успехи химии. - 1965. - Вып. 3. - С. 565-583]. Недостатком способа является то, что большинство органических растворителей относится к легколетучим, пожароопасным и токсичным веществам; некоторые металлы дают окрашенные соединения с антипирином при введении дополнительных агентов.
Задачей изобретения является разработка экстрагента без применения токсичных и горючих органических растворителей, обладающего большой экстракционной емкостью при минимальном количестве компонентов в системе.
Для решения поставленной задачи предлагается экстрагент для выделения ионов металлов из водных растворов, содержащий антипирин, воду и высаливатель, где в качестве высаливателя выступает сульфат натрия.
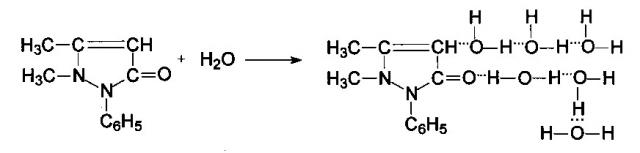
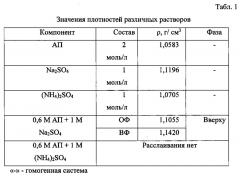
Изобретение основано на способности АП при определенной «критической» концентрации образовывать самостоятельную органическую фазу, насыщенную водой - 53,22% (ОФ). Необходимым условием в таком случае для образования ОФ является введение в систему высаливателя. Приведенный факт был установлен в присутствии 1 моль/л раствора сульфата натрия, при этом концентрация АП оставалась постоянной при объеме водной фазы 10 мл. Небольшая по объему верхняя фаза является экстрагентом макроколичеств ионов железа (III) и большой группы микроколичеств ионов металлов.
Верхняя органическая фаза представляет собой гидратированную форму АП:
Чем большей высаливающей способностью обладает неорганическая соль, тем больше будет объем ОФ. Гидратированная форма АП может быть достаточно сложной и зависит от присоединения 2-х и более молекул Н2О.
Такой гидратации способствует высокая концентрация АП и неорганического высаливателя в водной фазе. Приведенные данные подтверждаются зафиксированными показателями плотности исходных растворов реагентов, растворов высаливателей, а также водной и органической фаз (табл. 1). При введении 1 моль/л раствора сульфата аммония в систему, а также при увеличении его концентрации до 2 моль/л, фаза с АП не образуется. Следовательно, сульфат натрия обладает большей высаливающей способностью, чем сульфат аммония.
Количественное соотношение компонентов напрямую влияет на объем ОФ, отклонение от которого может привести к полной гомогенизации системы или к выделению твердых фаз переменного состава. Поэтому, чтобы расслаивающаяся система АП-Н2О-Na2SО4 могла использоваться в качестве экстракционной, необходимо определить и строго соблюдать это соотношение.
На рис. 1 приведены сведения о влиянии концентрации высаливателя на объем ОФ при фиксированном содержании АП. Из рис. 1 следует, что повышение концентрации Na2SО4 увеличивает объем ОФ. Последняя практически сохраняется при концентрации АП в интервале 0,3-0,8 моль/л. Однако, при концентрации АП выше 0,8 моль/л и при выдерживании водно-расслаивающейся системы в течение часа и более наблюдается выделение кристаллов. Для практических целей выбрана концентрация АП, равная 0,6 моль/л, обеспечивающая достаточный объем верхней фазы (1,3-1,4 мл) при оптимальном соотношении компонентов (CNa2SO4 = 1 моль/л).
Полученная органическая фаза подвижна, прозрачна, практически не окрашена и удобна как для экстракции ионов металлов, так и для их определения разными методами, в том числе с их последующим атомно-эмиссионным определением с применением индуктивно-связанной плазмы. Важным достоинством ОФ также является хорошая водорастворимость, что позволяет проводить экстракцию без применения токсичных и горючих органических растворителей. Нельзя не отметить и такой факт, как исключение при анализе стадии реэкстракции. При этом коэффициент относительного концентрирования увеличивается, поскольку распределение элемента осуществляется в небольшую по объему органическую фазу. Таким образом, применение расслаивающейся системы повышает уровень экологической безопасности экстракционных методов, напрямую влияющих на здоровье химика-аналитика и состояние окружающей среды.
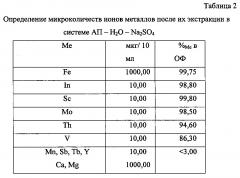
Пример 1. Методика экстракционного выделения и последующего спектрального определения микроколичеств Fe, In, Sc, Mo, Th, V (iCAP 6500). Анализируемые растворы готовились из стандартных образцов (Internal Standard Mix. Agilent Part Number: 5183-4681; Initial calibration verification standard. Agilent Part Number: 5183-4682).
Выполнение определения: 1 мл каждого эталона переносили в делительную воронку на 50 мл, вводили 3 мл 2 моль/л раствора АП в объеме водной фазы V=10 мл. Поскольку указанные стандарты приготовлены на 5% HNO3, то при экстракции приливали 0,8 мл 2 моль/л раствора NaOH для нейтрализации данной кислотности. В качестве высаливателя вводили сульфат натрия до концентрации 1 моль/л. Экстракцию ионов металлов проводили в течение 5 мин, после отстаивания к водной фазе приливали еще 1,5 мл АП и проводили повторную экстракцию. В объединенных экстрактах определяли содержание входящих в состав эталона компонентов (табл. 2):
При определении микроколичеств Fe, In, Sc, Mo, Th, V относительное стандартное отклонение не превышает 0,01.
Пример 2. Оценка экстракционной способности ОФ на примере извлечения макроколичеств ионов железа. К анализируемому раствору, содержащему ионы железа (III), вводили 3 мл 2М раствора антипирина, в качестве высаливателя вводили сульфат натрия до концентрации 1 моль/л в объеме 10 мл. Экстракцию ионов Fe3+ осуществляли в делительных воронках на 50 мл в течение 5 мин, после отстаивания и расслоения к водной фазе приливали еще 1,5 мл АП и проводили повторную экстракцию. В объединенных экстрактах определяли железо комплексонометрически, предварительно разбавив экстракт дистиллированной водой. Контроль за содержанием ионов Fe3+ в экстракте осуществляли по его остатку в водной фазе по указанному выше методу. В качестве индикатора применяли 25%-ный раствор сульфосалициловой кислоты (2-3 капли) и титровали раствором ЭДТА (0,025 моль/л) до перехода окраски от винно-красной до соломенно-желтой.
Оказалось, что при экстракции 1 мг Fe (III) в условиях 0,6 моль/л раствора АП и 1 моль/л Na2SO4 в ОФ переходит 99,8% железа, то есть 0,99 мг. При экстракции 7,19 мг Fe (III), последнее переходит в ОФ только на 43% и, наконец, при извлечении 14,38 мг Fe (III) степень его извлечения уменьшается до 9,3%. То есть с увеличением концентрации железа в водной фазе экстракционная емкость ОФ уменьшается (до ~ 9%). Тем самым можно заключить, что система АП-Н2О-Na2SO4 обладает большей экстракционной емкостью, например, по сравнению с ПЭГ-Н2О-(NH4)2SO4, где ионы металлов извлекаются на уровне 5⋅10-5 моль/л.
Расслаивающаяся система для выделения ионов металлов из водных растворов, содержащая производное из группы пиразолонов, воду и высаливатель, отличающаяся тем, что в качестве высаливателя выступает сульфат натрия, а гидратированная форма антипирина является экстрагентом.