Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина р1
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1. Изобретение обеспечивает получение и тестирование безмаркерных растений каланхоэ с повышенными антибиотическими свойствами за короткий промежуток времени для использования в фармакологии и медицине. 8 з.п. ф-лы, 4 ил., 1 табл., 12 пр.
Реферат
Изобретение относится к области биотехнологии и генетической инженерии растений, в частности к способу получения безмаркерных растений Каланхоэ перистого, экспрессирующих ген антимикробного пептида цекропина Р1.
В настоящее время методы генетической инженерии открывают возможности получения различных рекомбинантных белков. Для этого используются экспрессионные системы бактерий, дрожжей, млекопитающих и насекомых. Однако эти системы имеют недостатки. В клетках прокариот не происходит правильная укладка полипептидных цепей и не происходит их посттрансляционная модификация. В клетках дрожжей, насекомых и млекопитающих этих недостатков нет, но их использование очень дорого [Russel С, Clarke l. Recombinant proteins for genetic disease // Clinical Genet. 1999. V. 55. P. 389-394].
Растения по сравнению с этими системами имеют ряд преимуществ: в клетках высших растений происходит гликозилирование и правильный фолдинг целевых белков и их выращивание не требует дорогостоящего оборудования. Кроме того, растительные клетки, в отличие от животных, не содержат в своем составе патогенные для человека вирусы и прионы. Трансформация и регенерация растений происходит значительно проще, чем у клеток животных [Daniell Н., Streatfield S., Wycoff K. Medical molecular farming: productionof antibodies, biopharmaceuticals and edible vaccines in plants // Trends in Plant Sci. 2001. V. 6. P. 219-226]. За последние годы множество ценных белков эффективно экспрессировано в растениях. Это регуляторы роста, антитела, вакцины, биополимеры, промышленные ферменты, белки человеческой сыворотки и реагенты для молекулярной биологии [Cabanes-Macheteau М., Fttchette-Laine А.С., Loutelier-Bourhis С. et al., N-Glycosylation of a mouse IgG expressed in transgenic tobacco plants // Glycobiology. 1999. V. 9. P. 365-372]. Некоторые белки, синтезируемые трансгенными растениями, уже производятся зарубежными компаниями [Рукавцова Е.Б., Бурьянов Я.И., Шульга Н.Я., Быков В.А. // Вопросы биологической, медицинской и фармацевтической химии. 2006. №2. С. 3-12].
Следует отметить перспективность получения трансгенных растений, экспрессирующих антимикробные пептиды (АМП) [Захарченко Н.С., Рукавцова Е.Б., Гудков А.Т, Юхманова А.А., Школьная Л.А., Кадо К.И., Бурьянов Я.И. Экспрессия искусственного гена антимикробного пептида цекропина Р1 повышает устойчивость растений картофеля к фитофторозу и белой гнили // Доклады Академии наук. 2007. Т. 415, №1, С. 129-131]. Это связано с тем, что широкое применение антибиотиков в качестве лекарственных препаратов привело к накоплению устойчивых форм микроорганизмов.
Распространены случаи устойчивости целого ряда патогенов человека (Mycobacterium tuberculosis, Enterococcus faecalis, Pseudomonas aeruginosa, Staphylococcus aureus, Salmonella typhi, Streptococcus pneumoniae, Vibrio cholerae и пр.) практически к любому из применяемых препаратов [Walsh С. Molecular mechanisms that confer antibacterial drug resistance // Nature. 2000. V. 406. P. 775-781].
Поэтому АМП в настоящее время рассматривают как альтернативу классическим антибиотикам. Они обладают определенными преимуществами: широкий спектр действия, способность быстро убивать клетки-мишени, активность в отношении штаммов, резистентных к другим антибиотикам, а также относительная трудность в развитии устойчивости. Поскольку некоторые антимикробные пептиды обладают цитотоксическим эффектом (действуют на эукариотические клетки), наиболее эффективно они могут быть использованы при лечении заболеваний слизистых оболочек и наружных покровов - без введения в кровь пациента. На сегодняшний день такие пептиды активно используются для создания новых лекарственных препаратов, например, пептидный антибиотик рамопланин (Ramoplanin) - продукт нерибосомального синтеза в грибах рода Actinomycetes spp. В данный момент рамопланин находится на клинических испытаниях фазы III в качестве антибиотика против инфекций дыхательных путей, в первую очередь, стафилококков [Breukink Е., de Kruijff В., Lipid II as a target for antibiotics // Nat. Rev. 2006. Drug Discov. V. 5. P. 321-332].
Все это позволяет рассматривать АМП в качестве основы для создания эффективных лекарств, особенно на фоне снижения потенциала обычных антибиотиков.
АМП, выделенных из трансгенных растений на рынке, пока нет, но возможно, в ближайшие годы появятся, так как некоторые из них находятся на последних стадиях клинических испытаний.
Одним из перспективных антимикробных пептидов является цекропин Р1, это линейный α-спиральный пептид, не содержащий цистеина [Martemyanov K.A., Shirin A.S., Gudkov А.Т. Synthesis, cloning and expression of genes for antibacterial peptides: cecropin. magainin, and bombinin // Biotechnology letters. V. 18. №. 12. 1996. P. 1357-1362]. В отличие от цекропинов насекомых, он состоит из одной длинной положительно заряженной α-спирали, в образовании которой задействованы практически все аминокислотные остатки. Цекропин Р1 высокоактивен против патогенных грамотрицательных и грамположительных бактерий, грибов и некоторых опухолевых клеток [Pillai A., Ueno S., Zhang Н., Lee J.M., Kato Y. Cecropin P1 and novel nematode cecropins: a bacteria-inducible antimicrobial peptide family in the nematode Ascaris suum // Biochem. J. 2005. V. 390. P. 207-214.].
Перенос гена цекропина P1 (CP1) в клетки лекарственного растения каланхоэ представляется актуальным для его фармацевтического и медицинского использования.
Для получения и отбора трансгенных растений обычно используют селективные маркерные гены устойчивости к антибиотикам (канамицину, гигромицину) и гербицидам (фосфинотрицину) [Angenon G., Dillen W., van Montagu M. Antibiotic-Resistance Markers for Plant Transformation // Plant Molecular Biology Manual // Eds. Gelvin S.B., Schilperoort R.A. Dordrecht: Kluwer Acad. Publ. 1994. C1. P. 1-13]. Полученные с помощью селективных маркеров трансгенные растения представляют потенциальную биологическую опасность, связанную с присутствием в их геноме этих генов и с возможностью их неконтролируемого переноса другим растениям и организмам. Поэтому в настоящее время актуальной задачей является получение растений нового поколения, не содержащих селективных маркерных генов.
Отбор трансгенных растений проводят различными методами: избирательной элиминацией маркерных генов из хромосомного или хлоропластного генома [Puchta Н. Gene replacement by homologous recombination in plants // Plant Mol. Biol. 2002. V.48. P. 173-182], с помощью использования агробактериальных генов синтеза фитогормонов и их последующего удаления с помощью рекомбиназ мобильных генетических элементов, например транспозона кукурузы Ac [Sugita K., Kasahara Т., Matsunaga Е., Ebinuma Н.A. Transformation vector for the production of marker-free transgenic plants containing a single copy transgene at high frequency // Plant J. 2000. V. 22. P. 461-469].
Наиболее близкими к предлагаемому способу является способ получения и отбора трансгенных растений томата Lycopersicon esculentum, включающий удаление селективных маркеров из генома трансгенных растений с использованием транспозонов. В этом способе селективный ген неомицинфосфотрансферазы nptII был фланкирован инфертированными повторами транспозона Ds-элемента кукурузы. Селективный ген выщеплялся при повторной трансформации растений томата геном транспозазы [Yoder J.I., Lassner m.W. Biologically safe plants transformation system using a Ds transposon // US 5225341, C12Q 1/68, 06.06.1993]. При этом каждый трансформант может содержать несколько вставок генов. Поэтому для отбора трансгенных растений необходимо проводить гибридизационный анализ ДНК по Саузерну.
Недостатком этого способа является длительность процедуры, так как необходимо проводить повторную трансформацию, и делать отбор трансформантов по методу Саузерну с использованием радиоактивных зондов.
Известен способ создания безмаркерных трансгенных растений картофеля Solanum tuberosum L. с использованием селективных генов для позитивной (ген неомицинфосфотрансферазы nptII) и негативной (ген цитозиндезаминазы cod А) селекции на одной плазмиде и целевого гена - на другой [Kondrak М., van der Meer I.M., Banfalvi Z. Generation of marker- and backbone-free transgenic potatoes by site-specific recombination and a bi-functional marker gene in a non-regular one-border Agrobacterium transformation vector // Transgenic Res. 2006. V. 15. P. 729-737]. Для трансформации использовали штамм Agrobacterium tumefaciens AGLO. Временная позитивная селекция трансформированных растений на среде с канамицином сменялась этапом негативной селекции на среде с 5-фторцитозином, что приводит к отбору растений, содержащих с частотой до 15% только целевой ген.
Недостатком этого способа является длительность проведения из-за необходимости дополнительных анализов методами ДНК-гибридизации по Саузерну и ПЦР.
Способы, ранее разработанные авторами заявляемого проекта, получения безмаркерных растений с помощью безмаркерной плазмиды рВМ [Бурьянов Я.И., Захарченко Н.С., Юхманова А.А., Пиголева С.В., Рукавцова Е.Б., Чеботарева Е.Н., Гаязова А.Р. Рекомбинантная плазмида рВМ и способ получения с ее использованием безмаркерных трансгенных растений, синтезирующих целевые продукты. Патент №2410433 (РФ) // Б.И. 2011. №3; Захарченко Н.С., Бурьянов Я.И. Получение биобезопасных безмаркерных трансгенных растений каланхоэ перистого (Kalanchoe pinnata L.) с повышенной устойчивостью к биотическим стрессовым факторам. Всероссийская научная конференция «Факторы устойчивости растений в экстремальных природных условиях и техногенной среде». Иркутск. СИФИБР. 10-13 июня 2013 г. С. 89-92]. Эти способы позволяют получать безмаркерные растения за короткий промежуток времени по детекции продукта экспрессии перенесенного целевого гена.
Недостатком этих способов является отсутствие возможности проведения одновременного анализа наличия и количественного уровня экспрессии перенесенного СР1 гена. Приблизительный уровень экспрессии цекропина Р1, определенный в этих способах, не превышал 0,005% от ОРБ.
Для практического или научного использования трансгенных растений необходимо четко определять достижение уровня экспрессии перенесенного гена.
Уровень экспрессии перенесенных генов в трансгенных растениях зависит от многих факторов: области ядерного хроматина, куда интегрировал введенный ген, вида используемого промотора, метода трансформации, количества встроенных копий гена, правильный дизайн конструкции - добавление терминаторов транскрипции, введение интрона в район 5'- конца мРНК целевого гена и др. [Романов Г.А. Генетическая инженерия растений и пути решения проблемы биобезопасности // Физиология растений. 2000. Т. 47. №3. С. 343-353; Jahne А., Becker D., Jorz Н. Genetic engineering of cereal crop plants: a review // Euphytica. 1995. V. 85. P. 35-44].
Известен способ определения количества копий перенесенного гена в трансгенных растениях методом ПЦР в реальном времени (RT-PCR) [Stenman J., Finne P., Stahls A., Grenman R., Stenman U.-H., Patotie A., Orpana A. Accurate determination of relative messenger RNA levels by RT-PCR // Nature. Biotech. 1999. V. 17. P. 720-723]. В этом методе, используя общие принципы полимеразной цепной реакции, измеряется количество амплифицированной ДНК в реальном времени после каждого цикла амплификации. Для количественного определения используют два метода - флюоресцентные красители, интеркалирующие в двухцепочечные молекулы ДНК, и модифицированные олигонкулеотиды (ДНК-зонды), которые флюоресцируют после гибридизации с комплементарными участками ДНК.
Недостатком этого способа является дороговизна реактивов и оборудования.
Известен способ определения экспрессии генов - в комбинации RT-ПЦР с ОТ ПЦР (обратная транскрипция) для измерения малых количеств мРНК, что позволяет получать количественную информацию о содержании данной мРНК в клетке и судить об уровне экспрессии данного гена в отдельной растительной клетке [Nolan Т., Hands R.E., Bustin S.A. 2006. Quantification of mRNA using real-time RT-PCR // Nat. Protoc. 2006. V. 1. P. 1559-1582].
Недостатком этого метода является дороговизна оборудования, которое пока не может применяться в каждой научной лаборатории.
Известен способ определения экспрессии генов путем тестирования РНК (мРНК) и их фрагментов в образцах (Нозерн-блот) методом РНК-ДНК гибридизации, где в качестве зондов используют комплементарные молекулы ДНК [Alwine J.C., Kemp D.J., Stark G.R. Method for detection of specific RNAs in agarose gels by transfer to diazobenzyloxymethyl-paper and hybridization with DNA probes // Proc. Natl. Acad. Sci. U.S.A. 1977. V. 74. №12. P. 5350-5354].
Недостатком этого способа является то, что данные количественного анализа синтеза мРНК целевого гена не всегда коррелируют с количеством синтезируемого клеткой целевого белка, что может быть связано с деградацией белка или РНК в процессе выделения и проведения гибридизации.
Наиболее близким к предлагаемому является способ определения экспрессии гена цекропина В (СВ) по конечному белковому продукту и тому эффекту, который вызывает получаемый белок. В трансгенных маркерных растениях томата экспрессию гена СВ определяли уровнем антибиотической активности экстрактов против фитопатогенов Ralstonia solanacearum и Xanthomonas campestris pv. vesicatoria и вестерн-блот анализом [Jan P-S, Huang H-Y, Chen H-M. Expression of a synthesized gene encoding cationic peptide cecropin В in transgenic tomato plants protects against bacterial diseases // Applied and Environmental Microbiology. 2010. V. 2. P. 769-775].
Недостатком данного способа является то, что получаемые растения томата содержали маркерный ген nptII и экспрессировали антимикробный пептид СВ на невысоком уровне 0,001% от ОРБ.
Задачей настоящего изобретения является разработка способа получения безмаркерных растений Kalanchoe pinnata, экспрессирующих ген антимикробного пептида цекропина Р1, который будет лишен вышеуказанного недостатка и позволит получить высокий уровень экспрессии пептида и одновременно определить его количество в прямом анализе регенерантов из трансформированных эксплантов каланхоэ перистого.
Эта задача решается предложенным способом, в котором получают и анализируют трансформированные безмаркерные растения путем обработки семян каланхоэ перистого (Kalanchoe pinnata) в условиях вакуумной инфильтрации или кокультивации листовых эксплантов каланхоэ перистого (Kalanchoe pinnata) суспензией штамма агробактерий из ряда Agrobacterium tumefaciens СВЕ21, А. tumafaciens GV3101 (pMP90RK), A. tumafaciens LBA4404 (pAL4404), содержащего безмаркерную плазмиду рВМ, несущую ген СР1, кодирующий цекропин Р1, и свободную от селективных маркерных генов устойчивости к антибиотикам.
При этом суспензию агробактерий Agrobacterium tumefaciens предварительно активируют ацетосирингоном, преинкубируют семена или нарезанные листовые экспланты каланхоэ перистого на твердой питательной среде МС 36-60 суток, обрабатывают семена в условиях вакуума в присутствии суспензии штамма агробактерий, а листовые экспланты при обычных комнатных условиях с последующей инкубацией семян на твердой питательной среде без антибиотика, а через 36-60 суток экспланты инкубируют на твердой питательной среде с антибиотиком для элиминации агробактерий. Полученные проростки или регенеранты возраста 4-5 недель используются для вестерн-блот анализа, отбирают растения с положительным иммуноферментным анализом и исследуются на присутствие гена цекропина Р1 и его экспрессию.
Штаммы бактерий Agrobacterium tumefaciens CBE21(pTiBo542), A. tumafaciens GV3101(pMP90RK), A. tumafaciens LBA4404 (pAL4404) содержат плазмиду pBM-CP1. При этом в состав кассеты экспрессии плазмиды рВМ-CP1 входят генетические конструкции, выбранные из ряда: промотор CaMV 35S - ген СР1 - терминатор pACaMV.
В качестве целевого гена для трансформации используют синтетический ген антимикробного пептида цекропина P1 (СР1), кодирующий 31-членную аминокислотную последовательность: SWLSKTAKKLENSAKKRISEGIAIAIQGGPR [Martemyanov K.A., Shirin A.S., Gudkov А.Т. Synthesis, cloning and expression of genes for antibacterialpeptides: cecropin, magainin, and bombinin // Biotechnology letters. V. 18. № 12. 1996. P. 1357-1362].
Сокультивацию листовых эксплантов каланхоэ с агробактериями (процесс трансформации) предпочтительно осуществляют в течение 48±5 часов при 18 - 24±2°С. При этом для регенерации используют питательную среду МС, содержащую регуляторы роста 1 мг/л 6-бензиламинопурин (БАП), 0,1 мг/л нафтилуксусную кислоту (НУК) и 30 г/л бананового порошка (Banana powder, "Sigma") (БП).
Инфильтрацию семян каланхоэ агробактериями (процесс трансформации) предпочтительно осуществляют в условиях вакуума (-0,1)-(-1,0) атм, в течение 5±1 мин при 24±2°С. При этом для проращивания семян используют среду МС, содержащую тикарциллин (500 или 250 мг/мл) (Duchefa Biochemien, Германия) (Tr) и банановый порошок (30 мг/л) (Banana powder, "Sigma", США) (БП).
Прямой поиск трансгенных растений каланхоэ, синтезирующих антимикробный пептид цекропин Р1, проводят способом вестерн-блот анализа.
Выбирают, например, 3 группы (30 растений), показавшие наибольшую интенсивность положительного сигнала.
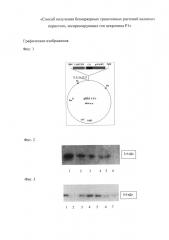
На Фиг. 1 представлена схема плазмиды рВМ-CP1. CaMV 35S - промотор 35S РНК вируса мозаики цветной капусты; pACaMV - сигнал полиаденилирования вируса мозаики цветной капусты; СР1 - ген цекропина P1; KmR - ген устойчивости к антибиотику канамицину для поддержания конструкции в бактериях (не входит в состав Т-элемента и не переносится в растения); oriV - начало репликации; LB, RB - левая и правая границы Т-ДНК; ColE1 - начало репликации плазмиды ColE1; R, K, Sm, В, SI - сайты рестрикции EcoRI, KpnI, SmaI, BamHI, SalI.
На Фиг. 2 - результаты Вестерн-блот анализа синтетического препарата цекропина Р1. Дорожки: 1 - 100 нг; 2 - 50 нг; 3 - 30 нг; 4 - 15 нг; 5 - 10 нг; 6 - 2 нг.
На Фиг. 3 - результаты Вестерн-блот анализа растений каланхоэ: 1 - синтетический цекропин Р1 мол. масса 3.4 кДа, (10 нг); 2 - экстракт нетрансформированного растения; 3-7 - экстракты трансформированных растений (линии 1-5).
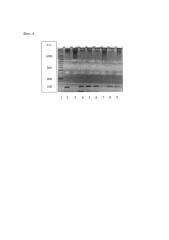
На Фиг. 4 - результаты ПЦР ДНК трансгенных растений методом электрофореза. 1 - ДНК маркера молекулярного веса (GeneRuler 100 bp, Fermentas); 2 - ДНК безмаркерного вектора рВМ::СР1 (контроль +); 3, 7 - ДНК не трансформированных растений (контроль -); 4-6, 8, 9 - ДНК трансформированных растений (линии 1-5).
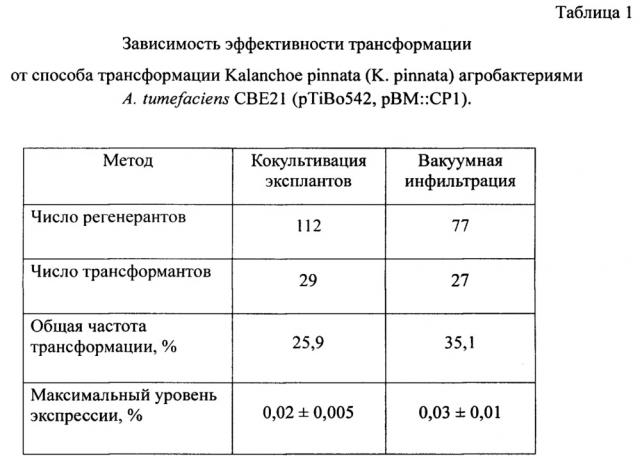
В таблице 1 показана зависимость эффективности трансформации от способа трансформации K. pinnata.
Возможность осуществления предлагаемого способа подтверждается представленными примерами, но не ограничивается ими.
Пример 1. Стерилизация растительного материала
Стерилизация листьев. Срезают молодые, полностью развернувшиеся листья каланхоэ, выращенные в теплице, дезинфицируют их, обработав 5% раствором гипохлорита натрия, содержащим 0,5% Твин 20, в течение 10 мин, затем ополаскивают трижды в стерильной дистиллированной воде. Разрезают листья на кусочки длиной 5 - 10 мм и помещают их на питательную среду МС [Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco cultures // Physiol. Plant. 1962. V. 15. P. 473-497], содержащую стандартный набор солей, 7 г/л агара, 30 г/л сахарозы (рН 5,8) и включающую в качестве регуляторов роста 6-бензиламинопурин 1 мг/л (6-БАП) и нафтилуксусную кислоту 0,1 мг/л (НУК), а также добавку - банановый порошок в количестве 30 г/л. Экспланты инкубируют при 22-24°С, 16-часовом световом дне и освещенности 2 клк. Придаточные побеги или регенеранты образуются из экспланта через 4 недели. Побеги отрезают и переносят в стеклянные пробирки со свежей средой МС. Черенкование растений проводят 1 раз в месяц. Для этого растение каланхоэ высотой 15-20 см делят на 4 части, оставляя на стебле 1-2 листа с междоузлиями, и рассаживают в пробирки.
Стерилизация семян. Семена перед проведением трансформации стерилизуют 1,5 мин в 70%-ном этаноле, затем 2 мин в 1%-ном растворе гипохлорита натрия и промывают 3 раза по 10 мин в стерильной дистиллированной воде. Семена переносят на среду МС и прекультивируют 48 часов при температуре 22-24°С, 16-часовом дне и освещенности 2 клк. Для эксперимента берут 100-500 семян на одну чашку Петри.
Пример 2. Получение культуры агробактерий A. tumefaciens СВЕ21, несущих безмаркерную конструкцию рВМ::СР1.
Для генетической трансформации используют клетки агробактерий А. tumefaciens СВЕ21 (pTiBo542), несущих вектор рВМ::СР1 с геном антимикробного пептида цекропина Р1. Для индукции vir-функции штамм агробактерий предварительно индуцируют ацетосирингоном. Для этого ночную культуру бактерий выращивают на качалке (150 об/мин) при 26°С в жидкой среде YEP (г/л): бакто-триптон - 10, бакто-дрожжевой экстракт - 10, NaCl - 0,5, рН 7,0, с добавлением 50 мкг/мл канамицина и 15 мкг/мл рифампицина. Перед инокуляцией эксплантов суспензию клеток центрифугируют при 6000 g в течение 5 минут. Суспендированный осадок промывают в 50 мл жидкой среды МС, содержащей 12,5 мМ фосфорнокислый натрий, рН 5,5, до оптической плотности OD600 = 0,05.
После 5 часов культивирования в клеточную суспензию добавляют ацетосирингон 100 мкМ [Schafer W., Gorz A., Kahl G. T-DNA integration and expression in a monocot crop plant afte induction of Agrobacterium. // Nature. 1987. V. 327. № 6122. P. 529-532] и продолжают культивировать в течение 12-18 часов. После этого агробактериальную культуру используют для трансформации.
Пример 3. Получение культуры агробактерий A. tumafaciens GV3101(pMP90RK), несущих безмаркерную конструкцию рВМ::СР1.
Получение культуры агробактерий A. tumafaciens GV3101(pMP90RK), несущих безмаркерную конструкцию рВМ::СР1 проводят по методу, описанному в примере 2.
Пример 4. Получение культуры агробактерий A. tumafaciens LBA4404 (pAL4404), несущих безмаркерную конструкцию рВМ::СР1.
Получение культуры агробактерий A. tumafaciens LBA4404 (pAL4404), несущих безмаркерную конструкцию рВМ::СР1 проводят по методу, описанному в примере 2.
Пример 5. Трансформация листовых эксплантов с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens СВЕ21 (pTiBo542, рВМ-CP1).
Co стерильных 3-4-х недельных растений, за два дня до трансформации срезают молодые листья, обрезают у них кромку и центральную жилку. Затем листья нарезают на небольшие кусочки размером 0.5×0.5 см2, которые раскладывают на поверхности твердой среды МС, содержащей 1 мг/л БАП, 0,1 мг/л НУК и 30 г/л БП. Инкубацию проводят при температуре 22-24°С и 16-часовом световом дне в течение 48 часов. Затем экспланты переносят в суспензию агробактерий Agrobacterium tumefaciens A. tumefaciens СВЕ21 (pTiBo542, рВМ-CP1) на 20 минут. После этого экспланты раскладывают на чашки со средой МС с 1 мг/л БАП, 0,1 мг/л НУК и 30 г/л БП на 48 часов. Полученные экспланты переносят в чашки Петри с твердой средой МС, содержащей 1 мг/л БАП, 0,1 мг/л НУК, 30 г/л БП, 500 мг/л тиракциллина для эиминации агробактерий. Регенерация побегов начинается через 3 недели культивирования трансформированных эксплантов.
Образовавшиеся побеги отделяют от исходной ткани эксплантов и переносят для дальнейшего роста на среду с солей МС и с уменьшенной концентрацией тиракциллина (250 мг/л). Укоренение протекает в течение 2-3 недель. Полученные укорененные растения используют для дальнейшего молекулярно-генетического анализа.
Пример 6. Трансформация листовых эксплантов с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens GV3101(pMP90RK, рВМ-CP1).
Трансформацию листовых эксплантов с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens GV3101(pMP90RK, рВМ-CP1) проводят по методу, описанному в примере 5.
Пример 7. Трансформация листовых эксплантов с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens LBA4404 (pAL4404, рВМ-CP1).
Трансформация листовых эксплантов с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens LBA4404 (pAL4404, рВМ-CP1) проводят по методу, описанному в примере 5.
Пример 8. Трансформация семян с помощью агробактерий A. tumefaciens СВЕ21 (pTiBo542, рВМ::СР1).
Стерильные семена, предварительно прекультивированные 48 часа на среде МС, погружают в колбу с суспензией агробактерий A. tumefaciens СВЕ21 (pTiBo542, рВМ::СР1) (109 кл/мл) (100 мл). Колбу с семенами помещают в вакуумный эксикатор и выдерживают 5 мин при отрицательном давлении - 0,8 атм. После прерывания вакуума семена перекладывают на стерильную фильтровальную бумагу для удаления избытка влаги и переносят на агаризованную среду МС. Через двое суток семена перекладывают на свежую среду МС, содержащую 500 мг/л антибиотика тикарциллина (Tr) и 30 г/л бананового порошка (БП). Семена проращивают 4 недели до длины проростков 3-5 см и используют для анализа. Дальнейшее культивирование растений in vitro проводят на среде МС с добавлением Tr 250 мг/л. Для получения семян растения пересаживают в теплицу.
Пример 9. Трансформация семян с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens GV3101 (pMP90RK, рВМ-CP1).
Трансформацию семян с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens GV3101(pMP90RK, рВМ-CP1) проводят по методу, описанному в примере 8.
Пример 10. Трансформация семян с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens LBA4404 (pAL4404, рВМ-CP1).
Трансформация семян с помощью агробактерий Agrobacterium tumefaciens A. tumefaciens LBA4404 (pAL4404, рВМ-CP1) проводят по методу, описанному в примере 8.
Пример 11. Калибровка синтетического цекропина Р1.
Для количественного определения цекропина Р1, экспрессируемого растениями проводят калибровку коммерческого препарата цекропина P1 (Sigma, США). Для вестерн-блот анализа берут различное количество пептида, разведенного в воде: 100 нг, 50 нг, 30 нг, 15 нг, 10 нг, 2 нг.
Пример 12. Вестерн-блот анализ растений
Для поиска трасформированных растений берут по одному листовому экспланту у каждого из регенерировавших или выросших из семян после генетической трансформации проростков каланхоэ перистого. Всего анализируют 500 растений. Листовые экспланты от каждого отдельного побега объединяют в группы по 10 эксплантов в одной группе и используют для приготовления исходных тестируемых образцов растительного экстракта. Все 10 листовых эксплантов помещают в одну пробирку. Всего 50 групп - 50 пробирок.
Далее проводят экстракцию белка из растительной ткани, выравнивают пробы по содержанию общего белкового продукта (около 100 мкг общего белка в каждой пробе), полученные пробы используют для электрофоретического разделения и проведения вестерн-блот анализа.
Проведение вестерн-блот анализа осуществляли по следующей схеме:
1. Проводят экстракцию белков: 1 г растительной ткани растирают в жидком азоте, добавляют равное количество воды, нагретой до 70°С и ставят в термостат на 1 час. Затем центрифугируют при 12000 об/мин. К супернатанту добавляют трихлоруксусную кислоту (ТХУ) до 5% и оставляют на 10 мин при 4°С. Снова центрифугируют при 12000 об/мин, осадок трижды промывают холодным ацетоном и растворяют в 200 мкл 0,1 н. NaOH. С полученным раствором белка проводят электрофорез в 12% -ном полиакриламидном геле (ПААГ). На элекрофорез берут 10 мкл раствора пептида.
2. Для переноса белков используют PVDF мембрану ("Porablot", Macherey -Nagel, Германия).
3. Электроперенос проводят в течение 2 часов при 200 мА или ночь при 20 мА в буфере (25 М Трис-HCl, 250 мМ глицин) с добавлением 20% метанола.
4. Затем мембрану инкубируют в 5%-ном растворе обезжиренного молока (1 г на 20 мл буфера TBS-т) при умеренном покачивании в течение 1 ч при комнатной температуре и промывают в буфере TBS-t.
5. После этого мембрану инкубируют с антителами к цекропину Р1, затем со вторичными кроличьими поликлональными антителами, коньюгированными с пероксидазой хрена.
6. Иммунодетекцию проводят с помощью набора реактивов ECL ("Amersham", Великобритания).
По результату первичного вестерн-блот анализа 50 исходных групп растений выбирают, например, 3 группы (30 растений), показавшие наибольшую интенсивность положительного сигнала. Группы, которые дали невысокую интенсивность сигнала, в работе не используются, как и группы, полностью отрицательные по результатам иммуноблоттинга.
Три группы используют для идентификации наиболее продуктивных индивидуальных трансгенных растений. Для этого растения отобранных групп - всего 30 растений - пересаживают в отдельные пробирки, подращивают в течение 3 недель и проводят повторный вестерн-блот анализ экстрактов из листьев каждого индивидуального растения.
На Фиг. 2 представлены результаты калибровочного вестерн-блот анализа синтетического препарата цекропина Р1. Дорожки: 1 - 100 нг; 2 - 50 нг; 3 - 30 нг; 4 - 15 нг; 5 - 10 нг; 6 - 2 нг.
На Фиг. 3 показаны результаты вестерн-блот анализа экстрактов пяти растений (линии 1-5), экспрессирующих пептид с молекулярной массой 3.4 кДа, соответствующей зрелой форме цекропина Р1. Дорожки: 1 - синтетический цекропин Р1, мол. масса 3.4 кДа (10 нг); 2 - экстракт нетрансформированного растения; 3-7 - экстракты трансформированных растений (линии 1-5).
Сравнивая с калибровочным анализом синтетического пептида (Фиг. 2), отмечают, что уровень синтеза цекропина Р1 в растениях линий 2 и 3 соответствует примерно 15 нг, что соответствует уровню экспрессии в 0,02% от общего растворимого белка (ОРБ).
Присутствие гена СР1 в трансгенных растениях каланхоэ подтверждают методом полимеразной цепной реакцией (ПЦР) с праймерами, специфичными для гена СР1. При разделении продуктов ПЦР ДНК трансгенных растений методом электрофореза идентифицируют наличие полосы 102 п.н., соответствующей гену СР1 (дорожки 4-6, 8, 9) (Фиг. 4).
Данные, представленные в Таблице 1, показывают, что эффективность трансформации зависит от способа трансформации. Трансформация методом вакуумной агроинфильтрации семян выше (35,1%), чем способом кокультивации листовых эксплантов агробактериями (25,9%), при этом максимальный уровень экспрессии составляет 0,03% и 0,02% от ОРБ соответственно.
Предлагаемый способ получения безмаркерных растений Kalanchoe pinnata, экспрессирующих ген антимикробного пептида цекропина Р1, позволяет получить трансгенные растения с высоким уровнем экспрессии гена цекропина Р1, сократить сроки получения и отбора трансгенных безмаркерных растений каланхоэ до 1-2 месяцев, по сравнению с другими способами получения безмаркерных растений - 4-8 месяцев [Truesdale M.R., Toldi О., Scott P. The effect of elevated concentrations of fructose 2.6 bisphosphate on carbon metabolism during deacidification in the crassulacean acid metabolism plant Kalanchoe daigremontiana // Plant physiology. 1999. V. 121. P. 957-964], за счет прямого органогенеза (регенерация побегов не через стадию каллуса, а непосредственно из эксплантов и прорастание семян), за счет использования укороченной на 2600 п.н. конструкции (вектор рВМ-CP1), не содержащей маркерного гена неомицинфосфотрансферазы II, предполагающий селекцию на антибиотике канамицине, когда растение подвергается дополнительному стрессу, а также быстрому вестерн-блот анализу на продукт гена СР1, независимо от возраста растения, способ обеспечивает экологическую и биологическую безопасность трансгенных растений, экспрессирующих ген цекропина Р1 без дополнительных селективных генов.
1. Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1, включающий генетическую трансформацию растений конструкцией рВМ-CP1 посредством вакуумной инфильтрации семян агробактериями вида Agrobacterium tumafaciens или кокультивацией листовых эксплантов с агробактериями, элиминацию агробактерий, отбор полученных трансгенных растений, отличающийся тем, что агробактерии перед трансформацией обрабатывают индуктором vir-области ацетосирингиноном, экспланты инкубируют 48 часов на среде МС с регуляторами роста и добавлением бананового» порошка до трансформации и после трансформации, элиминацию агробактерий осуществляют тикарциллином, трансгенные растения получают посредством регенерации побегов не через стадию каллюса, а непосредственно из эксплантов и прорастание семян, а также определяют присутствие и количественное содержание пептида цекропина Р1 вестерн-блот анализом экстрактов проростков каланхоэ перистого, при этом для количественного определения синтезируемого пептида цекропина Р1 в растениях проводят сравнение калибровочных данных с различными количествами синтетического цекропина Р1 с данными вестерн-блот анализа экстрактов проростков каланхоэ перистого.
2. Способ по п. 1, отличающийся тем, что в качестве штамма бактерии вида Agrobacterium tumafaciens используют штамм, выбранный из ряда A. tumefaciens СВЕ21, A. tumafaciens GV3101(pMP90RK), A. tumafaciens LBA4404 (pAL4404), содержащий безмаркерную рекомбинантную плазмиду рВМ с геном антимикробного пептида цекропина Р1.
3. Способ по п. 1, отличающийся тем, что агробактерии активизируют в питательной среде МС ацетосирингоном 100 мкМ.
4. Способ по п. 1, отличающийся тем, что семена растений Kalanchoe pinnata и листовые экспланты прекультивируют 48 часов на питательной среде МС с банановым порошком (30 г/л) до трансформации и после нее.
5. Способ по п. 1, отличающийся тем, что семена растений Kalanchoe pinnata подвергают обработке вакуумом в течение 1-15 мин.
6. Способ по п. 1, отличающийся тем, что для элиминации агробактерий используют антибиотик тикарциллин в количестве 250-500 мг/л.
7. Способ по п. 1, отличающийся тем, что для количественного определения синтезируемого пептида цекропина Р1 в растениях ставят калибровочные эксперименты вестерн-блот анализа с разными количествами синтетического препарата цекропина Р1, что позволяет определить уровень экспрессии гена СР1 в индивидуальных трансгенных растениях.
8. Способ по п. 1, отличающийся тем, что для приготовления экстрактов экспериментальных растений каланхоэ используют способ осаждения пептида 5%-ной ТХУ и растворения в 0.1 н. NaOH.
9. Способ по п. 1, отличающийся тем, что уровень экспрессии цекропина Р1 в полученных трансгенных растениях каланхоэ составлял 0,02-0,03% от общего растворимого белка клетки.