Сорбционная композитная мембрана и биосепарирующее устройство для выделения днк
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложена сорбционная композитная мембрана и биосепарирующее устройство для выделения ДНК. Указанная мембрана включает пористую подложку и сорбционное покрытие, при этом пористая подложка представляет собой микрофильтрационную полимерную мембрану с пористостью 0,2-0,65 мкм. Подложека выполнена из полиамида, полиэфирсульфона или поливинилиденфторида. Сорбционное покрытие подложки выполнено из полианилина, а массовая доля сорбционного покрытия составляет 10-25%. Биосепарирующее устройство представляет собой пластиковый картридж, вставленный в микропробирку. Пластиковый картридж содержит вышеуказанную сорбционную композитную мембрану, скрученную в рулон с плотностью упаковки 24-48 см2/см3. Изобретения обеспечивают сокращение продолжительности выделения ДНК при высокой эффективности. 2 н. и 1 з.п. ф-лы, 1 ил.
Реферат
Изобретение относится к аналитической химии в области молекулярной биологии и фармакологической биотехнологии и может найти широкое применение в современной медицинской диагностике. Эффективность современных методов медицинской диагностики в значительной мере определяется возможностью быстро выделить чистый препарат биополимера (нуклеиновой кислоты или соответствующего белкового маркера), не нарушая его вторичную или третичную структуру, из клинических образцов сложного состава (таких как кровь, плазма, моча, мазок, мокрота и т.д.).
Как правило, способы разделения и выделения биополимеров, в частности, ДНК основаны на различной растворимости нуклеиновых кислот, белков и полисахаридов. Несмотря на их эффективность, большинство методов разделения многостадийны, трудоемки и часто сопровождаются потерями выделяемого компонента. Это является следствием того, что такие методы основываются на концепции «улавливания» и «удерживания» целевого биополимера сорбентом из смеси на первом этапе разделения с последующей отмывкой от примесей и элюцией целевого компонента из сорбционного материала на последующих этапах.
На практике широко распространены различные микроколоночные методы биосепарации, основанные на использовании спин-колонок или картриджей, пропускание через которые мобильной фазы (т.е. элюента) осуществляют за счет воздействия центробежной силы в центрифуге или под действием давления с использованием различных насосов. Такие микроколонки содержат немодифицированные кремнеземы, модифицированные кремнеземы (с использованием низкомолекулярных и высокомолекулярных модификаторов), синтетические мембраны, полимерные монолиты, полимерные или стеклянные капилляры и т.д. В отличие от традиционной колоночной хроматографии, такой подход позволяет относительно быстро, с использованием незначительных количеств сорбционного материала, очистить и выделить необходимую ДНК.
Ряд методик выделения ДНК основан на предварительном концентрировании клеток микроорганизмов из биологических образцов, в частности, используются следующие методики: фильтрация образца (Icuta, K., Maruo, S., Fujisawa, Т., Yamada, А. Micro Concentrator with OptoSense Micro Reactor for Biochemical IC Chip Family - 3D Composite Structure and Experimental Verification Proc. of 12th IEEE International Conference on Micro Electro Mechanical Systems (MEMS'99), Orlando, 1999: p. 376-381), электрокинетическая фокусировка (C.R. Cabrera, P. Yager, Continuous concentration of bacteria in a microfluidic flow cell using electrokinetic techniques. Electrophoresis, 2001, v. 22, p. 355-362), микродиализ (F. Xiang, Y. Lin, J. Wen, D.W. Matson, R.D. Smith. An integrated microfabricated device for dual microdialysis and on-line ESI-ion trap mass spectrometry for analysis of complex biological samples. Anal Chem., 1999, v. 71, p. 1485-1490), аффинная хроматография с целью концентрирования клеток и последующей твердофазной экстракции НК (C. Yu, M.H. Davey, F. Svec, J.M. Frechet, Monolithic porous polymer for on-chip solid-phase extraction and preconcentration prepared by photoinitiated in situ polymerization within a microfluidic device. Anal Chem., 2001, v. 73, p. 5088-5096).
В качестве полупроницаемых мембран могут быть использованы разнообразнейшие материалы из боросиликатного стекла, целлюлозы, политетрафторэтилена, поливинилидендифторида и пр.
Наиболее предпочтительными являются полупроницаемые мембраны на основе поливинилидендифторида. Благодаря гидрофильности, химической инертности, механической прочности, легкости в обработке и отсутствию ингибирующего действия на полимерную цепную реакцию (ПЦР), данный тип фильтров может быть использован для осуществления механического концентрирования и химического лизиса клеток в формате миниатюрного закрытого устройства (микрофлюидного модуля).
Важно отметить, что все перечисленные материалы используются именно в качестве фильтров, позволяющих механически удержать целевой биополимер при пропускании через мембрану образца. Основным недостатком таких методик лизиса клеток и вирусных частиц является то, что в результате данной процедуры наряду с целевыми нуклеиновыми кислотами фильтром удерживается множество веществ, способных ингибировать ПЦР. В некоторых случаях процесс выделения и очистки ДНК основан на способности ДНК обратимо адсорбироваться на поверхности мембраны. При этом необходимо дополнительно осуществлять отмывку адсорбированной ДНК от примесей и последующую элюцию целевого продукта подходящим буферным раствором, что приводит к существенным потерям выделяемого компонента биологической смеси.
Поэтому с практической точки зрения более привлекательной представляется одностадийная схема выделения целевого продукта. При этом выделяемый (а заодно и очищаемый) биополимер после контакта смеси с сорбентом остается в несвязанном виде, в то время как нежелательные примеси удерживаются сорбентом. Оказалось, что для некоторых полимерных материалов, в частности, для полианилинов и фторполимеров, такой подход реализуется при одностадийном отделении нуклеиновых кислот от белков. При этом компоненты фракции нуклеиновых кислот (однонитевые и двунитевые ДНК, РНК) не удерживается или слабо удерживаются поверхностью сорбента, в то время как белки обратимо сорбируются. При этом сохраняется возможность последовательно десорбировать компоненты удерживаемой белковой фракции в зависимости от заряда белковой макромолекулы.
Получение таких сорбентов требует применения сложной трудоемкой процедуры отмывки, кроме того, они не всегда оказываются эффективными при выделении и очистке нуклеиновых кислот из некоторых «сложных» биологических образцов, таких как кровь, ткани растений и т.д., содержащих наряду с белками мощные ингибиторы ПЦР, такие как гем и хлорофиллы, или для разделения ДНК и РНК, однонитевых ДНК от двунитевых ДНК и т.д.
Напротив, использование полимерных мембран в качестве подложек при синтезе композиционных полианилинсодержащих сорбентов позволяет реализовать несколько преимуществ по сравнению с технологиями получения композиционных дисперсных носителей: во-первых, в настоящем изобретении полимерная мембрана используется именно в качестве носителя, имеющего требуемую химическую структуру поверхностного слоя, необходимую для формирования равномерно распределенного полианилинового покрытия в составе сорбционной композитной мембраны, в результате чего удается осуществить более технологичный способ получения композиционного сорбента (по сравнению с получением дисперсных или капиллярных сорбентов); во-вторых, модифицированная полианилиновым покрытием мембрана используется в составе биосепарирующего элемента в качестве селективного сорбента, но не в качестве фильтра.
Известен трехслойный мембранно-сорбционный элемент по патенту РФ №2239490, опубл. в 2004 г., предназначенный для обработки жидких сред с целью фильтрации, детоксикации и т.д. В соответствии с заявленным решением мембранно-сорбционный элемент состоит из двух микрофильтрационных мембран, между которыми размещен слой сорбционной мембраны, имеющий каркас с ячейками, заполненными сорбирующим материалом различной природы.
Существенным недостатком данного мембранно-сорбционного элемента является технологическая сложность его изготовления, связанная с формированием внутреннего сорбционного слоя из сыпучего сорбента и мембранной конструкции, а также необходимости герметичной спайки внешних мембран. Кроме того, серьезным недостатком известного решения является высокая продолжительность выделения и очистки биологических жидкостей при его применении.
Наиболее близким техническим решением к предлагаемому изобретению в отношении сорбционной композитной мембраны служит композитная мембрана с фиксированной толщиной слоя полианилина, обладающая высокой электропроводностью и селективностью (Патент РФ 2481885 опубл. в 2013). Недостатком, препятствующим достижению обозначенного ниже технического результата, является присутствие в композите эфирных групп и остаточных сульфогрупп, обусловленное способом получения вышеуказанной мембраны, что значительно снижает эффективность возможного применения получаемых мембран при выделении нуклеиновых кислот, т.к. присутствие эфирных групп определяет рост неспецифической сорбции нуклеиновых кислот (Е.Yu. Yagudaeva, D.-J. Liaw, A.A. Ischenko, V.N. Bagratashvili, V.P. Zubov, A.I. Prostyakova, D.Yu. Ryazantsev, A.P. Sviridov, D.V. Kapustin. New polyamide-containing sorbents for one-step isolation of DNA. J Mater Sci (2014) 49:3491-3496), а наличие остаточных сульфогрупп может являться причиной потери нуклеиновыми кислотами нативных свойств при контакте с поверхностью такой мембраны вследствие апуринизации (Kapustin D., Prostyakova A., Bryk Ya., Yagudaeva E., Zubov V. New Composite Materials Modified with Nano-Layers of Functionalized Polymers for Bioanalysis and Medical Diagnostics. In: Nanocomposites and polymers with analytical methods. In: Nanocomposites and polymers with analytical methods / Cuppoletti J. (Ed.) - Croatia: Intech, 2011. ISBN: 978-953-307-352-1, p.p. 83-106).
Известны устройства, в которых для проведения лизиса и выделения нуклеиновых кислот из получаемых лизатов, используется одна или несколько пористых мембран, через которые последовательно в автоматическом режиме пропускают образец. В одном из таких устройств, запатентованных фирмой Millipore Corporation, для выделения нуклеиновых кислот из клеток или вирусных частиц (Filter device for the isolation of a nucleic acid, Заявка ЕР 1873242, опубл. в 2008 г.) на первой пористой мембране, изготовленной из полисахарида или полиэфирсульфона, выполняется лизис клеток; полученный лизат поступает на стекловолоконный фильтр для последующей очистки и элюции нуклеиновых кислот. Фильтрующие мембраны соединены системой клапанов. Устройство может быть как одноразового, так и многоразового использования. Для одновременной обработки нескольких образцов несколько фильтрующих устройств могут быть собраны в кассету. Очевидным недостатком такого устройства является необходимость в использовании двух различных типов мембран, причем выделение нуклеиновых кислот проводится в результате многостадийной процедуры с использованием набора элюентов.
Известно устройство для молекулярной сепарации и экстракции нуклеиновых кислот (патент US 7943393 опубл. в 2005 г.), в которых используют спин-колонки, например, в виде полипропиленовой трубки с одним или несколькими слоями адсорбента, такого как стекловолокна, стеклянные шарики, полимерные гранулы, частицы кремнезема, модифицированные силанами или полимерами и т.д. В этих патентах представлена реализация классического многостадийного принципа сепарации биомолекул на основе спин-колонок (картриджей), содержащих сорбционный материал, обратимо удерживающий целевой сорбат.
Аналогичный принцип положен в основу ряда более сложных технических устройств пробоподготовки. Так, запатентованы колонки (Заявка KR 100286896, опубл. в 2001 г.) со стеклянным микроволокном и методики очистки на этих колонках плазмидной ДНК, выделение ее из агарозного и полиакриламидного гелей, а также очистка РНК, изотопов, продуктов полимеризационной цепной реакции (ПЦР). Колонки содержат слой боросиликатного стеклянного микроволокна и гидрохлорид гуанидина. Дезинтеграция клеток образца осуществляется за счет содержащегося в колонках гидрохлорида гуанидина, который, являясь хаотропным веществом, оказывает специфическое воздействие на живые клетки микроорганизмов: разрушает мембраны, рибосомы и другие клеточные структуры, обуславливая тем самым дезинтеграцию клеток и переход ДНК в свободную форму. Кроме того, он вызывает быструю денатурацию всех клеточных белков, в том числе нуклеаз. При этом в обработанных клетках удерживается высокомолекулярная геномная ДНК, не только доступная для неспецифических (таких как, например, микрококковая нуклеаза) и специфических (рестриктазы) нуклеаз, но и способная служить матрицей в полимеразной цепной реакции (ПЦР). Освобожденная ДНК сорбируется на пористый слой боросиликатного стеклянного микроволокна.
Данный метод является вариантом традиционного способа очистки ДНК: дезинтеграция клеток хаотропными агентами и адсорбция ДНК на сорбенте. Данный метод очистки ДНК достаточно прост, дает хороший выход ДНК и не требует дальнейших процедур по очистке. Однако имеется и ряд недостатков. Во-первых, степень дезинтеграции клеток не достаточно высокая, и данный метод эффективен только при использовании довольно высокого исходного титра микроорганизмов или при проведении предварительного концентрирования и лизиса клеток. Т.е., метод не достаточно эффективен при работе с разбавленными образцами. Во-вторых, метод является относительно дорогостоящим для широкомасштабного использования.
Наиболее близким техническим решением к заявляемому в отношении биосепарирующего устройства для выделения нуклеиновых кислот является устройство по международной заявке WO/2005/012521, опубл. в 2005 г. фирмы Inivitrogen «Nucleic acid isolation» по Corp., США. В соответствии с решением прототипа устройство состоит из картриджа, включающего пробирку, соединенную с фильтрующим элементом и далее с колонкой для очистки нуклеиновых кислот, при этом фильтрующий элемент содержит несколько слоев фильтров, а колонка включает носитель, способный связывать нуклеиновые кислоты, например носитель с переменным зарядом. Манипуляции с образцом осуществляются с помощью шприца или насоса. Недостатком данного метода также является наряду с лизисом клеток, разбавлением сыворотки крови и т.п. манипуляций, необходимость проведения многостадийной процедуры выделения нуклеиновые кислоты. Причиной, препятствующей достижению обозначенного ниже технического результата, является отсутствие специального селективного сорбционного слоя в фильтрующем элементе, а также технологическая громоздкость заявленного решения, приводящая к продолжительности выделения целевого продукта.
Суть изобретения заключается в следующем.
Единой технической задачей заявляемого изобретения является разработка сорбционной композитной полимерной мембраны для выделения ДНК и устройства на ее основе, обеспечивающего выделение целевого продукта в одну стадию.
Единым техническим результатом заявляемого изобретения является сокращение продолжительности выделения ДНК при высокой эффективности используемой сорбционной композитной полимерной мембраны и устройства, содержащего данную мембрану.
Технический результат в отношении заявляемой сорбционной композитной мембраны для выделения ДНК достигается за счет введения в структуру сорбционной композитной мембраны пористой подложки и сорбционного покрытия подложки, что пористая подложка представляет собой микрофильтрационную полимерную мембрану со средним размером пор 0,2-0,65 мкм, выполненную из полиамида, полиэфирсульфона или поливинилиденфторида, сорбционное покрытие выполнено из полианилина, а массовая доля сорбционного покрытия из полианилина в составе сорбционной композитной мембраны составляет 10-25%.
Наиболее эффективным вариантом осуществления изобретения является выполнение сорбционной композитной мембраны для выделения ДНК со средним размером пор 0,45 мкм.
Технический результат в отношении биосепарирующего устройства для выделения ДНК достигается за счет включения в конструкцию устройства пластикового картриджа, вставленного в микропробирку, при этом пластиковый картридж содержит вышеописанную сорбционную композитную мембрану, скрученную в рулон с плотностью упаковки 25-60 см2/см3.
Дополнительные исследования, проведенные заявителем, показали, что заявляемая композитная мембрана выполняет роль селективного сорбента, а выделение ДНК осуществляется не за счет фильтрации, а за счет селективной сорбции компонентов разделяемой биологической смеси, в частности, ДНК, протекающей на поверхности вышеупомянутой мембраны.
Кроме того, достижение заявленного технического результата обусловлено применением полианилина для модифицирования поверхности полимерной мембраны за счет следующего фактора. Преимущество полианилинов перед другими полимерами заключается в том, что макромолекула полианилина содержит как гидрофобные участки, так и заряженные азотсодержащие фрагменты. При этом молекула полианилина характеризуется наличием системы полисопряжения, что определяет рН-чувствительность полианилиновых покрытий. Благодаря этому структура молекулы полианилина подвержена обратимым изменениям в зависимости от рН среды, что дает возможность обратимо изменять сорбционные свойства полианилиновых покрытий. В частности, это свойство проявляется в способности полианилиновых покрытий разделять компоненты смесей белков и/или пептидов в зависимости от значений pI сорбатов, изменяя рН среды (элюента). Высокая селективность и гидрофильность полианилиновых покрытий в условиях разделения биополимеров на определенных этапах разделения позволяет не использовать элюент (мобильную фазу) для эффективного разделения компонентов используемой смеси (т.е. для эффективного разделения достаточно растворителя, присутствующего в пробе). В результате изменяются сорбционные свойства поверхности мембраны за счет образования устойчивого равномерного биосовместимого полимерного покрытия на поверхности мембраны (включая поверхность пор), обеспечивающего высокую селективность в процессах выделения нуклеиновых кислот из сложных биологических смесей в одну стадию с одновременной очисткой нуклеиновых кислот от примесей. При пропускании ДНК-содержащего лизата через слой модифицированной указанным способом мембраны достигается соотношение интенсивностей поглощения при 260 нм и 280 нм (А260/280) получаемого элюата от 1,7 до 1,85.
Изобретение осуществляют следующим образом.
Для получения сорбционной композитной мембраны проводят матричную окислительную полимеризацию анилина на поверхности микрофильтрационной полимерной мембраны при комнатной температуре в присутствии персульфата аммония в качестве окислителя. Затем полученную сорбционную композитную мембрану промывают спиртом, дистиллированной водой до обесцвечивания фильтрата, а потом деионизованной водой до исчезновения оптического поглощения в фильтратах в диапазоне длин волн от 200 до 700 нм и сушат в вакууме при комнатной температуре до стабилизации веса.
При необходимости осуществляют модификацию (увеличение массовой доли сорбционного покрытия) микрофильтрационной полимерной мембраны полианилином следующим образом. Лист мембраны помещают в стеклянную или пластиковую ванну с ровным дном и добавляют половину подготовленного непосредственно перед модификацией водного раствора анилина и окислителя. Раствор готовят, отбирая реагенты из тары производителя в стеклянный лабораторный стакан с помощью механических дозаторов с одноразовыми наконечниками. Полученную смесь инкубируют 15 мин при постоянном перемешивании при температуре 25°С. Затем к реакционной смеси добавляют необходимый объем приготовленного непосредственно перед модификацией водного раствора персульфата аммония. Затем лист мембраны переносят во вторую ванну с раствором анилина и соляной кислоты (вторая половина объема рабочего раствора). Полимеризацию ведут при комнатной температуре до приобретения мембраной темно-синего цвета. Затем лист переносят в чистую ванну с дистиллированной водой и отмывают поверхность мембраны от несвязанных частиц анилина при постоянном перемешивании с периодической сменой дистиллированной воды в ванне, контролируя степень отмывки путем измерения поглощения промывочной воды на спектрофотометре. Отмывку продолжают до отсутствия поглощения отмывочной воды в УФ-области. Отмытую мембрану растягивают с помощью подходящих прищепок или иных устройств на деревянной рамке и высушивают до постоянной массы при комнатной температуре. Полученный лист сорбционной композитной мембраны хранят в плотно закрытой стеклянной или полиэтиленовой таре до дальнейшего использования или нарезают на единичные ленты размером 1×12 см2.
Для модифицирования отрезка мембраны площадью 100 см2 (одновременно с обеих сторон) одним слоем полианилина использовали 5,85 мл 37%-ной соляной кислоты и 2.095 мл анилина, смешанных в 210 мл воды, а также 4.56 г персульфата аммония.
Прирост массы образца модифицированной мембраны по сравнению с исходной мембраной составляет 10±0.1% (в среднем, 9,91%).
Единичный образец сорбционной композитной мембраны (площадь 12 см2) скручивают и помещают в пластиковый картридж. Картридж закрывают крышкой и упаковывают в стерильных условиях в плотную полиэтиленовую тару. Полученную сорбционную композитную мембрану используют в виде скрученной в рулон с плотностью упаковки 25-60 см2/см3 и помещенной в пластиковый катридж для одностадийного выделения (очистки) ДНК из сложных биологических смесей.
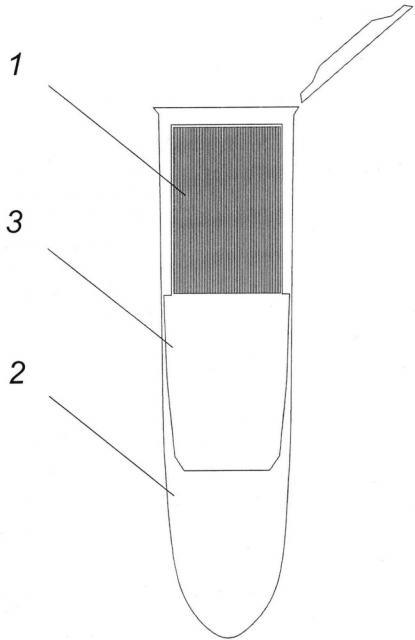
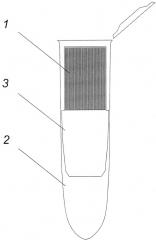
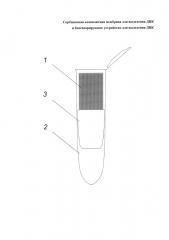
Заявляемое биосепарирующее устройство для выделения ДНК представлено на фиг. 1, где
1 - сорбционная композитная мембрана, скрученная в рулон
2 - микропробирка
3 - пластиковый картридж
Заявляемое биосепарирующее устройство для выделения ДНК работает следующим образом.
ДНК-содержащую смесь (например, бактериальный лизат, 50-100 мкл) помещают на предварительно смоченную деионизованной водой скрученную сорбционную композитную мембрану 1 с плотностью упаковки 25-60 см2/см3, помещенную в мембранный биосепарирующий элемент, представляющий собой пластиковый картридж 2 (6×25 мм), помещенный в микропробирку 3. При необходимости избыток воды удаляют. Затем пластиковый картридж 2 помещают в центрифугу центрифугируют в течение 30 с при скорости оборотов 2000 об/мин. Полученный раствор очищенной ДНК пригоден для различных биотехнологических применений, в первую очередь, для проведения ПЦР-анализа.
Для реализации изобретения используют следующие вещества и материалы.
В качестве пористой подложки использовали микрофильтрационные композиционные гидрофильные мембраны из полиамида, полиэфирсульфона и поливинилиденфторида.
В качестве реагентов для получения сорбционного покрытия и оценки его сорбционных свойств использовали анилин, персульфат аммония, ацетат натрия; изопропиловый спирт, хлороформ, гидроксид натрия, трис(гидроксиметил)аминометан (трис), этилендиаминтетрауксусную кислоту (ЭДТА), борную кислоту, агарозу, бромид этидиума, оранжевый Ж, глицерин, бычий сывороточный альбумин - все реагенты производства Sigma, Германия, а также соляную кислоту (ГОСТ 3118-77) производства ООО «Сигма Тек», Россия, водный аммиак (ГОСТ 24147-80) производства ЗАО «Химсервис», Россия, этиловый спирт 96%-ный (ГОСТ 5962-2013) производства ОАО «Медхимпром, Россия. Все реагенты и материалы - марки о.с.ч. или для ВЭЖХ-анализа, с чистотой от 96,5 до 99,5% - использовали без дополнительной очистки.
Деионизацию воды проводили с помощью установки Milli Q RG ultra pure water system (Millipore, США).
Тесты с использованием модельных микроорганизмов или клинических проб проводили на базе группы Молекулярной диагностики ИБХ РАН и НПФ «Генлаб» (Россия), соответственно, с использованием аппаратурной базы, наборов и реагентов и в соответствии с лабораторными протоколами указанных организаций.
Эффективность применения сорбционной композитной мембраны для выделения и очистки ДНК оценивали путем использования модельных смесей в заявленном биосепарирующем устройстве в виде пластикового картриджа, вставленного в микропробирку-приемник.
Для эксперимента использовали сорбционные композитные мембраны с массовой долей сорбционного покрытия из полианилина 10, 15, 25% соответственно и со средним размером пор, соответственно, 0,65; 0,45 и 0,2 мкм.
Выделение ДНК из клеточных культур (Е. coli) проводили следующим образом:
- к 50 мл клеточной суспензии (109 клеток/мл) добавляли 100 мкл буфера-1 (250 мкл 1М Трис HCl pH 8.0, 250 мкл 1М хлорида магния, 500 мкл Triton X 100, 5.48 г сахарозы, доводили объем до 50 мл деионизованной воды) и 20 мкл 3% водного раствора протеиназы К (полученного с использованием препарата протеиназы К, иммобилизованной на частицах полиэтиленгликоля - Максатазы), полученную смесь перемешивали на шейкере 5-10 с и инкубировали при 60°С в течение 10 мин;
- к смеси добавляли 100 мкл буфера-2 (5 мл 1М Трис-HCl pH 8,0, 0,5 мл 0,5М ЭДТА pH 8,0, 2 мл 5М хлорида натрия, 0.1 г додецилсульфата натрия и доводили объем до 50 мл деионизованной водой), перемешивали на шейкере 5-10 сек и повторно инкубировали при 60°С в течение 10 мин;
- смесь перемешивали на шейкере 10-15 сек и наносили на предварительно смоченные деионизованной водой поверхности мембраны по 50-100 мкл на картридж. Для смачивания на каждый картридж предварительно наносили по 250 мкл воды и центрифугировали 2 мин при 2000 об/мин;
- картриджи инкубировали не менее 2.5 мин, затем центрифугировали 30 сек при 2000 об/мин;
- полученные элюаты анализировали спектрофотометрически и после проведения электрофореза в 2% агарозном геле.
Соотношение интенсивностей поглощения при 260 нм и 280 нм (А260/280) получаемых элюатов составило 1,71; 1,85 и 1,82.
Для демонстрации эффекта обратимого удерживания белков в биосепарирующее устройство, содержащего сорбционную композитную мембрану скрученную в рулон с заданной плотностью, с помощью механического дозатора вносили 100 мкл раствора БСА (550 мкг) в ТЭ-буфере (pH 7,2). Картриджи инкубировали в течение 2,5 мин, затем центрифугировали 30 сек при 2000 об/мин. Затем полученный элюат переносили в пластиковую пробирку и анализировали спектрофотометрически, определяя по калибровочной кривой содержание белка в пробе. После этого на биосепарирующий элемент наносили 100 мкл разбавленной соляной кислоты (pH 4,0) и снова переносили полученный элюат и анализировали спектрофотометрически.
Анализ полученных данных свидетельствует о том, что белок, удерживаемый при нейтральных значения pH среды, практически полностью десорбируется с поверхности мембраны при понижении pH.
В результате проведенных экспериментов по выделению ДНК получены данные по выходу целевого вещества до 90-95% с продолжительностью всего технологического цикла от 4 до 5 мин при продолжительности стадии центрифугирования (собственно стадии выделения ДНК) - 30 сек.
Как видно из приведенных примеров, предлагаемое изобретение позволяет эффективно выделить в одну стадию ДНК. При этом ДНК не удерживается поверхностью созданной сорбционной композитной мембраны (исключается последующая стадия десорбции при ее выделении) и может быть выделена с поверхности этой же мембраны с помощью элюции подходящим буфером. Процесс предельно прост и одинаково удобен как для ручного, так и для автоматического исполнения.
Таким образом, предлагаемая сорбционная композитная мембрана для выделения ДНК и биосепарирующее устройство на ее основе является простым, экономически эффективным решением, позволяющим проводить экспресс-выделение и очистку как нуклеиновых кислот, так и белков, не требующим использования дорогих материалов в качестве носителя при получении композиционного сорбента.
Приведенные экспериментальные данные показывают перспективность нового материала - сорбционной композитной мембраны и биосепарирующего устройства на ее основе, применяемых для одностадийного выделения и очистки ДНК. Полученные новые мембранные сорбенты могут быть с успехом использованы в биотехнологии и медицинской диагностике, в частности, при упрощенной пробоподготовке при проведении ПЦР-анализа.
1. Сорбционная композитная мембрана для выделения ДНК, включающая пористую подложку и сорбционное покрытие, отличающаяся тем, что пористая подложка представляет собой микрофильтрационную полимерную мембрану с пористостью 0,2-0,65 мкм, выполненную из полиамида, полиэфирсульфона или поливинилиденфторида, сорбционное покрытие подложки выполнено из полианилина, при этом массовая доля сорбционного покрытия из полианилина в составе сорбционной композитной мембраны составляет 10-25%.
2. Сорбционная композитная мембрана для выделения ДНК по п. 1, отличающаяся тем, что предпочтительная пористость составляет 0,45 мкм.
3. Биосепарирующее устройство для выделения ДНК, представляющее собой пластиковый картридж, вставленный в микропробирку, при этом пластиковый картридж содержит сорбционную композитную мембрану по п. 1, скрученную в рулон с плотностью упаковки 24-48 см2/см3.