Комбинации и способы введения терапевтических средств и комбинированной терапии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака яичников у индивидуума. При этом лечение включает: a) первое лечение, включающее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и белок-носитель, и b) второе лечение, включающее лучевую терапию, где первое лечение проводят перед вторым лечением. Изобретение обеспечивает лечение рака яичников у пациента. 21 з.п. ф-лы, 9 ил., 3 табл., 23 пр.
Реферат
2420-184354RU/031
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки 60/654245, поданной 18 февраля 2005 г., которая полностью включена сюда в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям для лечения пролиферативных заболеваний путем введения комбинации таксана и, по меньшей мере, одного другого или других лечебных средств, а также других методов лечения, которые можно использовать при лечении пролиферативных заболеваний. В частности, изобретение относится к применению наночастиц, содержащих паклитаксел и альбумин (таких как AbraxaneTM) в комбинации с другими химиотерапевтическими средствами или облучением, которые можно применять для лечения рака.
Описание предшествующего уровня техники
Отсутствие реакции значительного числа опухолей на медикаментозную и/или лучевую терапию представляет собой серьезную проблему при лечении рака. Действительно, это одна из основных причин того, почему многие из наиболее распространенных форм рака человека еще устойчивы к эффективному химиотерапевтическому вмешательству, несмотря на достижения в области химиотерапии.
В настоящее время рак в первую очередь лечат одним или комбинацией трех типов лечения: хирургического лечения, лучевой терапии и химиотерапии. Хирургическое лечение представляет собой традиционный подход, при котором вся или часть опухоли удаляется из организма. В целом, хирургическое лечение эффективно только для лечения ранних стадий рака. Хотя хирургическое лечение иногда эффективно при удалении опухолей, локализующихся в определенных участках, например, в молочной железе, ободочной кишке и коже, его нельзя использовать ни при лечении опухолей, расположенных в других областях, недоступных для хирургов, ни при лечении диссеминированных неопластических состояний, таких как лейкоз. Более чем 50% лиц, страдающих раком, ко времени, когда у них поставлен диагноз, больше не являются кандидатами на эффективное хирургическое лечение. Хирургические процедуры могут увеличить количество метастазов опухолей через систему кровообращения во время операции. Большинство лиц, страдающих раком, не умирают от рака во время постановки диагноза или операции, а скорее от метастазов и рецидива рака.
Другие способы лечения также часто неэффективны. Лучевая терапия эффективна только у лиц, которые имеют клинически локализованное заболевание на ранних или средних стадиях рака, и она неэффективна на поздних стадиях рака с метастазами. Облучение, в целом, направлено на определенную область тела индивидуума, которая содержит патологическую пролиферативную ткань, для доведения до максимума дозы, поглощенной патологической тканью, и минимизации дозы, поглощенной расположенной рядом нормальной тканью. Однако трудно (или невозможно) селективно направить терапевтическое облучение на патологическую ткань. Таким образом, нормальная ткань, расположенная рядом с патологической тканью, также подвержена воздействию потенциально повреждающих доз облучения в течение всего курса лечения. Имеются также некоторые способы лечения, которые требуют воздействия облучения на весь организм индивидуума при процедуре, называемой «полное облучение тела» или «TBI». Поэтому эффективность радиотерапевтических методик в разрушении патологических пролиферативных клеток уравновешивается связанными с ними цитотоксическими эффектами на расположенные рядом нормальные клетки. Ввиду этого, методики лучевой терапии имеют присущий им низкий терапевтический индекс, что приводит к неадекватному лечению большинства опухолей. Даже самые лучшие радиотерапевтические методики могут привести к неполной редукции опухоли, рецидиву опухоли, увеличению опухолевой нагрузки и индукции устойчивых к облучению опухолей.
Химиотерапия включает прерывание клеточной репликации или клеточного метаболизма. Химиотерапия может быть эффективной, но имеются тяжелые побочные эффекты, например, рвота, лейкопения, потеря волос, потеря массы тела и другие токсические эффекты. Ввиду крайне токсичных побочных эффектов многие индивидуумы, страдающие раком, не могут успешно завершить полную схему химиотерапии. Вызванные химиотерапией побочные эффекты оказывают значительное воздействие на качество жизни индивидуума и могут оказывать большое влияние на соблюдение предписанного лечения. Кроме того, неблагоприятные побочные эффекты при применении химиотерапевтических средств представляют собой, в целом, высокую ограничивающую дозу токсичность (DLT) при введении этих препаратов. Например, мукозит представляет собой основную ограничивающую дозу токсичность для нескольких противораковых средств, включая антиметаболитные цитотоксические средства 5-фторурацил, метотрексат и противоопухолевые антибиотики, такие как доксорубицин. Многие из этих вызванных химиотерапией побочных эффектов в случае, если они тяжелые, могут привести к госпитализации или требовать лечения анальгетиками для лечения боли. Некоторые индивидуумы, страдающие раком, умирают от химиотерапии вследствие низкой переносимости химиотерапии. Крайне выраженные побочные эффекты противораковых препаратов вызваны низкой целевой специфичностью таких препаратов. Препараты циркулируют через большинство здоровых органов индивидуума, а также предполагаемые опухоли-мишени. Низкая целевая специфичность, которая вызывает побочные эффекты, также снижает эффективность химиотерапии, потому что лишь часть препаратов правильно нацелена. Эффективность химиотерапии, кроме того, снижается низким удерживанием противораковых препаратов внутри опухолей-мишеней.
Ввиду тяжести и большого количества новообразований, опухолей и рака имеется большая потребность в эффективных способах лечения таких заболеваний или расстройств, которые преодолевают недостатки хирургического, химиотерапевтического и лучевого лечения.
Проблемы химиотерапевтических средств
Проблема лекарственной устойчивости является причиной дополнительного значения комбинированной химиотерапии, поскольку терапия и должна избежать возникновения устойчивых клеток, и уничтожить ранее существующие клетки, которые уже устойчивы к лекарственным препаратам.
Лекарственная устойчивость представляет собой название, которое характеризует обстоятельство, при котором заболевание не реагирует на лечение лекарственным препаратом или препаратами. Лекарственная устойчивость может быть или эндогенной, означающей, что заболевание никогда не реагировало на препарат или препараты, или она может быть приобретенной, означающей, что заболевание прекращает реагировать на препарат или препараты, на которые заболевание ранее реагировало. Устойчивость к множеству препаратов (MDR) представляет собой специфический тип лекарственной устойчивости, которая характеризуется перекрестной устойчивостью заболевания более чем к одной функциональности и/или структурно не связанных препаратов. Устойчивость к множеству препаратов в области онкологии более детально обсуждается в документах «Detoxification Mechanisms and Tumor Cell Resistance to Anticancer Drugs» Kuzmich и Tew, в частности, раздел VII «The Multidrug-Resistant Phenotype (MDR)» Medical Research Reviews, Vol.11, No.2, 185-217, (раздел VII, pp.208-213) (1991); и в «Multidrug Resistance and Chemosensitization: Therapeutic Implications for Cancer Chemotherapy» Georges, Sharom и Ling, Advances in Pharmacology, Vol.21, 185-220 (1990).
Одна форма устойчивости к множеству препаратов (MDR) опосредуется связанным с мембраной энергетически зависимым насосом выходящего потока 170-180 кД, обозначенным как Р-гликопротеид (P-gp). Было показано, что Р-гликопротеид играет основную роль в эндогенной и приобретенной устойчивости ряда человеческих опухолей к гидрофобным, натуральным продуктовым препаратам. Препараты, которые действуют в качестве субстратов для P-gp и в последующем детоксифицируются им, включают алкалоиды винки (винкристин и винбластин), антрациклины (адриамицин) и эпиподофиллотоксины (этопозид). Хотя связанная с P-gp MDR представляет собой основную детерминанту при устойчивости опухолевых клеток к химиотерапевтических средствам, ясно, что феномен MDR является многофакторным и включает ряд различных механизмов.
Основным осложнением химиотерапии рака и противовирусной химиотерапии является повреждение клеток костного мозга или подавление их функции. В частности, химиотерапия повреждает или разрушает гематопоэтические клетки-предшественники, в первую очередь обнаруживаемые в костном мозге и селезенке, нарушая продукцию новых клеток крови (гранулоцитов, лимфоцитов, эритроцитов, моноцитов, тромбоцитов и т.д.). Например, лечение лиц, страдающих раком, 5-фторурацилом снижает количество лейкоцитов (лимфоцитов и/или гранулоцитов) и может привести к повышенной восприимчивости индивидуумов к инфекции. Многие индивидуумы, страдающие раком, умирают от инфекции или других последствий гематопоэтической недостаточности вследствие химиотерапии. Химиотерапевтические средства могут также привести к субнормальному образованию тромбоцитов, что создает склонность к кровотечению. Ингибирование продукции эритроцитов может привести к анемии. У некоторых индивидуумов, страдающих раком, риск повреждения гематопоэтической системы или других важных тканей часто ограничивает возможность увеличения химиотерапевтических доз химиотерапевтических средств до достаточно высокого уровня, обеспечивающего хорошую противоопухолевую или противовирусную эффективность. Циклы химиотерапии повторными или высокими дозами могут быть ответственны за тяжелое истощение запасов стволовых клеток, ведущее к серьезным долгосрочным гематопоэтическим последствиям и истощению костного мозга.
Предотвращение или защита от побочных эффектов химиотерапии принесли бы большую пользу лицам, страдающим раком. По поводу угрожающих жизни побочных эффектов усилия были сконцентрированы на изменении дозы схем введения химиотерапевтических средств для снижения побочных эффектов. Становятся доступными другие варианты, такие как применение фактора, стимулирующего колонии гранулоцитов (G-CSF), фактора, стимулирующего колонии гранулоцитов-макрофагов (GM-CSF), эпидермального ростового фактора (EGF), интерлейкина 11, эритропоэтина, тромбопоэтина, фактора развития и роста мегакариоцитов, фактора стволовых клеток, FLT-лиганда, а также интерлейкинов 1, 3, 6 и 7 для увеличения количества нормальных клеток в различных тканях перед началом химиотерапии (см. Jimenez и Yunis, Cancer Research 52:413-415; 1992). Хотя механизмы защиты этими факторами не полностью понятны, они вероятнее всего связаны с увеличением количества нормальных имеющих решающее значение клеток-мишеней перед лечением цитотоксическими средствами, а не с увеличенным выживанием клеток после химиотерапии.
Нацеливание химиотерапевтических средств для лечения опухолей
И рост, и метастазирование солидных опухолей являются зависимыми от ангиогенеза (Folkman, J. Cancer Res., 46, 467-73 (1986); Folkman, J. Nat. Cancer Inst., 82, 4-6 (1989); Folkman et al., «Tumor Angiogenesis» Chapter 10, pp.206-32, in The Molecular Basis of Cancer, Mendelsohn et al., eds. (W.B. Saunders, 1995)). Например, было показано, что опухоли, которые увеличиваются до диаметра более чем 2 мм, должны получить свое собственное кровоснабжение, и они достигают этого индукцией роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды внедряются в опухоль, они обеспечивают поступление питательных веществ и ростовых факторов, существенных для роста опухоли, а также служат средством для проникновения опухолевых клеток в систему кровообращения и метастазирования в отдаленные участки, такие как печень, легкие или кости (Weidner, New Eng. J. Med., 324(1), 1-8 (1991)). При использовании в качестве лекарственных препаратов у животных, пораженных опухолями, естественные ингибиторы ангиогенеза могут предотвратить рост мелких опухолей (O’Reilly et al., Cell, 79, 315-28 (1994)). Действительно, в некоторых протоколах применение таких ингибиторов ведет к обратному развитию и состоянию покоя опухолей даже после прекращения лечения (O’Reilly et al., Cell, 88, 277-85 (1997)). Более того, подача ингибиторов ангиогенеза в определенные опухоли может потенцировать их реакцию на другие схемы лечения (например, химиотерапию) (см., например, Teischer et al., Int. J. Cancer, 57, 920-25 (1994)).
Протеин и тирозин киназы катализируют фосфорилирование определенных остатков тирозила в различных белках, участвующих в регуляции роста и дифференциации клеток (A.F. Wilks, Progress in Growth Factor Research, 1990, 2, 97-111; S.A. Courtneidge, Dev. Supp.l, 1993, 57-64; J.A. Cooper, Semin. Cell Biol., 1994, 5(6), 377-387; R.F. Paulson, Semin. Immunol., 1995, 7(4), 267-277; A.C. Chan, Curr. Opin. Immunol., 1996, 8(3), 394-401). Протеин тирозин киназы можно широко классифицировать как рецепторные (например, EGFr, c-erbB-2, c-met, tie-2, PDGFr, FGFr) или не рецепторные (например, c-src, Ick, Zap70) киназы. Неадекватная или неконтролируемая активация многих из этих киназ, т.е., было показано, что аберрантная активность протеин тирозин киназы, например, путем избыточной экспрессии или мутации, приводит к неконтролируемому клеточному росту. Например, повышенная активность рецептора эпидермального ростового фактора (EGFR) была вовлечена в патологический процесс при немелкоклеточном раке легких, мочевого пузыря и раковых опухолях головы и шеи, а повышенная активность c-erbB-2 – при раке молочной железы, яичников, желудка и поджелудочной железы. Таким образом, ингибирование протеин тирозин киназ должно быть полезным в качестве лечения по поводу таких опухолей, как те, которые описаны выше.
Ростовые факторы представляют собой вещества, которые вызывают пролиферацию клеток обычно связыванием со специфическими рецепторами на клеточных поверхностях. Эпидермальный ростовой фактор (EGF) вызывает пролиферацию разнообразных клеток in vivo и требуется для роста большинства культивированных клеток. Рецептор EGF представляет собой распределенный по мембране гликопротеид 170-180 кД, который можно выявить на широком разнообразии типов клеток. Внеклеточный N-концевой домен рецептора является высоко гликозилированным и связывает антитела против EGF, которые селективно связываются с EGFR. Средства, которые конкурентно связываются с EGFR, использовались для лечения определенных типов рака, поскольку многие опухоли мезодермального и эктодермального происхождения избыточно экспрессируют рецептор EGF. Например, было показано, что рецептор EGF избыточно экспрессирован во многих глиомах, плоскоклеточных карциномах, карциномах молочных желез, меланомах, инвазивных карциномах мочевого пузыря и раковых опухолях пищевода. Попытки использовать систему EGFR для противоопухолевой терапии, в целом, включали применение моноклональных антител против EGFR. Кроме того, исследования с первичными опухолями молочных желез показали корреляцию между высокой экспрессией EGFR и наличием метастазов, более высокими скоростями пролиферации и более коротким выживанием индивидуумов.
Herlyn et al. в патенте США № 5470571 описывают применение меченого радиоактивной меткой Mab 425 для лечения глиом, которые экспрессируют EGFR. Herlyn et al. сообщают, что антитела против EGFR могут или стимулировать, или ингибировать рост и пролиферацию раковых клеток. Сообщалось, что другие моноклональные антитела, имеющие специфичность к EGFR, или отдельно, или конъюгированному с цитотоксическим соединением, эффективны для лечения определенных типов рака. Bendig et al. в патенте США № 5558864 описывают терапевтические моноклональные антитела (Mab) против EGFR для конкурентного связывания с EGFR. Heimbrook et al. в патенте США № 5690928 описывают применение EGF, конденсированного с полученными из вида Pseudomonas эндотоксинами для лечения рака мочевого пузыря. Brown et al. в патенте США № 5859018 описывают способ лечения заболеваний, характеризуемых клеточной гиперпролиферацией, опосредованной, наряду с другими факторами, EGF.
Методы введения химиотерапевтических средств
Людей, у которых диагностирован рак, часто лечат одним или множественными химиотерапевтическими средствами для уничтожения раковых клеток в первичном опухолевом участке или в отдаленных участках, куда метастазировал рак. Химиотерапевтическое лечение обычно проводится одной или несколькими большими дозами или в течение различных периодов времени, от нескольких недель до нескольких месяцев. Однако химиотерапия повторными циклами или высокими дозами может быть ответственна за увеличенную токсичность и тяжелые побочные эффекты.
Новые исследования свидетельствуют о том, что метрономная химиотерапия, частое введение цитотоксических средств низкими дозами без длительных перерывов, без введения препаратов нацелена на активированные эндотелиальные клетки в сосудистой сети опухоли. Ряд преклинических исследований продемонстрировал более высокую противоопухолевую эффективность, сильные антиангиогенные эффекты и сниженную токсичность и побочные эффекты (например, миелосуппрессию) метрономных схем по сравнению со схемами введения максимальных переносимых доз (MTD) (Bocci et al., Cancer Res, 62:6938-6943, (2002); Bocci et al., PNAS, vol, 100(22):12917-12922, (2003); и Bertolini et al, Cancer Res, 63(15):4342-4346, (2003)). Остается неясным, все ли химиотерапевтические препараты оказывают одинаковые эффекты, или некоторые лучше подходят для таких схем, чем другие. Тем не менее, представляется, что метрономная химиотерапия эффективна в преодолении некоторых из основных недостатков, связанных с химиотерапией.
Химиотерапевтические средства
Было показано, что паклитаксел оказывает значительные антинеопластические и противораковые эффекты при устойчивом к медикаментозной терапии раке яичников и показал превосходную противоопухолевую активность при широком разнообразии моделей опухолей, а также ингибирует ангиогенез при использовании в очень низких дозах (Grant et al., Int. J. Cancer, 2003). Однако плохая растворимость паклитаксела в воде создает проблему для введения людям. Действительно, доставка препаратов, которым присуща нерастворимость или плохая растворимость в водной среде, может быть серьезно нарушена, если пероральная доставка неэффективна. Соответственно, используемые в настоящее время препаративные формы паклитаксела (например, Taxol®) требуют Cremophor® для солюбилизации препарата. Присутствие Cremophor® в этой препаративной форме было связано с тяжелыми реакциями гиперчувствительности у животных (Lorenz et al., Agents Actions 7:63-67 (1987)) и людей (Weiss et al., J. Clin. Oncol. 8:1263-68 (1990)) и, следовательно, требует предварительного введения индивидуумам кортикостероидов (дексаметазона) и антигистаминных препаратов. Сообщалось также, что клинически релевантные концентрации носителя препаративной формы Cremophor® EL в Taxol® сводит к нулю антиангиогенную активность паклитаксела, свидетельствуя о том, что может потребоваться применение этого средства или других противораковых препаратов, включенных в состав Cremophor® EL, в гораздо более высоких дозах, чем те, которые предполагаются для достижения эффективной метрономной химиотерапии (Ng et al., Cancer Res., 64:821-824 (2004)). Таким образом, может быть нивелировано преимущество отсутствия нежелательных побочных эффектов, связанных со схемами низких доз паклитаксела в сравнении с обычной химиотерапией MTD. См. также патентную публикацию США № 2004/0143004; WO 00/64437.
AbraxaneTM представляет собой лишенный Cremophor® EL связанный с альбумином паклитаксел в виде наночастиц
Преклинические модели показали значительное улучшение безопасности и эффективности AbraxaneTM, по сравнению с Taxol® (Desai et al., EORTC-NCI-AACR, 2004), и у индивидуумов с метастатическим раком молочных желез (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Возможно, это связано с отсутствием поверхностно-активных веществ (например, Cremophor® или Tween® 80, используемых соответственно в Taxol® и Taxotere®) в Abraxane® и/или предпочтительным использованием механизма транспорта на основе альбумина, использующего gp60/кавеолы на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004). Кроме того, было показано, что и Cremophor®, и Tween® 80 сильно ингибируют связывание паклитаксела с альбумином, возможно, воздействуя на транспорт, основанный на альбумине (Desai et al., EORTC-NCI-AACR, 2004).
IDN5109 (Ortataxel) представляет собой новый таксан, проходящий в настоящее время фазу II испытания, выбранный за его отсутствие перекрестной устойчивости в линиях опухолевых клеток, экспрессирующих фенотип, устойчивый к множеству препаратов (MDR/Pgp), ингибирование Р-гликопротеина (Pgp) (Minderman; Cancer Chemother. Pharmacol. 2004; 53:363-9). Ввиду его гидрофобности, IDN5109 в настоящее время включен в состав в поверхностно-активном веществе Tween® 80 (тот же носитель, что и Taxotere®). Удаление поверхностно-активных веществ из препаративных форм таксана в случае связанного с альбумином паклитаксела в виде наночастиц (AbraxaneTM) проявило улучшения безопасности и эффективности в сравнении с их аналогами, содержащими поверхностно-активные вещества (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Tween® 80 также сильно ингибировал связывание таксана, паклитаксела с альбумином, возможно нарушая основанный на альбумине транспорт лекарственных препаратов через рецептор gp60 на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004).
О противоопухолевой активности колхицина, который является основным алкалоидом осеннего крокуса Colchicum autumnale, и африканской глориозы Gloriosa superba впервые сообщалось в начале XX века. Выяснение его структуры было окончательно завершено по рентгеновским исследованиям и ряду случаев полного синтеза (см. Shiau et al., J. Pharm. Sci. 1978, 67(3) 394-397). Считают, что колхицин представляет собой митотический яд, в частности, в тимусных, кишечных и гематопоэтических клетках, который действует в качестве веретенного яда и блокирует кинез. Считают, что его воздействие на митотическое веретено представляет особый случай его воздействий на различные организованные, лабильные, волоконные системы, связанные со структурой и движением.
Димер тиоколхицина IDN5404 был выбран, благодаря его активности в подгруппе клеток яичников человека, устойчивой к цисплатину и топотекану A2780-CIS и A2780-TOP. Этот эффект был связан с двойными механизмами действия, т.е. активностью микротрубочек, как в алкалоидах винки, и ингибирующим эффектом топоизомеразы I, отличным от камптотецина (Raspaglio, Biochemical Pharmacology 69:113-121 (2005)).
Было обнаружено, что композиции таксана в виде наночастиц (такие как связанный с альбумином паклитаксел (AbraxaneTM)) имеют значительно более низкую токсичность, чем другие таксаны, подобные Taxol® и Taxotere®, со значительно улучшенными исходами и по безопасности, и по эффективности.
Было обнаружено, что комбинированная химиотерапия, например, комбинирование одного или более химиотерапевтических средств или других способов лечения, например, комбинирование химиотерапии с облучением или хирургическим лечением, более успешна, чем соответственно отдельные химиотерапевтические средства или отдельные способы лечения.
Другие ссылки включают патентную публикацию США № 2006/0013819; патентную публикацию США № 2006/0003931; WO 05/117986; WO 05/117978 и WO 05/000900.
Требуются более эффективные способы лечения по поводу пролиферативных заболеваний, в частности, рака.
Описания всех публикаций, патентов и патентных заявок и опубликованных патентных заявок, приводимых здесь, полностью включены сюда в качестве ссылки.
Краткое описание сущности изобретения
Настоящее изобретение предоставляет способы лечения пролиферативных заболеваний, таких как рак. Изобретение предоставляет способы комбинированной терапии для лечения пролиферативных заболеваний (таких как рак), включающие: а) первое лечение, содержащее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), и b) второе лечение, такое как химиотерапия, лучевая терапия, хирургическое лечение или их комбинация. В другом аспекте предоставляются способы введения индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), на основании метрономной схемы.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок (такой как AbraxaneTM), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любой из (а в некоторых вариантах осуществления выбран из группы, состоящей из) антиметаболитов (включая аналоги нуклеозидов); средства на основе платины, алкилирующие агенты, ингибиторы тирозин киназы, антрациклиновые антибиотики, алкалоиды винки, ингибиторы протеасом, макролиды и ингибиторы топоизомеразы. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой средство на основе платины, такое как карбоплатин.
В некоторых вариантах осуществления композиция, содержащая наночастицы (также именуемая «композицией в виде наночастиц»), и химиотерапевтическое средство вводятся одновременно, или в одной и той же композиции, или в отдельных композициях. В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся последовательно, т.е. композиция в виде наночастиц вводится или перед или после введения химиотерапевтического средства. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит одновременно, т.е. периоды введения композиции в виде наночастиц и химиотерапевтического средства перекрывают друг друга. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит не одновременно. Например, в некоторых вариантах осуществления, введение композиции в виде наночастиц прекращается перед введением химиотерапевтического средства. В некоторых вариантах осуществления введение химиотерапевтического средства прекращается перед введением композиции в виде наночастиц.
В некоторых вариантах осуществления первое терапевтическое средство таксан представляет собой паклитаксел, связанный с альбумином в виде частиц, описанный, например, в патенте США № 6566405, и имеющийся в продаже под торговым названием AbraxaneTM. Кроме того, первое терапевтическое средство таксан также считается представляющим собой доцетаксел, связанный с альбумином в виде наночастиц, описанный, например, в опубликованной заявке на патент США 2005/0004002А1.
В другом аспекте предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение. В некоторых вариантах осуществления первое лечение проводится перед вторым лечением. В некоторых вариантах осуществления первое лечение проводится после второго лечения.
В другом аспекте способ включает проведение у млекопитающего, имеющего пролиферативное заболевание (такое как рак), комбинированного лечения, включающего первое лечение, включающее таксан, и второе лечение, выбранное из группы, состоящей из химиотерапевтического средства и облучения, или их комбинации. Комбинированное лечение можно проводить любыми из разнообразных путей, такими как последовательно или одновременно, и, в случае последовательного лечения, таксан можно вводить перед или после второго лечения, хотя предпочтительно, чтобы первое лечение, включающее таксан, проводилось первым. Также понятно, что второе лечение может включать более чем одно химиотерапевтическое средство.
Настоящее изобретение также предоставляет метрономные схемы лечения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза токсана при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и белок (такой как AbraxaneTM), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза паклитаксела при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% максимальной переносимой дозы. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между введениями составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок (такой как альбумин), где таксан вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым приемом больше, чем, по меньшей мере, 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и белок-носитель (такой как альбумин), где паклитаксел вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22 и 25 мг/м2. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
Способы по изобретению в целом включают введение композиции, содержащей наночастицы, включающие таксан и белок-носитель. В некоторых вариантах осуществления композиция в виде наночастиц содержит наночастицы, включающие паклитаксел и альбумин. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления соотношение между массой альбумина и паклитаксела в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. Предусмотрены также другие комбинации указанных выше характеристик. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM. Композиции в виде наночастиц, содержащие другие таксаны (такие как доцетаксел и ортатаксел), могут также иметь одну или более из указанных выше характеристик.
Эти и другие аспекты и преимущества настоящего изобретения станут очевидными из последующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что одно, некоторое или все свойства описанных здесь различных вариантов осуществления могут комбинироваться для образования других вариантов осуществления настоящего изобретения.
Краткое описание чертежей
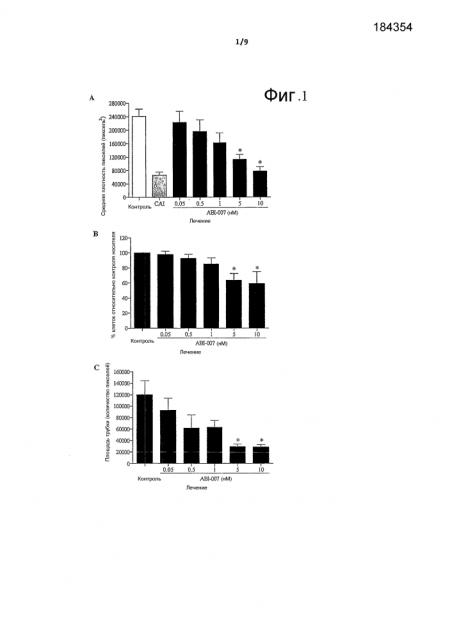
На фиг.1А показано воздействие ABI-007 на ангиогенез аортальных колец крыс. На фиг.1В показано воздействие ABI-007 на пролиферацию эндотелиальных клеток человека. На фиг.1С показано воздействие ABI-007 на формирование трубки из эндотелиальных клеток.
На фиг.2 показано определение оптимальной биологической дозы ABI-007 для метрономного введения. Показаны уровни жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей Balb/cJ в ответ на возрастающие дозы ABI-007. Untr’d = необработанный контроль; S/A = контроль носителя солевой раствор/альбумин. Ограниченные отрезки = средняя величина ± стандартная ошибка. * значимо отличается (p<0,05) от необработанного контроля.
На фиг.3А и 3В показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на рост опухоли MDA-MB-231 (А) и PC3 (B) у мышей SCID, пораженных опухолью. На фиг.3С и 3D показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на массу тела мышей SCID, пораженных опухолью MDA-MB-231 (С) и PC3 (D).
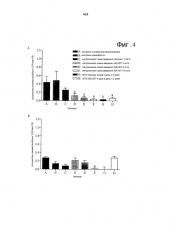
На фиг.4А и 4В показаны изменения уровней жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей SCID, пораженных опухолью MDA-MB-231 (фиг.4А) и PC3 (фиг.4В), после лечения А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. а значимо отличается (p<0,05) от контроля носителя солевого раствора/альбумина. b значимо отличается (p<0,05) от контроля носителя Cremophor EL.
На фиг.5А показана плотность микрососудов в опухоли ксенотрансплантатов MDA-MB-231 (■) и PC3 (□), обработанных А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. На фиг.5В и 5C показана корреляция между плотностью микрососудов в опухоли и количеством жизнеспособных СЕР в периферической крови у мышей SCID, пораженных опухолью MDA-MB-231 (фиг.5В) и PC3 (фиг.5С).
На фиг.6 показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на ангиогенез, вызванный основным фактором роста фибробластов (bFGF) в пробках из ма