Арил-или гетероарилзамещенные бензольные соединения
Иллюстрации
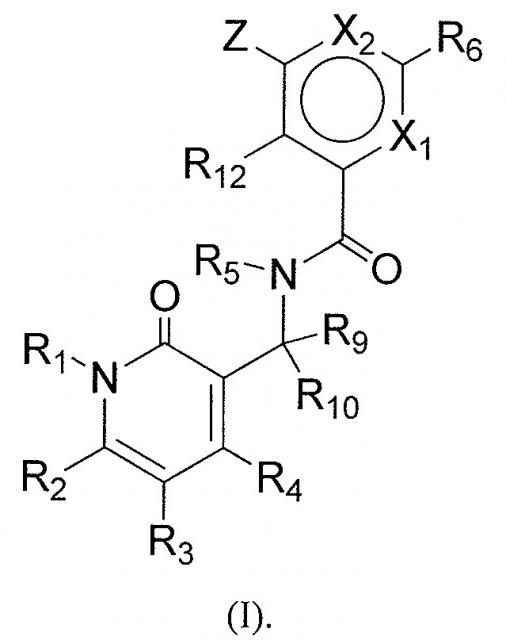
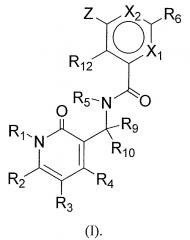
Показать всеИзобретение относится к соединениям формулы (I):
где X1 представляет собой N или CR11; Х2 представляет собой N или CR13; Z представляет собой NR7R8 или CR7R8R14; каждый из R1, R5, R9 и R10 независимо представляет собой Н или C1-С6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена и гидроксила; каждый из R2, R3 и R4 независимо представляет собой -Q1-T1, где Q1 представляет собой связь или C1-С3алкильный линкер, необязательно замещенный галогеном, и Т1 представляет собой Н, галоген, гидроксил или RS1, где RS1 представляет собой C1-С3алкил, С3-С8циклоалкил и RS1 необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и гидроксила; R6 представляет собой С6-С10арил или 5- или 6-членный гетероарил, содержащий 1 или 2 гетероатома, независимо выбранных из N, О и S, каждый из которых необязательно замещен одним или несколькими -Q2-T2, где Q2 представляет собой связь или C1-С3алкильный линкер, необязательно замещенный галогеном, и Т2 представляет собой Н, галоген, -NRaRb или RS2, где каждый из Ra и Rb независимо представляет собой Н или RS3, каждый из RS2 и RS3 независимо представляет собой C1-С6алкил, или 4-12-членный гетероциклоалкил, содержащий 1 или 2 гетероатома, независимо выбранных из N и О, или Ra и Rb образуют вместе с атомом N, к которому они присоединены, 4-12-членное гетероциклоалкильное кольцо, содержащее гетероатом N и дополнительно содержащее 0 или 1 дополнительный гетероатом, выбранный из N или О; R7 представляет собой -Q4-T4, где Q4 представляет собой связь или С1-С4алкильный линкер, необязательно замещенный галогеном, и Т4 представляет собой Н или RS4, где каждый RS4 представляет собой C1-С6алкил, С3-С8циклоалкил или 4-12-членный гетероциклоалкил, содержащий один гетероатом, выбранный из О или N, и каждый из RS4 необязательно замещен одним или несколькими -Q5-T5, где Q5 представляет собой связь и Т5 представляет собой Н, галоген, C1-С6алкил, амино или моно -C1-С6алкиламино; каждый из R8, R11, R12 и R13 независимо представляет собой Н, галоген, гидроксил или RS6, где RS6 представляет собой C1-С6алкил или С3-С8циклоалкил, 4-12-членный гетероциклоалкил, содержащий 1 или 2 гетероатома; или R7 и R8 образуют вместе с атомом N, к которому они присоединены, 4-11-членное гетероциклоалкильное кольцо, содержащее 0-2 дополнительных гетероатома, или R7 и R8 образуют вместе с атомом С, к которому они присоединены, 4-11-членное гетероциклоалкильное кольцо, содержащее от 1 до 3 гетероатомов; и R14 отсутствует или представляет собой Н или C1-С6алкил, необязательно замещенный галогеном, или их фармацевтически приемлемым солям. Заявленные соединения применяют для лечения рака. 6 н. и 55 з.п. ф-лы, 12 ил., 7 табл., 201 пр.
.
Реферат
Родственные заявки
По данной заявке испрашивается приоритет на основании и интересах предварительных заявок на выдачу патента США №№ 61/474,821, поданной 13 апреля 2011 года, и 61/499,595, поданной 21 июня 2011 года, полное содержание которых включено во всей их полноте в настоящий документ посредством ссылки.
Включение посредством ссылки последовательности секвенирования
Информация, содержащаяся в созданном 28 марта 2012 года текстовом файле размером 2 KB, озаглавленном «41478-507001WO_ST25.txt», включена во всей своей полноте в настоящий документ посредством ссылки.
Предпосылки создания изобретения
В эукариотических клетках ДНК находится в упакованном виде с гистонами для образования хроматина. Изменения в упорядоченной структуре хроматина могут приводить к изменениям в транскрипции ассоциированных генов. Контроль изменений структуры хроматина (и, следовательно, транскрипции) опосредован ковалентными модификациями гистонов, особенно их N-концевых участков. Данные модификации часто называют эпигенетическими, поскольку они могут приводить к наследуемым изменениям в экспрессии гена, но не влияют на саму последовательность ДНК. Ковалентные модификации (например, метилирование, ацетилирование, фосфорилирование и убиквитинирование) боковых цепей аминокислот являются ферментативно опосредованными. Селективное добавление метильных групп к определенным аминокислотным участкам в гистонах регулируется функционированием уникального семейства ферментов, известных как метилтрансферазы гистонов (HMT).
Скоординированная сборка биохимических систем вслед за транскрипционной регуляцией должна строго регулироваться с тем, чтобы рост и дифференцировка клеток происходили оптимально. Если при аберрантной экспрессии и/или активности ферментов, ответственных за модификацию ДНК и гистона, указанные системы регуляции нарушаются, то возникают патологические состояния. Существует растущая совокупность доказательств предположения, что, например, при видах рака человека, нарушенная активность эпигенетических ферментов способствует неконтролируемой пролиферации клеток, ассоциированной с раком, а также возникновению других связанных с раком клинических проявлений, таких как увеличенная миграция и инвазия клеток. Помимо рака, существует растущее число доказательств роли эпигенетических ферментов в целом ряде других заболеваний человека, включающих в себя метаболические заболевания (такие как сахарный диабет), воспалительные заболевания (такие как болезнь Крона), нейродегенеративные заболевания (такие как болезнь Альцгеймера) и сердечно-сосудистые заболевания. Поэтому, селективное модулирование аберрантного действия эпигенетических ферментов может быть перспективным в отношении лечения ряда заболеваний.
Белки группы поликомб (PcG) и группы триторакс (trxG), как известно, являются частью системы клеточной памяти (см., например, Francis et al. (2001) Nat Rev Mol Cell Biol 2:409-21 и Simon et al. (2002) Curr Opin Genet Dev 12:210-8). В целом, белки PcG являются репрессорами транскрипции, которые поддерживают «нерабочее состояние», и белки trxG являются активаторами транскрипции, которые поддерживают «рабочее состояние». Поскольку представители белков PcG и trxG характеризуются присущей им активностью гистонметилтрансферазы (HMTазы), белки PcG и trxG могут участвовать в клеточной памяти посредством метилирования коровых гистонов (см., например, Beisel et al. (2002) Nature 419:857-62; Cao et al. (2002) Science 298:1039-43; Czermin et al. (2002) Cell 111:185-96; Kuzmichev et al. (2002) Genes Dev 16:2893-905; Milne et al. (2002) Mol Cell 10:1107-17; Muller et al. (2002) Cell 111:197-208; и Nakamura et al. (2002) Mol Cell 10:1119-28).
Биохимические и генетические исследования представили доказательства, что белки PcG дрозофилы действуют по меньшей мере в двух различных белковых комплексах, репрессорном комплексе поликомб 1 (PRC1) и комплексе ESC-E(Z) (также известном как репрессорный комплекс поликомб 2 (PRC2)) (Otte et al. (2003) Curr Opin Genet Dev 13:448-54). Исследования на дрозофилах продемонстрировали, что комплексы ESC-E(Z)/EED-EZH2 (то есть PRC2) обладают присущей им активностью гистонметилтрансферазы. Хотя составы комплексов, выделенных из различных групп, слегка различаются, они, как правило, содержат EED, EZH2, SUZ12 и RbAp48 или их гомологи у дрозофилы. Однако, реконструированный комплекс, содержащий только EED, EZH2 и SUZ12, сохраняет активность гистонметилтрансферазы в отношении лизина 27 гистона H3 (патент США 7,563,589).
Из различных белков, составляющих комплексы PRC2, EZH2 (гомолог белка-энхансера Zeste 2) представляет собой каталитическую субъединицу. В свою очередь, каталитический участок EZH2 находится в домене SET, мотиве высококонсервативной последовательности (носящем имя Su(var)3-9, энхансер Zeste, триторакс), который обнаружен у нескольких ассоциированных с хроматином белков, включая представителей как группы триторакс, так и группы поликомб. Домен SET является характеристичным для всех известных лизиновых метилтрансфераз гистонов, за исключением метилтрансферазы DOT1 для H3-K79.
В дополнение к выключению гена Hox, опосредованное PRC2 метилирование гистона H3-K27, как было показано, участвует в X-инактивации (Plath et al. (2003) Science 300:131-5; Silva et al. (2003) Dev Cell 4:481-95). Рекрутирование комплекса PRC2 для Xi и последующего триметилирования гистона H3-K27 имеет место во время стадии инициации X-инактивации и зависит от Xist РНК. Кроме того, было обнаружено, что EZH2 и его связанная с гистоном активность в качестве H3-K27 метилтрансферазы отличительно характеризуют полипотентные клетки эпибласта и дифференцированную трофэктодерму, и в соответствии с ролью EZH2 по поддержанию паттернов эпигенетической модификации полипотентных клеток эпибласта, опосредованная Cre делеция EZH2 приводит к отсутствию метилирования гистона H3-K27 в клетках (Erhardt et al. (2003) Development 130:4235-48). Кроме того, исследования клеточных линий и тканей рака предстательной железы и молочной железы выявили корреляцию между уровнями EZH2 и SUZ12 и инвазивностью данных видов рака, указывающую на то, что дисфункция комплекса PRC2 может способствовать развитию рака (Bracken et al. (2003) EMBO J 22:5323-35; Kirmizis et al. (2003) Mol Cancer Ther 2:113-21; Kleer et al. (2003) Proc Natl Acad Sci USA 100:11606-11; Varambally et al. (2002) Nature 419:624-9).
Как недавно сообщалось, что соматические мутации тирозина 641 (Y641C, Y641F, Y641N, Y641S и Y641H, иногда также называемых Y646C, Y646F, Y646N, Y646S и Y646H, соответственно) в EZH2 ассоциированы с фолликулярной лимфомой (FL) и подтипом подобной В-клеточной, возникшей из зародышевого центра (GCB), диффузной B-крупноклеточной лимфомы (DLBCL) (Morin et al. (2010) Nat Genet 42:181-5). Во всех случаях, было обнаружено, что наличие мутантного гена EZH2 являлось гетерозиготным, и экспрессию аллелей как дикого типа, так и мутантных, детектировали в мутантных образцах, профили которых получали при транскриптомном секвенировании. Также было показано, что все мутантные формы EZH2 могли встраиваться в мультибелковый комплекс PRC2, и что получившиеся комплексы теряли способность катализировать метилирование эквивалентного H3-K27 остатка в пептидном субстрате. Таким образом, пришли к заключению, что ассоциированные с заболеванием изменения Tyr641 в EZH2 приводят к потере функции применительно к катализируемому EZH2 метилированию H3-K27.
Краткое описание сущности изобретения
Согласно одному аспекту, настоящее изобретение относится к арил- или гетероарилзамещенному бензольному соединению представленной ниже формулы (I), или к его фармацевтически приемлемой соли или сложному эфиру.
В указанной формуле
X1 представляет собой N или CR11;
X2 представляет собой N или CR13;
Z представляет собой NR7R8, OR7, S(O)nR7 или CR7R8R14, где n равно 0, 1 или 2;
каждый из R1, R5, R9 и R10 независимо представляет собой H или C1-C6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, гидроксила, COOH, C(O)O-C1-C6алкила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
каждый из R2, R3 и R4 независимо представляет собой -Q1-T1, где Q1 представляет собой связь или C1-C3алкильный линкер, необязательно замещенный галогеном, циано, гидроксилом или C1-C6алкокси, и T1 представляет собой H, галоген, гидроксил, COOH, циано или RS1, где RS1 представляет собой C1-C3алкил, C2-C6алкенил, C2-C6алкинил, C1-C6алкоксил, C(O)O-C1-C6алкил, C3-C8циклоалкил, C6-C10арил, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и RS1 необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, гидроксила, оксо, COOH, C(O)O-C1-C6алкила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
R6 представляет собой C6-C10арил или 5- или 6-членный гетероарил, каждый из которых необязательно замещен одним или несколькими -Q2-T2, где Q2 представляет собой связь или C1-C3алкильный линкер, необязательно замещенный галогеном, циано, гидроксилом или C1-C6алкокси, и T2 представляет собой H, галоген, циано, -ORa, -NRaRb, -(NRaRbRc)+A-, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRbC(O)Ra, -NRbC(O)ORa, -S(O)2Ra, -S(O)2NRaRb или RS2, где каждый из Ra, Rb и Rc независимо представляет собой H или RS3, A- представляет собой фармацевтически приемлемый анион, каждый из RS2 и RS3 независимо представляет собой C1-C6алкил, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, или Ra и Rb образуют вместе с атомом N, к которому они присоединены, 4-12-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, и каждый из RS2, RS3 и 4-12-членного гетероциклоалкильного кольца, образованного Ra и Rb, необязательно замещен одним или несколькими -Q3-T3, где Q3 представляет собой связь или C1-C3алкильный линкер, необязательно замещенный галогеном, циано, гидроксилом или C1-C6алкокси, и T3 выбирают из группы, состоящей из галогена, циано, C1-C6алкила, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила, 5- или 6-членного гетероарила, ORd, COORd, -S(O)2Rd, -NRdRe и -C(O)NRdRe, причем каждый из Rd и Re независимо представляет собой H или C1-C6алкил, или -Q3-T3 представляет собой оксо; или любые два смежных -Q2-T2 образуют вместе с атомами, к которым они присоединены, 5- или 6-членное кольцо, необязательно содержащее 1-4 гетероатома, выбранных из N, O и S, и необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из галогена, гидроксила, COOH, C(O)O-C1-C6алкила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
R7 представляет собой -Q4-T4, где Q4 представляет собой связь, C1-C4алкильный линкер или C2-C4алкенильный линкер, причем каждый линкер необязательно замещен галогеном, циано, гидроксилом или C1-C6алкокси, и T4 представляет собой H, галоген, циано, NRfRg, -ORf, -C(O)Rf, -C(O)ORf, -C(O)NRfRg, -C(O)NRfORg, -NRfC(O)Rg, -S(O)2Rf или RS4, где каждый из Rf и Rg независимо представляет собой H или RS5, каждый из RS4 и RS5 независимо представляет собой C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и каждый из RS4 и RS5 необязательно замещен одним или несколькими -Q5-T5, где Q5 представляет собой связь, C(O), C(O)NRk, NRkC(O), S(O)2 или C1-C3алкильный линкер, Rk представляет собой H или C1-C6алкил, и T5 представляет собой H, галоген, C1-C6алкил, гидроксил, циано, C1-C6алкоксил, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)qRq, где q равно 0, 1 или 2, и Rq представляет собой C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и T5 необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C6алкила, гидроксила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, за исключением случая, когда T5 представляет собой H, галоген, гидроксил или циано; или -Q5-T5 представляет собой оксо;
каждый из R8, R11, R12 и R13 независимо представляет собой H, галоген, гидроксил, COOH, циано, RS6, ORS6 или COORS6, где RS6 представляет собой C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C8циклоалкил, 4-12-членный гетероциклоалкил, амино, моно-C1-C6алкиламино или ди-C1-C6алкиламино, и RS6 необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, гидроксила, COOH, C(O)O-C1-C6алкила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино и ди-C1-C6алкиламино; или R7 и R8 образуют вместе с атомом N, к которому они присоединены, 4-11-членное гетероциклоалкильное кольцо, содержащее 0-2 дополнительных гетероатома, или R7 и R8 образуют вместе с атомом C, к которому они присоединены, C3-C8циклоалкил или 4-11-членное гетероциклоалкильное кольцо, содержащее от 1 до 3 гетероатомов, и каждый из 4-11-членных гетероциклоалкильных колец или C3-C8циклоалкила, образованного R7 и R8, необязательно замещен одним или несколькими -Q6-T6, где Q6 представляет собой связь, C(O), C(O)NRm, NRmC(O), S(O)2 или C1-C3алкильный линкер, Rm представляет собой H или C1-C6алкил, и T6 представляет собой H, галоген, C1-C6алкил, гидроксил, циано, C1-C6алкоксил, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)pRp, где p равно 0, 1 или 2, и Rp представляет собой C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C3-C8циклоалкил, C6-C10арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и T6 необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, C1-C6алкила, гидроксила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, за исключением случая, когда T6 представляет собой H, галоген, гидроксил или циано; или -Q6-T6 представляет собой оксо; и
R14 отсутствует или представляет собой H или C1-C6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, гидроксила, COOH, C(O)O-C1-C6алкила, циано, C1-C6алкоксила, амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино, C3-C8циклоалкила, C6-C10арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила.
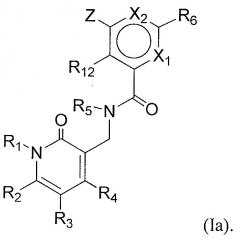
Одна подгруппа соединений формулы (I) включает в себя соединения формулы (Ia):
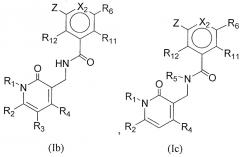
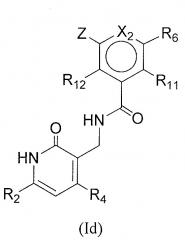
Другая подгруппа соединений формулы (I) включает в себя соединения формул (Ib), (Ic) или (Id):
или
Другая подгруппа соединений формулы (I) включает в себя соединения формул (Ie), (Ig), (II) или (IIa):
или
Соединения формулы (I), (Ia), (Ib), (Ic), (Id), (Ie), (Ig), (II) или (IIa) могут характеризоваться одним или несколькими из следующих признаков:
X1 представляет собой CR11, и X2 представляет собой CR13.
X1 представляет собой CR11, и X2 представляет собой N.
X1 представляет собой N, и X2 представляет собой CR13.
X1 представляет собой N, и X2 представляет собой N.
Z представляет собой NR7R8.
Z представляет собой CR7R8R14.
Z представляет собой OR7.
Z представляет собой S(O)nR7, где n равно 0, 1 или 2.
R6 представляет собой незамещенный C6-C10арил или незамещенный 5- или 6-членный гетероарил.
R6 представляет собой C6-C10арил, замещенный одним или несколькими -Q2-T2, или 5- или 6-членный гетероарил, замещенный одним или несколькими -Q2-T2.
R6 представляет собой фенил, замещенный одним или несколькими -Q2-T2.
R6 представляет собой 5- или 6-членный гетероарил, содержащий 1-3 дополнительных гетероатома, выбранные из N, O и S, и необязательно замещенный одним или несколькими -Q2-T2.
R6 представляет собой хинолинил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, фурил или тиенил, каждый из которых необязательно замещен одним или несколькими -Q2-T2.
T2 представляет собой C1-C6алкил, C6-C10арил, галоген, -ORa, -NRaRb, -(NRaRbRc)+A-, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRbC(O)Ra, -NRbC(O)ORa, -S(O)2Ra или -S(O)2NRaRb.
T2 представляет собой -NRaRb, где каждый из Ra и Rb независимо представляет собой H или C1-C6алкил, или Ra и Rb образуют вместе с атомом N, к которому они присоединены, 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, C1-C6алкил и 4-12-членное (например, 4-7-членное) гетероциклоалкильное кольцо, необязательно замещенное одним или несколькими -Q3-T3.
Q2 представляет собой C1-C3алкильный линкер, необязательно замещенный галогеном или гидроксилом.
Q2 представляет собой связь или метильный или этильный линкер, и T2 представляет собой H, галоген, -ORa, -NRaRb, -(NRaRbRc)+A- или -S(O)2NRaRb.
R7 не представляет собой H.
R7 представляет собой C1-C6алкил, C3-C8циклоалкил или 4-12-членный (например, 4-7-членный) гетероциклоалкил, каждый необязательно замещенный одним или несколькими -Q5-T5.
R7 представляет собой 4-7-членный гетероциклоалкил, необязательно замещенный одним или несколькими -Q5-T5.
R7 представляет собой пиперидинил, тетрагидропиран, циклопентил или циклогексил, каждый необязательно замещенный одним -Q5-T5.
T5 представляет собой H, галоген, C1-C6алкил, C1-C6алкоксил, C3-C8циклоалкил, C6-C10арил или 4-12-членный (например, 4-7-членный) гетероциклоалкил.
Q5 представляет собой связь, и T5 представляет собой C1-C6алкил, C3-C8циклоалкил или 4-12-членный (например, 4-7-членный) гетероциклоалкил.
Q5 представляет собой CO, S(O)2 или NHC(O); и T5 представляет собой C1-C6алкил, C1-C6алкоксил, C3-C8циклоалкил или 4-12-членный (например, 4-7-членный) гетероциклоалкил.
Q5 представляет собой C1-C3алкильный линкер, и T5 представляет собой H или C6-C10арил.
Q5 представляет собой C1-C3алкильный линкер, и T5 представляет собой C3-C8циклоалкил, 4-7-членный гетероциклоалкил или S(O)qRq.
R11 представляет собой H.
R7 представляет собой циклопентил или циклогексил, каждый необязательно замещенный одним -Q5-T5.
Q5 представляет собой NHC(O), и T5 представляет собой C1-C6алкил или C1-C6алкокси.
R7 представляет собой изопропил.
Каждый из R2 и R4 независимо представляет собой H или C1-C6алкил, необязательно замещенный амино, моно-C1-C6алкиламино, ди-C1-C6алкиламино или C6-C10арилом.
Каждый из R2 и R4 представляет собой метил.
R1 представляет собой H.
R12 представляет собой H, метил, этил, этенил или галоген.
R12 представляет собой метил.
R12 представляет собой этил.
R12 представляет собой этенил.
R8 представляет собой H, метил или этил.
R8 представляет собой метил.
R8 представляет собой этил.
R8 представляет собой 4-7-гетероциклоалкил, например, тетрагидропиран.
Z представляет собой NR7R8 или CR7R8R14, где R7 и R8 образуют вместе с атомом, к которому они присоединены, кольцо, выбранное из группы, состоящей из пиперидинила, морфолинила, пиперазинила и циклогексенила, причем каждый необязательно замещен одним -Q6-T6.
R13 представляет собой H или метил.
R13 представляет собой H.
R3 представляет собой H.
A- представляет собой Br-.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим один или несколько фармацевтически приемлемых носителей и одно или несколько соединений, выбранных из соединений любой формулы, раскрытых в настоящем документе.
Другим аспектом настоящего изобретения является способ лечения или профилактики рака. Способ включает в себя введение нуждающемуся в этом субъекту терапевтически эффективного количества одного или нескольких соединений, выбранных из соединений любой формулы, раскрытых в настоящем документе.
Если иное не указано особо, то любое описание способа лечения включает в себя применения соединений для обеспечения лечения или профилактики, такого как представлено в описании, а также применения соединений для получения лекарственного средства для лечения или профилактики такого состояния. Лечение включает в себя лечения людей или отличных от челевека животных, таких как грызуны и другие модели заболеваний.
Например, способ включает в себя стадию введения пациенту, страдающему раком с аберрантным метилированием H3-K27, эффективного количества одного или нескольких соединений любой из формул, раскрытых в настоящем документе, где соединение(ия) ингибирует(ют) гистонметилтрансферазную активность EZH2, проводя тем самым лечение рака. Примеры аберрантного метилирования H3-K27 могут включать в себя общее увеличение и/или изменение распределения ди- или триметилирования H3-K27 в хроматине злокачественной клетки.
Например, рак выбирают из группы, состоящей из видов рака, которые экспрессируют увеличенное количество EZH2 или других субъединиц PRC2, содержат мутации с потерей функции в деметилазах H3-K27, таких как UTX, или экспрессируют увеличенное количество вспомогательных белков, таких как PHF19/PCL3, способных увеличивать и или смещать активность EZH2 (см. ссылки в Sneeringer et al. Proc Natl Acad Sci USA 107(49):20980-5, 2010).
Например, способ включает в себя стадию введения пациенту, страдающему раком с повышенной экспрессией EZH2, терапевтически эффективного количества одного или нескольких соединений любой из формул, раскрытых в настоящем документе, где соединение(ия) ингибирует(ют) гистонметилтрансферазную активность EZH2, осуществляя тем самым лечение рака.
Например, способ включает в себя cтадию введения пациенту, страдающему раком с мутацией с потерей функции деметилазы H3-K27 UTX, терапевтически эффективного количества одного или нескольких соединений любой формулы, раскрытой в настоящем документе, где соединение(ия) ингибирует гистонметилтрансферазную активность EZH2, проводя тем самым лечение рака.
Например, способ включает в себя стадию введения пациенту, страдающему раком с повышенной экспрессией вспомогательного компонента(ов) PRC2, такого как PHF19/PCL3, терапевтически эффективного количества одного или нескольких соединений любой формулы, раскрытой в настоящем документе, где соединение(ия) ингибирует гистонметилтрансферазную активность EZH2, осуществляя тем самым лечение рака.
Согласно другому аспекту, настоящее изобретение относится к способу модулирования активности EZH2 дикого типа, каталитической субъединицы комплекса PRC2, которая катализирует от моно- до триметилирования лизина 27 в гистоне H3 (H3-K27). Например, настоящее изобретение относится к способу ингибирования активности EZH2 в клетке. Данный способ может быть осуществлен либо in vitro, либо in vivo.
Согласно еще одному аспекту, настоящее изобретение относится к способу ингибирования у пациента преобразования H3-K27 в триметилированный H3-K27. Способ включает в себя введение пациенту терапевтически эффективного количества одного или нескольких соединений любой из формул, раскрытых в настоящем документе, для ингибирования гистонметилтрансферазной активности EZH2, ингибируя тем самым преобразование H3-K27 в триметилированный H3-K27 у пациента.
Например, способ включает в себя стадию введения пациенту, страдающему раком с экспрессией мутанта EZH2 по остатку Y641, терапевтически эффективного количества одного или нескольких соединений любой формулы, раскрытой в настоящем документе, где соединение(ия) ингибирует(ют) гистонметилтрансферазную активность EZH2, осуществляя тем самым лечение рака.
Например, рак выбирают из группы, состоящей из фолликулярной лимфомы и диффузной B-крупноклеточной лимфомы (DLBCL) из подобных В-клеткам клеток зародышевого центра (GCB). Например, рак представляет собой лимфому, лейкоз или меланому. Предпочтительно лимфома представляет собой неходжкинскую лимфому, фолликулярную лимфому или диффузную крупноклеточную B-клеточную лимфому. В качестве альтернативы, лейкоз представляет собой хронический миелоидный лейкоз (CML), острый миелолейкоз, острый лимфоцитарный лейкоз или лейкоз смешанного происхождения. Преканцерозным состоянием является миелодиспластический синдром (MDS, ранее известный как предлейкоз). Например, рак представляет собой рак системы крови.
Например, способ включает в себя введение пациенту, страдающему раком, экспрессирующим мутант EZH2 по остатку Y641, терапевтически эффективного количества одного или нескольких соединений любой формулы, раскрытой в настоящем документе, где соединение(ия) селективно ингибирует(ют) гистонметилтрансферазную активность мутанта EZH2 по остатку Y641, осуществляя тем самым лечение рака.
Например, способ дополнительно включает в себя стадии проведения анализа для определения мутанта EZH2 по остатку Y641 в образце, содержащем злокачественные опухолевые клетки пациента, страдающего раком.
Согласно другому аспекту, настоящее изобретение относится к способу модулирования гистонметилтрансферазной активности EZH2 дикого типа и мутанта EZH2, каталитической субъединицы комплекса PRC2, который катализирует от моно- до триметилирования лизина 27 в гистоне H3 (H3-K27). Например, настоящее изобретение относится к способу ингибирования активности определенных мутантных форм EZH2 в клетке. Мутантные формы EZH2 включают в себя замену другим аминокислотным остатком тирозина 641 (Y641, также Tyr641) в EZH2 дикого типа. Способ включает в себя воздействие на клетку эффективным количеством одного или нескольких соединений любой из формул, раскрытых в настоящем документе. Данный способ можно осуществлять либо in vitro, либо in vivo.
Согласно еще одному аспекту, настоящее изобретение относится к способу ингибирования у пациента преобразования H3-K27 в триметилированный H3-K27. Способ включает в себя введение пациенту, экспрессирующему мутанта EZH2 по остатку Y641, терапевтически эффективного количества одного или нескольких соединений любой из формул, раскрытых в настоящем документе, для ингибирования гистонметилтрансферазной активности EZH2, ингибируя тем самым преобразование H3-K27 в триметилированный H3-K27 у пациента. Например, ингибированная гистонметилтрансферазная активность представляет собой гистонметилтрансферазную активность мутанта EZH2 по остатку Y641. Например, соединение согласно настоящему изобретению селективно ингибирует гистонметилтрансферазную активность мутанта EZH2 по остатку Y641. Например, мутант EZH2 по остатку Y641 выбирают из группы, состоящей из Y641C, Y641F, Y641H, Y641N и Y641S.
Способ ингибирования у пациента преобразования H3-K27 в триметилированный H3-K27 может также включать в себя проведение анализа для определения мутанта EZH2 по остатку Y641 в образце пациента до введения пациенту, экспрессирующему мутант EZH2 по остатку Y641, терапевтически эффективного количества одного или нескольких соединений любой из формул, раскрытых в настоящем документе. Например, проведение анализа для определения мутанта EZH2 по остатку Y641 включает в себя полногеномное ресеквенирование или ресеквенирование целевых участков, которое выявляет нуклеиновую кислоту, кодирующую мутантный Y641 в EZH2. Например, проведение анализа для определения мутанта EZH2 по остатку Y641 включает в себя взаимодействие образца с антителом, которое специфически связывается с полипептидом или его фрагментом, характеристичным для мутанта EZH2 по остатку Y641. Например, проведение анализа для определения мутанта EZH2 по остатку Y641 включает в себя взаимодействие образца в очень строгих условиях с зондом нуклеиновой кислоты, которая гибридизуется с нуклеиновой кислотой, кодирующей полипептид или его фрагмент, характеристичный для мутанта EZH2 по остатку Y641.
Кроме того, настоящее изобретение также относится к способу идентификации ингибитора мутанта EZH2 по остатку Y641. Способ включает в себя стадии объединения выделенного мутанта EZH2 по остатку Y641 с гистоновым субстратом, донором метильной группы и тестируемым соединением, где гистоновый субстрат включает в себя форму H3-K27, выбранную из группы, состоящей из неметилированного H3-K27, монометилированного H3-K27, диметилированного H3-K27 и любого их сочетания; и проведения анализа для выявления метилирования H3-K27 (например, образования триметилированного H3-K27) в гистоновом субстрате, идентифицируя тем самым тестируемое соединение в качестве ингибитора мутанта EZH2 по остатку Y641, когда метилирование H3-K27 (например, образование триметилированного H3-K27) в присутствии тестируемого соединения меньше, чем метилирование H3-K27 (например, образование триметилированного H3-K27) в отсутствие тестируемого соединения.
Согласно одному варианту осуществления, проведение анализа для выявления метилирования H3-K27 в гистоновом субстрате включает в себя измерение встраивания меченых метильных групп.
Согласно одному варианту осуществления, меченые метильные группы представляют собой меченные изотопом метильные группы.
Согласно одному варианту осуществления, проведение анализа для выявления метилирования H3-K27 в гистоновом субстрате включает в себя взаимодействие гистонового субстрата с антителом, которое специфически связывается с триметилированным H3-K27.
Кроме того, под объем настоящего изобретения подпадает способ идентификации селективного ингибитора мутанта EZH2 по остатку Y641. Способ включает в себя стадии объединения выделенного мутанта EZH2 по остатку Y641 с гистоновым субстратом, донором метильной группы и тестируемым соединением, где гистоновый субстрат включает в себя форму H3-K27, выбранную из группы, состоящей из монометилированного H3-K27, диметилированного H3-K27 и сочетания монометилированного H3-K27 и диметилированного H3-K27, с получением тем самым тестируемой смеси; объединения выделенного EZH2 дикого типа с гистоновым субстратом, донором метильной группы и тестируемым соединением, где гистоновый субстрат включает в себя форму H3-K27, выбранную из группы, состоящей из монометилированного H3-K27, диметилированного H3-K27 и сочетания монометилированного H3-K27 и диметилированного H3-K27, с получением тем самым контрольной смеси; проведения анализа для определения триметилирования гистонового субстрата в каждой из тестируемой смеси и контрольной смеси; вычисления соотношения (a) триметилирования с использованием мутанта EZH2 по остатку Y641 и тестируемого соединения (M+) к (b) триметилированию с использованием мутанта EZH2 по остатку Y641 без тестируемого соединения (M-); вычисления соотношения (c) триметилирования с использованием EZH2 дикого типа и тестируемого соединения (WT+) к (d) триметилированию с использованием EZH2 дикого типа без тестируемого соединения (WT-); сравнения соотношения (a)/(b) с соотношением (c)/(d); и идентификации тестируемого соединения в качестве селективного ингибитора мутанта EZH2 по остатку Y641, когда соотношение (a)/(b) меньше, чем соотношение (c)/(d).
Настоящее изобретение дополнительно относится к способу определения пациента в качестве кандидата для лечения одним или несколькими соединениями согласно настоящему изобретению. Способ включает в себя стадии проведения анализа для определения мутанта EZH2 по остатку Y641 в образце пациента; и выявления пациента, экспрессирующего мутант EZH2 по остатку Y641, в качестве кандидата для лечения одним или несколькими соединениями согласно настоящему изобретению, где соединение(ия) ингибирует(ют) гистонметилтрансферазную активность EZH2.
Согласно еще одному аспекту, настоящее изобретение относится к способу ингибирования преобразования H3-K27 в триметилированный H3-K27. Способ включает в себя стадию взаимодействия мутанта EZH2 по остатку Y641 с гистоновым субстратом, содержащим H3-K27 и эффективное количество соединения согласно настоящему изобретению, где соединение ингибирует гистонметилтрансферазную активность EZH2, ингибируя тем самым преобразование H3-K27 в триметилированный H3-K27.
Кроме того, соединения или способы, описанные в настоящем документе, могут быть использованы для исследования (например, изучения эпигенетических ферментов) и для других, не относящихся к терапии целей.
Если иное не указано особо, то все технические и научные термины, используемые в настоящем документе, имеют те же значения, что обычно понимаемые средним специалистом в области техники, к которой относится настоящее изобретение. В настоящем описании, формы единственного числа также включают в себя множественные числа, если контекст документа четко не диктует иное. Хотя при применении на практике или тестировании настоящего изобретения могут быть использованы способы и вещества, сходные или эквивалентные описанным в настоящем документе, подходящие способы и вещества описаны ниже. Все публикации, заявки на выдачу патента, патенты и другие материалы, процитированные в настоящем документе, включены в него посредством ссылки. Материалы, процитированные в настоящем документе, не признаются в качестве уровня техники, предшествующего заявляемому изобретению. В случае конфликта, настоящее описание, включая определения, будет иметь преимущественную силу. Кроме того, вещества, способы и примеры являются иллюстративными и не призваны быть ограничивающими.
Другие черты и преимущества настоящего изобретения станут очевидны из последующего подробного описания и формулы изобретения.
Краткое описание чертежей
Фигура 1 (A) представляет собой идеализированный график зависимости числа клеток (то есть количества клеток) от времени, отражающий экспоненциальную пролиферацию в процессе log-фазы роста клеток.
Фигура 1(B) представляет собой идеализированный график за