Композиции и способы доставки терапевтических средств
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и представляет собой наночастицу для подавления ретровирусной инфекции, содержащую по меньшей мере одно терапевтическое средство и по меньшей мере одно поверхностно-активное вещество, где указанная наночастица является кристаллической, где указанное поверхностно-активное вещество покрывает кристалл указанного терапевтического средства, где указанное терапевтическое средство выбрано из группы, состоящей из атазанавира (ATV), эфавиренза (EFV), индинавира (IDV) и ритонавира (RTV), где указанное поверхностно-активное вещество является амфифильным блок-сополимером, где указанная наночастица получена с помощью мокрого размола или гомогенизации высокого давления и где указанная наночастица содержит по меньшей мере 95% терапевтического средства; композицию для подавления ретровирусной инфекции; способ лечения или подавления HIV-инфекции. Изобретение обеспечивает устойчивую доставку лекарственного средства в сыворотку и ткани и улучшенную противовирусную эффективность относительно эквивалентной дозы свободного лекарственного средства. 3 н. и 15 з.п. ф-лы, 5 пр., 4 табл., 25 ил.
Реферат
В соответствии с §119 (е) Патентного закона США раздела 35 настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/409372, поданной 2 ноября 2010 года, и предварительной заявки на патент США №61/526976, поданной 24 августа 2011 года. Вышеупомянутая заявка включена в данный документ посредством ссылки.
Настоящее изобретение выполнено при правительственной поддержке в рамках гранта №1P01DA026146-01, предоставленного Национальными институтами здравоохранения/Национальным институтом по вопросам злоупотребления наркотическими средствами. Правительство имеет определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение, в основном, относится к доставке терапевтических средств. А именно, настоящее изобретение относится к композициям и способам доставки терапевтических средств пациенту для лечения вирусной инфекции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Необходимость в улучшении биодоступности, фармакологии, цитотоксичности и интервала дозирования противоретровирусных лекарственных препаратов в лечении инфекции, вызываемой вирусом иммунодефицита человека (HIV), широко известна (Broder, S. (2010) Antivir. Res., 85:1-18; Este et a 1. (2010) Antivir. Res., 85:25-33; Moreno et al. (2010) J. Antimlcrob. Chemother., 65:827-835). После внедрения противоретровирусной терапии (ART) значительно снизились случаи, как летальных исходов, так и сопутствующих заболеваний, ассоциированных с HIV-1 инфекцией. Было показано, у что составленного в наночастицы индинавира (IDV) может улучшаться поиск тканей-мишеней и противоретровирусная эффективность (Dou et al. (2006) Blood 108:2827-2835; Dou et al. (2009) J. Immunol. 183:661-669; Dou et al. (2007) Virology 358:148-158; Nowacek et al. (2009) Nanomedicine 4:903-917). Однако все еще остаются многие ограничения, ассоциированные с ART, которые препятствуют полной супрессии репликации вируса у HIV-инфицированных индивидуумов. Эти ограничения включают неудовлетворительную фармакокинетику (РК) и поиск тканей-мишеней, пожизненное лечение и множество неблагоприятных токсических побочных эффектов (Garvie et al. (2009) J. Adolesc. Health 44:124-132; Hawkins, Т. (2006) AIDS Patient Care STDs 20:6-18; Royal et al. (2009) AIDS Care 21:448-455). Поскольку противоретровирусные лекарственные препараты быстро выводятся из организма и не до конца проникают во все органы, схемы дозирования обычно бывают сложными и предполагают большие количества лекарственного средства. Пациентам тяжело надлежащим образом следовать рекомендациям терапии, что приводит к неоптимальному соблюдению рекомендаций и повышенному риску развития вирусной резистентности, результатом чего может быть безуспешность лечения и ускоренное прогрессирование заболевания (Danel et al. (2009) J. Infect. Dis. 199:66-76). Для HIV-инфицированных пациентов, у которых также имеются психиатрические и психические расстройства и/или злоупотребление наркотическими средствами, точное соблюдение рекомендаций терапии является даже более сложным (Meade et al. (2009) AIDS Patient Care STDs 23:259-266; Baum et al. (2009) J. Acquir. Immune Defic. Syndr., 50:93-99). В этой связи, существует необходимость в системах доставки лекарственных средств, которые оптимизируют поглощение клеткой, улучшают внутриклеточную стабильность, расширяют высвобождение лекарственного средства, поддерживают противоретровирусную эффективность и минимизируют клеточную токсичность внутри транспортирующих клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением обеспечиваются кристаллические наночастицы, содержащие по меньшей мере одно терапевтическое средство и по меньшей мере одно поверхностно-активное вещество. В конкретном варианте осуществления поверхностно-активное вещество представляет собой амфифильный блок-сополимер. В конкретном варианте осуществления поверхностно-активное вещество связано по меньшей мере с одним нацеливающим лигандом, таким как макрофаг-нацеливающий лиганд. В конкретном варианте осуществления терапевтическое средство представляет собой противовирусное, противоретровирусное соединение или соединение против HIV. Также обеспечиваются композиции, содержащие по меньшей мере наночастицу по настоящему изобретению и по меньшей мере один фармацевтически приемлемый носитель.
В соответствии с другим аспектом настоящего изобретения обеспечиваются способы нацеливания терапевтических средств на орган(ы) и способы лечения, подавления или предупреждения заболевания или расстройства у субъекта. В конкретном варианте осуществления способ включает введение субъекту по меньшей мере одной наночастицы по настоящему изобретению. В конкретном варианте осуществления способ включает нацеливание терапевтического средства на головной мозг. В конкретном варианте осуществления способы служат для лечения, подавления или предупреждения HIV-инфекции, и терапевтическое средство наночастицы представляет собой соединение против HIV. В конкретном варианте осуществления способ дополнительно включает введение по меньшей мере одного дополнительного терапевтического средства или терапии заболевания или расстройства, например, по меньшей мере одно добавочное соединение против HIV.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
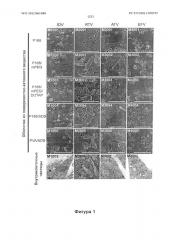
На фигуре 1 представлены фотоснимки морфологии nanoART и включения nanoART в клетку. Анализы с помощью сканирующей электронной микроскопии (SEM) (увеличение 15000х) составов с наночастицами IDV (М1001-М1005), RTV (M2001-M2005), ATV (М3001-М3005) и EFV (M4001-M4005) на верхней поверхности поликарбонатной мембраны для фильтрации толщиной 0,2 мкм. Все IDV nanoART были от сферических до эллипсоидных с зазубренными краями; nanoART ритонавира (RTV) были похожи на толстые палочки с гладкими краями; nanoART атазанавира (ATV) были похожи на тонкие палочки с гладкими краями, а nanoART эфавиренза (EFV) были от сферических до эллипсоидных с зазубренными краями. Трансмиссионная электронная микроскопия (ТЕМ) (увеличение 15000х) продемонстрировала поглощение nanoART в MDM, на которые воздействовали М1004, М2006, М3001 и М4002. Внутри клеток каждый тип nanoART легко идентифицируется по форме, и пример был приведен для IDV (М1004), RTV (M2006), ATV (М3001) и EFV (М4002). Масштабная линия на всех кадрах равна 1,0 мкм.
На фигуре 2 представлены динамики поглощения IDV, RTV, ATV и EFV nanoART в макрофаг, происходящий из моноцита (MDM). Уровни IDV (фиг.2А), RTV (фиг.2В), ATV (фиг.2С) или EFV (фиг.2D) из клеточных лизатов культивируемых MDM, обработанных nanoART и собранных в 1, 2, 4 и 8 часов, анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Данные представлены в виде среднего±стандартная ошибка среднего (SEM) для n=3 определений/момент времени.
На фигуре 3 представлена площадь под кривой (AUC) поглощения nanoART в MDM. AUC поглощения IDV (фиг.3А), RTV (фиг.3В), ATV (фиг.3С) и EFV (фиг.3D) определяли в клеточных лизатах культивируемых MDM, обработанных 100 мкм nanoART и собранных после 1, 2, 4 и 8 часов. Данные представлены в виде средней AUC для n=3 определений/обработку.
На фигуре 4 представлено балльное оценивание составов nanoART на основании поглощения лекарственного средства, высвобождения и противоретровирусной активности. а Поглощение лекарственного средства на основании AUC концентрации лекарственного средства в MDM на протяжении 8 часов. b Удержание клеткой на основании AUC концентрации лекарственного средства, удержанного в MDM на протяжении 15 дней. с Высвобождение в среду на основании AUC концентрации лекарственного средства, высвобождаемого в среду на протяжении 15 дней. d Противоретровирусная активность определялась исходя из AUC активности обратной транскриптазы (RT) из супернатанта от инфицированных MDM через 15 дней. е GO/NOGO на основании среднего значения параметров, получивших балльную оценку.
На фигурах 5А и 5В представлены динамики удержания клеткой и высвобождения IDV, RTV, ATV и EFV nanoART. Уровни IDV, RTV, ATV или EFV в клеточных лизатах и среде клеток анализировали с помощью ВЭЖХ в дни 1, 5, 10 и 15 после обработки nanoART. Данные представлены в виде среднего ± SEM для n=3 определений/момент времени. Для М1002-М1005 уровни IDV не обнаруживались в среде в день 15 (предел обнаружения: 0,025 мкг/мл).
На фигуре 6 показана Противоретровирусная эффективность nanoART. Сравнение противоретровирусных эффектов в MDM, зараженных HIV-1ADA через 15 дней после предварительной обработки nanoART, которые измерялись с помощью активности RT через 10 дней после заражения вирусом. Активности RT измеряли с помощью включения 3H-ТТР. Данные представлены в виде среднего для n=8 определений/обработку.
На фигуре 7 представлена экспрессия антигена р24 HIV-1 в клетках, обработанных nanoART. Сравнение противоретровирусных эффектов М1002 с М1004, М2002 с М2004, М3001 с М3005 и М4003 с М4005 при заражении hiv-iada через 1-15 дней после предварительной обработки nanoART. Через десять дней после каждого заражения вирусом клетки окрашивали с применением иммунной метки к антигену р24 HIV-1. Для клеток, обработанных обоими составами IDV, M2002 (RTV) и М3005 (ATV), показано постепенное снижение подавления вируса и возрастание экспрессии р24 HIV с течением времени; тогда как для клеток, обработанных М2004 (RTV), M3001 (ATV) и обоими составами EFV, показано полная или сильно улучшенная супрессия вирусной продукции р24. Однако даже в клетках, обработанных nanoART, где наблюдался вирусный прорыв, экспрессия р24 была ниже, чем в клетках, инфицированных HIV-1, которые не были обработаны nanoART.
На фигуре 8 показаны характеристики наночастицы ритонавира и ее взаимодействие с клеткой. На фигуре 8А показана RTV-NP с измерениями физических свойств и с изображением покрытия из внутреннего слоя mPEG2000 DSPE/ISS и наружного слоя DOTAP. Размер и заряд определяли с помощью динамического рассеяния света. Получали по меньшей мере четыре повторения для каждого измеренного значения с <2% дисперсией. Сканирующая электронная микроскопия (увеличение 15000х) RTV-NP на верхней поверхности поликарбонатной мембраны толщиной 0,2 мкм показывает типичную морфологию, напоминающую короткие палочки с гладкими краями (фиг.8В). Поглощение RTV-NP в макрофагах, происходящих из моноцитов (MDM), в продолжение 12 часов и удержание RTV-NP внутри MDM (левая y-ось) и высвобождение лекарственного средства в окружающую среду (правая y-ось) в продолжение 15 дней определяли с помощью высокоэффективной жидкостной хроматографии (фиг.8С и 8D). Данные проточной цитометрии и данные высокоэффективной жидкостной хроматографии для MDM, на которые воздействовали флуоресцентными RTV-NP, демонстрируют, что обработка MDM ингибитором клатрина дайносором значительно снижает поглощение (фиг.8Е и 8F). Все данные представлены в виде среднего±стандартная ошибка среднего для n=3.
На фигуре 9 показаны протеомные анализы мест локализации RTV-NP. Внутриклеточные RTV-NP идентифицировали внутри обособленных мембранных компартментов с помощью трансмиссионной электронной микроскопии (увеличение 15000х) (фиг.9А). На фигуре 9В показан способ определения внутриклеточной локализации. RTV-NP пометили бриллиантовым голубым-250 и воздействовали ими на MDM. Клетки лизировали и внутриклеточные компартменты разделили с помощью центрифугирования в градиенте сахарозы. Полоски представляют компартменты, содержащие RTV-NP. Эти полоски собирали и белки разделяли электрофорезом. После расщепления трипсином в геле белки идентифицировали с применением жидкостной хроматографии/масс-спектрометрии. На фигуре 9С показано внутриклеточное распределение идентифицированных белков. Идентифицировали всего 38 эндосомальных белков. Протеомный анализ показал, что распределение RTV-NP было преимущественно в компартментах ре циркулирующих эндосом (RE) и ранних эндосом (ЕЕ).
На фигуре 10 представлены белковые маркеры, ассоциированные с эндосомами, содержащими наночастицы ритонавира. +Для каждого белка был идентифицирован ряд уникальных значимых (р<0,05) пептидов. +Теоретическую молекулярную массу для первичного продукта трансляции рассчитывали на основании последовательностей ДНК. § Номера доступа для UniProt (доступны на www.uniprot.org). 1[Постулируемые внутриклеточные локализации (см. www.uniprot.org, locate.imb.uq.edu.au, andwww.ncbi.nim.nih.gov/pubmed). #Постулируемая клеточная функция (см. www.uniprot.org, locate.imb.uq.edu.au и www.ncbi.nim.nih.gov/pubmed). CCP: Ямки, окаймленные клатрином; L: лизосомы; LE: поздние эндосомы; MVB: мультивезикулярные тельца; SE: сортирующие эндосомы.
На фигуре 11 показана иммуногистологическая идентификация внутриклеточной локализации наночастиц. С помощью конфокальной микроскопии подтвердилось распределение RTV-NP внутри эндоцитозных компартментов (фиг.11А-Н). Коэффициенты колокализации Пирсона указывают, что RTV-NP распределены преимущественно в рециркулирующих эндосомах Rab11 и Rab14 по сравнению с ранними эндосомами, эндосомами Rab8 или Rab7 и лизосомами (фиг.11I). Анализ распределения RTV-NP внутри подкисленных (деградирующих) компартментов, идентифицируемых посредством декстрановых гранул pHrodo™, выявляет минимальное перекрывание, указывающее на то, что RTV-NP, вероятно, избегают деградации внутри клетки и, в основном, рециклируются на высвобождение. Высокая колокализация RTV-NP с трансферрином также указывает на то, что частицы, наиболее вероятно, рециклируются. Масштабные линии равны 1 мкм. Данные на графе представлены в виде среднего ± стандартная ошибка среднего для n=3.
На фигуре 12 показана проверка данных внутриклеточной локализации наночастиц. Нарушение эндоцитозного рециклирования с помощью siRNA (Rab8, 11 и 14), а также нарушение клеточной секреции с помощью брефелдина А, привело в результате к нокауту ассоциированного белка и вызвало перераспределение RTV-NP внутри макрофагов, происходящих из моноцитов (фиг.12Л и 12В). В каждом случае, обработка siRNA привела в результате к скоплению RTV-NP в перинуклеарной области внутри крупных вакуолей. siRNA-сайленсинг специфических белков подтверждали посредством вестерн-блоттинга (фиг.12С). Количественное определение RTV-NP с помощью высокоэффективной жидкостной хроматографии в клетках (фиг.12D) и культуральных жидкостях (фиг.12Е) продемонстрировало, что нарушение эндоцитозного рециклирования и подавление секреции значительно повысило клеточное удержание RTV-NP и снизило высвобождение. Верхнее р-значение указывает отличие от контрольных клеток и нижнее р-значение указывает отличие от клеток, обработанных скремблированной siRNA. Масштабные линии равны 1 мкм. Данные на графе представлены в виде среднего ± стандартная ошибка среднего для n=3.
На фигуре 13 показано, что наночастицы ритонавира транспортируются во время эндоцитозной сортировки. Поскольку RTV-NP пометили с помощью липофильных красителей (DiD или DiO), которые связываются с полимерной оболочкой, а не с собственно кристаллом лекарственного средства, протестировали, совпадало ли эндоцитозное распределение лекарственного средства с таковым помеченного полимера. Обработка MDM с помощью RTV-NP и последующее иммунное выделение внутриклеточных компартментов и ВЭЖХ-анализ содержания лекарственного средства (фиг.13А). На фигуре 13В представлен фотоснимок магнитных гранул вместе с выделенными иммунным способом эндосомальными компартментами перед ВЭЖХ-анализом; белое вещество на верхней поверхности осадка гранул в пробирке Rabll составляли, предположительно, эндосомы, заполненные RTV-NP. На фигуре 13С представлены ВЭЖХ-анализы выделенных иммунным способом компартментов, которые подтвердили, что большее количество RTV присутствует в эндосомах Rabll, чем как в ЕЕА1, так и в LAMP1. Данные на графе представлены в виде среднего ± стандартная ошибка среднего для n=3. Значимо(р<0,01) отличается от контроля. Значимо (р<0,01) отличается от Rab11.
На фигуре 14 показано, что наночастицы ритонавира высвобождаются интактными и сохраняют свою противоретровирусную эффективность. Сканирующая электронная микроскопия (увеличение 15000х) нативных RTV-NP (фиг.14А) и RTV-NP, высвобожденных из клеток в окружающую среду (фиг.14В). RTV-NP отделили от растворенного лекарственного средства с помощью ультрацентрифугирования; показана процентная доля общего лекарственного средства как в форме частиц, так и растворенной форме. Концентрация общего лекарственного средства составила 40 мкг/мл (фиг.14С). Макрофаги, происходящие из моноцитов, обработали или свободным RTV, или нативными RTV-NP, или высвобожденными RTV-NP и затем заразили HIV. Обработка макрофагов, происходящих из моноцитов, высвобожденными RTV-NP снижало вирусную инфекцию до уровней подобных нативным (не подвергшимся эндоцитозу) частицам, как видно посредством р24-окраски и образования многоядерных гигантских клеток (фиг.14D), измерения активности RT (фиг.14Е) и плотности р24-окраски (фиг.14F). Для обоих измерений, как активности RT, так и плотности р24, все данные представлены в виде среднего±стандартная ошибка среднего для n=4.
На фигуре 15 представлено схематическое изображение возможных внутриклеточных путей частиц ритонавира. RTV-NP попадают внутрь MDM через ямки, окаймленные клатрином, и затем транспортируются в компартмент ранней эндосомы (ЕЕ). Из компартмента ЕЕ частицы могут иметь три различные судьбы: быстрая рециркуляция через эндосомы Rab4+ или 14+; направленное перемещение в позднюю эндосому, регулируемое, частично, с помощью системы ESCRT для последующего высвобождения в виде секреторной лизосомы; или, для большинства частиц, транспорт в компартмент рециркулирующей эндосомы (RE), где они будут храниться в течение продолжительных периодов и медленно рециркулировать через эндосомы Rab11+.
На фигуре 16 представлено схематическое изображение синтеза полоксамеров с концевым фолатом (FA) (P188 и Р407).
На фигуре 17 представлены фотоснимки морфологии наносуспензий ATV. Полученные с помощью сканирующего электронного микроскопа (SEM; 15000х увеличение) микрофотографии составов с наночастицами ATV на верхней поверхности поликарбонатной мембраны толщиной 0,2 мкм. Все составы с наночастицами ATV были палочкообразными независимо от типа полимерной оболочки. Линия = 1 микрон.
На фигуре 18 показано поглощение наносуспензий ATV, содержащих немодифицированные P188 или FA-P188. На фигуре 18А показано, что поглощение наносуспензий ATV в неактивированных человеческих макрофагах, происходящих от моноцитов (MDM) улучшилось, когда частицы покрыли 10% или 30% FA-P188. На фигуре 18В показано, что поглощение наносуспензий ATV не менялось у MDM, предварительно обработанных 50 нг/мл LPS в течение 24 часов. На фигуре 18С показано, что улучшенное поглощение наносуспензий ATV, покрытых 20% FA-P188, снизилось при добавлении 2,5 мМ свободной фолиевой кислоты. Данные представлены в виде среднего ± SEM.
На фигуре 19 показано поглощение наносуспензий ATV, декорированных FA-P407. Поглощение наносуспензий P407-ATV улучшилось при включении FA-P407 в полимерную оболочку. Данные представлены в виде среднего ± SEM.
На фигуре 20 показано поглощение, удержание и высвобождение макрофагами наносуспензий ATV с модифицированными фолатом полоксамерами и без них. Поглощение наносуспензий ATV, содержащих Р407, улучшилось относительно поглощения наносуспензий ATV, содержащих Р188. Наблюдали улучшенное поглощение наносуспензий ATV, покрытых конъюгированными с фолатом полоксамерами, в сравнении с наносуспензиями, покрытыми неконъюгированными полоксамерами. Профили удержания клеткой наносуспензий ATV на протяжении 15 дней были аналогичными для всех полимерных оболочек и зависели от первоначальной загрузки клетки. Непрерывное высвобождение ATV в среду было аналогичным на протяжении 15 дней для всех составов. Данные представлены в виде среднего ± SEM.
На фигуре 21 показаны противоретровирусные эффекты наносуспензий ATV. Активность обратной транскриптазы (RT) в среде от клеток, нагружаемых наносуспензиями ATV в течение 8 часов и затем зараженных HIV-1ADA в 1, 5, 10 и 15 дни после обработки лекарственным средством. Активность RT измеряли посредством внедрения 3H-ТТР. Данные представлены в виде среднего N=8 измерений.
На фигуре 22 показано р24+ - окрашивание HIV-1 у MDM, загруженных наносуспензиями ATV и инфицированных HIV-1ADA - MDM загружали nanoART в течение 8 часов и затем заражали вирусом HIV-1 в 1, 5, 10 или 15 дни после удаления наносуспензий ATV из культуральной среды. Масштабная линия ± 250 микрон.
На фигуре 23 представлено схематическое изображение синтеза F127 с концевой маннозой (манноза-F127).
На фигуре 24 показано поглощение фолат-ATV nanoART в MDM. P188-FA, F127-FA и F127-M отражают поглощение фолат-F68-АТУ nanoART, фолат-F127-АТУ nanoART и манноза-F127-АТУ nanoART в MDM, соответственно. Р188 и F127 представляют поглощение ненацеленных F68- и F127-ATV nanoART в MDM.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Долгосрочная противоретровирусная терапия (ART) в отношении инфекции, вызываемой вирусом иммунодефицита человека типа один (HIV-1) показывает ограничения в фармакокинетике и поиске тканей-мишеней, при этом вызывает метаболические и цитотоксические отклонения. В свою очередь, при ART обычно требуются сложные схемы дозирования, и это приводит к возникновению резистентности вируса и безуспешности лечения. Составленные в наночастицы композиции для ART по настоящему изобретению устраняют такие ограничения и влияют на улучшенные клинические исходы. В данном документе, показано, что после клатрин-зависимого эндоцитоза наночастицы (NP) избегали лизосомной деградации посредством сортировки из ранних эндосом в рециркулирующем пути эндосом. Частицы высвобождались интактными и полностью сохраняли противоретровирусную эффективность. Эти результаты предусматривают возможные пути внутриклеточного транспорта противоретровирусных составов наночастиц, которые сохраняют как целостность частицы, так и противоретровирусные активности, что демонстрирует потенциальную полезность данного подхода для нацеленной доставки лекарственного средства. В самом деле, внутриклеточное место локализации NP и их медленное высвобождение лежит в основе долгосрочной противоретровирусной эффективности. Кроме того, данные демонстрируют, что клетки, такие как макрофаги, могут действовать как переносчики лекарственного средства и, что важно, не деградируют и не модифицируют нагруженные лекарственным средством частицы при переносе. В связи с этим, биологически активное(ые) лекарственное(ые) средство(а) доставляется неизмененным в его намеченные места назначения.
Настоящее изобретение охватывает наночастицы для доставки соединений в клетку. В конкретном варианте осуществления наночастица служит для доставки противоретровирусной терапии субъекту. Наночастицы по настоящему изобретению содержат по меньшей мере одно соединение, представляющее интерес, и по меньшей мере одно поверхностно-активное вещество. Эти компоненты наночастицы вместе с другими необязательными компонентами описаны ниже.
I. Терапевтическое средство
Наночастицы по настоящему изобретению можно применять для доставки любого средства(средств) или соединения(и), в частности биоактивных средств (например, терапевтического средства или диагностического средства), в клетку или субъекту (в том числе животным, отличным от человека). Используемое в данном документе выражение "биоактивное средство" также включает соединения, подлежащие скринингу в качестве потенциальных лидеров в разработке лекарственных средств или средств защиты растений. Биоактивное средство и терапевтические средства включают, без ограничения, полипептиды, пептиды, гликопротеины, нуклеиновые кислоты, синтетические и природные лекарственные средства, пептоиды, полиены, макроциклы, гликозиды, терпены, терпеноиды, алифатические и ароматические соединения, малые молекулы и их производные и соли. В конкретном варианте осуществления терапевтическое средство представляет собой химическое соединение, такое как синтетическое и природное лекарственное средство. Несмотря на то, что любой тип соединения может доставляться в клетку или субъекту с помощью композиций и способов по настоящему изобретению, в следующем описании настоящего изобретения приводится пример соединения в качестве терапевтического средства.
Наночастицы по настоящему изобретению содержат по меньшей мере одно терапевтическое средство. Наночастицы являются, в основном, кристаллическими (твердые вещества со свойствами кристаллов) наночастицами терапевтического средства, причем наночастицы, как правило, содержат приблизительно 99% чистого терапевтического средства. В конкретном варианте осуществления наночастицы синтезируют с помощью добавления терапевтического средства, в частности, формы свободного основания терапевтического средства к раствору поверхностно-активного вещества (описывается ниже), и затем получают наночастицы с помощью мокрого размола или гомогенизации высокого давления. Терапевтическое средство и раствор поверхностно-активного вещества можно перемешивать перед мокрым размолом или гомогенизацией высокого давления.
В конкретном варианте осуществления получаемая в результате наночастица составляет до 1 мкм в диаметре. В конкретном варианте осуществления наночастица имеет от приблизительно 200 нм до приблизительно 500 им в диаметре, в частности, приблизительно 250-350 нм в диаметре. В конкретном варианте осуществления наночастицы являются палочкообразными, в частности, удлиненными палочками, а не неправильными или округлыми. Наночастицы по настоящему изобретению могут быть нейтральными или заряженными. Наночастицы могут быть заряжены положительно или отрицательно.
Терапевтическое средство может представлять собой гидрофобное, нерастворимое в воде соединение, или слаборастворимое в воде соединение. Например, терапевтическое средство может иметь растворимость меньше чем приблизительно 10 мг/мл, меньше чем 1 мг/мл, конкретнее, меньше чем приблизительно 100 мкг/мл и, конкретнее, меньше приблизительно 25 мкг/мл в воде или водных средах в диапазоне рН 0-14, конкретно, рН 4-10, в частности, при 20°С.
В конкретном варианте осуществления терапевтическое средство наночастиц по настоящему изобретению представляет собой противомикробное средство. В другом варианте осуществления терапевтическое средство является противовирусным средством, конкретнее, противоретровирусным средством. Противоретровирусное средство может быть эффективным против лентивирусов или специфичным к ним. Лентивирусы включают, без ограничения, вирус иммунодефицита человека (HIV) (например, HIV-1, HIV-2), вирус иммунодефицита крупного рогатого скота (BIV), вирус иммунодефицита кошек (FIV), вирус иммунодефицита обезьян (SIV) и вирус инфекционной анемии лошадей (EIA). В конкретном варианте осуществления терапевтическое средство представляет собой средство против HIV.
Соединение против HIV или средство против HIV представляет' собой соединение, которое подавляет HIV. Примеры средств против HIV включают, без ограничения:
(I) Нуклеозидные аналоги ингибиторов обратной транскриптазы (NRTI). NRTI относится к нуклеозидам и нуклеотидам и их аналогам, подавляющим активность обратной транскриптазы HIV-1. Примером нуклеозидного аналога ингибиторов обратной транскриптазы является, без ограничения, адефовира дипивоксил.
(II) Ненуклеозидные ингибиторы обратной транскриптазы
(NNRTI). NNRTI представляют собой аллостерические ингибиторы, которые обратимо связываются в несубстратном центре связывания на обратной транскриптазе HIV, таким образом меняя форму активного центра или блокируя активность полимеразы. Примеры NNRTI включают, без ограничения, делавирдин (ВНАР, U-90152; RESCRIPTOR®), эфавиренз (DMP-266, SUSTIVA®), невирапин (VIRAMUNE®), PNU-142721, каправирин (S-1153, AG-1549), эмивирин (+)-каланолид A (NSC-675451) и В, этравирин (ТМС-125), рилпивирин (ТМС278, Edurant™), DAPY (TMC120), BILR-355 BS, PHI-236 и PHI-443 (TMC-278).
(III) Ингибиторы протеазы (PI). Ингибиторы протеазы представляют собой ингибиторы протеазы HIV-1. Примеры ингибиторов протеазы включают, без ограничения, дарунавир, ампренавир (141W94, AGENERASE®), типранавир (PNU-140690, APTIVUS®), индинавир (МК-639; CRIXIVAN®), саквинавир (INVIRASE®, FORTOVASE®), фосампренавир (LEXIVA®), лопинавир (АВТ-378), ритонавир (АВТ-538, NORVIR®), атазанавир (REYATAZ®), нелфинавир (AG-1343, VIRACEPT®), лазинавир (BMS-234475/CGP-61755), BMS-2322623, GW-640385X (VX-385), AG-001859 и SM-309515.
(IV) Ингибиторы слияния (FI). Ингибиторы слияния представляют собой соединения, такие как пептиды, которые действуют посредством связывания с белком оболочки HIV и блокируют структурные изменения, необходимые для слияния вируса с клеткой-хозяином. Примеры ингибиторов слияния включают, без ограничения, маравирок (Selzentry®, Celsentri), энфувиртид (INN, FUZEON®), Т-20 (DP-178, FUZEON®) и Т-1249.
(V) Ингибиторы интегразы. Ингибиторы интегразы представляют собой класс противоретровирусных лекарственных средств, разработанных для блокирования действия интегразы, вирусного фермента, который вставляет вирусный геном в ДНК клетки-хозяина. Примеры ингибиторов слияния включают, без ограничения, ралтегравир, элвитегравир и МК-2048.
Соединения против HIV также включают вакцины против HIV, такие как, без ограничения, ALVAC® HIV (vCPl521), AIDSVAX®B/E (gp120) и их комбинации. Соединения против HIV также включают антитела к HIV (например, антитела к gp120 или gp41), в частности, нейтрализующие антитела широкого спектра действия.
В конкретном варианте осуществления средство против HIV по настоящему изобретению представляет собой ингибитор протеазы, NNRTI или NRTI. В конкретном варианте осуществления средство против HIV выбирается из группы, состоящей из индинавира, ритонавира, атазанавира и эфавиренза. Можно применять более одного средства против HIV, в частности, если средства обладают отличающимися механизмами действия (как обозначено выше). В конкретном варианте осуществления терапия против HIV представляет собой высокоактивную противоретровирусную терапию (HAART).
II. Поверхностно-активные вещества
Как указано в данном документе выше, наночастицы по настоящему изобретению содержат по меньшей мере одно поверхностно-активное вещество. "Поверхностно-активным веществом" называется поверхностно-активное средство, в том числе вещества, обычно называемые смачивающими средствами, детергентами, диспергирующими средствами или эмульгирующими средствами. Поверхностно-активные вещества обычно представляют собой органические соединения, которые являются амфифильными. В конкретном варианте осуществления поверхностно-активное вещество представляет собой амфифильный блок-сополимер. В конкретном варианте осуществления по меньшей мере одно поверхностно-активное вещество наночастицы представляет собой амфифильный блок-сополимер, в частности, сополимер, содержащий по меньшей мере один блок поли(оксиэтилена) и по меньшей мере один блок поли(оксипропилена).
В конкретном варианте осуществления настоящего изобретения поверхностно-активное вещество присутствует в растворе наночастиц и/или поверхностно-активного вещества для синтеза наночастицы (как описано в данном документе выше) при концентрации в диапазоне от приблизительно 0,0001% до приблизительно 5%. В конкретном варианте осуществления концентрация поверхностно-активного вещества находится в диапазоне от приблизительно 0,1% до приблизительно 2%.
Поверхностно-активное вещество по настоящему изобретению может быть заряженным или нейтральным. В конкретном варианте осуществления поверхностно-активное вещество является положительно или отрицательно заряженным, в частности, отрицательно заряженным.
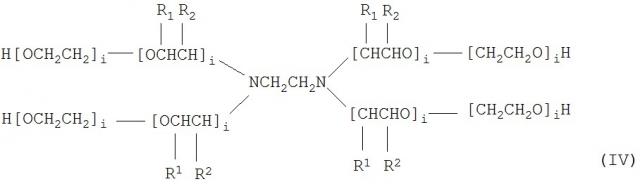
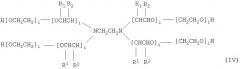
В конкретном варианте осуществления амфифильный блок-сополимер представляет собой сополимер, содержащий по меньшей мере один блок поли(оксиэтилена) и по меньшей мере один блок поли(оксипропилена). Примерами амфифильных блок-сополимеров служат блок-сополимеры с формулами:
,
,
,
,
,
в которых х, у, z, i и j имеют значения от приблизительно 2 до приблизительно 800, в частности, от приблизительно 5 до приблизительно 200, конкретнее, от приблизительно 5 до приблизительно 80, и где для каждой пары R1, R2, показанных на формуле (IV) и (V), один представляет собой водород и другой является метильной группой. Специалист в данной области будет учитывать, что значения х, у и z обычно будут отражать статистическое среднее и, что значения х и z зачастую, хотя необязательно, являются одинаковыми. Формулы (I)-(III) являются упрощенными в том, что, фактически, ориентация изопропиленовых радикалов внутри В-блока будет случайной. Эта случайная ориентация указывается на формулах (IV) и (V), которые являются более полными. Такие соединения поли(оксиэтилена)-поли(оксипропилена) были описаны Santon (Am. Perfumer Cosmet. (1958) 72 (4):54-58); Schmolka (Loc. cit. (1967) 82 (7):25-30), Schick, ed. (Non-ionic Surfactants, Dekker, N.Y-, 1967 pp.300-371). Ряд таких соединений имеются в продаже под такими родовыми торговыми наименованиями как "липолоксамеры", "Pluronics®", "полоксамеры" и "синпероники". Сополимеры Pluronic® в рамках формулы В-А-В, в противовес формуле А-В-А, типичной для Pluronics®, часто называются "обращенными" Pluronics®, "Pluronic® R" или "мероксаполом". В основном, блок-сополимеры можно описать в зависимости от наличия гидрофильных "А" и гидрофобных "В" блоков-сегментов. Так, например, сополимер с формулой А-В-А представляет собой триблок-сополимер, состоящий из гидрофильного блока, соединенного с гидрофобным блоком, соединенным с другим гидрофильным блоком. "Полиоксаминовый" полимер формулы (IV) доступен от BASF под торговым названием Tetronic®. Порядок полиоксиэтиленовых и полиоксипропиленовых блоков, представленных на формуле (IV), может обращаться, образуя Tetronic R®, также доступный от BASF (см., Schmolka, J. Am. Oil. Soc. (1979) 59:110).
Блок-сополимеры полиоксипропилена-полиоксиэтилена можно также разрабатывать с гидрофильными блоками, содержащими неупорядоченную смесь повторяющихся элементарных звеньев этиленоксида и пропиленоксида. Для поддержания гидрофильного свойства блока должен преобладать этиленоксид. Аналогичным образом, гидрофобный блок может представлять собой смесь повторяющихся элементарных звеньев этиленоксида и пропиленоксида. Такие блок-сополимеры доступны от BASF под торговым названием Pluradot™. He требуется, чтобы элементарные звенья блоков поли(оксиэтилена)-поли(оксипропилена), составляющих первый сегмент, состояли исключительно из этиленоксида. Также нет необходимости, чтобы все сегменты В-типа состояли исключительно из элементарных звеньев пропиленоксида. Наоборот, в простейших случаях, например, по меньшей мере один из мономеров в сегменте А может замещаться группой боковой цепи.
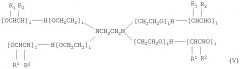
Ряд сополимеров полоксамера разработаны, чтобы удовлетворять следующей формуле:
.
Примеры полоксамеров включают, без ограничения, Pluronic® L31, L35, F38, L42, L43, L44, L61, L62, L63, L64, Р65, F68, L72, Р75, F77, L81, Р84, Р85, F87, F88, L92, F98, L101, Р103, Р104, Р105, F108, L121, L122, L123, F127, 10R5, 10R8, 12R3, 17R1, 17R2, 17R4, 17R8, 22R4, 25R1, 25R2, 25R4, 25R5, 25R8, 31R1, 31R2 и 31R4. Блок-сополимеры Pluronic® обозначаются посредством буквенного префикса с последующим двузначным или трехзначным числом. Буквенные префиксы (L, Р или F) относятся к физической форме каждого полимера, (жидкость, паста или образующее чешуйки твердое вещество). Числовой код определяет структурные параметры блок-сополимера. Последний разряд этого кода приблизительно равен весовому содержанию ЕО-блока в десятках весовых процентов (например, 80% по весу, если разряд равен 8, или 10% по весу, если разряд равен 1). Остальные первые один или два разряда кодируют молекулярную массу центрального РО-блока. Для расшифровки кода следует умножить соответствующее число на 300, чтобы получить приблизительную молекулярную массу в дальтонах (Да). Следовательно, номенклатура Pluronic обеспечивает удобный подход для оценки характеристик блок-сополимера в отсутствие справочной литературы. Например, код 'F127' обозначает блок-сополимер, который представляет собой твердое вещество, имеет РО-блок 3600 Да (1.2Х300) и 70% по весу ЕО. Точные молекулярные свойства каждого блок-сополимера Pluronic® можно получить от производителя.
Другие биосовместимые амфифильные сополимеры включают описываемые у Gaucher et al. (J. Control Rel. 2005) 109:169-188. Примеры других полимеров включают, без ограничения, поли(2-оксазолин)овые амфифильные блок-сополимеры, полиэтиленгликоль-полимолочную кислоту (PEG-PLA), PEG-PLA-PEG, полиэтиленгликоль-сополимер(лактида и гликолида) (PEG-PLG), полиэтиленгликоль-сополимер (молочной и гликолевой кислоты) (PEG-PLGA), полиэтиленгликоль-поликапролактон (PEG-PCL), полиэтиленгликоль-полиаспартат (PEG-PAsp), полиэтиленгликоль-поли(глутаминовую кислоту) (PEG-PGlu), полиэтиленгликоль-поли(акриловую кислоту) (PE;G-РАА), полиэтиленгликоль-поли(метакриловую кислоту) (PEG-РМА), полиэтиленгликоль-поли(этиленимин) (PEG-PEI), полиэтиленгликоль-поли(L-лизин) (PEG-PLys), полиэтиленгликоль-поли(2-(N,N-диметиламино)этилметакрилат) (PEG-PDMAEMA) и полиэтиленгликол