Способ предлучевой подготовки больных с опухолями в зоне прецентральной извилины головного мозга
Иллюстрации
Показать всеИзобретение относится к медицине, радиологии, предлучевой подготовке больных с опухолями головного мозга в области прецентральной извилины при высокотехнологичной конформной лучевой терапии. Проводят магнитно-резонансную томографию (МРТ) и магнитную стимуляцию головного мозга. Дополнительно проводят позитронно-эмиссионную томографию (ПЭТ) с последующим построением 3D модели головного мозга на основе комбинации данных ПЭТ и МРТ. Причем магнитную стимуляцию осуществляют в зоне топического представительства прецентральной извилины. По наибольшему мышечному ответу, регистрируемому с помощью электромиографии на выбранной мышце кисти руки, определяют местоположение ее в прецентральной извилине. Полученное изображение топического представительства этой мышцы совмещают с МРТ-изображением, которое используют для составления карты дозного распределения, исключая при предлучевой подготовке больных с опухолями в зоне прецентральной извилины головного мозга область топического представительства этой мышцы, с выведением из зоны 110% изодозы выделенных центров мышечного контроля. Способ обеспечивает повышение точности выявления зон моторного представительства мышц-мишеней в коре головного мозга при облучении опухолей любого размера, позволяя исключить переоблучение зон топического представительства этих мышц и превысить толерантные дозы для здоровых тканей при локализации опухолевого очага вблизи них. 6 ил., 1 пр.
Реферат
Изобретение относится к медицине, а именно к технологии предлучевой подготовки больных с опухолями головного мозга для высокотехнологичной конформной лучевой терапии.
Патологическими очагами головного мозга являются опухоли, сосудистые мальформации (кавернозные ангиомы и артерио-венозные мальформации), эпилептические очаги, а также определенные структуры головного мозга, участвующие в развитии обсессивно-компульсивного синдрома. Лечение таких патологических очагов является одной из сложнейших задач нейрохирургии. К тому же нередко они располагаются в труднодоступных для открытого хирургического вмешательства местах, что связано с высоким риском послеоперационных осложнений. Альтернативой хирургического вмешательства могут являться стереотаксические лучевые методы лечения, для которых характерны малая травматичность и высокое прецизионное воздействие на структуру-мишень. Однако при применении стереотаксического лечения очень важно определить точную локализацию патологического очага, воздействие на который может привести к максимальному положительному клиническому эффекту.
Для определения локализации патологических очагов головного мозга широко используются методы лучевой диагностики, такие как рентгеновская компьютерная томография (РКТ) и магнитно-резонансная томография (МРТ). Эти методы позволяют с достаточно высокой точностью выявить очаг поражения и определить его локализацию. С помощью РКТ хорошо визуализируются костные структуры. Что же касается тканевой дифференцировки, то она недостаточно высока, что нередко приводит к невозможности отграничения очага поражения, в частности опухолевого образования, от зоны отека, а в ряде случаев и от прилегающих участков интактного вещества мозга. Кроме того, наличие костных артефактов во многих случаях затрудняет интерпретацию изображений при расположении очага поражения в височных долях и глубинных структурах головного мозга. Это ограничивает применение РКТ для диагностики парциальной эпилепсии и некоторых объемных образований головного мозга, в частности кавернозных ангиом.
Более информативным методом диагностики патологических образований головного мозга является МРТ. Преимуществом ее по сравнению с РКТ является более высокая дифференцировка интенсивности сигнала между тканями, использование специальных импульсных последовательностей для подавления частичного объемного эффекта, индуцированного спинномозговой жидкостью, а также отсутствие костных артефактов. В настоящее время МРТ является методом выбора для диагностики различных заболеваний головного мозга (парциальной эпилепсии, первичных опухолей и метастазов, сосудистых мальформаций и т.д.), а также для наведения на целевую зону при лучевых и хирургических стереотаксических вмешательствах. В то же время МРТ, являясь методом, выявляющим преимущественно структурные изменения, не позволяет судить о биологических свойствах визуализируемых патологических изменений. Так, по данным МРТ невозможно определить границы эпилептического очага при парциальной эпилепсии, а также сказать, в каком участке солидного компонента опухоли находятся жизнеспособные опухолевые клетки, что очень важно для точного наведения на целевую зону при выполнении стереотаксических вмешательств. Это несколько снижает ее ценность.
Методы ядерной визуализации, особенно позитронная эмиссионная томография (ПЭТ), в отличие от РКТ и МРТ позволяют характеризовать биологические свойства тканей. ПЭТ заключается во введении в организм больного радиофармпрепаратов (РФП), меченных ультракоротко-живущими позитрон-излучающими радионуклидами. Наиболее распространенным РФП, используемым в клинической практике, является 18F-2-фтор-2-дезокси-D-глюкоза (18F-ФДГ), позволяющая оценить метаболизм вещества головного мозга, выявить тонкие биохимические изменения в очаге поражения на клеточном уровне. У больных нейроонкологического профиля ПЭТ с 18F-ФДГ дает возможность выявить наиболее активную часть опухоли, в которой находятся жизнеспособные опухолевые клетки, находящиеся в стадии пролиферации. У пациентов с симптоматической эпилепсией этот метод позволяет визуализировать эпилептический очаг, точно оценить его границы, а также динамику патологических изменений в процессе проводимого лечения. Однако недостатком ПЭТ является относительно низкая разрешающая способность метода, что в ряде случаев затрудняет точную локализацию очага поражения. Это ограничивает применение ПЭТ с 18F-ФДГ для стереотаксического наведения, особенно при проведении радиотерапевтических и радиохирургических вмешательств.
В последние годы для определения зон топического представительства по коре головного мозга стала применяться транскраниальная магнитная стимуляция (ТКМС) интегрированная с системой позиционирования в пространстве. Данная система позволяет отслеживать позиционирование пациента и магнитной катушки относительно друг друга, благодаря этому стало возможным применение ТКМС в режиме одиночного импульса применять для определения моторной коры, а в режиме импульсной ритмической стимуляции для картирования зоны, ответственной за речь.
Таким образом, каждый из вышеприведенных методов диагностики патологических образований головного мозга имеет свои особенности, в связи с чем для определения точной локализации этих очагов необходимо применение совокупности вышеназванных методов. Особенно важно использовать при выявлении очагов поражения головного мозга совмещенных изображений, полученных с помощью методов, выявляющих структурные (РКТ или МРТ) и функциональные изменения (ПЭТ). Это позволяет точно сопоставить анатомические и функциональные изменения в очаге поражения и благодаря этому получить комплексное представление о структурно-функциональном состоянии определенной анатомической зоны, что в значительной степени увеличивает диагностические возможности проводимого исследования. Совмещение мультимодальных изображений головного мозга в последние годы находит все большее применение в клинической практике для выявления патологических образований головного мозга, их локализации, а также планирования и контроля эффективности хирургического и лучевого лечения опухолевых, сосудистых и нейропсихических заболеваний головного мозга.
Полученный диагностический пакет данных позволяет точно определить зону патологического очага, его отношение к здоровым тканям и потенциал роста, и могут быть переданы на планирующую станцию для подготовки больного к конформной лучевой терапии.
Конформная лучевая терапия представляет собой вариант дистанционной высокоточной лучевой терапии основанной на расчете дозы с учетом трехмерного объема опухоли и расположения ее относительно критических структур - т.е. структур, облучение которых выше толерантной дозы ведет к тяжелым осложнениям. К критическим зонам в головном мозге относится ствол головного мозга, зрительные нервы, хиазма и хрусталики глаз. Неотъемлемым элементом конформной лучевой терапии является конформное облучение, в основе которого лежит максимальное приближение формы облучаемого объема к форме (конфигурации) опухоли. Благодаря этому лучевое воздействие выполняется прецизионно - то есть, с одной стороны, в облучаемый объем попадают все части опухоли, которая может иметь самую разнообразную форму. С другой стороны, лучевое воздействие осуществляется селективно - исключается или минимизируется лучевое воздействие на окружающие опухоль здоровые ткани и критические органы, которые имеют большую чувствительность к ионизирующему излучению, чем опухолевая ткань.
Благодаря прецизионности и селективности конформной лучевой терапии снижается лучевая нагрузка на окружающие опухоль здоровые ткани.
В то же время особенности локализации и диффузного роста опухоли, как правило, не дают возможности подведения полной терапевтической дозы на опухоль без риска повреждения здоровых тканей головного мозга.
Развивающаяся при опухолях головного мозга, вследствие масс-эффекта, дисфункция нервной ткани в зоне перифокального отека представляет собой ничто иное, как прогредиентно нарастающую ишемию мозга. Основными этапами в патогенезе вторичной церебральной ишемии являются: нарастающая внутричерепная гипертензия вследствие увеличения объема головного мозга в связи с ростом опухоли, снижение оксигенации мозга по причине уменьшения кровотока и угнетение аэробного и активация анаэробного пути обмена глюкозы, а также, снижение энергообмена и нарушение транспорта ионов и кислотно-основного состояния. Как было показано в экспериментальных исследованиях по ишемии головного мозга на лабораторных животных, даже кратковременное нарушение кровообращения ведет к глубоким повреждениям вследствие снижения метаболизма и эксайотоксичности, что может привести к повреждению и гибели нервных клеток под воздействием нейромедиаторов, способных гиперактивировать NMDA- и АМРА-рецепторы (рецепторы глутамата).
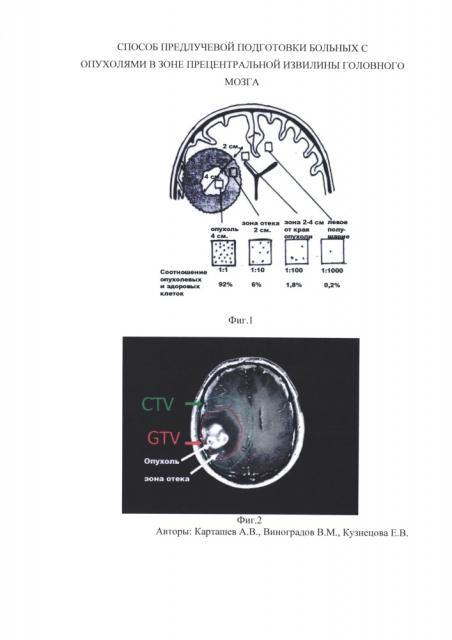
Особенностью опухолевой ишемии является то, что при опухолевом росте злокачественные клетки могут находиться до 2 см от зоны перефокального отека (Фиг. 1).
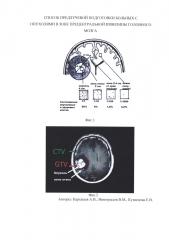
В связи с этим неизбежно при составлении плана лучевой терапии в зону облучения включается не только опухоль (GTV - gross tumor volume, объем, который включает в себя визуализируемую опухоль и зону перифокального отека), но и зона потенциального распространения опухолевых клеток в здоровой ткани головного мозга (CTV - clinical target volume клинический объем мишени, объем, который включает в себя не только опухоль, но и зоны субклинического распространения опухолевого процесса) (Фиг. 2).
Вследствие этого даже при использовании конформной лучевой терапии в зону высокого лучевого воздействия попадают функционально-значимые зоны находящиеся в состоянии ишемии, а получаемая ими доза ионизирующего излучения усугубляет их дисфункцию.
В основу современной цитоархитектоники и определения функциональных зон легли работы Беца (киевский анатом), открывшего в 1874 году гигантские пирамидные клетки. Затем исследования Бродмана (немецкий невролог) - 1907-1909 г. г., который разделил кору головного мозга человека по цитоархитектоническим признакам на 11 областей и 52 поля дальнейшие исследования, проводимые канадским нейрохирургом Уайлдером Грейвсом, Пенфилдом, который, занимаясь лечением эпилептических больных, содействовал созданию карты сенсорных и моторных участков коры головного мозга. Его важнейшей работой стала книга: «Эпилепсия и функциональная анатомия человеческого мозга» (1954). Он обобщил результаты картографии основных моторных и сенсорных областей коры и впервые точно нанес на карту корковые области, касающиеся речи. С помощью метода электрической стимуляции отдельных участков мозга Пенфилдом было установлено точное представительство в коре головного мозга различных мышц и органов тела человека. Таким образом, этого человечка придумал канадский ученый Пенфилд, который таким наглядным образом изобразил мозг человека.
Схематично его изображают в виде «гомункулуса» (человечка), части тела которого пропорциональны зонам мозга, в которых они представлены. Пропорции этого человечка соответствуют представлению нашего тела в коре головного мозга. Около трети занимает кисть руки, еще треть - губы, язык, гортань, т.е. речевой аппарат, остальное тело непропорционально мало. Поэтому пальцы рук, губы и язык с большим числом нервных окончаний изображаются крупнее, чем туловище и ноги (Фиг. 3).
При полушарно расположенной опухоли головного мозга во время лучевой терапии происходит неизбежное повреждение функционально-значимых зон, топически локализованных в зоне прецентральной извилины. Ниже описанный способ, предложенный авторами настоящего изобретения, позволяет исключить их из зоны высокодозного воздействия.
Ключевым моментом при подготовке к высокотехнологичному облучению больных с опухолями головного мозга является предлучевая подготовка. При современном техническом обеспечении основным способом расчета полей облучения является анализ компьютерных томограмм (КТ), выполненных в условиях положения лечебной укладки, с вынесенной на них референсной плоскостью (точкой нулевого отсчета), являющейся ориентиром для формирования границ поля. КТ-снимки, полученные в таком режиме, передаются на планирующую станцию, где они могут быть совмещены с нативными МРТ-снимками, выполненными в аксиальном режиме. Однако известный способ не обеспечивает визуализацию функциональных зон головного мозга, сопоставление анатомических данных с атласом функциональных карт головного мозга неточен, вследствие того что опухолевый узел и зона перефокального отека изменяет топографию коры. В ряде исследований было показано, что расположение зоны моторной коры у разных людей может смещаться в значительных пределах (Баарс Б. (Ред.) Мозг, познание, разум: введение в когнитивные нейронауки: в 2 ч. Ч. 1 / под ред. Б. Баарса, Н. Гейдж: пер. с англ. - М.: БИНОМ. Лаб. знаний, 2014а. - 544 с.). Так, например, локализация центральной борозды по отношению к системе координат Talairach составляет 1,5-2 см. (Steinmetz, Н. Variation of perisylvian and calcarine anatomic landmarks within stereotaxic proportional coordinates / H. Steinmetz, G. Furst, H.J. Freund // AJNR: Am. J. Neuroradiol. - 1990. - Vol. 11, №6. - P. 1123-1130.) He вызывает сомнений, что при наличии опухоли, а также после хирургического воздействия это смещение может быть еще больше.
Известен способ стереотаксического наведения узкого фотонного пучка на целевую точку головного мозга [RU 2257177, 27.07.2005], включающий проведение МРТ и ПЭТ с последующим совмещением полученных изображений, определение координат целевой точки относительно изоцентра линейного ускорителя со стереотаксическим адаптером и наведение с их использованием узкого фотонного пучка на целевую точку. Недостатком данного изобретения является отсутствие оценки и учета функциональных зон головного мозга.
Известен способ выявления в коре головного мозга сенсомоторных зон, ответственных за локомоцию [RU 2504329, 2014 г.], включающий проведение МРТ в режиме T1 MPR и фМРТ с последующим проведением навигационной транскраниальной магнитной стимуляции, а полученные данные МРТ в режимах T1 MPR и фМРТ загружают в систему NBS eXimia Nexstim и строят индивидуальную трехмерную модель головного мозга обследуемого с нанесением на нее зон активации. Однако данный способ не пригоден для онкологических больных и предназначен только для пациентов, проходящих реабилитацию после нарушения мозгового кровообращения.
Недостатками данного способа являются использование дополнительного оборудования в виде аппарата, имитирующего ходьбу (аппарат "Корвит"), и отсутствие использования данных с ПЭТ-томографа.
Наиболее близким по технической сути к заявляемому изобретению является способ предлучевой подготовки [Integration of navigated brain stimulation data into radiosurgical planning: potential benefits and dangers, Picht T, Schilt S, Frey D, Vajkoczy P, Kufeld M., doi: 10.1007/s00701-014-2079-8. Epub 2014 Apr 18.], включающий MPT-исследование в режиме Т1, согласно которому больным для выявления двигательных зон до хирургической операции выполнялась нТКМС с последующей передачей данных в систему координат хирургической навигационной установки BrainLab. К недостаткам данного способа можно отнести невозможность использования полученных данных в других системах, произведенных не компанией BrainLab, а также совмещение данных с ПЭТ-томографа. Основным недостатком данной системы является то, что допускается ее использование только у пациентов с опухолями головного мозга размером в поперечном измерении не более 3 сантиметров, что является серьезным ограничением применения ее в нейроонкологии.
Технический результат настоящего изобретения состоит в дополнительном применении ПЭТ для исследования головного мозга и совмещении полученных мультимодальных данных в различных программах для планирования лучевой терапии опухолей головного мозга любых размеров.
Этот результат достигается тем, что в известном способе предлучевой подготовки больных с опухолями в зоне прецентральной извилины головного мозга, включающем использование МРТ и проведение навигационной транскраниальной магнитной стимуляции, согласно изобретению МРТ-исследование проводят в режиме Т2 Propeller и 3D-T1, дополнительно осуществляют ПЭТ - исследование с 11С-метионином головного мозга, данные МРТ- и ПЭТ-исследований загружают в систему NBS eXimia Nexstim, осуществляют построение 3D модели головного мозга с маркировкой на ней зоны опухолевого очага, затем выполняют наложение ЭМГ-электродов на мышцу, отводящую большой палец - m. abducenc policis longus, противоположную пораженному полушарию, и проводят одиночную импульсную магнитную стимуляцию зоны топического представительства выбранной мышцы в коре головного мозга в зоне прецентральной извилины, полученные мультимодальные изображения загружают в систему планирования лучевой терапии Electa Monaco, на основании этого составляют карту дозного распределения таким образом, чтобы на зоны топического представительства приходилось не более 110% изодозы.
Целесообразно при выполнении МРТ исследования головного мозга в режиме 3D-Т1 осуществлять одно бесконтрастное, второе - с контрастным усилением.
Изодоза, или изодозная кривая, - линия на схеме облучения зоны организма, соединяющая точки облученного объекта, в которых поглощены одинаковые дозы ионизирующего излучения. Ряд таких линий позволяет наглядно представить, как в тканях тела по ходу лучей снижается поглощаемая дозы тканями.
Проведение МРТ-исследования в режиме Т2 Propeller, обеспечивающего программную редукцию двигательных артефактов, позволяет получить точный анатомический образ головного мозга, в том числе у больных с пограничным состоянием сознания.
Дополнительное ПЭТ-исследование головного мозга с использованием 11С-метионином, являющимся "золотым стандартом" в нейроонкологии для выявления опухолей различной этиологии головного мозга, обеспечивает выявление активно растущего опухолевого очага, что является необходимым для формирования зоны облучения.
Использование полученных мультимодальных изображений МРТ и ПЭТ после загрузки в систему NBS eXimia Nexstim позволяет осуществить построение 3D модели головного мозга с маркировкой на ней зоны опухолевого очага.
Наложение ЭМГ-электродов на мышцу, отводящую большой палец - m. abducenc policis longus, используется в связи с ее удобным анатомическим расположением для исследования, что обеспечивает регистрацию мышечного ответа в ответ на раздражение зоны топического представительства по коре головного мозга данной мышцы.
Проведение одиночной импульсной магнитной стимуляции зоны топического представительства выбранной мышцы в коре головного мозга в зоне прецентральной извилины обеспечивает выявление зоны наибольшего мышечного ответа на стимуляцию, тем самым определение зоны представительства данной мышцы в коре головного мозга.
Загрузка полученных данных в систему планирования лучевой терапии Electa Monaco обеспечивает набор изображений с выделенными зоной топического представительства и зон опухолевого распространения (GTV) и перефокального отека (CTV), необходимых для формирования полей облучения.
Составление карты дозного распределения позволяет исключить из зоны облучения выше 110% изодозы топического представительства в коре головного мозга.
Выполнение двух последовательных исследование 3D-T1, одно бесконтрастное, второе с контрастным усилением для верификации опухолевого очага, обеспечивает получение 180 сагиттальных срезов, включающих в себя весь объем головы с мягкими тканями, позволяя отдифференцировать опухолевую массу (при контрастировании) от зоны перифокального отека (при бесконтрастном исследовании), что повышает точность при формировании клинических объемов облучения.
Последовательность вышеназванных действий обеспечивает высокую точность наведения фотонного пучка на опухоль при предлучевой подготовки больных с опухолями в зоне прецентральной извилины головного мозга.
Сущность способа поясняется следующим алгоритмом действий:
1. Проведение обследуемому МРТ в режимах двух последовательных исследований 3D-Т1, одно с контрастным усилением для верификации опухолевого очаг на магнитно-резонансном томографе 3,0 Т Toshiba Vantage titan, а второе для построения 3D модели в системе NBS eXimia. Nexstim.
2. Проведение обследуемому ПЭТ-исследования с использованием 11С-метионина.
3. Загрузка данных 3D-T1 и ПЭТ-томограммы в систему NBS eXimia. Nexstim; построение индивидуальной трехмерной модели головного мозга обследуемого с дополнением данных ПЭТ-томографии.
4. Соотнесение реальных анатомических образований с данными, полученными на МРТ в режиме 3D-T1.
5. Наложение ЭМГ электродов на исследуемые мышцы руки - m. abducenc policis longus.
6. Проведение предварительной магнитной стимуляции - нТМС - зоны активации коры головного мозга, с определением вызванных моторных ответов (ВМО), имеющих амплитуду 100-500 мкВ, при напряженности магнитного поля в точке стимуляции 80-110 В/м.
7. Определение точки на индивидуальной трехмерной реконструкции головного мозга с максимальной амплитудой ВМО.
8. Определение пассивного моторного порога в точке с максимальной амплитудой ВМО с использованием специального режима NBS eXimia. Nexstim «Повтор стимула». Данный режим позволяет с точностью до 2 мм наносить стимул в выбранную точку. Моторным порогом называют минимальную интенсивность магнитной стимуляции (в %), при которой более чем в половине повторных стимулов регистрируется ВМО с амплитудой более 50 мкВ.
9. Перевод координат точек моторного представительства в DICOM формат.
10. Постобработка данных полученных DICOM данных в программах DICOMDump, Sante DICOM Editor) для сопряжения форматов с системой дозиметрического планирования Monaco.
11. Вынесение на томограмму, выполненную в положении леченой укладки, для лучевой терапии зон интереса (GTV,CTV, критических органов, зоны топического представительства).
12. Построение изодозных карт.
Изобретение поясняется следующими примерами.
Пример 1.
Пациент Ш., 43 года. Диагноз: Глиобластома GrIV правой гемисферы головного мозга. Состояние после костно-пластической трепанации черепа, субтотальное удаление опухоли. Со стороны клинической картины: Умеренные головные боли гипертензионного характера, левосторонний гемипарез в левой руке до 3 баллов.
Проведено МРТ-исследование в двух последовательных режимах 3D Т1, одно из которых с контрастным усилением для верификации опухолевого очага, а другое - для последующей передачи в системе NBS eXimia. Nexstim. На Фиг. 2 представлен МРТ Т1-с контрастным усилением с вынесенными зонами интереса (GTV и CTV). Как видно на Фиг. 2 зона CTV перекрывает всю область прецентральной извилины.
Было выполнено ПЭТ-исследование с использованием радиофармпрепарата 11С-метионин.
Полученные данные последовательно загружаются в систему навигационной магнитной стимуляции NBS eXimia. Nexstim. После чего была сформирована 3D модель головного мозга и позиционирована относительно реального пациента с помощью системы позиционирования «Polaris».
Пациент был уложен на специальную кушетку. На мышцу, отводящую большой палец левой руки, был установлен ЭМГ-электрод в соответствии со стандартными ЭМГ. После чего была произведена предварительная магнитная стимуляция - нТМС - зоны активации коры головного мозга, с определением вызванных моторных ответов (ВМО), имеющих амплитуду 100-500 мкВ, при напряженности магнитного поля в точке стимуляции 80-110 В/м. Были определены точки на построенной 3D модели головного мозга с максимальной амплитудой ВМО. Далее было определен порог моторного ответа в точке с максимальной амплитудой ВМО с использованием специального режима NBS eXimia. Nexstim «Повтор стимула», который составил 55 мкВ.
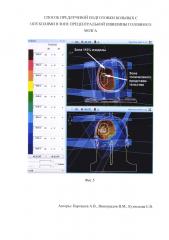
После чего координаты точек моторного представительства были переведены DICOM формат с последующей постобработкой данных полученных DICOM данных в программах DICOMDump, Sante DICOM Editor. Полученные в результате обработки набор изображений в формате DICOM были загружены в систему планирования лучевой терапии Monaco, в которой были отмечены зоны интереса - GTV,CTV, критических органов, зоны топического представительства и сформированы изодозные карты. По предписанию вся зона CTV должна быть охвачена 90% изодозой, разовая доза облучения за фракцию составляет 3 Гр, суммарная доза 51 Гр. (Фиг. 4)
Последующий анализ дозного распределения и установки ограничения на 110% от предписанной дозы выявил переоблучение зоны топического представительства m. abducenc policis longus. (Фиг. 5)
Коррекция плана позволила вывести зоны топического представительства m. abducenc policis longus из области 110% изодозы (Фиг. 6). На фиг.6 представлена томограмма с нанесенной на нее изодозной картой представленной в виде градации от синего к красному, что соответствует дозам облучения в диапазоне от 28 до 52 Гр.
К настоящему времени предлагаемый способ прошел клиническую апробацию у 5 больных с опухолями головного мозга от 3 до 8 см в поперечном измерении в области прецентральной извилины с выведением зон топического представительства, что позволило провести адекватную лучевую терапию, исключив из зоны переоблучения функционально значимые области головного мозга.
Предлагаемый способ имеет ряд важных преимуществ, заключающихся в том, что способ обеспечивает расширение возможностей использования его в клинической практике и повышение точности выявления зон моторного представительства в коре головного мозга мышц-мишеней при облучении опухолей любого размера, позволяет исключить их переоблучение и превышение толерантных доз для здоровых тканей при локализации опухолевого очага вблизи них, что не обеспечивает ни один из известных в настоящее время способов предлучевой подготовки больных с опухолями головного мозга в зоне прецентральной извилины.
Способ разработан в четвертом радиологическом отделении ФГБУ РНЦРХТ и прошел клиническую апробацию у 5 больных с положительным результатам.
Способ предлучевой подготовки больных с опухолями в зоне прецентральной извилины головного мозга, включающий магнитно-резонансную томографию (МРТ) и магнитную стимуляцию головного мозга, отличающийся тем, что дополнительно проводят позитронно-эмиссионную томографию (ПЭТ) с последующим построением 3D модели головного мозга на основе комбинации данных ПЭТ и МРТ, магнитную стимуляцию осуществляют в зоне топического представительства прецентральной извилины, по наибольшему мышечному ответу, регистрируемому с помощью электромиографии на выбранной мышце кисти руки, определяют местоположение ее в прецентральной извилине, полученное изображение топического представительства этой мышцы совмещают с МРТ-изображением, которое используют для составления карты дозного распределения, исключая при предлучевой подготовке больных с опухолями в зоне прецентральной извилины головного мозга область топического представительства этой мышцы, превышающую 110%.