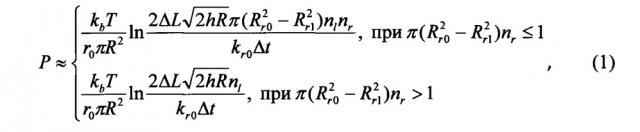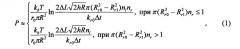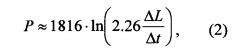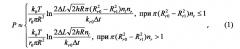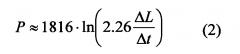Способ определения давления в опухоли
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии и химиотерапии, предназначено для определения давления в опухолях, что может быть использовано для оптимизации режимов проведения химиотерапии с целью повышения эффективности лечения, выбора терапевтического агента или их комбинации, корректировки доз назначаемых препаратов, оптимизации времени введения в течение суток. Проводят измерение среднего радиуса опухоли (ΔL), введение в опухоль контрольного препарата, в качестве которого используют магнитоконтрастные наночастицы, в концентрации, достаточной для детекции с использованием МРТ. Затем измеряют MP-сигнала в процессе выведения из опухоли контрольного препарата с построением зависимости изменения интенсивности МР-сигнала в опухоли от времени. Далее вводят в опухоль целевой препарат, представляющий собой наночастицы, используемые в контрольном препарате, ковалентно сшитые с белком, обладающим лектиновыми свойствами, через время, необходимое для выведения из организма контрольного препарата. Затем измеряют MP-сигнал в процессе выведения из опухоли целевого препарата с построением зависимости изменения интенсивности МР-сигнала в опухоли от времени. По полученным зависимостям определяют время задержки Δt выведения из опухоли целевого препарата относительно контрольного с последующим расчетом значения давления в опухоли по соответствующей формуле. Способ обеспечивает объективное и неинвазивное измерение давления в опухоли, в том числе, в нескольких опухолевых очагах. 7 з.п. ф-лы, 1 ил., 2 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к области онкологии и химиотерапии, предназначено для определения давления в различных опухолях, локализованных в мягких тканях - доброкачественных или злокачественных, различных гистологических типов, результаты которого могут быть использованы для оптимизации режимов проведения химиотерапии с целью повышения эффективности лечения, а именно выбора терапевтического агента или их комбинации, корректировки доз назначаемых препаратов, оптимизации времени введения в течение суток.
Уровень техники
По сравнению с окружающими нормальными тканями большинство солидных опухолей характеризуются повышенным внутритканевым давлением (intratumoural pressure, IP) [Heldin, С.H., Rubin, K., Pietras, K. & Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nat. Rev. Cancer 4, 806-13 (2004); Jain, R.K., Martin, J.D. & Stylianopoulos, T. The role of mechanical forces in tumor growth and therapy. Annu. Rev. Biomed. Eng. 16, 321-46 (2014)]. Повышенное значение IP вызвано несколькими факторами, в том числе негерметичностью кровеносных сосудов, их извилистой формой, фиброзом стромы опухоли и малым количеством или даже отсутствием лимфатических сосудов в опухоли. В некоторых опухолях давление может достигать 60 мм рт.ст. (или 8 кПа). Повышенное IP существенно ограничивает диффузию кислорода, питательных веществ внутрь опухоли и является существенным препятствием проникновению лекарственных препаратов.
Впервые про повышенное внутритканевое давление в опухоли заговорили еще в 1950 году [Heldin, С.Н., Rubin, K., Pietras, K. & Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nat. Rev. Cancer 4, 806-13 (2004)]. Первые упоминания о том, что повышенное IP существенно затрудняет доставку лекарственных препаратов в опухоль и, соответственно, снижает эффективность терапии относятся к 1987 году [Heldin, С.Н., Rubin, K., Pietras, K. & Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nat. Rev. Cancer 4, 806-13 (2004)]. Исследование давления в опухоли особенно актуально при терапии препаратами на основе моноклональных антител, т.к. их диффузия в тело опухоли наблюдается не более чем на 100 мкм в солидных опухолях [Heine, М. et al. High interstitial fluid pressure is associated with low tumor penetration of diagnostic monoclonal antibodies applied for molecular imaging purposes. PLoS One 7, e36258 (2012); Heine, M. et al. Investigations on the usefulness of CEACAMs as potential imaging targets for molecular imaging purposes. PLoS One 6, e28030 (2011)].
Показано, что давление в опухоли увеличивается с увеличением размера опухоли. Однако для разных типов опухолей ввиду особенностей строения опухолевой ткани и внеклеточного матрикса эта зависимость может отличаться. [Jain, R.K., Martin, J.D. & Stylianopoulos, Т. The role of mechanical forces in tumor growth and therapy. Annu. Rev. Biomed. Eng. 16, 321 - 46 (2014)]
Таким образом, вопрос влияния давления опухоли на эффективность химиотерапии является очень актуальным. Исследуются причины повышенного давления в опухоли, способы его уменьшения для увеличения проницаемости химиотерапевтических препаратов. Все это обуславливает важность разработки новых не- и малоинвазивных способов оценки давления в опухоли с возможностью применения у человека.
На сегодняшний день известно два способа измерения давления внутри опухоли. Первый способ - «Тампон-в-игле» (Wick-in-needle technique), характеризуется тем, что для измерения используют тонкую стальную иглу, конец которой заполнен тампоном (обычно из нейлоновой нити, раньше использовали хлопковый тампон). Остальной объем иглы заполнен изотоническим раствором. Игла подключена к датчику измерения давления. Если толщина используемой иглы позволяет, данным способом возможно измерять давление в глубоких тканях [Heldin, С.Н., Rubin, K., Pietras, K. & Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nat. Rev. Cancer 4, 806-13 (2004)]. Аппаратная реализация одного из вариантов метода «Тампон-в-игле» представлена прибором DSI ТА11РА-C10 (Data Sciences International, New Brighton, MN, USA). Данный прибор может быть полностью имплантирован под кожу животного и позволяет проводить непрерывные измерения в течение длительного времени (до 1,5 месяца).
Второй способ - «Микропунктура» (Micropuncture technique), характеризуется тем, что для измерения давления жидкости в тканях используется заостренный стеклянный капилляр, как правило, 3-10 мкм в диаметре. Капилляр подключают к системе измерения давления. Данный метод позволяет получать более надежные данные оценки давления жидкости в ткани, чем техника «Тампон-в-игле», в связи с тем, что измерения проводятся в меньшем объеме и являются менее травматичными. Однако метод не позволяет проводить измерения в глубоких тканях. Как правило, измерения проводятся не глубже, чем 1 мм от поверхности. [Boucher Y., Baxter L.Т., Jain R.K. Interstitial pressure gradients in tissue-isolated and subcutaneous tumors: implications for therapy // Cancer research. - 1990. - T. 50. - №. 15. - С. 4478-4484; Heldin, С.Н., Rubin, K., Pietras, K. & Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nat. Rev. Cancer 4, 806-13 (2004)]
Главным недостатком перечисленных методов оценки давления в опухоли является их инвазивность, травматичность, при этом в некоторых случаях для измерения давления в опухоли может потребоваться проведение хирургической операции.
Раскрытие изобретения
Задачей настоящего изобретения является разработка неинвазивного способа измерения давления в опухоли.
Поставленная задача решается заявляемым способом, который включает следующие этапы:
- измерение среднего радиуса опухоли (ΔL), например, с помощью магнитно-резонансной томографии (МРТ);
- ведение в опухоль, например, путем внутривенного или внутриопухолевого введения, контрольного препарата, в качестве которого используют магнитоконтрастные наночастицы, например ферромагнитные наночастицы, в концентрации, достаточной для детекции с использованием МРТ;
- проведение МРТ исследований (измерение MP-сигнала) до введения контрольного препарата в опухоль, а также не менее трех раз после его введения, при этом одно из МРТ исследований осуществляют в промежуток времени, характеризующийся достаточным накоплением контрастного вещества в опухоли (с максимальной концентрацией), второе и третье - в промежуток времени, характеризующий процесс выведения контрастного вещества из опухоли;
- измерение MP-сигнала в наиболее стабильной магнитоконтрастной ткани, например, мышцах, которое осуществляют одновременно с измерением MP-сигнала в опухоли и затем используют для нормирования MP-сигналов опухоли с последующим расчетом средней интенсивности MP-сигнала в опухоли;
- после выведения из опухоли контрольного препарата осуществляют введение (не ранее, чем через 24 часа после введения контрольного препарата) в опухоль аналогичным способом целевого (таргетного) препарата, представляющего собой наночастицы, используемые в контрольном препарате, ковалентно сшитые с белком, обладающим лектиновыми свойствами, например лектином омелы белой - вискумином (mistletoe lectin, MLI), при этом количество таргетного препарата по содержанию магнитоконтрастного вещества должно быть аналогично контрольному препарату;
- проведение МРТ исследований (измерение MP-сигнала) до введения целевого препарата в опухоль, а также не менее трех раз после его введения, при этом одно из МРТ исследований осуществляют в промежуток времени, характеризующийся достаточным накоплением целевого препарата в опухоли (с максимальной концентрацией), второе и третье - в промежуток времени, характеризующий процесс выведения целевого препарата из опухоли,
- одновременно с измерением MP сигнала в опухоли при введении целевого препарата измеряют MP-сигнал в наиболее стабильной магнитоконтрастной ткани, например мышцах, которое также затем используют для нормирования полученных МР-сигналов опухоли с последующим расчетом средней интенсивности MP-сигнала в опухоли,
- по итогам полученных данных строят зависимость изменения интенсивности МР-сигнала в опухоли от времени в процессе накопления и выведения контрольного и целевого препаратов из опухоли;
- на основании полученных зависимостей определяют время задержки Δt выведения целевого препарата (наночастиц, ковалентно сшитых с лектином) из опухоли по сравнению с контрольным препаратом, которое в частном варианте выполнения может быть определено как разница между временем, характеризующим начало снижения максимально накопленной концентрации в опухоли целевого препарата относительно контрольного (по увеличению интенсивности MP-сигнала, которая пропорциональна концентрации препарата в опухоли). Для этого, используя построенные зависимости интенсивности MP-сигнала от времени фиксируют время, соответствующее точке перегиба от минимального значения сигнала МРТ к максимальному для контрольного препарата (tk) и для таргетного препарата (tt), и время задержки Δt выведения целевого препарата по сравнению с контрольным препаратом, определяют по разнице полученных значений: Δt=tt-tk.
- расчет значения давления в опухоли производят по формуле:
где kb - постоянная Больцмана;
Т - абсолютная температура (тела) пациента;
R - радиус наночастицы (характеристика используемых наночастиц в контрольном и целевом препаратах);
h - высота рецептора, находящегося на поверхности опухолевой клетки, которая может быть определена в соответствии с работой [Jeong О. Lee, Hye Mi So, Eun Kyoung Jeon, Hyunju Chang, Keehoon Won, and Yong Hwan Kim. Aptamers as molecular recognition elements for electrical nanobiosensors. Anal. Bioanal. Chem., 390(4): 1023-1032, 2008], в контексте заявляемого изобретения может составлять постоянную величину, равную 5 нм;
Rr0 и Rr1 - внешний и внутренний радиусы кольца, в пределах которого может взаимодействовать рецептор, которые также могут быть определены в соответствии с работой [Jeong О. Lee, Hye Mi So, Eun Kyoung Jeon, Hyunju Chang, Keehoon Won, and Yong Hwan Kim. Aptamers as molecular recognition elements for electrical nanobiosensors. Anal. Bioanal. Chem., 390(4): 1023-1032, 2008], в контексте заявляемого изобретения могут составлять постоянную величину 7 нм и 3,5 нм, соответственно;
kr0 - константа скорости диссоциации комплекса лектин (или лиганд)-рецептор при нулевой нагрузке (зависит от лектина, конъюгированного с наночастицами);
- поверхностная плотность лектинов (лигандов), характеристика используемых наночастица, зависит от размера частицы и количества молекул лиганда, связанных с одной частицей; рассчитывается по формуле , где N - количество молекул лектина, ковалентно связанных с одной частицей.
nr - плотность рецепторов для данного лектина на поверхности опухолевой клетки (зависит от специфичности лектина, конъюгированного с наночастицами и типа клеток), рассчитывается по формуле nr=Nr/600, где Nr - количество рецепторов для данного лектина на поверхности опухолевой клетки.
В случае, если в качестве магнитоконтрастных частиц в контрольном препарате использованы ферромагнитные наночастицы, а в целевом препарате ферромагнитные наночастицы, конъюгированные с лектином вискумин [Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека A172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12. Р. 797-801], значение kr0 составляет 18⋅10-3 с-1 [K. Sandvig, S. Olsnes, and A. Pihl. Kinetics of Binding of the Toxic Lectins Abrin and Ricin to Surface Receptors of Human Cells. 251(13): 3977-3984, 1976], поверхностная плотность лигандов n1 составляет 130 мкм-2, поверхностная плотность рецепторов nr может быть принята равной 105 мкм-2, значение температуры тела Т принимается равным 37°C (или 310,15 K), соответственно, давление в опухоли может быть рассчитано по формуле:
где ΔL - средний радиус опухоли, Δt - время задержки выведения ферромагнитных наночастиц, ковалентно сшитых с лектином MLI, по сравнению с контрольным препаратом ферромагнитных наночастиц.
При этом средний радиус опухоли (ΔL) может быть определен по следующей методике: получают изображения (томограммы) опухоли в разных плоскостях с помощью известных средств, например МРТ, по которым определяют максимальные параметры опухоли по трем осям (x-y-z), затем рассчитывают условный объем опухоли, из которого находят средней радиус опухоли.
Техническим результатом, на достижение которого направлено заявленное изобретение, является возможность получения объективных данных о давлении в опухоли неинвазивным методом.
Кроме того, преимуществом заявляемого способами перед существующими на сегодняшний день способами является то, что измерение давления в опухоли можно проводить параллельно с МРТ исследованием, для измерения не требуется хирургических вмешательств.
Кроме того, известно, что величина давления изменяется от центра опухоли к периферии [Soltani М., Chen P. Numerical modeling of fluid flow in solid tumors // PloS one. - 2011. - T. 6. - №. 6. - С. e20344]. С помощью MPT оценивают интегральную интенсивность по всей опухоли, что помогает избежать ошибок, которые могут возникать при использовании методов прямого измерения давления, связанных со смещением иглы от центра опухоли.
Кроме того, при наличии нескольких опухолевых очагов, заявляемый способ позволяет проводить оценку давления одновременно во всех очагах.
Т.к. существующие способы определения давления в опухоли являются достаточно травматичными, а в некоторых случаях требуют серьезных хирургических операций, по этой причине они рекомендованы к применению преимущественно на животных моделях при проведении доклинических исследований. Предлагаемый новый подход позволит проводить измерения давления внутри опухоли также у человека.
Краткое описание чертежей
Изобретение поясняется графическими материалами, где на фиг. 1 представлена динамика изменения интенсивности МРТ сигнала в опухоли большого (опухоли типа В, объем опухоли (V)>500 мм3) и малого (опухоли типа S, V<500 мм3) размера к сигналу в мышце при внутриопухолевом введении препаратов ФНЧ (контрольный препарат ферромагнитных наночастиц) и ФНЧ-MLI (ферромагнитные наночастицы, конъюгированные с MLI).
Осуществление изобретения
Определение давления в опухоли основано на измерении радиуса опухоли (ΔL), которое может быть реализовано в частном варианте выполнения изобретения с помощью магнитно-резонансной томографии (МРТ), а также на расчете времени задержки (Δt) выведения из опухоли целевого препарата по сравнению с контрольным, где в качестве контрольного препарата используют магнитоконтрастные наночастицы, в качестве целевого - наночастицы, используемые в контрольном препарате, ковалентно сшитые с белком, обладающим лектиновыми свойствами.
Средний радиус опухоли (значение ΔL) может быть измерен в ходе проведения магнитно-резонансной томографии (МРТ). В одном из вариантов осуществления изобретения средний радиус может быть определен посредством измерения линейных размеров опухоли и расчета среднего радиуса опухоли ΔL. Данные измерения могут проводится в любой момент, в том числе непосредственно перед введением контрольного препарата наночастиц. Для определения ΔL берут изображения МРТ-исследования (срезы), соответствующие максимальному размеру опухоли, измеряют максимальные значения длины , ширины (w) и высоты (h) (в мм); на основании полученных данных рассчитывают объем опухоли путем перемножения всех трех измеренных линейных параметров: - объем опухоли (мм3) и значение ΔL рассчитывают по следующей формуле:
В качестве магнитоконтрастных наночастиц контрольного препарата могут быть использованы ферромагнитные наночастицы, наночастицы, содержащие гадалиний, и др. В качестве белков, обладающих лектиновыми свойствами, могут быть использованы белки, узнающие углеводный остаток, специфически или повышено экспрессируемый опухолевой тканью, например MLI, Е-селектин, другие растительные и животные лектины в нетоксичных дозах. Ферромагнитные наночастицы и наночастицы с ковалентно связанным лектином MLI (ФНЧ-MLI) могут быть получены способом, подробно описанным в работе [Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека A172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12. Р. 797-801].
Контрольный и целевой препараты вводят в опухоль пациента (путем внутривенного или внутриопухолевого введения) последовательно в равных объемах в количестве, достаточном для детекции сигнала с помощью МРТ для соответствующего способа введения в организм. При этом введение целевого препарата в опухоль осуществляют после выведения из нее контрольного препарата (рекомендуется не ранее, чем через 24 часа после введения контрольного препарата), а количество контрольного и таргетного препаратов должно быть одинаковым по содержанию магнитоконтрастного вещества. Например, в случае ферромагнитных наночастиц, по содержанию железа не менее 5 мкг при внутриопухолевом введении и 200 мкг при внутривенном введении (в организм мыши). Например, в случае ксенографтной модели опухоли с использованием иммунодефицитых мышей при внутриопухолевом введении ферромагнитных наночастиц необходимое количество наночастиц составляет 5 мкг по содержанию железа.
За изменением содержания ФНЧ-MLI и контрольного препарата в опухоли следят с помощью магнитно-резонансной томографии (МРТ). Для этого проводят измерения интенсивности сигнала магниторезонасного вещества (ФНЧ) в опухоли до начала введения препарата и после введения, например через 15 мин (время, в течение которого происходит накопление препарата в опухоли, т.е. характеризуется максимальной концентрацией), 2 часа (время, характеризующееся начальной стадией процесса выведения препарата из опухоли) и 24 часа (время, характеризующееся конечной стадией процесса выведения препарата из опухоли) (указано минимальное количество временных точек). Предпочтительно использование одинаковых временных точек при проведении МРТ исследований с контрольным и целевым препаратами. Увеличение количества проводимых измерений MP-сигнала повышает достоверность получаемого результата.
Одновременно с измерением интенсивности MP сигнала в опухоли измеряют МР-сигнал в мышцах бедра, как наиболее стабильной магнитоконтрастной ткани. Данное значение далее используют для нормировки сигнала в опухоли. На основании полученных данных, для обоих препаратов строят зависимость изменения МРТ сигнала в опухоли по отношению к сигналу в мышце от времени (фиг. 1).
После чего производят расчет времени задержки выведения наночастиц, ковалентно сшитых с лектином, из опухоли по разнице длительности содержания наночастиц в максимальной концентрации. Для этого, используя построенные зависимости интенсивности MP-сигнала от времени, фиксируют время, соответствующее точке перегиба от минимального значения сигнала МРТ к максимальному для контрольного препарата (tt) и для таргетного препарата (tt), и время задержки Δt выведения целевого препарата по сравнению с контрольным препаратом определяют по разнице полученных значений: Δt=tt-tk. В частном эксперименте, представленном на фиг. 1, в качестве точки перегиба допускается использовать временную точку со значением интенсивности MP-сигнала, наиболее близким в минимальному перед фазой достоверного увеличения сигнала.
Расчет значения давления в опухоли производят по формуле (1) или в случае использования в качестве магнитоконтрастных наночастиц ферромагнитных наночастиц, а в качестве белка, обладающего лектиновыми свойствами, - лектина MLI, по формуле (2).
Формула определения давления в опухоли была получена исходя из следующих предположений: время задержки ферромагнитной наночастицы с ковалентно связанным лектином MLI (ФНЧ-MLI) при единичном связывании с рецептором на поверхности клеток эндотелия обратно пропорционально константе скорости диссоциации kr, которая согласно [G.I. Bell. Models for the specific adhesion of cells to cells. A theoretical framework for adhesion mediated by reversible bonds between cell surface molecules. Science (80-.)., 200 (4342): 618-627, 1978] зависит от внешней приложенной силы F, как
где r0≈1,0 нм - расстояние, на котором лиганд (гликозилированный белок на поверхности клетки) и рецептор (лектин MLI) могут вступить в контакт, kB - постоянная Больцмана, Т - абсолютная температура тела пациента или животного, kr0 - константа скорости диссоциации комплекса лиганд-рецептор при нулевой нагрузке, значение которой по данным [K. Sandvig, S. Olsnes, and A. Pihl. Kinetics of Binding of the Toxic Lectins Abrin and Ricin to Surface Receptors of Human Cells. 251(13): 3977-3984, 1976] составляет 18⋅10-3 с-1.
Для оценки полного времени задержки ФНЧ-MLI по сравнению с контрольными наночастицами ФНЧ (без MLI) необходимо оценить число связываний за то время, пока частица находится в опухоли.
В качестве приближения предполагаем, что наночастица катится по поверхности эндотелия. При этом площадь частицы Ac, на которой может происходить взаимодействие, определяется высотой рецептора h:
где R - радиус наночастицы, Sbead - площадь ее поверхности (Sbead=4πR2).
Если поверхностная плотность лигандов на наночастице (, где N - количество молекул лектина, ковалентно связанных с одной частицей), то на эту площадь приходится NL лигандов:
Соответствующая ей площадь поверхности эндотелия Splate за один оборот составляет:
При поверхностной плотности рецепторов nr на эту площадь приходится NR рецепторов:
Считаем, что площадь, на которой может взамодействовать один рецептор, определяется его геометрией [Jeong О. Lee, Hye Mi So, Eun Kyoung Jeon, Hyunju Chang, Keehoon Won, and Yong Hwan Kim. Aptamers as molecular recognition elements for electrical nanobiosensors. Anal. Bioanal. Chem., 390(4): 1023-1032, 2008] и представляет собой кольцо с внешним и внутренним радиусами: Rr0 и Rr1, соответственно. Отсюда эффективная площадь, на которой может происходить связывание, составляет:
Предполагаем, что если лиганд попал в эту эффективную площадь, произойдет связывание, тогда вероятность соединения составляет:
Отсюда среднее количество связей за один оборот составит:
Прокатившись на расстояние ΔL, наночастица сделает оборотов, что дает оценку на полное число связываний при прохождении расстояния ΔL:
Отсюда полное время запаздывания наночастицы ФНЧ-MLI, покрытой вискумином, по сравнению с непокрытой ФНЧ составляет:
Соответственно, если известно время запаздывания, силу F, приходящуюся на одну связь, можно оценить по следующей формуле:
Или, приближенно оценивая давление в опухоли Р, как
получаем:
Или в общем виде:
Для численной оценки давления поверхностную плотность рецепторов оценивали как nr~105 мкм-2. Как описано в работе [Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека A172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12 / Р. 797-801], для ферромагнитных наночастиц, конъюгированных с MLI, радиус одной наночастицы составляет 50 нм, при этом на одну такую частицу приходится в среднем 4 молекулы лектина. В этом случае поверхностная плотность молекул лектина составляет n1~130 мкм-2. Характеристики молекулы рецептора брали из работы [Jeong О. Lee, Hye Mi So, Eun Kyoung Jeon, Hyunju Chang, Keehoon Won, and Yong Hwan Kim. Aptamers as molecular recognition elements for electrical nanobiosensors. Anal. Bioanal. Chem., 390(4): 1023-1032, 2008]: h~5 нм, Rr0~7 нм, Rr1~3,5 нм.
Подставляя эти значения в формулу (1), получаем итоговую формулу для расчета давления в опухоли для случая использования ферромагнитных наночастиц и MLI:
В случае использования в контрольном и целевом препаратах других магнитоконтрастных частиц и иных белков значения характеризующих их коэффициентов (R - радиус наночастицы, - поверхностная плотность лигандов, nr - поверхностная плотность рецепторов на поверхности опухолевой клетки, kr0 - константа скорости диссоциации комплекса лиганд-рецептор при нулевой нагрузке) можно брать из соответствующих источников информации, описывающих характеристики данных частиц и свойства данного лектина, или определить экспериментально (для коэффициентов , nr, kr0). Например, для растительного лектина абрин значения kr0 можно найти в работе [K. Sandvig, S. Olsnes, and A. Pihl. Kinetics of Binding of the Toxic Lectins Abrin and Ricin to Surface Receptors of Human Cells. 251(13): 3977-3984, 1976]. Из этой же работы находим, что Nr - количество рецепторов для данного лектина на поверхности опухолевой клетки составляет 107 молекул, далее по формуле nr=Nr/600 рассчитывается значение nr, равное 1,67⋅104 мкм-2. В случае, если диаметр наночастицы составляет 0,12 мкм, и на одну наночастицу приходиться 10 молекулы лектина (N), значение рассчитывается в соответствии с формулой , где N - количество молекул лектина, ковалентно связанных с одной частицей, и составит 221 мкм-2.
Ниже представлены примеры реализации изобретения на лабораторных животных.
Пример 1
Самкам иммунодефицитных мышей линии SCID с ортотопически привитой подкожной опухолью (типа S (объем опухоли V<500 мм3)) молочной железы человека (клеточная линия MDA-MB231) однократно вводилось в тело опухоли 10 мкл контрольного препарата ферромагнитных наночастиц (ФНЧ), не содержащих вектор-лиганд MLI, и препарата ФНЧ-MLI, содержащего эквивалентное количество железа (5 мкг по содержанию железа). За изменением содержания ФНЧ-MLI и контрольного препарата в опухоли следили с помощью магнитно-резонансной томографии (МРТ).
Все МРТ измерения были выполнены на горизонтальном магнитно-резонансном томографе для лабораторных животных с напряженностью магнитного поля 11,7 Тесла (BioSpec 117/16 USR, Bruker, Германия). Измерения были выполнены с использованием радиочастотной объемной катушки 1Н, работающей на частоте 500,3 МГц, томограммы получены с помощью импульсной последовательности FISP (Fast Imaging with Steady State Precession). В импульсной последовательности градиентные эхо-сигналы генерируются срезами-селективных радиочастотных импульсов с ТЕ=TR/2 и полной переориентацией всех каналов градиента (режим TRUE_FISP). Параметры импульсной последовательности: время повторения / время эхо (TR/ТЕ)=3,6/1,8 мсек, матрицей - 256×256×128, полем зрения (FOV)=60×60 мм2, толщиной среза - 0,31 мм, количеством срезов в случае исследования на мышах - 128, количеством накоплений - 4, общим временем сканирования - 4 мин 18 сек.
Перед проведением процедуры сканирования и во время нее каждая мышь была наркотизирована при помощи газового наркоза изофлюрана. Животное помещали в положении лежа в специально предназначенную для томографии горизонтальную «кроватку», которую затем задвигали внутрь прибора. Кроватка снабжена температурным обогревом для предотвращения снижения температуры тела животного при его нахождении в наркотизированном состоянии. На протяжении всего сканирования при помощи специализированного устройства (SA Instruments, Stony Брук, штат Нью-Йорк, США), совместимого и поставляемого с МРТ системой, производился мониторинг физиологического состояния животного, в частности частоты дыхания. Информация о частоте дыхания использовалась для контроля глубины наркоза.
Измерения сигнала магниторезонасного вещества (ФНЧ) проводили через 0, 15 мин, 2 часа и 24 часа после введения. В эти же временные точки проводили измерения МРТ сигнала в мышцах бедра мыши, как наиболее стабильной магнитоконтрастной ткани. Данное значение далее использовали для нормировки сигнала в опухоли. На основании полученных данных, используя программу Microsoft Excel, строили зависимость изменения МРТ сигнала в опухоли по отношению к сигналу в мышце от времени (фиг. 1) для обоих препаратов.
В проведенном нами эксперименте с использованием ксенографтной модели опухоли молочной железы человека у иммунодефицитных мышей SCID, было показано достоверное различие в скорости выведения контрольных наночастиц и наночастиц, содержащих MLI, для опухолей типа S (объем опухоли V<500 мм3). Расстояние, пройденное наночастицей, оценивали как средний радиус опухоли, который для опухоли типа S составил ΔL=2,2 мм. Считали, что время задержки составило 1,75 ч (см. фиг 1). На основании этих данных оценка значения давления в опухоли составила порядка 2,5 кПа (или 19,4 мм рт.ст.).
Измерение давления в опухоли также было проведено стандартным на сегодняшний день методом «Тампон-в-игле» в соответствии с работой [Boucher Y., Baxter L.Т., Jain R.K. Interstitial pressure gradients in tissue-isolated and subcutaneous tumors: implications for therapy // Cancer research. - 1990. - T. 50. - №. 15. - C. 4478-4484]. Для измерения использовали прибор DSI ТА11РА-C10 (Data Sciences International, New Brighton, MN, USA). Перед проведением измерений игла прибора имплантировалась в организм животного. Конец иглы устанавливался непосредственно в центре опухоли. Перед трансплантацией прибор был откалиброван для стандартных условий эксперимента. Мышей подвергали анестезии смесью изофлурана и кислорода. Проведенные измерения показали значение давления в центре опухоли, сравнимое с рассчитанным на основании представленных экспериментальных данных по времени задержки выведения наночастиц, конъюгированных с MLI, по сравнению с контрольными наночастицами, и составило 2,65 кПа.
Пример 2
Для опухоли типа В (объем опухоли V>500 мм3) достоверного различия времени выведения контрольных наночастиц и наночастиц, конъюгированных с MLI, не наблюдалось (см. фиг. 1), что свидетельствует о существенно большем давлении внутри опухолей такого размера. Расстояние, пройденное наночастицей оценивали, как средний радиус опухоли, который для опухоли типа В составил ΔL=4,8 мм. Расчетное время задержки выведения наночастиц с MLI составило 10 мин, значение давления в опухоли составило 4,2 кПа.
Как и в примере 1, значение давления в центре опухоли также было определенно прямым инзазивным методом «Тампон-в-игле». Значение давления внутри опухоли составило 4,5 кПа.
Таким образом, значение максимального давления в центре опухоли, определенное с помощью предлагаемого метода на основании задержки выведения наночастиц, конъюгированных с лектином вискумин, и методом прямого инвазивного измерения путем введения в опухоль датчика, составляет не более 10%.
Поскольку все выкладки, приведенные в патенте, не затрагивают специфичные для организма мыши параметры, их можно использовать и для аналогичных исследований у человека.
1. Способ определения давления в опухоли, включающий:
- измерение среднего радиуса опухоли (ΔL);
- введение в опухоль контрольного препарата, в качестве которого используют магнитоконтрастные наночастицы в концентрации, достаточной для детекции с использованием МРТ, с последующим измерением MP-сигнала в процессе выведения из опухоли контрольного препарата и построением зависимости изменения интенсивности МРТ сигнала в опухоли от времени;
- введение в опухоль целевого препарата, представляющего собой наночастицы, используемые в контрольном препарате, ковалентно сшитые с лектином, через время, необходимое для выведения из организма контрольного препарата, с последующим измерением MP-сигнала в процессе выведения из опухоли целевого препарата и построением зависимости изменения интенсивности МРТ сигнала в опухоли от времени;
- определение по полученным зависимостям времени задержки Δt выведения из опухоли целевого препарата относительно контрольного, с последующим расчетом значения давления в опухоли по формуле:
формуле:
где:
kb - постоянная Больцмана;
Т - абсолютная температура тела;
R - радиус наночастицы;
h - высота рецептора, находящаяся на поверхности опухолевой клетки, которую принимают равной 5 нм;
Rr0 и Rr1 - внешний и внутренний радиусы кольца, в пределах которого может взаимодействовать рецептор, принимают равными 7 нм и 3,5 нм, соответственно;
kr0 - константа скорости диссоциации комплекса лектин-рецептор при нулевой нагрузке;
nl - поверхностная плотность лектинов, являющаяся характеристикой используемых наночастиц, определяемой по формуле nl=N/4πR2, где N - количество молекул лектина, ковалентно связанных с одной частицей;
nr - плотность рецепторов для лектина на поверхности опухолевой клетки, определяемая по формуле nr=Nr/600, где Nr - количество рецепторов для лектина на поверхности опухолевой клетки;
ΔL - средний радиус опухоли;
Δt - время задержки выведения наночастиц, ковалентно сшитых с лектином.
2. Способ по п. 1, характеризующийся тем, что средний радиус опухоли (ΔL) измеряют с помощью МРТ.
3. Способ по п. 2, характеризующийся тем, что для определения среднего радиуса опухоли (ΔL) получают изображения опухоли в разных плоскостях, по которым определяют максимальные параметры опухоли по трем осям x-y-z, затем рассчитывают объем опухоли, из которого находят средней радиус опухоли.
4. Способ по п. 1, характеризующийся тем, что в качестве магнитоконтрастных наночастиц используют ферромагнитные наночастицы, в качестве лектина используют лектин омелы белой - вискумин (mistletoe lectin, MLI).
5. Способ по п. 4, характеризующийся тем, что давление в опухоли рассчитывают по формуле:
где Δt - время задержки выведения ферромагнитных наночастиц, ковалентно сшитых с лектином MLI, по сравнению с контрольным препаратом из ферромагнитных наночастиц.
6. Способ по п. 1, характеризующийся тем, что время задержки выведения из опухоли целевого препарата относительно контрольного определяют по разнице длительности содержания наночастиц в максимальной концентрации.
7. Способ по п. 1, характеризующийся тем, что для определения времени задержки Δt фиксируют время, соответствующее точке перегиба от минимального значения сигнала МРТ к максимальному при введении контрольного препарата (tk), затем для таргетного препарата фиксируют значение времени, соответствующее точке перегиба от минимального значения сигнала МРТ к максимальному (tt), после чего время задержки определяют по формуле: Δt=tt-tk.
8. Способ по п. 1, характеризующийся тем, что таргетный препарат берут в количестве по содержанию магнитоконтрастного вещества, равном его количественному содержанию в контрольном препарате.