2-оксо-1,3-диоксолан-4-карбоксамиды, их получение и применение
Иллюстрации
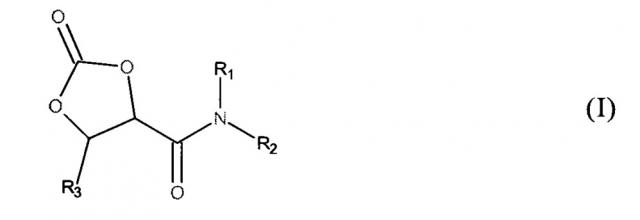
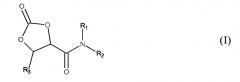
Показать всеИзобретение относится к 2-оксо-1,3-диоксолан-4-карбоксамидам формулы (I), где R1 и R2, в каждом случае независимо друг от друга, являются выбранными из Н, неразветвленных или разветвленных или циклических групп С1-12-алкила, a R3 представляет собой Н, или R1 и R3 каждый представляет собой Н, a R2 представляет собой n-валентный радикал в виде неразветвленных или разветвленных групп С2-22-алкилена, где n равно 2-3, и который является замещенным n-1 дополнительными группами 2-оксо-1,3-диоксолан-4-карбоксамида общей формулы (II), способам получения этих 2-оксо-1,3-диоксолан-4-карбоксамидов на основе 2-оксо-1,3-диоксолан-4-карбоновых кислот формулы (III), а также к применению указанных 2-оксо-1,3-диоксолан-4-карбоксамидов для получения (поли)гидроксиуретанов, гидроксикарбонатов и гидроксисульфонилформиатов, а также в качестве концевых групп для блокирования аминов. 5 н. и 8 з.п. ф-лы, 2 табл., 14 пр.
Реферат
Настоящее изобретение относится к 2-оксо-1,3-диоксолан-4-карбоксамидам формулы (I),
в которой R2 может представлять собой, среди прочих, n-валентный радикал (n>1), который является замещенным n-1 дополнительными группами 2-оксо-1,3-диоксолан-4-карбоксамида общей формулы (II),
для способов получения этих 2-оксо-1,3-диоксолан-4-карбоксамидов, для способов получения 2-оксо-1,3-диоксолан-4-карбоновых кислот формулы (III),
которые являются приемлемыми исходными материалами для указанных выше способов, а также для применения указанных 2-оксо-1,3-диоксолан-4-карбоксамидов для получения (поли)гидроксиуретанов, -гидроксикарбонатов и -гидроксисульфонилформиатов, а также в качестве концевых групп для блокирования аминов.
Структурно подобные соединения уже являются известными из области техники. Например, WO 2004/003001 А1 описывает соединения общей формулы (VI)
где R1 и R2 могут представлять собой радикалы, независимые друг от друга, R1+R2=О или CR1+R2 может представлять собой 3-6-членную группу циклоалкила. R4 может представлять собой водород, неразветвленный или разветвленный C1-8-алкил, C5-12-циклоалкил или С6-15-арил. R3 может представлять собой неразветвленный или разветвленный C1-8-алкил или С6-15-арил. В общем случае, WO 2004/003001 А1 описывает ферментативное разделение рацематов энантиомеров типа (VI) без указания синтеза этих соединений.
ЕР 1941946 А1 описывает применение карбонитридного катализатора, среди прочих, для получения определенных дизамещенных органических карбонатов. Такие также могут представлять собой соединения общей формулы (VII),
где R10 и R11, независимо друг от друга, представляют собой выбранные необязательные заместители. Возможные значения заместителей представляют собой алкил, арил, гетероарил и сложноэфирные группы СО2А, где А может, в свою очередь, представлять собой алкил или арил, например, неразветвленный или разветвленный C1-6-алкил, предпочтительно C1-3-алкил и особенно предпочтительно метил или этил. Однако никаких способов для синтеза систем 2-оксо-1,3-диоксолана не указано.
JP 2006-003433 А раскрывает герметизирующую композицию для элементов жидкокристаллических дисплеев, которая включает соединение общей формулы (VIII),
где R представляет собой Н, гидроксильную группу, цианогруппу, группу карбоновой кислоты, необязательно замещенную ароматическим кольцом, неразветвленную или разветвленную, или циклическую алкильную группу, ацильную группу или сложноэфирную группу. 2-оксо-1,3-диоксолан-4-карбоновая кислота (R=СООН) также упоминается.
ЕР 0001088 А1 описывает, среди прочих, 2-оксо-1,3-диоксоланы общей формулы (IX), где R может представлять собой Н или СН3.
ЕР 2397474 А1 описывает сложные эфиры 2-оксо-1,3-диоксолан-4-карбоновой кислоты формулы (X)
в которой R1 может предпочтительно представлять собой Me или Et или n-валентный радикал, который может быть замещенным максимально с помощью n-1 дополнительных 2-оксо-1,3-диоксолан-4-карбоксильных групп, способ их получения путем карбоксилирования соответствующих эпоксидов, способ их переэтерификации, а также их применение для получения гидроксиуретанов и в качестве концевых групп для блокирования аминов.
US 2010/0317838 А1 описывает соединения формулы (XI)
в которой Z=О и n=0, по крайней мере, один из радикалов W1 или W1a включает защищенный гликозид, и каждый из радикалов W1 и W1a, независимо друг от друга, может, среди прочих, также представлять собой амидную группу. Отличие от настоящего изобретения заключается в том, что в соответствии с изобретением никаких защищенных групп гликозида не обеспечивается.
Полиуретаны на основе полиизоцианатов относятся к уровню техники. Они используются, например, в качестве склеивающих агентов, герметиков, композиций для формовки, в качестве защитных агентов от коррозии и для покрытий. Высокая устойчивость к кислотам, щелочам и химическим агентам для вулканизированных композиций, полученных таким образом, являются преимущественными. Однако низкий молекулярный вес мономеров (поли)изоцианатного соединения является токсикологически неприемлемым, особенно тогда, когда они являются высоколетучими или способны к перегруппировке.
Полиуретанные системы могут также быть получены, исходя из циклических карбонатных соединений, которые являются токсикологически приемлемыми. Так, например, глицерин карбонат (4-(гидроксиметил)-2-оксо-1,3-диоксолан) регулярно используется в косметических средствах.
Циклические карбонатные соединения вступают в реакцию с аминами с открытием кольца и, среди прочих, обеспечивают получение гидроксиуретанов (сравните формулу на схеме, представленной ниже):
Недостатки систем на основе глицерин карбонатов представляют собой низкую региоселективность, что приводит к реакционным путям А, В и С, сравнительно низкую реактивность систем при комнатной температуре, и тот факт, что катализаторы, которые повышают скорость раскрытия кольца, очевидным образом способствуют осуществлению обратной реакции, которая может приводить к частичному разложению уже сформированных продуктов.
В упомянутом выше ЕР 2397474 А1 эти проблемы были частично решены при использовании сложноэфирной группы вместо простой эфирной группы в R. Эта электроноакцепторная группа приводит к значительному повышению скорости реакции и к предпочтению для реакционного пути А. В случае образования вторичных гидроксиуретанов [I] никакой обратной реакции не наблюдается. Однако получение связующих агентов, которые включают две или более 2-оксо-1,3-диоксолан-4-карбоксильные группы в молекуле, является сложным, поскольку это происходит с помощью переэтерификации, при осуществлении которой кольцо циклокарбоната может также подвергаться атаке.
Упомянутая выше заявка US 2010/0317838 А1 создает видимость того, что эта реакция открытия кольца является зависимой от природы R (сравни пункт 17 заявки US 2010/0317838 А1, направленный на открытие кольца соединения в соответствии с пунктом 1, которое может содержать сложноэфирные группы или группы, подобные амидным). Однако такая видимость является в корне неверной.
Во-первых, были проведены исследования (сравни Н. Tomita, F. Sanda, Т. Endo, Journal of Polymer Science: Part A: Polymer Chemistry, Vol. 39, 3678-3685 (2001)), в соответствии с которыми реактивность 2-оксо-1,3-диоксоланов, которые являются замещенными в 4-положении с помощью группы R, аминами повышаются в следующем порядке: R=Me<R=H<R=Ph<R=CH2OPh<<R=CF3.
Во-вторых, в случае продуктов упомянутой выше заявки ЕР 2397474 А1, где основная полимерная цепь является присоединенной с помощью сложноэфирных связей, то есть R в схеме формулы, приведенной ниже, означает основную полимерную цепь, реакцию открывания кольца (отверждения) осуществляют с помощью определенного количества аминолиза сложноэфирной связи, что приводит к отсоединению основной цепи в форме спирта с низкой реакционной способностью.
Задачей изобретения было существенно избежать, по крайней мере, некоторых недостатков уровня техники, описанного выше. В общем случае, цель представляла собой обеспечение системы 2-оксо-1,3-диоксолана электроноакцепторной группой. В частности, цель изобретения заключалась в том, чтобы обеспечить систему 2-оксо-1,3-диоксолана, которая является токсикологически приемлемой, легко доступной и в высокой степени реактивной с аминными отверждающими агентами, а также приемлемой для способного к сшиванию связующего агента (со связыванием с полимерной цепью, которая является менее чувствительной к атаке с помощью аминов). Решение поставленной задачи было достигнуто при использовании признаков независимых пунктов формулы. Зависимые пункты формулы относятся к предпочтительным воплощениям.
В случае амидов настоящего изобретения аминолиз сам по себе не является возможным. В случае если имеет место какое-либо трансаминирование, то образовавшийся амин будет способным действовать в качестве реактивно отверждающего агента для атаки дополнительных циклических карбонатных групп. Поперечное сшивание и отверждение продуктов, таким образом, является намного выше. Это следует из приведенной ниже схемы и будет продемонстрировано в разделе "Эксперименты", приведенном в данной заявке ниже.
Настоящее изобретение обеспечивает 2-оксо-1,3-диоксалан- формулы (I),
который характеризуется тем, что R1 и R2 в каждом случае, независимо друг от друга, являются выбранными из Н, неразветвленных или разветвленных или циклических групп С1-12-алкила, групп С6-10-арила, групп С6-12-аралкила и групп С6-12-алкарила или вместе с атомом N, с которым они являются связанными, формируют 5-8-членное кольцо, a R3 является выбранным из Н и неразветвленных или разветвленных, или циклических групп C1-12-алкила, или R1 и R3 каждый представляет собой Н, a R2 является n-валентным радикалом, где n представляет собой целое число больше 1,
который является замещенным n-1 дополнительными группами 2-оксо-1,3-диоксолан-4-карбоксамида общей формулы (II)
Атом углерода, с которым является связанным R3, может также дополнительно нести еще одну группу С1-12-алкила. Атом углерода в 4-м положении может также дополнительно нести еще одну группу С1-12-алкила. При этом оба могут присутствовать одновременно.
В 2-оксо-1,3-диоксолан-4-карбоксамиде в соответствии с изобретением группы R1 и R3 предпочтительно каждая представляет собой Н, a R2 является выбранным из метила, этила, н-пропила, изопропила, н-бутила, втор.-бутила, трет.-бутила, н-пентила, неопентила, н-гексила, 2-этил-н-гексила, н-лаурила, циклогексила, фенила и бензила.
2-оксо-1,3-диоксолан-4-карбоксамиды в соответствии с изобретением могут использоваться в качестве способных к отверждению связующих агентов. В этом случае необходима функциональность в отношении группы 2-оксо-1,3-диоксолана большая, чем 1 (как определяется в данной заявке выше). Предпочтительно, n может представлять собой 2-5, в частности, 2-3.
В этом случае R2 представляет собой полимерный скелет способного к отверждению связующего агента и является выбранным из неразветвленных или разветвленных групп С2-22-алкилена, групп полиэфира общей формулы -(A1O)m-, где A1 представляет собой С2-5-алкилен, a m равно 1-100, групп поликарбоната, сложно-полиэфирных групп, групп поли(мет)акрилата и их комбинаций.
Ключевые промежуточные соединений при получении 2-оксо-1,3-диоксолан-4-карбоксамидов (I) в соответствии с изобретением представляют собой 2-оксо-1,3-диоксолан-4-карбоновые кислоты формулы (III).
Настоящее изобретение также обеспечивает способ для получения 2-оксо-1,3-диоксолан-4-карбоксамида формулы (I), который в соответствии с первым воплощением характеризуется тем, что 2-оксо-1,3-диоксолан-4-карбоновая кислота формулы (III) подвергается реакции с амином формулы R1-NH-R2 с образованием 2-оксо-1,3-диоксолан-4-карбоксамида (I) в соответствии с изобретением, где R1, R2 и R3 имеют приведенные значения. Является возможным с помощью этой реакции получать 2-оксо-1,3-диоксолан-4-карбоксамиды формулы (I), где R1 и R2 оба отличаются от Н.
Поскольку в процессе реакции образуется вода, является особенно предпочтительным осуществлять реакцию в присутствии удаляющего воду агента, в частности карбодиимида.
В соответствии с другим воплощением 2-оксо-1,3-диоксолан-4-карбоновая кислота формулы (III) может также подвергаться реакции с изоцианатом формулы R2-NCO с образованием 2-оксо-1,3-диоксолан-4-карбоксамида (I) в соответствии с изобретением, где R1=Н и R2 и R3 имеют приведенные значения.
В соответствии с этим воплощением 2-оксо-1,3-диоксолан-4-карбоновая кислота формулы (III) может вступать в реакцию либо с моноизоцианатом, либо с полиизоцианатом, имеющим NCO группы, где n имеет значения, приведенные выше.
Реакцию предпочтительно осуществляют в присутствии катализатора, выбранного из третичных аминов, органометаллических соединений и их смесей. Третичный амин может быть выбранным, например, из диметилциклогексиламина, 4-диметиламинопиридина (DMAP), диазабициклооктана (DABCO) и диазабициклоундецена (DBU); органометаллическое соединение может быть выбранным, например, из дибутилтин дилаурата (DBTL), карбоксилата висмута, такого, как висмут октаноат или висмут неодеканоат, алкоксилата или карбоксилата титана или циркония, и подобных им катализаторов, которые являются известными из уровня техники.
В случае моноизоцианата формулы R2-NCO в соответствии с изобретением R2 предпочтительно является выбранным из метила, этила, н-пропила, изопропила, н-бутила, втор.-бутила, трет.-бутила, н-пентила, неопентила, н-гексила, 2-этил-н-гексила, н-лаурила, циклогексила, фенила и бензила.
Полиизоцианат в соответствии с изобретением предпочтительно представляет собой алифатический изоцианат, ароматический изоцианат или комбинированный алифатический/ароматический изоцианат с NCO функциональностью (количество NCO групп в молекуле) n=2-5, предпочтительно n=2-3.
Приемлемые полиизоцианаты включают тетраметилен 1,4-диизоцианат, 2-метилпентаметилен 1,5-диизоцианат, гексаметилен 1,6-диизоцианат (HDI), 2,2,4- и 2,4,4-триметилгексаметилен 1,6-диизоцианат (TMDI), додекаметилен 1,12-диизоцианат, лизин диизоцианат и сложный эфир лизин диизоцианата, 1-изоцианато-3,3,5-триметил-5-изоцианатометилциклогексан (изофорон диизоцианат - IPDI), 1,4-диизоцианато-2,2,6-триметилциклогексан (TMCDI), 2,2'-, 2,4'- и 4,4'-дициклогексилметан диизоцианат (H12MDI), циклогексан 1,3-диизоцианат и циклогексан 1,4-диизоцианат (CHDI), 1,3- и 1,4-бис(изоцианатометил)циклогексан, 4,4'-диизоцианатодициклогексил-2,2-пропан, м- и п-фенилен диизоцианат, 2,3,5,6-тетраметил-1,4-диизоцианатобензол, 3,3'-диметил-4,4'-диизоцианатодифенил (TODI), 2,4- и 2,6-толуол диизоцианат (TDI), 2,2'-, 2,4'- и 4,4'-дифенилметан диизоцианат (MDI), нафталин 1,2-диизоцианат и нафталин 1,5-диизоцианат (NDI), м- и п-ксилилен диизоцианат (XDI), тетраметилксилилен диизоцианат (TMXDI), а также любую смесь упомянутых выше изоцианатов.
Для целей настоящего изобретения термин полиизоцианаты в соответствии с изобретением является также предназначенным для включения димеров (уретдионов) и тримеров (изоциануратов). Особая важность в данной заявке приписывается HDI тримеру. Кроме того, также включаются олигомеры, такие, как, например, "полимерный MDI" где n=1-8:
Кроме того, преполимеры полиизоцианатов с полиолами могут также использоваться, если присутствует стехиометрический избыток NCO групп. Приемлемые полиолы включают полиоксиалкилен полиолы (также называются "полиэфирные полиолы"), которые могут содержать, среди прочих, единицы этиленоксида, единицы пропиленоксида и единицы бутиленоксида, алифатические диолы и полиолы, а также сложно-полиэфирные полиолы и поликарбонат полиолы, касторовое масло, гидроксилированное эпоксидированное соевое масло, а также смесь упомянутых выше полиолов.
Типичный, неисчерпывающий обзор продуктов реакции 2-оксо-1,3-диоксолан-4-карбоновой кислоты с моно- и полиизоцианатами является приведенным на схеме, представленной ниже:
Настоящее изобретение, кроме того, обеспечивает способ для получения 2-оксо-1,3-диоксолан-4-карбоновой кислоты формулы (III), представленной ниже, которая представляет собой ключевое промежуточное соединение в получении 2-оксо-1,3-диоксолан-4-карбоксамида в соответствии с изобретением.
В соответствии с первым воплощением 2-оксо-1,3-диоксолан-4-карбоновая кислота формулы (III) может быть получена путем гидролиза сложного эфира 2-оксо-1,3-диоксолан-4-карбоновой кислоты формулы (IV)
где R2 и R3 имеют приведенные значения, в кислой среде, предпочтительно в водной уксусной кислоте.
Также является возможным, исходя из сложного эфира 2-оксо-1,3-диоксолан-4-карбоновой кислоты формулы (IV) непосредственно получать 2-оксо-1,3-диоксолан-4-карбоксамид в соответствии с изобретением формулы (I) путем осуществления реакции сложного эфира (IV) с формамидом формулы R1R2H-СНО, где R1 и R2 имеют приведенные значения.
Кроме того, в соответствии с другим воплощением, 2-оксо-1,3-диоксолан-4-карбоновая кислота формулы (III) может быть получена путем окисления глицерин карбоната формулы (V)
где R3 имеет приведенные значения и, в частности, например, с помощью опосредованного N-оксидом окисления или с помощью аэробного окисления.
Опосредованное N-оксидом окисление может осуществляться с помощью 1,3,5-трихлороциануровой кислоты и 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO). Оно может также осуществляться при использовании перекиси водорода в качестве окислителя, например, в присутствии соли марганца.
Аэробное окисление использует кислород из воздуха или кислород в чистой форме в качестве окислителя. Его приемлемым образом осуществляют в присутствии, по крайней мере, одной соли переходного металла, выбранного из Co, Mn, Cu, Fe и их смесей, предпочтительно Mn. Его также предпочтительно осуществляют в приемлемом растворителе или в уксусной кислоте (например, водной). Давление кислорода должно быть в интервале от 0,1 до 100 бар, при этом присутствии N-оксида, такого, как TEMPO, является предпочтительным. Реакция аэробного окисления является особенно предпочтительной для окисления глицерин карбоната (4-(гидроксиметил)-2-оксо-1,3-диоксолана) с образованием 2-оксо-1,3-диоксолан-4-карбоновой кислоты. Источник кислорода может также представлять собой реакцию разложения перекиси водорода при использовании, например, ионов марганца. В общем случае, реакция аэробного окисления, описанная в данной заявке выше, изящно решает проблему обеспечения источника 2-оксо-1,3-диоксолан-4-карбоновой кислоты из глицерин карбоната.
Изобретение также обеспечивает применение 2-оксо-1,3-диоксолан-4-карбоксамидов в соответствии с изобретением для получения гидроксиуретанов. Амиды в соответствии с изобретением подвергают реакции, как было показано на схеме, приведенной в начале, с R'-NH2 для получения гидроксиуретанов. Как и в случае с сложными эфирами 2-оксо-1,3-диоксолан-4-карбоновой кислоты (РСТ/ЕР 2011/058945), гидроксиуретаны с вторичными гидроксильными группами преимущественно образуются в этом случае, поскольку во время атаки нуклеофильного атома азота негативный заряд на атоме кислорода, который находится рядом с группой CONR1R2, является лучше стабилизированным. Гидроксиуретаны с вторичной гидроксильной группой имеют преимущество, которое заключается в том, что не происходит никакой обратной реакции. Теоретически, разрушающее воздействие амина на амидную группу будет также вероятным. Однако было показано, что амин оказывает разрушающее воздействие только на группу 2-оксо-1,3-диоксолана.
Приемлемые амины в данной заявке представляют собой первичные и вторичные амины с алкильными группами, арильными группами, аралкильными группами, а также алкарильными группами в качестве радикалов. Первичные амины подвергаются реакции быстрее, чем вторичные амины; алифатические амины подвергаются реакции быстрее, чем ароматические амины. В частности, (поли)амины с относительно высоким молекулярным весом, такие, как, например, Jeffamine® от Huntsman Corp. и полиэфирамины от BASF SE, являются приемлемыми в данной заявке.
В случае первичных аминов с формулой R'-реакция может представлять собой такую, как показано ниже, где приведена только предпочтительная реакция, которая обеспечивает получение гидроксиуретана с вторичной гидроксильной группой, которая приведена ниже:
Изобретение также обеспечивает применение 2-оксо-1,3-диоксолан-4-карбоксамидов в соответствии с изобретением для получения гидроксикарбонатов. Схема, представленная ниже, демонстрирует только предпочтительную реакцию с получением гидроксикарбоната со вторичной гидроксильной группой. Приемлемые спирты формулы R'-OH представляют собой частный случай упомянутых выше полиолов.
Изобретение также обеспечивает применение 2-оксо-1,3-диоксолан-4-карбоксамидов в соответствии с изобретением для получения гидроксисульфонилформиатов в соответствии с аналогичной схемой:
Если используются оба амина, спирта и/или тиола, а также 2-оксо-1,3-диоксолан-4-карбоксамиды в соответствии с изобретением являются поливалентными (R2=n-валентный радикал с n-1 дополнительными группами 2-оксо-1,3-диоксолан-4-карбоксамида), реакция приводит к получению полимерных продуктов, а именно к полимерным гидроксиуретанам, гидроксикарбонатам и/или гидроксисульфонилформиатам. Другими словами, связующие агенты на основе поливалентного 2-оксо-1,3-диоксолан-4-карбоксамида (где n>1) могут быть легко отверждаемыми при использовании полиаминов, полиолов и/или политиолов.
Соответственно, настоящее изобретение также заключается в применении 2-оксо-1,3-диоксолан-4-карбоксамидов в соответствии с изобретением для получения полимерных гидроксиуретанов, гидроксикарбонатов и/или гидроксисульфанилформиатов.
Одно преимущество систем полигидроксиуретанов заключается в относительно высокой гидрофильности этих систем, что может быть приписано наличию ОН групп. Эти ОН группы в принципе также являются доступными для перекрестного сшивания при использовании полиизоцианатов, несмотря на то что свободные от изоцианата системы в соответствии с изобретением являются предпочтительными в отношении их более низкой токсичности.
Кроме того, при получении систем полигидроксиуретана, которые основаны на 2-оксо-1,3-диоксоланах, образование пузырьков как результат образования СО2, может не происходить, даже в присутствии влажности. Следовательно, являются возможными покрытия с большими порами и свободные от пузырьков, что иногда является проблематичным для классических систем полиуретана. Кроме того, термальная стабильность таких полигидроксиуретановых систем также быть выше, чем стабильность классических полиуретановых систем.
Кроме того, 2-оксо-1,3-диоксолан-4-карбоксамиды с низким молекулярным весом могут использоваться для блокирования аминов в качестве концевых групп (так называемые "концевые колпачки"), которые представляют собой дополнительный объект в соответствии с изобретением. Это также представляет интерес в отношении традиционных амин-перекрестносшитых полиуретановых систем, поскольку избыток амина может приводить к обесцвечиванию, в то время, как избыток изоцианата является токсикологически неприемлемым.
Настоящее изобретение более подробно иллюстрируется со ссылкой на примеры, представленные ниже.
Пример 1: Получение 4-метоксикарбонил-2-оксо-1,3-диоксолана (эталон)
80 г карбоната натрия растворяли в 200 мл дистиллированной воды в трехгорлой колбе на 1000 мл. Раствор охлаждали до температуры 10°C. Потом приблизительно через 10 минут, также при температуре 10°C, прибавляли 58,5 г метил акрилата и перемешивали в 400 мл 7%-ного водного раствора гипохлорита натрия. Потом систему немедленно интенсивно наполняли СО2. Температуре позволяли повыситься до комнатной. Колбу интенсивно наполняли СО2 в течение 1 часа при температуре приблизительно от 25 до 30°C, в течение этого времени температура поддерживалась в пределах указанного интервала с помощью эпизодического охлаждения на ледяной бане. Полученное белое твердое вещество отфильтровывали при использовании вакуумного фильтра. Фильтрат экстрагировали с помощью 4×90 мл дихлорметана. Объединенную органическую фазу высушивали с помощью сульфата натрия и отфильтровывали. Фильтрат удаляли на роторном испарителе. Метил эпоксипропионат получали с 50-60% выходом и чистотой 97%.
20 г метил эпоксипропионата смешивали с 20 г трет.-бутил метилового эфира и 1 г тетрабутиламмоний бромида. Гомогенную смесь переносили в реактор под давлением на 100 мл и подвергали карбоксилированию в течение 4 дней при 40°C и давлении СО2 20 бар. После карбоксилирования получали двухфазную систему; верхняя фаза состояла из трет.-бутил метилового эфира, а нижняя фаза состояла из 4-метоксикарбонил-2-оксо-1,3-диоксолана (чистота 94% (GC), выход 94%).
Продукт характеризовался следующими параметрами: 1Н ЯМР (500 МГц, CDCl3): 3,82 (3Н, s, СН3), 4,50 (1Н, dd, J=5,5, 9,0, СН2), 4,66 (1Н, dd, J=9,0, 9,0, СН2), 5,09 (1H, dd, J=9,0, 5,5, СН); 13С ЯМР (125 МГц, CDCl3): 53,81 (СН3), 67,00 (СН2), 72,34 (СН), 153,97 (-O-CO-O-), 167,42 (-CO-O-); ИФ (четкий): 1812 см-1, (-O-СО-O-), 1742 см-1 (-СО-O-).
Пример 2: Получение 4-метоксикарбонил-2-оксо-1,3-диоксолана (эталон)
940 мл 7%-ного водного раствора гипохлорита натрия вводили в качестве исходной загрузки в трехгорлую колбу на 2000 мл. Раствор охлаждали до 0°C при использовании ледяной/солевой бани. Потом прибавляли 58,5 г метил акрилата и смесь поддерживали при температуре 0°C в течение 30 минут. Низкотемпературную смесь потом изымали и дополнительно перемешивали в течение приблизительно 1,5 часа, так, что смесь нагревалась сама по себе (65-70°C). Образовывался бесцветный, мутный раствор. Потом раствор охлаждали до комнатной температуры и экстрагировали с помощью 4×150 мл дихлорметана. Объединенную органическую фазу высушивали с помощью сульфата магния и отфильтровывали. Фильтрат удаляли на роторном испарителе. Метил эпоксипропионат получали с 70-80% выходом и чистотой 97%. Дополнительную реакцию с получением 4-метоксикарбонил-2-оксо-1,3-диоксолана проводили так, как описано в Примере 1.
Пример 3: Получение 4-метоксикарбонил-2-оксо-1,3-диоксолана (эталон)
20 г метил эпоксипропионата смешивали с 20 г ацетонитрила, 1,5 г бензилтриметиламмоний хлорида и 1,5 г ZnBr2. Гомогенную смесь переносили в реактор на 100 мл под давлением и подвергали карбоксилированию в течение 6 дней при 25°C и давлении CO2 30 бар. После осуществления карбоксилирования смесь разводили с помощью 100 г ацетонитрила. Смесь очищали при использовании оксида алюминия и активированного угля. Потом отгоняли ацетонитрил. Это обеспечивало получение 4-метоксикарбонил-2-оксо-1,3-диоксолана (чистота 72% (GC), выход 65%).
Пример 4: Получение 4-метоксикарбонил-2-оксо-1,3-диоксолана (эталон)
20 г метил эпоксипропионата смешивали с 20 г трет.-бутил метилового эфира, 1,5 г тетрабутиламмоний бромида и 1,5 г йодида калия. Гомогенную смесь переносили в реактор на 100 мл под давлением и подвергали карбоксилированию в течение 6 дней при 50°C и давлении CO2 30 бар. После осуществления карбоксилирования получали двухфазную систему; верхняя фаза состояла из трет.-бутил метилового эфира, нижняя фаза состояла из 4-метоксикарбонил-2-оксо-1,3-диоксолана (чистота 83% (GC), выход 79%).
Пример 5: Кислотный гидролиз 4-метоксикарбонил-2-оксо-1,3-диоксолана
73 г (0,5 моля) 4-метоксикарбонил-2-оксо-1,3-диоксолана нагревали при кипении в течение 3 часов с 11 г (0,55 моля) воды и 48 г (0,8 моля) уксусной кислоты.
Смесь потом прибавляли к циклогексану, отделенное масло осторожно освобождали ото всех летучих компонентов и остаток измельчали при использовании метилен хлорида до образования бесцветного кристаллического преципитата. Преципитат промывали с помощью диэтилового эфира и высушивали в вакууме. Это обеспечивало получение 2-оксо-1,3-диоксолан-4-карбоновой кислоты.
Точка плавления: 119-121°C. 1Н-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 9,486 (broad, s; 1Н); 5,012 (dd; 1H); 4,637 (t; 1H); 4,506 (dd; 1H). 13С-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 168,425 (CO кислота); 153,348 (CO циклокарбонат); 72,247 (CH-COOH); 66,988 (CH2CH-COOH). ИФ (об. [см-1]): 2977 bs (ОН кислота), 2751 bw, 2658 bw, 2621 bw, 2538 bw, 2407 bw, 1785 bm (CO циклокарбонат), 1793 bs (CO кислота), 1546 w, 1481 w, 1431 w, 1399 s, 1345 w, 1325 w, 128 m, 1196 s, 1087 s, 1074 s, 1039 m, 928 w, 832 s, 769 s, 724 m, 699 s, 650 m, 633 s, 525 s.
Пример 6: Опосредованное N-оксидом окисление глицерин карбоната
(Процедура аналогичная JOC 2003; 68; стр. 4999 ff.) 118,1 г (1 моль) глицерин карбоната, 168 г (2 моля) гидрокарбоната натрия, 232 г (1 моль) трихлоризоциануровой кислоты, 18 г (1 моль) воды, 1,5 г (0,01 моля) TEMPO (2,2,6,6-тетраметилпиперидин-1-оксил) и 5 г (0,05 моля) NaBr вводили в качестве исходной загрузки в 1,5 л ацетона при температуре 0°C с перемешиванием. Смесь оставляли для нагревания до комнатной температуры и перемешивали в течение дополнительных 12 часов, после чего ее отфильтровывали. Фильтрат концентрировали путем выпаривания. Полученное масло нагревали при кипении с хлороформом. Это обеспечивало получение 2-оксо-1,3-диоксолан-4-карбоновой кислоты с выходом 97%.
Пример 7: Аэробное окисление глицерин карбоната
118 г (1 моль) глицерин карбоната (4-(гидроксиметил)-2-оксо-1,3-диоксолан), 16,3 г (0,1 моля) N-гидроксифталамида, 7,8 г (0,045 моля) м-хлорбензойной кислоты и 1,3 г (0,05 моля) ацетилацетоната кобальта(II) растворяли в 300 мл ледяной уксусной кислоты и 1 л этил ацетата. Раствор насыщали кислородом и нагревали при кипении в течение 6 часов в атмосфере кислорода. Все летучие компоненты отгоняли, и остаток измельчали при использовании диэтилового эфира. Нерастворимые компоненты удаляли путем промывания с помощью дихлорметана и толуола. Это обеспечивало получение 2-оксо-1,3-диоксолан-4-карбоновой кислоты. Выход составлял приблизительно 15%.
Пример 8: Аэробное окисление глицерин карбоната
11,81 г (0,1 моля) глицерин карбоната (4-(гидроксиметил)-2-оксо-1,3-диоксолан), 0,50 г (0,002 моля) тетрагидрата нитрата марганца(II) (Mn(NO3)2⋅4H2O), 0,58 г (0,002 моля) гексагидрата нитрата кобальта(II) (Co(NO3)2⋅6H2O) и 1,88 г (0,012 моля) TEMPO (2,2,6,6-тетраметилпиперидин-1-оксил) растворяли в 100 мл уксусной кислоты. Красноватый раствор перемешивали в течение 72 часов при комнатной температуре в атмосфере кислорода, выпаривали до осушения, и сырьевой продукт очищали с помощью перекристаллизации. Это обеспечивало получение 2-оксо-1,3-диоксолан-4-карбоновой кислоты в форме белых/желтых кристаллических иголок. Выход составлял приблизительно 75%, и аналитические данные находились в соответствии с известными данными (Пример 5).
Пример 9: Реакция 2-оксо-1,3-диоксолан-4-карбоновой кислоты с н-бутил изоцианатом
(Процедуру осуществляли аналогично Synthesis 2001; 2, стр. 243-246.) Эквимолярные количества 2-оксо-1,3-диоксолан-4-карбоновой кислоты (4,089 г; 37 ммолей) и н-бутил изоцианат (3,67 г; 37 ммолей) растворяли в 100 мл безводного ТГФ. Прибавляли 1 мол. % DMAP (4-диметиламинопиридин), и смесь перемешивали при комнатной температуре до тех пор, пока спектр ИФ не свидетельствовал об исчезновении сигнала изоцианата при 2050 см-1 и исчезновении сигнала амина при 1690 см-1. После прибавления диоксида кремния, смесь отфильтровывали и удаляли растворитель. Остаток перекристаллизовывали из циклогексана.
Точка плавления: 69-71°С. 1Н-ЯМР (ДМСО-d6): 8,454 (broad, s; 1Н;); 5,134 (dd; 1H); 4,676 (t; 1H); 4,412 (dd; 1H); 3,126 (dd; 2H); 1,438 (quint.; 2H); 1,302 (hex.; 2H); 0,895 (t; 3Н). 13С-ЯМР (ДМСО-d6): 165,836 (CO амид); 153,510 (CO циклокарбонат); 73,103 (CH-CONHBu); 67,305 (CH2CH-CONHBu); 38,267 (H-СН2СН2СН2СН3); 30,821 (Н-СН2СН2СН2СН3); 19,534 (Н-СН2СН2СН2СН3); 13.704 (Н-СН2СН2СН2СН3). ИФ (об. [см-1]): 3307 m (NH); 2959 m, 2933 m, 2873 m, 1780 s (CO циклокарбонат), 1657 s (CO амид), 1561s (CN амид) 1473 w, 1385 m, 1298 w, 1248 w, 1161 s, 1093 m, 1075 m, 1052 s, 999 w, 878 w, 820 w, 766 s, 740 w, 708 m, 672 s, 617 s.
Пример 10: Реакция 2-оксо-1,3-диоксолан-4-карбоновой кислоты с циклогексил изоцианатом
(Процедуру осуществляли аналогичной таковой Synthesis 2001; 2, стр. 243-246.) 2,56 г (19 ммолей) 2-оксо-1,3-диоксолан-4-карбоновой кислоты и 2,42 г (19 ммолей) циклогексил изоцианата растворяли в 50 мл безводного ТГФ. Прибавляли 0,05 г (1 мол. %) ДМАП (диметиламинопиридин), и смесь перемешивали в течение ночи при комнатной температуре, при этом образовывался бесцветный преципитат. Удаляли растворитель, и остаток экстрагировали при использовании диэтилового эфира, из которого выкристаллизовывали продукт при выпаривании. Это обеспечивало получение N-циклогексил-2-оксо-1,3-диоксолан-4-карбоксамида.
Точка плавления: 123-125°C. 1Н-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 6,284 (broad, s; 1Н); 5,007 (dd; 1H); 4.735 (t; 1H); 4,506 (dd; 1H); 3,803 (m; 1H); 1,935-1,232 (m; 10H).
13С-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 165,273 (CO амид); 153,002 (CO циклокарбонат); 73,088 (CH-CONHCyHex); 67,077 (CH2CH-CONHCyHex); 48,843 (NH-CH(CyHex)); 33,021 (CyHex); 32,952 (CyHex); 25,560 (CyHex); 25,110 (CyHex). ИФ (об. [см-1]): 3284 bm (NH); 2933 m; 2909 m; 2852 m; 1807 s, 1790 s (CO циклокарбонат); 1649 s (CO амид); 1544 s (CN); 1485 w; 1448 w; 1380 m; 1321 w; 1150 s; 1084 s; 1058 s; 1013 s; 934 w; 893 m; 869 w; 815 w; 767 s; 732 m; 689 m; 637w; 529 m.
Пример 11: Реакция 2-оксо-1,3-диоксолан-4-карбоновой кислоты с ГМДИ (гексаметилендиизоцианатом)
(Процедуру осуществляли аналогичной таковой Synthesis 2001; 2, стр. 243-246.) 9,55 г (57 ммолей) ГМДИ и 0,14 г (14 ммолей) ДМАП растворяли в 20 мл безводного ТГФ. По каплям прибавляли 15 г (140 ммолей) раствора 2-оксо-1,3-диоксолан-4-карбоновой кислоты в 50 мл безводного ТГФ, и полученную смесь перемешивали в течение ночи при комнатной температуре. Полученный преципитат собирали, промывали с помощью ТГФ и эфира и перекристаллизовывали из воды. Это обеспечивало получение дифункционального амида.
Точка плавления: 181-182°C (разложение). 1Н-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 9,486 (broad, s; 1Н;); 5,012 (dd; 1H); 4,637 (t; 1H); 4,506 (dd; 1H). 13С-ЯМР (CDCl3/ДМСО-d6 (1/0,1 [мол/мол])): 168,425 (CO кислота); 153,348 (CO циклокарбонат); 72,247 (CH-CONH-Bu-); 66,988 (CH2 CH-CONH-Bu-).
Пример 12: Реакция 2-оксо-1,3-диоксолан-4-карбоновой кислоты с тримерным ГМДИ
80 г (0,16 моля) тримера ГМДИ (Desmodur® N3600, Bayer AG, или Basonat® LR 9046, BASF SE), 64 г (0,48 моля) 2-оксо-1,3-диоксолан-4-карбоновой кислоты и 0,585 г (4,8 ммоля) ДМАП растворяли в одном литре ТГФ и перемешивали в течение ночи при комнатной температуре. Потом прибавляли 10 г активированного угля и 5 ммолей уксусной кислоты, и смесь перемешивали в течение дополнительного часа. Потом смесь отфильтровывали и отгоняли растворитель.
Это обеспечивало получение 130 г красноватого масла, которое использовали для последующих экспериментов без дополнительной очистки.
Вязкость: 35 500 мПа. ИФ (об. [см-1]): 3345, 2935, 2860, 1803, 1670, 1544, 1461, 1400, 1179, 1080, 747, 665. 1Н-ЯМР (CDCl3); 7,21 (t; 1Н); 4,952 (dd; 1Н); 4,601 (t; 1Н); 4,414 (dd; 1Н); 3,698 (bs; 1H); 3,147 (decapl., 2Н); 1,484 (wt, 2Н); 1,416 (wt, 2Н); 1,217 (bs, 4Н). 13С-ЯМР (CDCl3); 166,109 (CONH); 153,089 (О-СО-О); 148,095 (H-CO-N), 77,194 (CH2-CH-CONH-), 73,057 (CH2-CH-CONH-); 42,504; 39,156; 28,855; 27,474; 26,133 (последние 5 сигналов: -н-гекс-).
Пример 13: Эксперименты по отверждению при использовании связующего агента из Примера 12
Связующую смолу из Примера 12 отверждали с традиционными аминами, то есть, изофорон диамином (IPDA) и изомерной смесью триметил гексаметилендиамина (TMD). Результаты (наличие способности к смешиванию, период рабочей жизнеспособности и твердость по Шору через 3 дня отверждения при комнатно