Способ повышения адгезивной активности лактобацилл, используемых в производстве пробиотиков и кисломолочных продуктов
Иллюстрации
Показать всеИзобретение относится к области микробиологии и биотехнологии, а именно к способу повышения адгезивной активности культур лактобацилл. Способ повышения адгезивной активности культур лактобацилл, включающий в себя выращивание на плотной питательной среде MRS лактобактерий при температуре 36-38°C в течение 24-48 ч, подготовку суспензии лактобактерий до концентрации 1 OD и суспензии эритроцитов до концентрации 1012 кл./мл в физиологическом растворе хлорида натрия при рН, равном 7,2-7,4, инкубирование смеси суспензий бактерий 2,5 мл и эритроцитов 1 мл в шейкер-инкубаторе в течение 30 мин при 36-38°C, центрифугирование смеси в течение 5 мин при 1000 об./мин, декантирование надосадочной жидкости, ресуспендирование осадка в физиологическом растворе хлорида натрия при рН равном 7,2-7,4, фильтрацию ресуспендированного осадка через мембранный фильтр с диаметром пор 1,2 мкм для освобождения от неприкрепившихся к эритроцитам бактерий, пересев лактобактерий с поверхности фильтра на плотную питательную среду MRS и выращивание культуры при температуре 36-38°C в течение 24-48 часов. Вышеописанный способ позволяет эффективно повысить адгезивную активность культур лактобацилл по сравнению с исходными значениями. 2 табл., 6 пр.
Реферат
Область применения
Производство медицинских и ветеринарных пробиотиков, производство кисломолочных продуктов.
Способ повышения адгезивной активности разных видов лактобацилл, составляющих основу коммерческих биопрепаратов медицинского и ветеринарного назначения или входящих в состав кисломолочных продуктов, заключается в селективном отборе из популяции лактобацилл бактерий с повышенными адгезивными свойствами. В качестве субстрата, адгезирующего на себе микробные клетки, используются эритроциты человека или животных. При этом для повышения адгезивных свойств культур лактобацилл, входящих в состав биопрепаратов медицинского назначения и кисломолочных продуктов, целесообразно использовать эритроциты человека 0(I)Rh+ группы крови, а для микроорганизмов, составляющих основу ветеринарных пробиотиков, - эритроциты того же вида животных, для которых предназначен данный биопрепарат.
Адгезированные на эритроцитах бактерии, которые остаются на поверхности фильтра, высевают на плотную питательную среду и подращивают. Адгезивные свойства культуры из прикрепившихся к эритроцитам лактобацилл значительно улучшаются. При использовании данного способа адгезивная активность культур лактобацилл повышается до 80%.
Уровень техники
Известно, что при длительном поддержании культур лактобацилл на искусственных питательных средах в условиях отсутствия природной селекции высокоадгезивных бактерий, которая происходит в естественных местах их обитания (желудочно-кишечный тракт, слизистые оболочки мочеполовой системы), свойство микроорганизмов адгезироваться на поверхности эукариотических клеток значительно снижается и они утрачивают способность колонизировать слизистые кишечника, мочеполового тракта и длительно персистировать в организме млекопитающих, следовательно, снижается эффективность приготовленных на их основе пробиотических препаратов.
В настоящее время отсутствуют сведения о способах повышения адгезивной активности микробных культур, утративших это свойство в результате многочисленных пересевов или длительного поддержания на искусственных питательных средах.
При разработке способа повышения адгезивной активности пробиотических микроорганизмов была использована методика определения бактериофиксирующей активности эритроцитов, сущность которой заключается в том, что смесь взвесей микробов и эритроцитов инкубируют при температуре 36…38°С на шуттель-аппарате в течение 30 мин, центрифугируют до осаждения эритроцитов, а затем с помощью фотоэлектроколориметра определяют оптическую плотность надосадочной жидкости. Данная методика позволяет определять адгезивную активность микроорганизмов на поверхности эукариотических клеток [Романов В.Е. Ивонин, А.Г., Бондаренко, А.Л., Оборин, В.А. Способ определения бактериофиксирующей активности эритроцитов // Патент России №2360969. 2007. Бюл. №19].
С помощью данного метода определяли уровень адгезии культур разных видов лактобацилл до и после их обогащения высокоадгезивными бактериями.
Изобретение поясняется следующими примерами.
Пример 1
Для приготовления бактериальной суспензии культуру пробиотических лактобацилл подращивают на плотной питательной среде MRS, трижды отмывают в стерильном физиологическом растворе хлорида натрия 7,2…7,4 ед. рН. Измерение оптической концентрации бактериальной суспензии проводят на колориметре фотоэлектрическом КФК-2 (Россия) при длине волны 540 нм, толщине кюветы 5 мм. Концентрация бактериальной суспензии доводится до 1,0 OD (оптической плотности).
Эритроциты крови (свежая цитратная кровь или эритроцитарная масса) трижды отмывают в стерильном физиологическом растворе хлорида натрия 7,2…7,4 ед. рН, концентрация эритроцитов в физиологическом растворе доводится до 1012 кл/л. Для повышения адгезивных свойств лактобацилл, входящих в состав медицинских биопрепаратов или кисломолочных продуктов, используются эритроциты человека 0(I)Rh+ группы крови, а для лактобацилл, составляющих основу ветеринарных пробиотических препаратов, - эритроциты крови того вида животного, которым выпаивается данный биопрепарат.
Для достижения адгезии бактериальных клеток на поверхности эритроцитов смесь суспензий бактерий 2,5 мл и эритроцитов 1 мл инкубируют в течение 30 мин при 36…38°С в шейкер-инкубаторе.
Бактерии, на поверхности которых имеются адгезины, адсорбируются на эритроцитах и образуют конгломераты, которые после центрифугирования оседают на дно центрифужной пробирки. Бактерии, утратившие способность адгезироваться, остаются в надосадочной жидкости. Отбор бактериальных клеток, адгезированных на эритроцитах, из суспензии свободных клеток осуществляют в два этапа.
1. Центрифугирование (в течение 5 минут при 1000 об/мин), при котором исследуемая суспензия эритроцитов и бактерий разделяется на две фракции - надосадочную жидкость, содержащую свободные бактериальные клетки, и осадок, состоящий из эритроцитов с адгезированными на них бактериальными клетками и свободных эритроцитов и бактериальных клеток. Надосадочную жидкость декантируют, измеряют ее оптическую концентрацию на колориметре фотоэлектрическом КФК-2 (Россия) при длине волны 540 нм, толщине кюветы 5 мм и вычисляют уровень адгезии бактериальной культуры (Пример вычисления см. в методике В.А. Оборина [Романов В.Е. Ивонин, А.Г., Бондаренко, А.Л., Оборин, В.А. Способ определения бактериофиксирующей активности эритроцитов // Патент России №2360969. 2007. Бюл. №19]).
Осадок, состоящий из эритроцитов с адгезированными на них бактериальными клетками и свободных эритроцитов и бактериальных клеток, ресуспендируют в стерильном физиологическом растворе хлорида натрия 7,2…7,4 ед. рН.
2. Фильтрация ресуспендированного осадка через мембранный фильтр с диаметром пор 1,2 мкм для освобождения от неприкрепившихся к эритроцитам бактерий: микроорганизмы, адгезированные на поверхности эритроцитов, образуют конгломераты и остаются на поверхности фильтра, а неприкрепившиеся бактерии свободно проходят через поры.
С поверхности фильтра адгезированные на эритроцитах бактерии пересевают на плотную питательную среду, выращивают при температуре 36…38°С в течение 24…48 часов, повторно измеряют уровень адгезии данной культуры и сравнивают с начальным значением адгезивной активности.
Пример 2. Повышение адгезивной активности культуры Lactobacillus plantarum 8Р-А3, входящей в состав пробиотического препарата «Лактобактерин»
Культуру бактерий L. plantarum 8Р-А3, выделенную из препарата «Лактобактерин», выращивают на плотной питательной среде MRS в течение 24 часов при температуре 36…38°С, ресуспендируют в стерильном физиологическом растворе хлорида натрия. Для адгезии клеток L. plantarum 8Р-А3 на поверхности эритроцитов смесь суспензий бактерий 2,5 мл и эритроцитов человека 0(I)Rh+ группы крови 1 мл инкубируют в течение 30 мин при температуре 36…38°С на шейкер-инкубаторе. Затем центрифугируют в течение 5 мин при 1000 об/мин. Надосадочную жидкость декантируют, измеряют ее оптическую плотность для определения начального уровня адгезии. Осадок, полученный в результате центрифугирования, ресуспендируют в стерильном физиологическом растворе хлорида натрия и фильтруют через мембрану с диаметром пор 1,2 мкм.
С поверхности фильтра адгезированные на эритроцитах бактерии пересевают на плотную питательную среду, выращивают при температуре 36…38°С в течение 24 часов, повторно измеряют уровень адгезии /данной культуры и сравнивают с начальным значением адгезивной активности. Полученные результаты: начальный уровень адгезии культуры L. plantarum 8Р-А3 составил 17,6±8,3%, после обогащения популяции высокоадгезивными бактериями уровень адгезии культуры составил 73,7±15,7%, что на 56% выше начального значения.
Пример 3. Повышение адгезивной активности культуры Lactobacillus acidophilus LA-5, входящей в состав пробиотического препарата «Нормобакт»
Культуру L. acidophilus LA-5, выделенную из пробиотического препарата «Нормобакт», выращивают на плотной питательной среде MRS в течение 48 часов при температуре 36…38°С, ресуспендируют в стерильном физиологическом растворе хлорида натрия. Для адгезии клеток L. acidophilus LA-5 на поверхности эритроцитов смесь суспензий бактерий 2,5 мл и эритроцитов человека 0(I)Rh+ группы крови 1 мл инкубируют в течение 30 мин при температуре 36…38°С на шейкер-инкубаторе. Затем центрифугируют в течение 5 мин при 1000 об./мин. Надосадочную жидкость декантируют, измеряют ее оптическую плотность для определения начального уровня адгезии. Осадок, полученный в результате центрифугирования, ресуспендируют в стерильном физиологическом растворе хлорида натрия и фильтруют через мембрану с диаметром пор 1,2 мкм.
С поверхности фильтра адгезированные на эритроцитах бактерии пересевают на плотную питательную среду, выращивают при температуре 36…38°С в течение 24 часов, повторно измеряют уровень адгезии данной культуры и сравнивают с начальным значением адгезивной активности. Полученные результаты: начальный уровень адгезии культуры L. acidophilus LА-5 составил 13,0±5,1%, после обогащения популяции высокоадгезивными бактериями уровень адгезии культуры составил 42,8±5,9%, что на 30% выше начального значения.
Пример 4. Повышение адгезивной активности культуры Lactobacillus rhamnosus, входящей в состав кисломолочного продукта «Имунеле»
Культуру L. rhamnosus, выделенную из кисломолочного продукта «Имунеле», выращивают на плотной питательной среде MRS в течение 24 часов при температуре 36…38°С, ресуспендируют в стерильном физиологическом растворе хлорида натрия. Для адгезии клеток L. rhamnosus на поверхности эритроцитов смесь суспензий бактерий (2,5 мл) и эритроцитов человека 0(I)Rh+ группы крови (1 мл) инкубируют в течение 30 мин при 36…38°С на шейкер-инкубаторе. Затем центрифугируют в течение 5 мин при 1000 об/мин. Надосадочную жидкость декантируют, измеряют ее оптическую плотность для определения начального уровня адгезии. Осадок, полученный в результате центрифугирования, ресуспендируют в стерильном физиологическом растворе хлорида натрия и фильтруют через мембрану с диаметром пор 1,2 мкм.
С поверхности фильтра адгезированные на эритроцитах бактерии пересевают на плотную питательную среду, выращивают при температуре 36…38°С в течение 24 часов, повторно измеряют уровень адгезии данной культуры и сравнивают с начальным значением адгезивной активности. Полученные результаты: начальный уровень адгезии культуры L. rhamnosus составил (2,1±0,8)%, после обогащения популяции высокоадгезивными бактериями уровень адгезии культуры составил (20,3±5,0)%, что на 18% выше начального значения.
Пример 5. Повышение адгезивной активности культуры Lactobacillus paracasei В-11821, перспективной для создания ветеринарного пробиотического препарата
Штамм лактобактерий L. paracasei В-11821 (депонирован в ВКПМ ГосНИИГенетики (г. Москва) 14 октября 2014 г. под номером В-11821), который обладает выраженными пробиотическими свойствами и является перспективным для создания на его основе ветеринарного пробиотического препарата, выращивают на плотной питательной среде MRS в течение 24 часов при температуре 36…38°С, ресуспендируют в стерильном физиологическом растворе хлорида натрия (7,2…7,4 ед. рН). Для адгезии клеток L. paracasei В-11821 на поверхности эритроцитов смесь суспензий бактерий (2,5 мл) и эритроцитов человека 0(I)Rh+ группы крови (1 мл) инкубируют в течение 30 мин при 36…38°С на шейкер-инкубаторе. Затем центрифугируют в течение 5 мин при 1000 об/мин. Надосадочную жидкость декантируют, измеряют ее оптическую плотность для определения начального уровня адгезии. Осадок, полученный в результате центрифугирования, ресуспендируют в стерильном физиологическом растворе хлорида натрия и фильтруют через мембрану с диаметром пор 1,2 мкм. С поверхности фильтра адгезированные на эритроцитах бактерии пересевают на плотную питательную среду, выращивают при температуре 36…38°С в течение 24 часов. Повторно измеряют уровень адгезии культуры.
Полученные результаты: начальный уровень адгезии культуры L. paracasei В-11821 составил (50,7±3,4)%, что соответствует высокой адгезивной активности. Однако при длительном поддержании культуры in vitro на искусственных питательных средах в условиях отсутствия селекции высокоадгезивных бактерий, которая происходит в естественных местах их обитания, уровень адгезии культуры может значительно снижаться.
Для имитации процесса длительного поддержания штамма в условиях in vitro на искусственных питательных средах культуру L. paracasei В-11821 подвергали последовательным пересевам в жидкой питательной среде MRS. Уже после 15 пересевов уровень адгезии лактобактерий понизился в два раза и составил (25,1±10,0)%. После обогащения искусственно состаренной культуры L. paracasei В-11821 высокоадгезивными бактериями ее уровень адгезии повысился и составил (40,38±6,2)%.
Пример 6. Влияние адгезивных свойств Lactobacillus paracasei В-11821 на эффективность пробиотика на его основе
Берут две культуры L. paracasei В-11821: первая - с высоким уровнем адгезии (50,7±3,4)%, вторая - со средним уровнем адгезии (25,1±10,0)%. Каждую из них выращивают в жидкой питательной среде MRS на капустном отваре до конечной концентрации живых клеток (4,1±0,5)⋅109 КОЕ/мл. Затем в каждую культуру в качестве стабилизатора вносят сахарозу до конечной концентрации 10% [Позолотина Н.В. Технология приготовления жидкой формы ветеринарного пробиотического препарата на основе штамма Lactobacillus paracasei / Н.В. Позолотина, И.В. Дармов, И.В. Маракулин, И.П. Погорельский // Фундаментальные исследования. - 2015. - №2.ч 10. - С. 2164-2169].
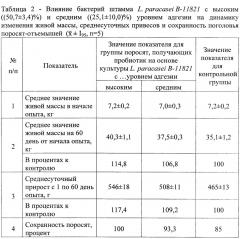
Полученные пробиотические добавки выпаивают поросятам-отъемышам сразу после отъема от свиноматки. Для этого формируют три равноценные группы поросят по 30 голов в каждой группе. Первой группе поросят-отъемышей выпаивают пробиотик на основе высокоадгезивной культуры L. paracasei В-11821, второй - пробиотик на основе среднеадгезивной культуры, третья группа является контрольной и не получает пробиотический препарат. Рацион питания и условия содержания поросят всех групп одинаковый. Пробиотические добавки выпаивают один раз в сутки по следующей курсовой схеме, представленной в таблице 1.
В ходе эксперимента оценивали живую массу поросят-отъемышей, среднесуточные привесы и сохранность поголовья. Результаты научно-производственного опыта представлены в таблице 2.
Как видно из данных таблицы 2, показатели опытных групп поросят выше по сравнению с данными показателями контрольной группы. Пробиотик на основе высокоадгезивной культуры L. paracasei В-11821 обеспечивает достоверное увеличение привесов на 8,2%, живой массы - на 8,0% и сохранности поголовья на 6,7% по сравнению с животными второй группы, получающих пробиотик на основе среднеадгезивной культуры. Из полученных результатов следует, что адгезивные свойства пробиотических микроорганизмов значительно влияют на эффективность пробиотического препарата на их основе.
Способ повышения адгезивной активности культур лактобацилл, включающий в себя выращивание на плотной питательной среде MRS лактобактерий при температуре 36…38°C в течение 24…48 ч, подготовку суспензии лактобактерий до концентрации 1 OD и суспензии эритроцитов до концентрации 1012 кл./мл в физиологическом растворе хлорида натрия при рН, равном 7,2…7,4, инкубирование смеси суспензий бактерий 2,5 мл и эритроцитов 1 мл в шейкер-инкубаторе в течение 30 мин при 36…38°C, центрифугирование смеси в течение 5 мин при 1000 об/мин, декантирование надосадочной жидкости, ресуспендирование осадка в физиологическом растворе хлорида натрия при рН, равном 7,2…7,4, фильтрацию ресуспендированного осадка через мембранный фильтр с диаметром пор 1,2 мкм для освобождения от неприкрепившихся к эритроцитам бактерий, пересев лактобактерий с поверхности фильтра на плотную питательную среду MRS и выращивание культуры при температуре 36…38°C в течение 24…48 часов.