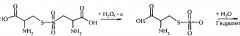Электрохимический способ выявления аминокислотных замен и идентификации пептидов
Иллюстрации
Показать всеИзобретение относится к области химии, а именно к аналитической химии, электрохимии и биохимии, и предназначено для идентификации пептидов и выявления аминокислотных замен в их структурах. Для осуществления способа на печатный графитовый электрод наносят аликвоту 60-100 мкл 50 мкМ раствора пептида в буферном растворе. Регистрируют квадратно-волновую вольтамперограмму окисления в области от 0 до 1,5 В (отн. Ag/AgCl). Измеряют потенциалы максимумов и высоты полученных сигналов окисления аминокислотных остатков - пиков или волн и фиксируют результаты. По различию в положении потенциалов максимумов сигналов окисления и их интенсивности, зная аминокислотные последовательности для группы исследуемых пептидов или имея базу данных, полученную ранее, проводят идентификацию пептидов. При сравнении результатов относительно контроля - «нормального» пептида, констатируют аминокислотную замену. Использование изобретения обеспечивает электрохимическую идентификацию пептидов и выявление в их структуре аминокислотных замен. 1 з.п. ф-лы, 3 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к области аналитической химии, электрохимии и биохимии и касается методики идентификации пептидов и выявления аминокислотных замен в их структуре электрохимическим методом с помощью регистрации анодных вольтамперограмм на печатных графитовых электродах.
Изобретение может быть использовано в аналитической химии, электрохимии и биохимии при идентификации пептидов и выявлении аминокислотными замен в их структуре, а также при изучении биологических процессов с участием пептидов in vitro. Создание в перспективе библиотек вольтамперограмм окисления пептидов расширит возможности по их идентификации. Аминокислотные замены в пептидах и белках представляют интерес при изучении молекулярных механизмов различных заболеваний. Очевидно, что свойства и функции пептидов определяются их аминокислотной последовательностью [1]. Так мутации, приводящие к аминокислотным заменам в β-амилоиде (Аβ) и α-синуклеине, могут быть связаны с развитием болезни Альцгеймера и болезни Паркинсона, соответственно [2-5].
На практике для исследования аминокислотных замен в пептидах используют электрофоретические методы; секвенирование молекул пептидов или анализ молекул ДНК, кодирующих исследуемые пептиды; протеомные методы, сопряженные с хромато-масс-спектрометрией, и предсказание аминокислотных замен методами in silico. К недостатку электрофоретического анализа можно отнести необходимость в достаточно больших количествах исследуемого вещества, кроме того, с помощью этого метода возможно выявление только тех аминокислотных замен, которые вносят существенный вклад в изменение заряда молекулы или молекулярной массы пептида. Предсказание аминокислотных замен в пептидах методами in silico требуют последующей экспериментальной проверки. Несмотря на широкое использование протеомных подходов и анализа ДНК, эти методы достаточно трудоемки, многостадийны, требуют большого количества реагентов и дорогостоящего оборудования.
Электрохимические методы анализа, отличающиеся своей чувствительностью, широким диапазоном определяемых концентраций, низкой себестоимостью оборудования и расходных материалов, скоростью и портативностью, представляются наиболее перспективными для создания нового подхода к идентификации пептидов и анализу аминокислотных замен в их молекулах. В настоящее время электрохимического способа идентификации пептидов и анализа аминокислотных замен в их молекулах не существует.
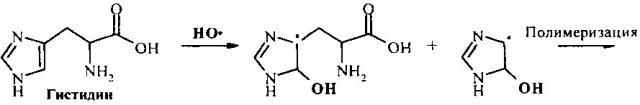
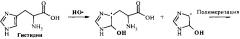
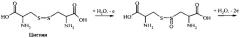
Идентификация молекул пептидов и выявление замен в их аминокислотных последовательностях могут быть осуществлены, используя электрохимическую активность аминокислотных остатков, входящих в их состав: тирозина, триптофана, цистеина, гистидина, метионина и цистина [6]. Реакции электрохимического окисления аминокислот могут быть выражены следующими схемами [6]:
Электрохимическая активность пептидов и белков за счет окисления аминокислотных остатков показана для ряда молекул, используя разные типы электродов их углеродных материалов [7-10]. Диапазоны потенциалов, при которых проходят реакции окисления аминокислотных остатков пептидов и белков описаны в литературе (Таблица 1) [7-11].
Так, окисление пептида Аβ через остаток Тир-10 при потенциале 0,6-0,7 В (отн. Ag/AgCl) используют для слежения за процессом его агрегации [7]. Ранее было показано, что электрохимический анализ сигнала окисления позволяет различить дикий тип и мутантные формы с одиночными аминокислотными заменами фермента ацетилхолинэстеразы [11]. Авторы работы [11] обращают внимание на то, что замены, приводящие к изменениям конформации белка, давали большие изменения электрохимического сигнала, чем другие замены. Наблюдаемые электрохимические эффекты в отношении ацетилхолинэстеразы также подтверждают предположение, что только аминокислоты, локализованные на поверхности белка, проявляют свои электроактивные свойства [12]. Однако, в отличие от молекул белков с относительно стабильной третичной структурой, пептиды достаточно подвижны в нейтральных рН, принимая конформацию случайного клубка.
Задачей настоящего изобретения является разработка способа электрохимической идентификации пептидов и выявления аминокислотных замен в их структуре. Метод основан на регистрации квадратно-волновых вольтамперограмм окисления пептидов в области 0-1,5 В.
Описываемый далее способ ранее никогда не использовался для идентификации пептидов и выявления аминокислотных замен в их структуре. Работы, опубликованные в данной области, в отличие от предлагаемого способа анализа, во-первых, направлены на изучение электрохимических свойств отдельных белков и пептидов в целом и, во-вторых, предлагают различные методы, основанные на регистрации только одного сигнала белка или пептида (в большинстве работ, сигнала окисления за счет остатков Тир). Предлагаемый способ состоит в расширении числа регистрируемых сигналов окисления пептида (белка) за счет нескольких аминокислотных остатков (всех проявляющих электрохимическую активность) и их комплексном анализе.
В соответствии с изобретением описывается способ идентификации пептидов и анализа аминокислотных замен в их структуре, заключающийся в том, что на печатный графитовый электрод наносят аликвоту (60-100 мкл) 50 мкМ раствора пептида в буферном растворе и регистрируют квадратно-волновую вольтамперограмму окисления в области от 0 до 1,5 В (отн. Ag/AgCl); измеряют потенциалы максимумов и высоты полученных сигналов окисления (пиков или волн); заносят результаты в таблицу и по различию в положении потенциалов максимумов сигналов окисления и их интенсивности, зная аминокислотные последовательности для группы исследуемых препаратов или имея базу данных, полученную ранее, проводят идентификацию пептидов. Путем сравнения результатов относительно контроля («нормального» пептида) констатируют аминокислотную замену или модификацию.
ПРИМЕР 1. Методика регистрации электрохимического сигнала образца Аβ16
Поскольку синтетический пептид Аβ16, соответствующий участку 1-16 Аβ человека, содержит в своем составе два вида потенциально электрохимически активных аминокислотных остатка: Тир (Тир-10) и Гис (Гис-6, Гис-13 и Гис-14). Следовательно, на квадратно-волновой вольтамперограмме ожидается появление двух сигналов, соответствующих окислению остатков Тир и Гис.
Исходный 2×10-4 М водный раствор пептида Аβ 16 или его мутатной формы (Таблица 1) перед измерениями разводят в два раза соответствующим фосфатным буферным раствором, для получения 200 мкл-образцы с концентрацией пептида 1×10-4 М в 1×10-2 фосфатном буфере с 5×10-2 M NaCl (рН 7,2). После чего из каждого образца отбирают по три аликвоты объемом 60 мкл и для каждой регистрируют квадратно-волновые вольтамперограммы при следующих параметрах:
Время инкубации: 10 с;
Частота: 25 Гц;
Начальный потенциал: 0 В;
Конечный потенциал: 1,5 В;
Шаг потенциала: 0,005 В;
Амплитуда: 0,040 В.
Для регистрации квадратно-волновых вольтамперограмм закрепляют печатный графитовый электрод в разъеме потенциостата в «горизонтальном режиме». С помощью автоматической пипетки ручного дозирования на поверхность печатного графитового электрода наносят 60 мкл образца пептида (или его мутантной формы) в буфере так, чтобы капля полностью закрыла рабочий, вспомогательный и электрод сравнения. Запускают процедуру измерения сигнала. Полученную вольтамперограмму сохраняют. Для каждого образца пептида проводят процедуру измерения вольтамперограммы окисления в трех технических повторах на трех печатных графитовых электродах. Один печатный графитовый электрод используют один раз для регистрации одной вольтамперограммы. Для каждого образца определяют потенциалы максимумов и высоты полученных пиков(волн)окисления.
В Таблице 2 приведены результаты, полученные для синтетического пептида Аβ 16, его мутантных форм Н6А-Н13А-Аβ16, D7H-Aβl6 и H6R-Aβ16, отличающихся числом остатков Гис; и кАβ16 - пептида, соответствующего участку 1-16 Аβ крысы, не имеющего в своей последовательности Тир. Согласно полученным результатам, вольтамперограммы окисления индивидуальны для каждого исследованного пептида с соответствующими значениями потенциалов максимумов и высот пиков окисления остатков Тир и Гис. По полученным вольтамперограммам можно идентифицировать каждый из тестируемых препаратов пептидов (Таблица 2). Препараты пептидов с аминокислотными заменами значимо отличаются от «нормального» варианта Аβ 16 (Таблица 2).
На приведенных ниже графиках представлены типичные квадратно-волновые вольтамперограммы окисления Аβ 16 в области от 0 до 1,5 В (Фиг. 1); Аβ 16, Н6А-Н13А-Аβ16 и кАβ16 в области потенциалов от 0,75 до 1,25 В (Фиг. 2) и от 0,2 до 0,9 В (Фиг. 3), полученные согласно разработанной методике анализа и демонстрирующие пики окисления пептидов за счет остатка Тир-10 (потенциал максимума пика около 0,6 В) и остатков Гис-6, Гис-13 и Гис-14 (потенциал максимума пика около 1,1 В). Концентрация пептидов составляет 1×10-4 М в фосфатном буфере, рН 7,2.
ЛИТЕРАТУРА
[1] Д. Нельсон, М. Кокс, Основы биохимии Ленинджера в 3-х томах, том 1, М.: БИНОМ. Лаборатория знаний, 2011, 694 с.
[2] A. Puschmann, R. Bhidayasiri, W.J. Weiner, Synucleinopathies from bench to bedside, Parkinsonism Relat Disord, 2012, 18 (Suppl. 1), S24-S27.
[3] Y. Wakutani, K. Watanabe, Y. Adachi, K. Wada-Isoe, K. Urakami, H. Ninomiya, Т.C. Saido, T. Hashimoto, T. Iwatsubo, K. Nakashima, Novel amyloid precursor protein gene missense mutation (D678N) in probable familial Alzheimer's disease, J. Neurol. Neurosurg. Psychiatry, 75 (2004), 1039.
[4] W.T. Chen, C.J. Hong, Y.T. Lin, W.H. Chang, H.T. Huang, J.Y. Liao, Y.J. Chang, Y.F. Hsieh, C.Y. Cheng, H.C. Liu, Y.R. Chen, I.H. Cheng, Amyloid-beta (Abeta) D7H mutation increases oligomeric Abeta42 and alters properties of Abeta-zinc/copper assemblies, PLoS One, 7 (2012), e35807.
[5] J.С.Janssen, J.A. Beck, T.A. Campbell, A. Dickinson, N.C. Fox, R.J. Harvey, H. Houlden, M.N. Rossor, J. Collinge, Early onset familial Alzheimer's disease: Mutation frequency in 31 families, Neurology, 60 (2003), 235.
[6] E.V. Suprun, V.V. Shumyantseva, A.I. Archakov, Protein Electrochemistry: Application in Medicine. A Review, Electrochim. Acta, 140 (2014), 72.
[7] M. Vestergaard, K. Kerman, M. Saito, N. Nagatani, Y. Takamura, E. Tamiya, A Rapid Label-Free Electrochemical Detection and Kinetic Study of Alzheimer's Amyloid Beta Aggregation, J. Am. Chem. Soc. 127 (2005), 11892-11893.
[8] M. Chiku, J. Nakamura, A. Fujishima, Y. Einaga, Conformational change detection in nonmetal proteins by direct electrochemical oxidation using diamond electrodes, Anal. Chem. 80 (2008), 5783-5787.
[9] T.A. Enache, A.M. Oliveira-Brett, Peptide methionine sulfoxide reductase A (MsrA): direct electrochemical oxidation on carbon electrodes, Bioelectrochemistry, 89 (2013), 11-18.
[10] B.D. Topal, S.A. Ozkan, B. Uslu, Direct electrochemistry of native and denatured alpha-2-macroglobulin by solid electrodes, J. Electroanal. Chem. 719 (2014), 14-18.
[11] M. Somji, V. Dounin, S. B. Muench, H. Schuize, Т. T. Bachmann, K. Kerman, Electroanalysis of amino acid substitutions in bioengineered acetylcholinesterase, Bioelectrochemistry, 88 (2012) 110.
[12] E.V. Suprun, M.S. Zharkova, G.E. Morozevich, A.V. Veselovsky, V.V. Shumyantseva, A.I. Archakov, Analysis of Redox Activity of Proteins on the Carbon Screen Printed Electrodes, Electroanalysis, 25 (2013), 2109-2116.
1. Способ идентификации пептидов и анализа аминокислотных замен в их структуре, заключающийся в том, что на печатный графитовый электрод наносят аликвоту 60-100 мкл 50 мкМ раствора пептида в буферном растворе и регистрируют квадратно-волновую вольтамперограмму окисления в области от 0 до 1,5 В (отн. Ag/AgCl); измеряют потенциалы максимумов и высоты полученных сигналов окисления аминокислотных остатков - пиков или волн; фиксируют результаты и по различию в положении потенциалов максимумов сигналов окисления и их интенсивности, зная аминокислотные последовательности для группы исследуемых пептидов или имея базу данных, полученную ранее, проводят идентификацию пептидов.
2. Способ по п. 1, где путем сравнения результатов относительно контроля («нормального» пептида) констатируют аминокислотную замену.