Способ формирования нанопористого оксида на поверхности имплантата из порошкового ниобия
Иллюстрации
Показать всеИзобретение относится к области гальванотехники и может быть использовано при изготовлении имплантатов. Способ формирования нанопористого оксида на поверхности имплантата из порошкового ниобия, включающий обработку в ультразвуковой ванне последовательно в ацетоне и этаноле, промывку в дистиллированной воде, сушку на воздухе и анодирование в водном растворе 1М H2SO4+1% HF в гальваностатическом режиме при плотности тока 0.01 А/дм2 в течение одного часа. Технический результат: увеличение удельной поверхности покрытия, повышение смачиваемости покрытия водой и физиологическим раствором и сохранение высокой коррозионной стойкости имплантата в биосредах. 3 пр., 2 ил.
Реферат
Изобретение относится к электрохимической обработке поверхности металлов и сплавов.
Широко известно применение титана в медицине для изготовления имплантатов в стоматологии, эндопротезировании. Известны способы обработки поверхности металла, улучшающие биосовместимость и приживаемость имплантатов [1]. Перед нанесением покрытий металл подвергается либо пескоструйной обработке, либо химическому или лазерному травлению для создания шероховатой поверхности. Покрытия создаются анодированием титана и его сплавов импульсным током в условиях искрового разряда в насыщенном растворе гидроксиапатита в фосфорной кислоте с концентрацией 5-20% или в 3-5%-ной суспензии гидроксиапатита дисперсностью менее 100 мкм. Покрытие содержит оксид титана и кальцийфосфатные соединения (гидроксиапатиты) и имеет слоистую структуру.
Известный способ формирования покрытий на поверхности титана трудоемок, энергозатратен и не всегда обеспечивает сплошность покрытия на металле. Кроме того, через несколько лет гидроксиапатиты полностью переходят в костную ткань, отслаиваясь от металлической поверхности [2].
Известно, что имплантаты из коррозионностойких аустенитных сталей имеют недостаточную коррозионную стойкость в биосредах. Из-за низкой биоинертности их не применяют для имплантатов длительного использования. В известном способе [3] предлагается на имплантаты из аустенитных сталей наносить покрытие из ниобия, его сплавов или соединений физическим осаждением из парогазовой фазы, химическим осаждением из парогазовой фазы и рядом других способов, которое обеспечит надежную защиту имплантата в биосредах.
Известен способ [4], в котором на поверхности стального имплантата золь-гель методом формируют нанопористый оксид ниобия. Полученное покрытие должно обеспечивать биоинертность имплантата и его длительное использование в биосредах.
Способ формирования покрытия на поверхности аустенитных сталей достаточно сложен и длителен и не всегда создает надежную адгезию покрытия из оксида ниобия к основному металлу.
Известен способ формирования пористых оксидов на плоских образцах ниобия анодированием в 1М H2SO4+1 вес. % HF в вольтстатическом режиме при 20 В в течение одного часа [5]. Известный режим анодирования позволяет сформировать на плоском металле пористый оксид с нерегулярными наноразмерными порами диаметром 20-40 нм.
Известен способ формирования пористого оксида на монолитном тантале, ниобии, цирконии и титане [6]. Способ включает очистку металлов в ультразвуковой ванне последовательно в метаноле, изопропаноле, ацетоне и этаноле, промывку в воде и сушку в потоке азота, анодирование Та и Nb в водном растворе 1М H2SO4+3.3 вес.% NH4F в вольтстатическом режиме при 20 В в течение 120 и 16 минут соответственно. После анодирования образцы тантала, ниобия и циркония термообрабатываются при температуре 290°С в течение 10 минут. Сформированные оксиды на ниобии представляют собой нерегулярную пористую структуру с наноразмерными порами.
Способ достаточно длителен, требует привлечения дополнительных методик и мощностей.
В работах [5, 6] анодирование монолитных деталей из ниобия проводят в электролитах на основе серной кислоты с добавкой фторидов. Процесс ведут в вольтстатическом режиме. Начальная стадия процесса проходит при высоких плотностях тока, провоцирующих рост температуры электролита в зоне реакции. При анодировании плоских деталей теплоотвод обеспечивается диффузией в объем электролита и на поверхности монолитного металла формируется пористый оксид.
Известные способы формирования покрытий могут быть реализованы только на плоских образцах ниобия. Процесс достаточно длительный, толщина оксидов на ниобии не превышает 150-300 нм. Образующееся покрытие представляет собой нерегулярно-пористую неоднородную структуру с растравленным поверхностным слоем.
Известно, что развитая поверхность имплантата увеличивает скорость его приживания. Удельная поверхность монолитного ниобия составляет ~0.7 см2/г. Увеличить ее можно использованием имплантатов из спеченного порошка металла, имеющего удельную поверхность ~500-800 см2/г. Дополнительного увеличения удельной поверхности можно достичь формированием на поверхности спеченного порошка нанопористого оксида методом анодирования.
Вольтстатический режим анодирования образцов из спеченного порошка может приводить к резкому увеличению температуры электролита в зоне реакции в начальной стадии процесса из-за невозможности рассеяния джоулевого тепла из объема пористого металла и как результат нестабильному тепловому режиму анодирования.
В наиболее близком аналоге, выбранном в качестве прототипа предлагаемого технического решения [7], проводят анодирование деталей из спеченного порошка сплава Ti-Al в 10%-ном сернокислом электролите с концентрацией фтористоводородной кислоты, не превышающей 0.15%, в гальваностатическом режиме при плотности тока 0.02 А/дм2 в течение одного часа, что обеспечивает формирование самоорганизованного пористого оксида, состоящего из TiO2 и Al2O3.
Однако этот способ не может быть использован для создания нанопористого покрытия на поверхности имплантатов из порошкового ниобия, так как при анодировании в известном режиме на поверхности ниобия формируется барьерный оксид, не изменяющий удельной поверхности имплантата.
Технический результат предлагаемого технического решения заключается в том, что на имплантатах из порошкового ниобия дополнительно увеличивается удельная поверхность, повышается смачиваемость водой и физиологическим раствором и сохраняется высокая коррозионная стойкость в биосредах. В результате анодирования на поверхности частиц порошка металла формируется нанопористая оксидная пленка толщиной ~500 нм, что значительно увеличивает удельную поверхность.
Технический результат достигается тем, что имплантаты из порошка ниобия обрабатывают в ультразвуковой ванне последовательно в ацетоне и этаноле, промывают в дистиллированной воде, высушивают на воздухе и анодируют в водном растворе 1М H2SO4+1% HF в гальваностатическом режиме при плотности тока 0.01 А/дм2 в течение одного часа.
В предлагаемом способе имплантаты из порошка ниобия обрабатывают в ультразвуковой ванне последовательно в ацетоне и этаноле, затем промывают в дистиллированной воде и высушивают на воздухе. Анодирование проводят в водном растворе 1М H2SO4+1 вес. % HF при постоянной плотности тока 0.01 А/дм2 в течение одного часа.
Предлагаемое техническое решение поясняется примерами.
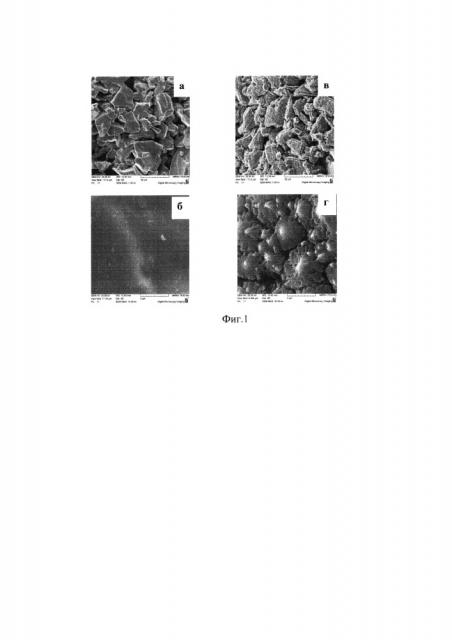
Пример 1. Лабораторные образцы из спеченного осколочного порошка ниобия с размером частиц 10-40 мкм и удельной поверхностью 570-800 см2/г обрабатывали в ультразвуковой ванне последовательно в ацетоне и этаноле, промывали в дистиллированной воде, высушивали на воздухе. Анодирование выполнялось в водном растворе 1М H2SO4+1% HF в гальваностатическом режиме при плотности тока 0.01 А/дм2 в течение одного часа. Изображения поверхности получены с помощью сканирующего электронного микроскопа (СЭМ) Mira TESCAN, Чехия).
На фиг. 1 приведены СЭМ-изображения поверхности спеченного порошка ниобия до анодирования (а, б) и после, со сформированной на поверхности частиц ниобия нанопористой оксидной пленкой (в, г).
Как видно из снимков, поверхность спеченных из порошкового ниобия образцов представляет собой совокупность частиц микронных размеров с достаточно гладкой поверхностью. После анодирования поверхность микрочастиц становится неоднородной - наблюдается появление пористого оксидного покрытия сложной морфологии в виде совокупности микроконусов с линейными размерами от 0.6 до 5 мкм, состоящих в свою очередь из нановолокон диаметрами 50-150 нм. Такая развитая пористая структура оксида увеличивает удельную поверхность порошинок по меньшей мере в 20 раз.
Пример 2. Оценка гидрофильных свойств покрытия была выполнена методом лежащей капли. Измерение угла смачивания поверхности водой и физраствором проводилось на образцах спеченного порошкового ниобия без покрытия и после анодирования в условиях примера 1. На фиг. 2 приведен типичный снимок водной капли на поверхности образца до (а) и после (б) анодирования и снимок капли физраствора до (в) и после анодирования (г). Угол смачивания поверхности порошкового ниобия водой составляет ~56°, физраствором ~77°; после анодирования угол смачивания измерить не удается, т.к. вода и физраствор мгновенно впитываются в поры анодированного металла, что свидетельствует о значительном увеличении гидрофильности поверхности детали.
Пример 3. Коррозионная стойкость анодированных лабораторных образцов из порошкового ниобия исследовалась стандартным методом измерения потенциала разомкнутой цепи (ПРЦ). Образцы без оксида и с оксидом, сформированным аналогично примеру 1, помещали в физиологический раствор (0.9% NaCl), близкий по составу к плазме крови. Величина ПРЦ во всех случаях составляла ±(10-15) мВ, что свидетельствует об отсутствии как процессов пассивации, так и процессов растворения покрытия. Выдержка образцов в физиологическом растворе в течение 60 часов не изменила значений потенциала, что подтверждает коррозионную стойкость порошкового ниобия с оксидом в биосредах.
Нанопористое оксидное покрытие, нанесенное на поверхность имплантатов из порошкового ниобия, увеличивает удельную поверхность, усиливает ее гидрофильность и коррозионную стойкость в биосредах, обеспечивая благоприятные условия их приживаемости.
Источники информации
1. Пат. РФ 2154463. А61К 6/033, A61N 1/32. Покрытие на имплантат из титана и его сплавов и способ его нанесения. Карлов А.В., Шахов В.П., Игнатов В.П., Верещагин В.И., Налесник О.И.; заявитель и патентообладатель Закрытое акционерное общество «Клиническое научно-производственное объединение "Биотехника". - 99114753/14; заявл. 07.07.1999; опубл. 20.08.2000, Бюл. №23.
2. Модификация поверхности титановых имплантатов и ее влияние на их физико-химические и биомеханические параметры в биологических средах / В. Савич [и др.]. - Минск. : Беларуская Навука, 2012. - 244 с.
3. Пат. РФ на полезную модель 71544, A61L 27/00. Металлический имплантат. 2007127633. заявл. 19.07.2007; опубликовано 20.03.2008, Бюл. №8.
4. Pauline S.A., Rajendran N. Biomimetic novel nanoporous niobium oxide coating for orthopaedic applications // Applied Surface Science. - 2014. - V. 290. - pp. 448-457.
5. I. Sieber, H. Hildebrand, A. Friedrich, P. Schmuki. Formation of self-organized niobium porous oxide on niobium. // Electrochemistry Communications, 7 (2005). P. 97-100. doi: 10.1016/elecom. 2004.11.012.
6. Sepideh Minagar, Christopher C. Berndt, Cuie Wen. Fabrication and Characterization of Nanoporous Niobia, and Nanotubular Tantala, Titania and Zirconia via Anodization. // J. Funct. Biomater. 2015, 6, P. 153-170; doi:10.3390/jfb6020153.
7. Пат. РФ №2509181. Способ формирования пористого оксида на сплаве титан-алюминий. C25D 11/26. Кокатев А.Н., Ханина Е.Я., Чупахина Е.А., Яковлев А.Н., Яковлева Н.М.; заявитель и патентообладатель ООО «Нелан-оксид плюс». Опубл. 10.03.2014. Бюлл. №29.
Способ формирования нанопористого оксида на поверхности имплантата из порошкового ниобия, включающий обработку в ультразвуковой ванне последовательно в ацетоне и этаноле, промывку в дистиллированной воде, сушку на воздухе и анодирование в водном растворе 1М H2SO4+1% HF в гальваностатическом режиме при плотности тока 0.01 А/дм2 в течение одного часа.