Полученные экструзией расплава твердые дисперсии, содержащие индуцирующее апоптоз средство
Иллюстрации
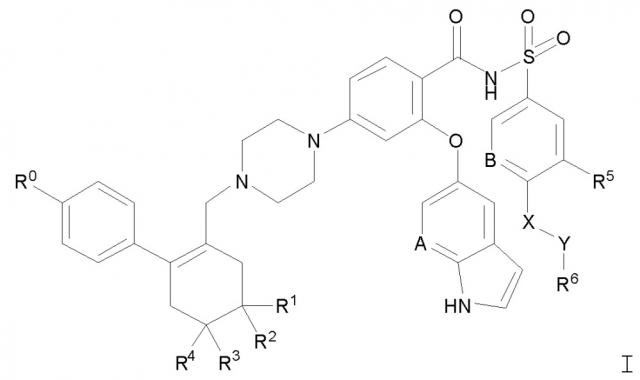
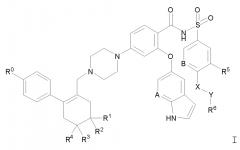
Показать всеИзобретение относится к твердой дисперсии, пригодной для индукции апоптоза. Дисперсия включает соединение Формулы I
где значение групп R0, R1, R2, R3, R4, A, В, R5, X, Y и R6 определено в формуле изобретения, или его фармацевтически приемлемую соль. Причем соединение Формулы I или его фармацевтически приемлемая соль диспергированы в твердой матрице, которая включает (a) по меньшей мере один фармацевтически приемлемый водорастворимый полимерный носитель и (b) по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество. При этом менее 5% соединения Формулы I или его фармацевтически приемлемой соли находится в кристаллической форме, как наблюдается при рентгеновской дифрактометрии. Соединение или его фармацевтически приемлемая соль присутствуют в количестве, эквивалентном количеству родительского соединения, от приблизительно 5% до приблизительно 40% по массе, по меньшей мере один фармацевтически приемлемый водорастворимый полимерный носитель присутствует в количестве от приблизительно 40% до приблизительно 85% по массе, и по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество присутствует в количестве от приблизительно 5% до приблизительно 20% по массе. Соединение Формулы I, в которой R0 обозначает хлор, R1 и R2 обозначают Н, R3 и R4 обозначают метил, A обозначет N, В обозначает CH, R5 обозначает нитро, X обозначает -NH-, Y обозначает -(CH2)n-, где n = 1, и R6 выбран из группы, состоящей из тетрагидропиранила и 4-гидрокси-4-метилциклогексила, исключено из объема соединения Формулы I. Также предложены способы получения твердой дисперсии, пригодной для пероральной доставки, фармацевтическая лекарственная форма и твердая дисперсия для применения в качестве лекарственного средства. Твердая дисперсия является подходящей для перорального введения пациенту, имеющему потребность в лечении заболевания, характеризующегося суперэкспрессией одного или более антиапоптотических белков семейства Bcl-2, например рака. 5 н. и 46 з.п. ф-лы, 1 ил., 17 табл., 19 пр.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет временной заявки 61/408,527, поданной 29 октября 2010, которая тем самым включена путем ссылки, как если бы была сформулирована полностью.
Перекрестная ссылка также делается, без испрашивания права приоритета или статуса уровня техники, на следующую находящуюся на рассмотрении заявку на патент США, содержащую объект, связанный с настоящей заявкой: номер 12/787,682 (U.S. 2010/0305122), названную “Индуцирующие апоптоз средства для лечения рака и иммунных и аутоиммунных заболеваний”, все раскрытие которой включено в настоящее описание путем ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердой дисперсии, включающей индуцирующее апоптоз средство, к фармацевтическим лекарственным формам, включающим такую дисперсию, к способам получения такой дисперсии и лекарственных форм и к способам их применения для лечения заболеваний, характеризующихся суперэкспрессией семейства антиапоптотических белков Bcl-2.
УРОВЕНЬ ТЕХНИКИ
Суперэкспрессия белков Bcl-2 коррелирует с резистентностью к химиотерапии, клиническими результатами, прогрессированием заболевания, полным прогнозом или их комбинацией при различных видах рака и нарушений иммунной системы.
Уклонение от апоптоза является маркером рака (Hanahan & Weinberg (2000) Cell 100:57-70). Раковые клетки должны преодолевать непрерывный обстрел клеточными стрессами, такими как повреждение ДНК, активация онкогена, аберрантная прогрессия клеточного цикла и суровое микроокружение, которые заставили бы нормальные клетки перенести апоптоз. Одним из первичных средств, которыми раковые клетки уклоняются от апоптоза, является повышающая регуляция антиапоптотических белков семейства Bcl-2.
Специфическим типом опухолевого заболевания, для которого необходимы улучшенные виды терапии, является неходжкинская лимфома (NHL). NHL является шестым из самых распространенных типов новых случаев рака в США и встречается прежде всего у пациентов в возрасте 60-70 лет. NHL представляет собой не одно заболевание, а семейство родственных заболеваний, которые классифицируются на основе нескольких характеристик, включая клинические признаки и гистологию.
Один способ классификации помещает различные гистологические подтипы в две главных категории на основании естественной истории заболевания, то есть является ли заболевание медленно развивающимся или агрессивным. В общем, медленно развивающиеся подтипы растут медленно и в целом инкурабельны, тогда как агрессивные подтипы растут быстро и потенциально излечимы. Фолликулярные лимфомы представляют собой самый распространенный медленно развивающийся подтип, а диффузные крупноклеточные лимфомы составляют самый распространенный агрессивный подтип. Онкогенный белок Bcl-2 был первоначально описан при B-клеточной неходжкинской лимфоме.
Лечение фолликулярной лимфомы обычно состоит из биологической или комбинированной химиотерапии. Обычно используется комбинированная терапия ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP), такая как комбинированная терапия ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Также используется монотерапия ритуксимабом (нацеливающим CD20, фосфопротеин, однородно экспрессируемый на поверхности B-клеток), или флударабином. Добавление ритуксимаба к режимам химиотерапии может обеспечить улучшенный уровень ответа и увеличенное выживание без прогрессии.
Средства радиоиммунотерапии, высокодозовая химиотерапия и трансплантация стволовых клеток могут использоваться для лечения рефрактерных или рецидивирующих NHL. В настоящее время не существует апробированного режима лечения, который приводил бы к выздоровлению, и текущие руководства рекомендуют лечить пациентов в контексте клинического испытания, даже в режиме первой линии.
Лечение первой линии пациентов с агрессивной большой B-клеточной лимфомой обычно состоит из ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизона (R-CHOP) или отрегулированной дозы этопозида, преднизона, винкристина, циклофосфамида, доксорубицина и ритуксимаба (DA-EPOCH-R).
Большинство лимфом первоначально отвечает на любую из этих терапий, но опухоли обычно рецидивируют и в конечном счете становятся рефрактерными. Чем больше число режимов, которые получают пациенты, тем более резистентным к химиотерапии становится заболевание. Средний ответ на терапию первой линии составляет приблизительно 75%, 60% на вторую линию, 50% на третью линию и приблизительно 35-40% на терапию четвертой линии. Уровень ответа, приближающийся к 20% в случае единственного средства при множественных рецидивах, считается положительным и гарантирующим дальнейшее исследование.
Другие опухолевые заболевания, для которых необходимы улучшенные виды терапии, включают лейкозы, такие как хронический лимфоцитарный лейкоз (такой как NHL, B-клеточная лимфома) и острый лимфоцитарный лейкоз.
Хронический лимфоидный лейкоз (CLL) является наиболее распространенным типом лейкоза. CLL прежде всего является заболеванием взрослых, более 75% людей, у которых его недавно диагностировали, имеет возраст 50, но в редких случаях он также встречается у детей. Комбинированные химиотерапии представляют собой превалирующий вид лечения, например, флударабин с циклофосфамидом и/или ритуксимабом, или более сложные комбинации, такие как CHOP или R-CHOP.
Острый лимфоцитарный лейкоз, также известный как острый лимфобластный лейкоз (ALL), является прежде всего детской болезнью, ранее с по существу нулевой выживаемостью, но в настоящее время с 75%-ной выживаемостью вследствие использования комбинированных химиотерапий, подобных упомянутым выше. Все еще необходимы новые терапии, чтобы обеспечить дальнейшее повышение выживаемости.
Существующие химиотерапевтические средства проявляют антиканцерогенный эффект, индуцируя апоптоз через различные механизмы. Однако многие опухоли в конечном счете становятся резистентными к этим средствам. Было показано, что Bcl-2 и Bcl-XL придают резистентность к химиотерапии в тестах кратковременного выживания in vitro и, совсем недавно, in vivo. Это позволяет предположить, что, если могут быть разработаны улучшенные виды терапии, направленные на подавление функции Bcl-2 и Bcl-XL, такая резистентность к химиотерапии может быть успешно преодолена.
Участие белков Bcl-2 в раке мочевого пузыря, раке мозга, раке молочной железы, раке костного мозга, раке шейки матки, CLL, колоректальном раке, раке желудка, гепатоцеллюлярном раке, лимфобластном лейкозе, фолликулярной лимфоме, лимфоидных злокачественных процессах Т-клеточного или B-клеточного происхождения, меланомах, миелогенном лейкозе, миеломе, раке полости рта, раке яичника, немелкоклеточном раке легкого, раке предстательной железы, мелкоклеточном раке легкого, раке селезенки и т.п. описан в международных патентных публикациях WO2005/024636 и WO2005/049593.
Участие белков Bcl-2 в иммунных и аутоиммунных заболеваниях описано, например, Puck & Zhu (2003) Current Allergy and Asthma Reports 3:378-384; Shimazaki et al. (2000) British Journal of Haematology 110(3):584-590; Rengan et al. (2000) Blood 95(4):1283-1292; и Holzelova et al. (2004) New England Journal of Medicine 351(14):1409-1418. Участие белков Bcl-2 в отторжении трансплантата костного мозга раскрыто в публикации заявки на патент США US 2008/0182845.
Соединения, которые занимают связывающий сайт на белках Bcl-2, являются известными. Чтобы быть терапевтически полезными при пероральном введении, такие соединения должны иметь высокое связывающее сродство, показывая например, Ki <1 нМ, предпочтительно <0,1 нМ, более предпочтительно <0,01 нМ, к белкам семейства Bcl-2, в частности, Bcl-2, Bcl-XL и Bcl-w. Они должны также быть составлены таким образом, чтобы обеспечивать высокое системное экспонирование после перорального введения. Типичной мерой системного экспонирования после перорального введения соединения является область под кривой (AUC), являющейся результатом выстраивания графика плазменной концентрации соединения против времени после перорального введения.
Если водорастворимость Bcl-2-связывающих соединений является очень низкой, составитель сталкивается со значительными трудностями в том, чтобы гарантировать приемлемую пероральную биодоступность, которая сильно зависит от растворимости в водной среде желудочно-кишечного тракта. Это верно даже там, где связывающее сродство очень высоко. Задача становится еще более трудной, учитывая потребность обеспечить адекватную загрузку лекарственного средства в составе, так, чтобы терапевтически эффективная доза могла вводиться в приемлемо малом объеме составленного продукта.
Жидкие лекарственные формы (включая инкапсулированные жидкости) могут быть полезными для некоторых лекарственных средств с низкой водорастворимостью, при условии, что может быть найдена подходящая фармацевтически приемлемая система растворителя (обычно на основе липидов), что обеспечивает адекватную загрузку лекарственного средства без проблем растворимости или стабильности при хранении. Другие подходы, которые были предложены для таких лекарственных средств, включают твердую дисперсию, которая вызывает собственные проблемы.
По различным причинам, таким как комплаенс пациента и маскировка вкуса, твердая лекарственная форма обычно предпочтительнее жидкой лекарственной формы. В большинстве случаев, однако, пероральные твердые лекарственные формы лекарственного средства обеспечивают более низкую биодоступность, чем пероральные растворы лекарственного средства.
Были попытки улучшить биодоступность, обеспечиваемую твердыми лекарственными формами, путем формирования твердой дисперсии, или более конкретно, твердых растворов лекарственных средств. Твердая дисперсия, или растворы, являются предпочтительными физическими системами, потому что компоненты в них легко образуют жидкие растворы при вхождении в контакт с жидкой средой, такой как желудочный сок. Легкость растворения может быть приписана, по меньшей мере частично, тому факту, что энергия, требуемая для растворения компонентов из твердой дисперсии или твердого раствора, меньше требуемой для растворения компонентов из кристаллической или микрокристаллической твердой фазы. Однако важно, чтобы лекарственное средство, высвобождаемое из твердой дисперсии или твердого раствора, оставалось водорастворимым в водных жидкостях желудочно-кишечного тракта; иначе лекарственное средство может осадиться в желудочно-кишечный тракт, приводя к низкой биодоступности.
Международная патентная публикация WO01/00175 относится к механически стабильным фармацевтическим лекарственным формам, которые являются твердыми растворами активных ингредиентов в матрице вспомогательного средства. Эта матрица содержит гомополимер или сополимер N-винилпирролидона и жидкое или полутвердое поверхностно-активное вещество.
Международная патентная публикация WO00/57854 относится к механически стабильным фармацевтическим лекарственным формам для перорального введения, содержащим по меньшей мере одно активное соединение, по меньшей мере одно термопластичное образующее матрицу вспомогательное вещество и более чем 10% и вплоть до 40% по массе поверхностно-активного вещества, которое имеет значение гидрофильно-липофильного баланса (HLB) от 2 до 18 и является жидким при 20°C, или имеет точку каплепадения от 20°C до 50°C.
Публикация заявки на патент США 2005/0208082 относится к солюбилизирующей композиции, включающей смесь TPGS (α-токоферил полиэтиленгликоль сукцинат или витамин E полиэтиленгликоль сукцинат) и линолевой кислоты. Эта солюбилизирующая композиция используется для диспергирования липофила в водной фазе.
Горячая экструзия расплава, многообещающая технология со все увеличивающимся использованием для усиления биодоступности плохо водорастворимых соединений лекарственного средства, является не вредящим окружающей среде процессом без использования растворителя, который, по сообщениям, предоставляет много преимуществ по сравнению с обычными твердыми лекарственными формами в терминах надежности и разнообразия (Crowley et al. (2007) Drug Development and Industrial Pharmacy 33:908-926).
Было показано, что составляющая собственность технология экструзии из расплава (Meltrex® of Abbott GmbH, Висбаден, Германия) значительно улучшает фармакокинетические свойства некоторых лекарственных средств по сравнению с альтернативными составами. См., например, Klein et al. (2007) J. Acquir. Immune Defic. Syndr. 44:401-410.
Индуцирующие апоптоз лекарственные средства, которые нацеливают семейство белков Bcl-2, таких как Bcl-2 и Bcl-XL, лучше всего вводить согласно режиму, который обеспечивает непрерывное, например ежедневное, пополнение плазменной концентрации, поддерживая концентрацию в терапевтически эффективном диапазоне измерений. Это может быть достигнуто ежедневным парентеральным, например, внутривенным (i.v.) или внутрибрюшинным (i.p.) введением. Однако ежедневное парентеральное введение часто является непрактичным в клинических условиях, особенно для амбулаторных больных. Для усиления клинической полезности индуцирующего апоптоз средства, например, такого как химиотерапевтическое средство в случае онкологических пациентов, твердая лекарственная форма с приемлемой пероральной биодоступностью была бы очень желательной. Такая лекарственная форма, и режим для ее перорального введения, представили бы важное достижение в лечении многих типов рака, включая NHL, CLL и ALL, и с большей легкостью позволили бы осуществление комбинированной терапии с другими химиотерапевтическими средствами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к твердой дисперсии, включающей в по существу некристаллической, например, аморфной форме, соединение Формулы I:
где:
R0 обозначает галоген;
R1 и R2 обозначают Н или независимо обозначают метил или метокси;
R3 и R4 независимо обозначают метил или метокси, если R1 и R2 обозначает Н, или обозначают Н, если R1 и R2 независимо обозначают метил или метокси;
A и B обозначают, каждый независимо, CH или N;
R5 обозначает C1-4 алкил или галогеналкил, C1-4 алкилсульфонил или галогеналкилсульфонил, галоген, нитро или циано;
X обозначает -O- или -NH-;
Y обозначает -(CH2)n-, где n=0, 1, 2 или 3; и
R6 обозначает незамещенное или замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо, как определено здесь, или обозначает NR7R8;
причем, если R6 обозначает NR7R8, R7 и R8 обозначают, каждый независимо, Н или группы R9-(CH2)m-, причем не более чем один из R7 и R8 обозначает Н, где каждый R9 независимо обозначает 3-7-членное карбоциклическое или гетероциклическое кольцо, в случае необходимости замещенное не более чем двумя группами Z1, как определено ниже, и каждый m независимо означает 0 или 1; и
причем, если R6 обозначает замещенное карбоциклическое или гетероциклическое кольцо, заместители на нем представляют собой не более чем две группы Z1 и/или не более чем одну группу Z2, причем группы Z1 независимо выбирают из (a) C1-4 алкила, C2-4 алкенила, C1-4 алкокси, C1-4 алкилтио, C1-4 алкиламино, C1-4 алкилсульфонила, C1-4 алкилсульфониламино, C1-4 алкилкарбонила, C1-4 алкилкарбониламино и C1-4 алкилкарбокси, каждый из которых в случае необходимости может быть замещен одним или более заместителями, независимо выбранными из галогена, гидрокси, C1-4 алкокси, амино, C1-4 алкиламино, ди-(C1-4 алкил)амино и циано, (b) галогена, (e) гидрокси, (f) амино и (g) оксо-групп, и причем Z2 обозначает (i) другое 3-6-членное карбоциклическое или гетероциклическое кольцо, в случае необходимости замещенное не более чем двумя группами Z1, как определено выше, или (ii) NR7R8, где R7 и R8 имеют значения, определенные выше;
или фармацевтически приемлемую соль такого соединения. Соединение или его соль диспергированы в твердой матрице, которая включает (a) фармацевтически приемлемый водорастворимый полимерный носитель и (b) фармацевтически приемлемое поверхностно-активное вещество.
Изобретение также относится к твердой перорально доставляемой лекарственной форме, включающей такую твердую дисперсию, в случае необходимости вместе с одним или более дополнительными эксципиентами.
Изобретение также относится к способу получения твердой дисперсии, как описано выше. Этот способ включает:
(a) подвергание повышенной температуре (i) активного фармацевтического ингредиента (API), который включает соединение Формулы I или его фармацевтически приемлемую соль, (ii) фармацевтически приемлемого водорастворимого полимерного носителя и (iii) фармацевтически приемлемого поверхностно-активного вещества, чтобы обеспечить экструдируемую полутвердую смесь;
(b) экструдирование полутвердой смеси, например, через фильеру; и
(c) охлаждение полученного экструдата, чтобы обеспечить твердую матрицу, включающую полимерный носитель и поверхностно-активное вещество и имеющую соединение, или его соль, диспергированное в ней в по существу некристаллической форме.
"Расплав" здесь означает жидкое или полутвердое (например, каучукообразное) состояние, вызванное повышенной температурой, причем первый компонент может гомогенно распределяться в матрице, включающей второй компонент. Как правило, второй (матричный) компонент, например, полимерный носитель, находится в таком состоянии, а другие компоненты, например, включая соединение Формулы I или его соль, растворяются в расплаве, таким образом образуя раствор.
Под "повышенной температурой" здесь понимают температуру, которая выше температуры размягчения полимерного носителя, затронутого другими компонентами, если они присутствуют, такими как мягчители или поверхностно-активные вещества.
Получение расплава может осуществляться различными путями. Смешивание компонентов может иметь место до, в течение или после формирования расплава. Например, компоненты могут быть сначала смешаны и затем подвергнуты повышенной температуре, чтобы образовать расплав; альтернативно смешивание и плавление могут иметь место одновременно. В одном варианте осуществления полимерный носитель сначала расплавляют, в случае необходимости с компонентом поверхностно-активного вещества, и API затем добавляют к полученному расплаву. Обычно расплав полностью смешивают в ходе действия повышенной температуры, чтобы гарантировать гомогенное диспергирование API.
Изобретение также относится к твердой дисперсии, полученной способом, описанным выше.
Изобретение также относится к способу лечения опухолевого, иммунного или аутоиммунного заболевания, включающему пероральное введение пациенту, имеющему заболевание, терапевтически эффективного количества твердой дисперсии, как описано выше, или одной или более твердых лекарственных форм, включающих такую дисперсию. Примеры опухолевых заболеваний включают рак. Частным иллюстративным типом рака, который может быть подвергнут лечению согласно способу по изобретению, является неходжкинская лимфома (NHL). Другим частным иллюстративным типом рака, который может быть подвергнут лечению согласно способу по изобретению, является хронический лимфоцитарный лейкоз (CLL). Еще одним частным иллюстративным типом рака, который может быть подвергнут лечению согласно способу по изобретению, является острый лимфоцитарный лейкоз (ALL), например, у педиатрического пациента.
Дополнительные варианты осуществления изобретения, включая более конкретные аспекты приведенных выше, будут найдены в следующем подробном описании или будут очевидны из него.
ФИГУРЫ
Фигуры приведены здесь только в целях иллюстрации выбранных вариантов осуществления, а не всех возможных, и не ограничивают объем настоящего раскрытия.
Фиг.1 представляет собой блок-схему способа, включающего экструзию из расплава, полезную для формирования твердого дисперсионного продукта согласно варианту осуществления настоящей технологии.
ПОДРОБНОЕ ОПИСАНИЕ
Попытки составить соединение Формулы I или его соль в перорально доставляемой лекарственной форме наткнулись на очень ограниченное число фармацевтически приемлемых жидких систем растворителя, обеспечивающих приемлемую растворимость соединения или его соли, и тенденцию всех таких проверенных систем растворителя к осаждению нерастворимых твердых частиц в ходе хранения. Теперь было обнаружено, что более успешный подход состоит в составлении соединения или соли в форме твердой дисперсии. Детали этого подхода, с помощью которого становится достижимой комбинация удовлетворительной загрузки лекарственного средства, приемлемой стабильности и адекватной биодоступности с очень неперспективным классом активного ингредиента, раскрыты здесь.
Твердая дисперсия в соответствии с настоящим раскрытием включает активный ингредиент в по существу некристаллической или аморфной форме, которая является обычно более растворимой, чем кристаллическая форма. Термин “твердая дисперсия” здесь охватывает системы, имеющие мелкие твердые частицы (например, по существу некристаллические или аморфные частицы) одной фазы, диспергированные в другой твердой фазе. Более конкретно, твердая дисперсия по изобретению включает частицы одного или более активных ингредиентов, диспергированные в инертном носителе или матрице в твердом состоянии, и может быть получена способами плавления или растворения или комбинацией способов плавления и растворения. Согласно настоящему изобретению, как описано здесь, особенно предпочтительным является способ экструзии из расплава.
“Аморфная форма” относится к частице без определенной структуры, то есть не имеющей кристаллической структуры.
Термин “по существу некристаллический” здесь означает, что не более чем приблизительно 5%, например, не более чем приблизительно 2% или не более чем приблизительно 1% кристалличности наблюдается при рентгеновской дифрактометрии. В частном варианте осуществления, никакой обнаружимой кристалличности не наблюдается одним или обоими из способов рентгеновской дифрактометрии или поляризационной микроскопии. В этом отношении должно быть отмечено, что, когда не наблюдается никакой обнаружимой кристалличности, твердая дисперсия, указанная здесь, может дополнительно или альтернативно быть описана как твердый раствор.
A. Активное соединение
Соединения Формулы I, включая их соли, пригодные согласно изобретению, обычно имеют очень низкую растворимость в воде, будучи классифицируемыми как чрезвычайно нерастворимые, то есть имеющие растворимость менее чем приблизительно 10 мкг/мл. Примерами таких активных ингредиентов являются, например, лекарственные вещества Класса IV Системы классификации биофармацевтических средств Biopharmaceutics Classification System (BCS), которые характеризуются низкой растворимостью и низкой проницаемостью (см. “Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system”, U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), August 2000). Следует понимать, что водорастворимость многих соединений является рН-зависимой; в случае таких соединений растворимость, представляющая интерес по изобретению, находится при физиологически релевантном рН, например, от приблизительно 1 до приблизительно 8. Таким образом, в различных вариантах осуществления, лекарственное средство имеет растворимость в воде по меньшей мере при одном значении в диапазоне от приблизительно 1 до приблизительно 8, меньше чем приблизительно 10 мкг/мл, в некоторых случаях менее чем приблизительно 1 мкг/мл или даже меньше чем приблизительно 0,1 мкг/мл. Иллюстративно, конкретное соединение, пригодное согласно изобретению, имеет растворимость в воде при рН 4 <0,004 мкг/мл.
Твердая дисперсия согласно настоящему изобретению включает в качестве активного ингредиента соединение Формулы I, как определено выше, или фармацевтически приемлемую соль такого соединения. В случае необходимости они могут дополнительно включать второй активный ингредиент, например, терапевтическое средство, полезное в комбинированной терапии с соединением Формулы I, как указано далее.
В одном варианте осуществления соединение имеет Формулу I, где R0 обозначает хлор.
В другом варианте осуществления соединение имеет Формулу I, где R1 обозначает метил или метокси, R2 обозначает метил, и R3 и R4, каждый, обозначают Н.
В другом варианте осуществления соединение имеет Формулу I, где R5 обозначает трифторметил, трифторметилсульфонил, хлор, бром или нитро. В более специфическом варианте осуществления, если A2 обозначает -CH-, тогда R5 обозначает нитро; и если A2 обозначает -N-, тогда R5 обозначает бром.
В более специфическом варианте осуществления соединение имеет Формулу I, где (a) R0 обозначает хлор, (b) R1 обозначает метил или метокси, R2 обозначает метил, и R3 и R4, каждый, обозначают Н, и (c) R5 обозначает трифторметил, трифторметилсульфонил, хлор, бром или нитро.
Соединения, пригодные согласно изобретению, значительно варьируют в заместителе -X-Y-R6, более конкретно, группе R6, Формулы I. В большинстве вариантов осуществления R6 обозначает 3-7-членное карбоциклическое или гетероциклическое кольцо, в случае необходимости замещенное, как определено выше.
Термин "карбоциклический" в рамках изобретения охватывает насыщенные и частично и полностью ненасыщенные кольцевые структуры, имеющие от 3 до 7 кольцевых атомов углерода, включая бициклические структуры. В одном варианте осуществления R6 обозначает насыщенное карбоциклическое (то есть циклоалкильное) кольцо, например, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил или циклогексил, в каждом случае, в случае необходимости замещенное, как более полно описано ниже.
Термин, "гетероциклический" в рамках изобретения охватывает насыщенные и частично и полностью ненасыщенные кольцевые структуры, имеющие от 4 до 7 кольцевых атомов, один или более из которых представляют собой гетероатомы, независимо выбранные из N, O и S. Обычно гетероциклическое кольцо имеет не более чем два таких гетероатома. В одном варианте осуществления R6 обозначает насыщенное гетероциклическое кольцо, например, но не ограничиваясь ими, азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил, в каждом случае, в случае необходимости, замещенное, как более полно описано ниже.
Если R6 обозначает карбоциклическое или гетероциклическое кольцо, например, насыщенное кольцо, как описано непосредственно выше, оно может быть незамещенным или замещенным в трех положениях на кольце. Заместители, если они присутствуют, включают не более чем две группы Z1 и/или не более чем одну группу Z2.
Группы Z1 независимо выбраны из (a) C1-4 алкила, C2-4 алкенила, C1-4 алкокси, C1-4 алкилтио, C1-4 алкиламино, C1-4 алкилсульфонила, C1-4 алкилсульфониламино, C1-4 алкилкарбонила, C1-4 алкилкарбониламино и C1-4 алкилкарбокси, каждый из которых в случае необходимости может быть замещен одним или более заместителями, независимо выбранными из галогена, гидрокси, C1-4 алкокси, амино, C1-4 алкиламино, ди-(C1-4 алкил)амино и циано, (b) галогена, (e) гидрокси, (f) амино и (g) оксо-групп. Иллюстративные примеры таких групп Z1 включают без ограничения метил, цианометил, метокси, фтор, гидрокси, амино и метилсульфонил.
Группа Z2, если она присутствует, является дополнительным 3-7-членным карбоциклическим или гетероциклическим кольцом, в случае необходимости замещенным не более чем двумя группами Z1, как описано выше. Кольцо Z2, если оно присутствует, является обычно, но не обязательно, насыщенным, и в большинстве случаев дополнительно не замещено. В одном варианте осуществления Z2 обозначает насыщенное карбоциклическое кольцо, например, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил или циклогексил. В другом варианте осуществления Z2 обозначает насыщенное гетероциклическое кольцо, например, но не ограничиваясь ими, азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил.
В некоторых вариантах осуществления R6 обозначает группу NR7R8, где R7 и R8 обозначают, каждый независимо, Н или группы R9-(CH2)m, причем не более чем один из R7 и R8 обозначает Н, где каждый R9 независимо обозначает 3-7-членное карбоциклическое или гетероциклическое кольцо, в случае необходимости замещенное не более чем двумя группами Z1, как определено выше, и каждый m независимо обозначает 0 или 1. Каждое из колец, R9 является обычно, но не обязательно, насыщенным, и в большинстве случаев незамещено. Иллюстративные карбоциклические кольца в R7 и/или R8 включают без ограничения циклопропил, циклобутил, циклопентил или циклогексил. Иллюстративные гетероциклические кольца в R7 и/или R8 включают без ограничения азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил.
В частных вариантах осуществления R6 выбран из группы, состоящей из 4-метоксициклогексила, цис-4-гидрокси-4-метилциклогексила, транс-4-гидрокси-4-метилциклогексила, 4-морфолин-4-илциклогексила, (3R)-1-(метилсульфонил)пирролидин-3-ила, (3R)-1-тетрагидро-2H-пиран-4-илпирролидин-3-ила, тетрагидро-2H-пиран-4-ила, (3S)-тетрагидро-2H-пиран-3-ила, 4-метокситетрагидро-2H-пиран-4-ила, 4-фтортетрагидро-2H-пиран-4-ила, 4-аминотетрагидро-2H-пиран-4-ила, 1-(цианометил)пиперидин-4-ила, 4-фтор-1-оксетан-3-илпиперидин-4-ила, 1-тетрагидро-2H-пиран-4-илпиперидин-4-ила, 4-метилпиперазин-1-ила, 1,4-диоксан-2-ила, 4-метилморфолин-2-ила и циклопропил(оксетан-3-ил)амино.
Соединения Формулы I могут содержать асимметрично замещенные атомы углерода в R- или S-конфигурации; такие соединения могут присутствовать как рацематы или в избытке одной конфигурации по сравнению с другой, например, в энантиомерном отношении по меньшей мере приблизительно 85:15. Соединение может быть в основном энантиомерно чистым, например, имеющим энантиомерное отношение по меньшей мере приблизительно 95:5, или в некоторых случаях по меньшей мере приблизительно 98:2 или по меньшей мере приблизительно 99:1.
Соединения Формулы I могут альтернативно или дополнительно содержать углерод-углеродные двойные связи или углерод-азотные двойные связи в Z- или E-конфигурации, причем термин “Z” обозначает конфигурацию, в которой более крупные заместители находятся на одной и той же стороне такой двойной связи, и термин “E” обозначает конфигурацию, в которой более крупные заместители находятся на противоположных сторонах двойной связи. Соединение может альтернативно присутствовать как смесь Z- и E-изомеров.
Соединения Формулы I могут альтернативно или дополнительно существовать как таутомеры или их равновесные смеси, в которых протон перемещается от одного атома до другого. Примеры таутомеров иллюстративно включают кето-енол, фенол-кето, оксим-нитрозо, нитро-аци, имин-енамин и т.п.
В одном варианте осуществления, API, присутствующий в твердой дисперсии, выбран из соединений, специфично идентифицированных в вышеуказанной заявке на патент США 12/787,682 (US 2010/0305122) в Примерах 1-378, и фармацевтически приемлемых солей таких соединений, независимо от того, охвачены ли эти соединения индивидуально Формулой I по изобретению. Соединения 1-378 из этих Примеров, и иллюстративные процедуры их синтеза, воспроизведены далее. В другом варианте осуществления API, присутствующий в твердой дисперсии, выбран из Соединений 1-378 и их фармацевтически приемлемых солей, но только в той степени, в какой такие Примеры индивидуально охвачены Формулой I по изобретению. Все раскрытие заявки на патент США 12/787,682 (US 2010/0305122) явно включено в настоящее описание путем ссылки.
Описание синтеза репрезентативных соединений приведено ниже. Другие соединения Формулы I могут быть получены в основном аналогичными способами, как будет ясно специалисту в данной области техники. Иллюстрируемые соединения называли, используя ACD/ChemSketch Version 5.06 (05 июня 2001, Advanced Chemistry Development Inc., Toronto, Ontario), ACD/ChemSketch Version 12.01 (13 мая 2009), Advanced Chemistry Development Inc., Toronto, Ontario) или ChemDraw® Ver. 9.0.5 (CambridgeSoft, Cambridge, MA). Промежуточные соединения называли, используя ChemDraw® Ver. 9.0,5 (CambridgeSoft, Cambridge, MA).
Соединение 1
4-{4-[(4'-хлор-1,1'-бифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение 1A
4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-трет-бутилкарбоксилат
4'-Хлорбифенил-2-карбоксальдегид (4,1 г), пиперазин-1-трет-бутилкарбоксилат (4,23 г), и триацетоксиборгидрид натрия (5,61 г) в CH2Cl2 (60 мл) перемешивали в течение 24 часов. Реакционную смесь гасили метанолом и вливали в простой эфир. Раствор промывали водой и солевым раствором, концентрировали и хроматографировали на силикагеле со смесью 2-25% этилацетата/гексаны.
Соединение 1B
1-((4'-хлорбифенил-2-ил)метил)пиперазин
Соединение 1A (3,0 г) и триэтилсилан (1 мл) перемешивали в CH2Cl2 (30 мл) и трифторуксусной кислоте (30 мл) в течение 2 часов, и реакционную смесь концентрировали и затем забирали в простом эфире и концентрировали снова. Материал забирали в дихлорметане (200 мл) и растворе NaHCO3 (100 мл) и разделяли. Органический слой высушивали над Na2SO4 и конденсировали, получая целевое соединение.
Соединение 1C
4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)-2-фтор-трет-бутилбензоат
4-Бром-2-фтор-трет-бутилбензоат (14,0 г), Соединение 1B (16,05 г), Pd2(dba)3 (трис(дибензилиденацетон)дипалладий(0)) (1,40 г), 2-(ди-трет-бутилфосфино)дифенил (1,82 г) и K3PO4 (16,2 г) перемешивали в 1,2-диметоксиэтане (300 мл) при 80°C в течение 24 часов. Реакционную смесь охлаждали и концентрировали. Сырой продукт хроматографировали на силикагеле со смесью 10-20% этилацетата/гексаны.
Соединение 1D
2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)трет-бутилбензоат
1H-Пирроло[2,3-B]пиридин-5-ол (167 мг), Соединение 1C (500 мг) и Cs2CO3 (508 мг) перемешивали в диметилсульфоксиде (5 мл) при 130°C в течение 24 часов. Смесь охлаждали, разбавляли этилацетатом, промывали три раза водой и солевым раствором, и высушивали (Na2SO4), фильтровали и концентрировали. Сырой продукт хроматографировали на силикагеле с использованием 25% этилацетата/гексаны.
Соединение 1E
2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение 1D (200 мг) и триэтилсилан (1 мл) перемешивали в дихлорметане (15 мл) и трифторуксусной кислоте (15 мл) в течение 1 часа. Смесь концентрировали, забирали в этилацетате, промывали дважды NaH2PO4 и солевым раствором и высушивали (Na2SO4), фильтровали и концентрировали.
Соединение 1F
3-нитро-4-((тетрагидро-2H-пиран-4-ил)метиламино)бензолсульфонамид
4-Фтор-3-нитробензолсульфонамид (2,18 г), 1-(тетрагидропиран-4-ил)метиламин (1,14 г) и триэтиламин (1 г) перемешивали в тетрагидрофуране (30 мл) в течение 24 часов. Раствор разбавляли этилацетатом, промывали раствором NaH2PO4 и солевым раствором и высушивали (Na2SO4), фильтровали и концентрировали. Продукт растирали в порошок из этилацетата.
Соедине