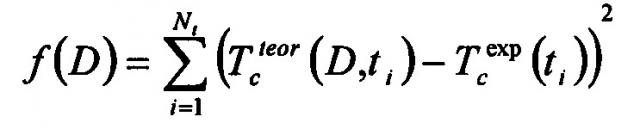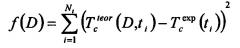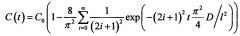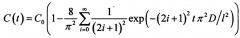Биосенсор для неинвазивного оптического мониторинга патологии биологических тканей
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к эндокринологии, и может быть использовано для неинвазивного оптического мониторинга патологии биологических тканей, связанных с развитием сахарного диабета. Биосенсор содержит: источник и приемник излучения; аппликатор, изготовленный в виде сосуда с биосовместимым иммерсионным агентом; излучающий световод, подключенный одним концом к источнику излучения, и принимающий световод, подключенный одним концом к приемнику излучения. Дистальные концы световодов расположены внутри аппликатора. Способ обеспечивает увеличение глубины зондирования тканей при снижении вредного влияния излучения на ткани организма за счет оптического просветления биологических тканей, а расположение световодов внутри аппликатора с биосовместимым иммерсионным агентом позволяет согласовать показатели преломления торца световода с иммерсионной жидкостью и устраняет оптическое отражение на границе биоткань-торец световода. 14 з.п. ф-лы, 1 табл., 3 ил.
Реферат
Изобретение относится к медицине, а именно к эндокринологии, в частности к определению патологии тканей жизненно важных органов, обусловленной развитием сахарного диабета.
Существующие в настоящее время методы определения степени гликированности гемоглобина крови и гликированности биотканей можно условно разделить на инвазивные и неинвазивные. Инвазивные методы определения степени гликированности гемоглобина, а именно определения концентрации гликированного гемоглобина HbA1c, основаны на биохимическом анализе взятой у пациента крови из вены и последующем спектрофотометрическом измерении концентрации HbA1c как продукта биохимической реакции, по интенсивности его полосы Соре.
Концентрация HbA1c в крови является биохимическим показателем крови, отражающим среднее содержание сахара в крови за период до трех месяцев (среднее время жизни эритроцитов), и представляет собой процентное содержание гемоглобина крови, необратимо связанного с молекулами глюкозы (максимально у больных тяжелой формой диабета порядка 15-16% от общей концентрации гемоглобина). Гликированный гемоглобин образуется в результате реакции Майера (N. Vigneshwaran, G Bijukumar, N. Karmakar, S. Anand, and A. Misra, "Autofluorescence characterization of advanced glycation end products of hemoglobin," Spectrochimica Acta Part A 61(1), 163-170 (2005)). Чем выше уровень HbA1c, тем выше была гликемия за последние три месяца и, соответственно, больше риск развития осложнений, вызванных сахарным диабетом, таких как ретинопатия, нефропатия, мышечная дистрофия и, как следствие, потеря подвижности, если поражены скелетные мышцы, или инфаркт миокарда, если поражен миокард, а также ряда других осложнений.
Известно устройство по патенту США US 8140147, опубл. 15.11.2007, МПК А61В 6/00, состоящее из гибкого зонда с источником света и приемником излучения. Оптический зонд может как контактировать, так и не контактировать с тканью. Оптический зонд доставляет широкополосный свет к биоткани и регистрирует ее диффузную флуоресценцию in vivo. Настоящее устройство способно определить наличие сахарного диабета или развитие преддиабета путем определения наличия конечных продуктов гликирования коллагена, измерения их концентрации. Устройство можно применять к тканям кожи, слизистой оболочки полости рта или склеры.
Известно устройство по заявке WO 2006009906, опубл. 26.01.2006, МПК G01F 19/00, для неинвазивной диагностики сахарного диабета, включающее в себя источник возбуждения света, детектор, принимающий сигнал флуоресценции, процессор для измерения затухания интенсивности сигнала флуоресценции. В устройстве используется ультракороткий импульс возбуждения света УФ, ИК или видимого диапазона, который представляет собой последовательность наносекундных импульсов. Импульс возбуждения направляется на поверхность кожи предплечья, ноги или ладони пациента. Свет взаимодействует с различными слоями кожи, поглощенный свет возбуждает продукты гликирования в коже, генерирующие сигнал флуоресценции, который собирается с помощью детектора. Процессор соединен с детектором для измерения затухания интенсивности флуоресценции кожи для определения вклада отдельных флуорофоров в суммарный сигнал флуоресценции, после чего идентифицируется характер и расположение флуорофоров. По полученному сигналу флуоресценции определяют присутствие или отсутствие продуктов гликирования, а соответственно, делают вывод о риске или диагностировании сахарного диабета.
Принцип действия описанных устройств основан на использовании флуоресценции биотканей и продуктов гликирования белков.
Наиболее близким по технической сущности является экспериментальная установка для неинвазивного оптического мониторинга патологии биологических тканей, обусловленной развитием сахарного диабета, содержащая источник и приемник излучения, аппликатор, изготовленный в виде кюветы с биосовместимым иммерсионным агентом, излучающий световод, подключенный одним концом источнику излучения, и принимающий световод, подключенный одним концом к приемнику излучения (Tuchina D.K. et al. Ex vivo optical measurements of glucose diffusion kinetics in native and diabetic mouse skin. 12.03.2015. J. Biophotonics 8, №4, p. 332-346). При этом концы светодов расположены на некотором расстоянии от кюветы.
Недостатком конструкции является низкая механическая прочность, так как волокна не защищены от смещений или повреждений. Кроме того, имеет место недостаточная чувствительность устройства, вызванная возможными смещениями при движении пациента во время измерений.
Технической проблемой, на решение которой направлено настоящее изобретение, является разработка биосенсора для неинвазивного оптического мониторинга патологии биологических тканей, обусловленной развитием сахарного диабета.
Техническим результатом является повышение чувствительности за счет согласования показателей преломления торца световода с иммерсионной жидкостью, что устраняет оптические отражения на границе биоткань - торец волоконного световода как в облучающей, так и в приемной части при повышении механической прочности.
Данная проблема решается тем, что в биосенсоре, содержащем источник и приемник света, излучающий и принимающий световоды, подключенные к источнику и приемнику соответственно, аппликатор, изготовленный в виде сосуда, содержащего биосовместимый иммерсионный агент, согласно решению дистальные концы световодов расположены внутри аппликатора. Световоды могут быть расположены параллельно друг другу, при этом расстояние l между центрами дистальных концов излучающего и принимающего световодов равно примерно двойной глубине зондирования биоткани h, l≅2h. В другом варианте исполнения дистальные концы излучающего и принимающего световодов расположены друг против друга.
В качестве источников, приемников излучения и иммерсионного агента могут использоваться различные варианты, описанные ниже.
Изобретение поясняется чертежами, где на фиг. 1 - гистограммы зависимости величины коэффициента диффузии глюкозы в здоровой и диабетической коже от концентрации раствора глюкозы, на фиг. 2 - схема биосенсора, излучающий и принимающий световоды которого располагаются параллельно друг другу, на фиг. 3 - схема биосенсора, излучающий и принимающий световоды которого располагаются друг напротив друга, где
1 - здоровая кожа;
2 - диабетическая кожа;
3 - кожа;
4 - излучающий (входной) световод;
5 - принимающий (выходной) световод;
6 - аппликатор с агентом;
7 - агент;
8 - вода, содержащаяся в биоткани;
9 - пучок света.
Оценку коэффициента диффузии иммерсионной жидкости (ИЖ) в биоткани проводят на основании кинетики изменения пропускания или отражения образца биоткани, взаимодействующего с ИЖ. Подробно используемый метод описан в литературе [Tuchin V.V. Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2005; Tuchin V.V. Handbook of Optical Sensing of Glucose in Biological Fluids and Tissues, Taylor & Francis Group LLC, CRC Press, 2009].
Способ измерения коэффициента диффузии иммерсионной жидкости в биологической ткани основан на определении значения коэффициента диффузии по кинетике изменения коллимированного пропускания, коэффициента ослабления света или коэффициента рассеяния биоткани, взаимодействующей с ИЖ путем минимизации методом наименьших квадратов функции, включающей в себя экспериментально полученные и теоретически рассчитанные данные. Коэффициент диффузии агента в биоткани определяется как скорость среднего потока молекул иммерсионного агента в ткань и воды из ткани. При использовании кинетики коллимированного пропускания целевая функция выглядит следующим образом:
где - теоретически рассчитанный коэффициент пропускания образца при заданном значении коэффициента диффузии D в момент времени t, сек, - измеренное значение коэффициента пропускания в момент времени t, сек, Nt - количество экспериментальных точек временной зависимости коллимированного пропускания образца биоткани на определенной длине волны.
Задачу оценки скорости диффузии решают в рамках модели свободной диффузии. Одномерное уравнение диффузии представляет собой второй закон Фика и имеет вид:
,
4
где С(x,t) - концентрация ОПА в образце биоткани, г/мл; D - коэффициент диффузии ОПА, см2/сек; t - время диффузии, сек; х - пространственная координата по толщине образца, см.
В зависимости от типа биоткани и геометрии эксперимента для решения уравнения диффузии используются различные граничные условия, что приводит к тому, что уравнение диффузии имеет разные решения. Так, например, для кожи (в случае ее иммерсирования в ИЖ) граничные условия имеют вид: C(0,t)=C0 и , а решение уравнения диффузии (усредненное по объему) имеет вид: . В случае же иммерсирования мышечной ткани граничные условия имеют вид: C(0,t)=С0 и C(l,t)=С0, тогда решение уравнения диффузии имеет вид: . В то же время в обоих случаях решение уравнения диффузии отражает кинетику изменения концентрации ОПА в образце биоткани.
В математических моделях биологических тканей учитывают их оптические характеристики (коэффициенты рассеяния и поглощения), геометрические параметры (толщина и площадь образца), показатели преломления и объемные доли компонентов биоткани и др.
Предлагаемый биосенсор использует не сигнал флуоресценции, а отраженный или пропущенный через биоткань 3 оптический сигнал на одной или многих длинах волн и содержит излучающий световод 4 и принимающий световод 5, а также аппликатор 6, заполненный биосовместимым просветляющим агентом 7 (фиг. 2, 3).
Световод 4 одним концом подключен к источнику, а световод 5 - к приемнику света. При этом дистальные (свободные) концы проходят через стенки аппликатора внутрь для подведения к исследуемой биоткани.
При регистрации отражения света от кожи или слизистой оболочки доступных органов тела человека (например, полости рта или носа) излучающий 4 и принимающий 5 световоды располагаются параллельно друг другу. Расстояние l между центрами дистальных концов излучающего и принимающего световодов равно примерно двойной глубине зондирования биоткани h, l≅2h. Один из противоположных концов световодов подводится к источнику излучения, а другой к оптическому детектору (фиг. 2).
При записи пропускания пучка света 9 через выступающий участок кожи дистальные концы излучающего и принимающего световодов 4, 5 одновременно подводятся с одной и другой стороны выступающего участка кожи, доступной для просвечивания (мочка уха, кожа между пальцами рук, кожа, оттянутая с любого места тела человека, позволяющая завести излучение и принять его «на просвет»). Аппликатор 6 снабжает агентом обе стороны выступающего участка кожи (фиг. 3). Регистрация оптического сигнала осуществляется в течение 10-30 минут.
В качестве источника излучения используют широкополосную лампу белого света, либо набор диодных лазеров разных длин волн в диапазоне 500-2000 нм, либо набор светодиодов разных длин волн в диапазоне 500-1100 нм, в качестве оптического детектора используют миниатюрный цифровой спектрометр, соединенный с компьютером или смартфоном, или набор миниатюрных фотодиодов, настроенных с помощью фильтров на разные длины волн и соединенные с компьютером или смартфоном.
Для обеспечения простоты, надежности, малой стоимости и максимальной чувствительности биосенсора к изменениям в исследуемой ткани пациента биосенсор настраивается на определенные длины волн при использовании одного или нескольких (два-три) диодных лазеров в диапазоне 400-2300 нм, либо одного или нескольких (два-три) светодиодов в диапазоне 400-2300 нм, а в качестве оптических детекторов используются миниатюрные фотодиоды, соединенные с компьютером или смартфоном.
Пример реализации
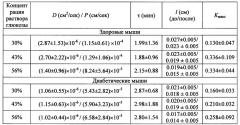
Описанный способ применялся для определения коэффициентов диффузии глюкозы в коже мышей, больных сахарным диабетом и не имеющих этого заболевания (контрольных), in vitro. Измерялись спектры коллимированного пропускания образцов кожи мышей in vitro, помещенных в водные растворы глюкозы разной концентрации, в диапазоне длин волн 500-900 нм. Коэффициенты диффузии D и проницаемости P=D/l, характерное время диффузии г, толщина образцов l до и после иммерсии в растворах глюкозы и максимальное пропускание образцов Kмакс, полученные для глюкозы и рассчитанные на основе измеренных спектров пропускания, представлены в таблице 1.
Таблица 1. Коэффициенты диффузии глюкозы в коже мыши, соответствующие коэффициенты проницаемости, характерное время диффузии, толщина образцов до и после иммерсии в растворах глюкозы, максимальное пропускание образцов.
± - стандартное отклонение
В результате для диабетической кожи при применении каждой концентрации раствора были получены меньшие значения коэффициента диффузии глюкозы по сравнению с контрольной (фиг. 1). Характерное время диффузии глюкозы в диабетической коже больше по сравнению с контрольной.
В данном случае коэффициент диффузии глюкозы в здоровой коже выше в 1.5-2.5 раза по сравнению с диабетической кожей для растворов глюкозы разной концентрации, коэффициент проницаемости в случае диабетической кожи на порядок меньше, что может служить критерием для дискриминации кожи в норме и при диабете. При оценке нескольких параметров, например коэффициента диффузии агента в ткани, коэффициента проницаемости ткани для агента, характерного времени диффузии, максимального пропускания света через образец можно получить больше информации о состоянии ткани. Представленные экспериментальные данные позволяют нам надежно дифференцировать состояние кожи в норме и при развитии диабета. Хотя использование молекул глюкозы в качестве тестовых при всех концентрациях просветляющего раствора от 30 до 56% дают существенную разницу в величинах коэффициента диффузии, проницаемости или характерного времени диффузии, целесообразнее выбирать менее концентрированный раствор. Так для 30%-ного раствора глюкозы имеем отношение коэффициентов диффузии глюкозы в здоровой коже к диабетической равным 2.7, проницаемости 2.1 и характерного времени диффузии 0.7.
С помощью предлагаемой технологии возможно неинвазивно определять коэффициенты проницаемости и диффузии тестового агента в коже, слизистых оболочках рта и носа, склере глаза по измерениям кинетики их оптического просветления и обратимой дегидратации. Измеренные коэффициенты проницаемости и скорости диффузии тестового агента дают информацию о степени гликированности белковых компонентов кожи человека, и по этим значениям можно экстраполировать наличие патологических изменений в недоступных для прямого анализа биологических тканях (тканях почки, ретине, миокарде, скелетных мышцах, тканях мозга и пр.). Такой тест должен позволить осуществлять мониторинг развития сахарного диабета, определять стадию заболевания и следить за состоянием организма при лечении заболевания на длительном интервале времени (месяцы и годы), что в принципе не позволяют сделать известные методы определения гликированного гемоглобина, основанные на исследованиях образцов крови, из-за сменяемости эритроцитов каждые три месяца.
В данной технологии должны использоваться биосовместимые агенты и диапазон длин волн сенсора и плотности мощности излучателя, которые не оказывают вредного действия на организм человека. В данном случае не требуется инвазивное вмешательство в организм, которое может причинять неудобства и быть опасным для больного диабетом, поскольку даже небольшие раны могут привести к серьезным осложнениям, вплоть до гангрены. В предлагаемой технологии есть возможность использования различных биосовместимых агентов, таким образом, можно учесть индивидуальные особенности кожи пациента (увлажненность, тип кожи, склонность к ирритации и др.).
В качестве иммерсионных агентов могут быть использованы водные или водно-спиртовые растворы глицерина с концентрациями в диапазоне от 20 до 80%, водные растворы полиэтиленгликоля разного молекулярного веса от 200 до 20000, водные или водно-спиртовые растворы глюкозы, сахарозы, фруктозы или других сахаров с концентрациями в диапазоне от 20 до 60% при содержании спирта на уровне от 5 до 20%, неионное водорастворимое рентгеноконтрастное вещество йогексол.
Измерения требуется проводить каждые 2-3 месяца для возможности соотнести результаты с измерениями гликированного гемоглобина.
Для реализации способа может использоваться биосенсор, осуществляющий неинвазивный оптический мониторинг патологии тканей, в том числе жизненно важных органов при сахарном диабете.
Предлагаемое изобретение позволяет судить о наличии или развитии патологии исследуемой ткани, а также тканей внутренних жизненно важных органов (миокарда, ретины, головного мозга, хрящевой ткани суставов, ткани почек и пр.), труднодоступных для светового излучения.
Предложенная конструкция существенно повышает качество работы сенсора, определяет его высокую стабильность, благодаря существенно меньшей чувствительности к движениям пациента во время измерений. Компактность также важна для удобства использования биосенсора. Преимуществом также является механическая прочность биосенсора, обусловленная отсутствием дополнительных крепежных элементов и волоконно-оптических разъемов.
1. Биосенсор для неинвазивного оптического мониторинга патологии биологических тканей, обусловленной развитием сахарного диабета, содержащий источник и приемник излучения, аппликатор, изготовленный в виде сосуда с биосовместимым иммерсионным агентом, излучающий световод, подключенный одним концом к источнику излучения, и принимающий световод, подключенный одним концом к приемнику излучения, отличающийся тем, что дистальные концы световодов расположены внутри аппликатора.
2. Биосенсор по п. 1, отличающийся тем, что световоды расположены параллельно друг другу, а расстояние l между центрами дистальных концов излучающего и принимающего световодов равно примерно двойной глубине зондирования биоткани h, l≅2h.
3. Биосенсор по п. 1, отличающийся тем, что дистальные концы излучающего и принимающего световодов расположены друг против друга.
4. Биосенсор по п. 1, отличающийся тем, что источником излучения является широкополосная лампа, а приемником излучения - миниатюрный цифровой спектрометр, соединенный с компьютером или смартфоном.
5. Биосенсор по п. 1, отличающийся тем, что источником излучения является набор диодных лазеров разных длин волн в диапазоне 400-2300 нм.
6. Биосенсор по п. 1, отличающийся тем, что источником излучения является набор светодиодов разных длин волн в диапазоне 400-2300 нм.
7. Биосенсор по п. 1, отличающийся тем, что источником излучения является диодный лазер определенной длины волны, выбранной в диапазоне 400-2300 нм, приемником излучения - миниатюрный фотодиод, соединенный с компьютером или смартфоном.
8. Биосенсор по п. 1, отличающийся тем, что источником излучения является светодиод определенной длины волны, выбранной в диапазоне 400-2300 нм.
9. Биосенсор по п. 1, отличающийся тем, что источником излучения являются два диодных лазера определенных длин волн, выбранных в диапазоне 400-2300 нм, а приемниками излучения - два миниатюрных фотодиода, настроенные с помощью фильтров на разные длины волн и соединенные с компьютером или смартфоном.
10. Биосенсор по п. 1, отличающийся тем, что источником излучения являются два светодиода определенных длин волн, выбранных в диапазоне 400-2300 нм.
11. Биосенсор по п. 1, отличающийся тем, что источником излучения является источник света терагерцового (ТГц) диапазона длин волн.
12. Биосенсор по п. 1, отличающийся тем, что в качестве иммерсионного агента используют водные или водно-спиртовые растворы глицерина с концентрациями в диапазоне от 20 до 80%.
13. Биосенсор по п. 1, отличающийся тем, что в качестве иммерсионного агента используют водные растворы полиэтиленгликоля разного молекулярного веса от 200 до 20000.
14. Биосенсор по п. 1, отличающийся тем, что в качестве иммерсионного агента используют водные или водно-спиртовые растворы глюкозы, сахарозы, фруктозы или других сахаров с концентрациями в диапазоне от 20 до 60% при содержании спирта на уровне от 5 до 20%.
15. Биосенсор по п. 1, отличающийся тем, что в качестве иммерсионного агента используют неионное водорастворимое рентгеноконтрастное вещество йогексол.