Пептиды торк и содержащие их вакцины
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к выделенному пептиду, обладающему способностью к индукции цитостатических Т-лимфоцитов (CTL) в присутствии антигенпрезентирующих клеток (APC), несущих HLA-A*0201 или HLA-A*2402 антиген. Настоящее изобретение раскрывает композиции, содержащие указанный пептид, которые используют для индукции иммунной реакции против злокачественной опухоли, экспрессирующей TOPK, или для лечения злокачественной опухоли, экспрессирующей TOPK, и вектор для экспрессии такого пептида. Настоящее изобретение также раскрывает способ индукции APC и способ индукции CTL с использованием указанного пептида, а также выделенные APC и CTL и способы индукции иммунной реакции против злокачественной опухоли, экспрессирующей TOPK. Настоящее изобретение позволяет расширить арсенал средств для лечения и индукции иммунного ответа против злокачественных опухолей, экспрессирующих TOPK. 12 н.п. ф-лы, 8 ил., 3 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к области биологической науки, более конкретно, к области терапии злокачественных опухолей. В частности, настоящее изобретение относится к новым пептидам, которые являются эффективными в качестве противораковых вакцин, и к лекарственным средствам для лечения или профилактики опухолей или для того и другого.
[0002] Приоритет
По настоящей заявке испрашивается приоритет предварительной заявки США №61/552817, зарегистрированной 28 октября 2011 года, полное содержание которой включено в настоящее описание посредством ссылки.
Предшествующий уровень техники
[0003] Было продемонстрировано, что CD8-положительные цитотоксические Т-лимфоциты (CTL) распознают пептиды-эпитопы, получаемые из опухолеассоциированных антигенов (ТАА) на молекуле главного комплекса гистосовместимости (МНС) класса I, а затем вызывают цитолиз этих опухолевых клеток. Со времени открытия семейства антигенов меланомы (MAGE) в качестве первого примера ТАА, были обнаружены многие другие ТАА посредством иммунологических подходов (NPL 1, 2), и в настоящее время некоторые из ТАА находятся в клинической разработке в качестве иммунотерапевтических мишеней.
[0004] Для пролиферации и выживания злокачественных клеток необходимыми являются подходящие ТАА. Использование таких ТАА в качестве мишеней для иммунотерапии может минимизировать хорошо описанный риск ускользания от иммунологического надзора злокачественных клеток, свойственный для делеции, мутации и/или подавления ТАА, такой как последствие терапевтически запускаемой иммунной селекции. Таким образом, необходимо дальнейшее развитие идентификации новых ТАА, способных индуцировать сильные и специфические противоопухолевые иммунные реакции. Таким образом, продолжается клиническое применение стратегий пептидной вакцинации для различных типов злокачественных опухолей (NPL 3-10). К настоящему времени существует несколько публикаций о клинических исследованиях с использованием этих получаемых из ТАА пептидов. К сожалению, к настоящему времени в этих испытания противораковых вакцин получали только низкую частоту объективных ответов (NPL 11-13). Таким образом, на данном уровне техники остается необходимость в новых ТАА, подходящих для применения в качестве иммунотерапевтических мишеней.
[0005] TOPK (протеинкиназа T-LAK-клеток) представляет собой сериновую/треониновую киназу, которая является представителем семейства MAPKK 3/6-родственных MAPK-киназ (MAPKK). Эта киназа фосфорилирует р38 МАРК и участвует в регуляции контроля клеточного цикла (NPL 14, 15). Анализ экспрессии генов TOPK с использованием клинических образцов показал, что TOPK является сверхэкспрессированной в некоторых злокачественных опухолях, таких как рак молочной железы, холангиоцеллюлярный рак, печеночноклеточная карцинома, лейкоз, колоректальный рак и меланома (NPL 16-19). Недавние исследования, свидетельствующие о том, что активность киназы играет важную роль в канцерогенезе молочной железы, вновь возродили исследовательский интерес к связанным с раком киназам, таким как TOPK. С этой целью анализом Нозерн-блоттинг выявили, что транскрипт TOPK является высоко экспрессируемым в раковых клетках молочной железы, но является трудно детектируемым в нормальных тканях человека за исключением семенников. Кроме того, было продемонстрировано, что нокдаун экспрессии эндогенной TOPK посредством миРНК в линиях клеток рака молочной железы уменьшает цитокинез и приводит к апоптозу злокачественных клеток (NPL 20).
Список цитированных документов [0006]
Непатентная литература
[NPL 1] Boon Т, Int J Cancer 1993 May 8, 54(2): 177-80.
[NPL 2] Boon T & van der Bruggen P, J Exp Med 1996 Mar 1, 183 (3): 725-9.
[NPL 3] Harris CC, J Natl Cancer Inst 1996 Oct 16, 88(20): 1442-55.
[NPL 4] Butterfield LH et al., Cancer Res 1999 Jul 1, 59 (13): 3134-42.
[NPL 5] Vissers JL et al., Cancer Res 1999 Nov 1, 59(21): 5554-9.
[NPL 6] van der Burg SH et al., J Immunol 1996 May 1, 156 (9): 3308-14.
[NPL 7] Tanaka F et al., Cancer Res 1997 Oct 15, 57(20): 4465-8.
[NPL 8] Fujie T et al., Int J Cancer 1999 Jan 18, 80(2): 169-72.
[NPL 9] Kikuchi M et al., Int J Cancer 1999 May 5, 81(3): 459-66.
[NPL 10] Oiso M et al., Int J Cancer 1999 May 5, 81(3): 387-94.
[NPL 11] Belli F et al., J Clin Oncol 2002 Oct 15, 20(20): 4169-80.
[NPL 12] Coulie PG et al., Immunol Rev 2002 Oct, 188: 33-42.
[NPL 13] Rosenberg SA et al., Nat Med 2004 Sep, 10(9): 909-15.
[NPL 14] Abe Y et.al., J Bio Chem. 2000 July 14: 21525-21531.
[NPL 15] Ayllon V and O'connor R., Oncogene. 2007 May 24; 26(24): 3451-61.
[NPL 16] He F et al., Hum Pathol. 2010 Mar; 41(3): 415-24.
[NPL 17] Li G et al., Ann Hematol. 2006 Sep; 85(9): 583-90.
[NPL 18] Minoo P et al., Int J Oncol. 2010 Sep; 37(3): 707-18.
[NPL 19] Zykova ТА et al., Clin Cancer Res. 2006 Dec 1; 12 (23): 6884-93.
[NPL 20] Park JH et al., Cancer Res. 2006 Sep 15; 66(18): 9186-95.
Сущность изобретения
[0007] Настоящее изобретение основано, по меньшей мере частично, на открытии новых пептидов, которые могут служить в качестве подходящих мишеней иммунотерапии. Поскольку ТАА, как правило, воспринимаются иммунной системой как "свое" и, таким образом, часто не имеют природной иммуногенности, крайне важным является обнаружение подходящих мишеней. На всем протяжении настоящего изобретения продемонстрировано, что TOPK (SEQ ID NO: 86, кодируемая геном номер доступа GenBank NM_018492 (SEQ ID NO: 85)) специфически сверхэкспрессируется в злокачественных клетках, в частности при остром миелолейкозе (AML), в клетках рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярного рака, хронического миелоидного лейкоза (CML), колоректального рака, рака желудка диффузного типа, немелкоклеточного рака легких (NSCLC), лимфомы, остеосаркомы, рака предстательной железы, почечно-клеточного рака, мелкоклеточного рака легких (SCLC) и опухолей мягки тканей, но не ограничивается ими. Таким образом, настоящее изобретение сосредоточено на TOPK в качестве подходящей мишени-кандидата иммунотерапии злокачественных опухолей/опухолей.
[0008] С этой целью настоящее изобретение направлено на идентификацию специфических пептидов-эпитопов среди продуктов гена TOPK, которые имеют способность индуцировать цитотоксические Т-лимфоциты (CTL), специфические в отношении TOPK. Как более подробно описано ниже, мононуклеарные клетки периферической крови (РВМС), получаемые у здорового донора, стимулировали с использованием связывающих HLA (лейкоцитарного антигена человека)-А*2402 или HLA-A*0201 пептидов-кандидат, получаемых из TOPK. Затем выводили линии CTL со специфической цитотоксичностью против HLA-A24- или HLA-А2-положительных клеток-мишеней, сенсибилизированных каждым из пептидов-кандидатов. Результаты в настоящем описании демонстрируют, что эти пептиды являются рестриктированными по HLA-A24- или HLA-A2 пептидами-эпитопами, которые могут индуцировать сильные и специфические иммунные реакции против экспрессирующих TOPK клеток. Эти результаты дополнительно демонстрируют, что TOPK является сильно иммуногенным и что его эпитопы являются эффективными мишенями для противоопухолевой иммунотерапии.
[0009] Таким образом, задачей настоящего изобретения является обеспечение выделенных пептидов, которые обладают способностью связываться с HLA-антигеном, и содержат последовательность TOPK (SEQ ID NO: 86) или ее иммунологически активный фрагмент. Ожидается, что такие пептиды обладают способностью к индукции CTL, и следовательно, их можно использовать для индукции CTL in vitro, ex vivo или in vivo, или непосредственно вводить индивидууму таким образом, чтобы индуцировать in vivo иммунные реакции против злокачественных опухолей, примеры которых включают, но не ограничиваются ими, AML, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, колоректальный рак, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почки, SCLC и опухоль мягких тканей.
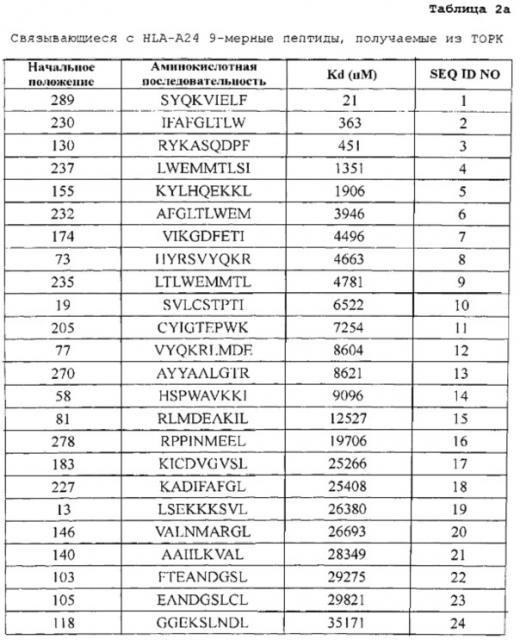
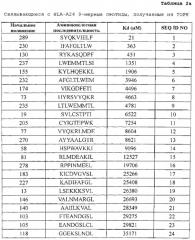
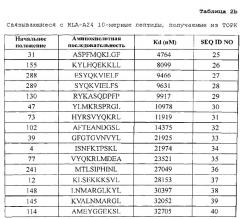
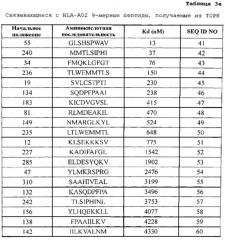
[0010] Предпочтительные пептиды являются нонапептидами или декапептидами и более предпочтительно нонапептидами или декапептидами, содержащими аминокислотную последовательность, выбранную из SEQ ID NO: 2-40 и 42-84. Из них пептиды, содержащие аминокислотную последовательность, выбранную из SEQ ID NO: 2, 3, 6, 27, 28, 42, 45, 47, 50, 51, 54, 62, 63, 64, 66, 71, 72 и 76, являются особенно предпочтительными.
[0011] В настоящем изобретении также предоставлены модифицированные пептиды, содержащие аминокислотную последовательность, выбранную из SEQ ID NO: 2-40 и 42-84, в которых заменены, удалены, введены и/или добавлены одна, две или более аминокислот при условии, что получаемые модифицированные пептиды сохраняют необходимую способность к индукции CTL исходного немодифицированного пептида.
[0012] Настоящее изобретение дополнительно включает выделенные полинуклеотиды, кодирующие любой из пептидов по настоящему изобретению. Эти полинуклеотиды можно использовать для индукции или получения антигенпрезентирующих клеток (APC), обладающих способностью к индукции CTL. Также как описанные выше пептиды по настоящему изобретению, такие APC можно вводить индивидууму для индукции иммунных реакций против злокачественной опухоли.
[0013] При введении индивидууму пептиды по настоящему изобретению предпочтительно презентируются на поверхности APC таким образом, чтобы индуцировать нацеливание CTL на соответствующие пептиды. Таким образом, одной из задач настоящего изобретения является обеспечение средств или композиций для индукции CTL, где такие композиции или средства содержат один или более пептидов по настоящему изобретению или один или более полинуклеотидов, кодирующих такие пептиды. Такие средства или композиции можно использовать для лечения и/или профилактики первичной злокачественной опухоли, метастазирования или послеоперационного рецидива рака. Примеры злокачественных опухолей-мишеней, рассматриваемых в настоящем изобретении, включают, но не ограничиваются ими, AML, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, колоректальный рак, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почки, SCLC и опухоль мягких тканей.
[0014] Настоящее изобретение дополнительно предусматривает фармацевтические композиции или средства, которые содержат один или более пептидов или полинуклеотидов по настоящему изобретению, составленных для лечения и/или профилактики первичной злокачественной опухоли, метастазирования или послеоперационного рецидива рака, как отмечено выше. Наряду или в дополнение к существующим пептидам или полинуклеотидам настоящие фармацевтические средства и/или композиции могут содержать в качестве активных ингредиентов APC и/или экзосомы, которые предоставляют любой из пептидов по настоящему изобретению.
[0015] Пептиды или полинуклеотиды по настоящему изобретению можно использовать для индукции APC, которые презентируют на поверхности комплекс HLA-антигена и пептида по настоящему изобретению, например, приведением APC, получаемых у индивидуума, в контакт с пептидом по настоящему изобретению или введением полинуклеотида, кодирующего пептид по настоящему изобретению, в APC. Такие APC имеют высокую способность к индукции CTL против пептидов-мишеней и являются пригодными для иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к способам индукции APC со способностью к индукции CTL, а также APC, полученным такими способами.
[0016] Дополнительной задачей настоящего изобретения является обеспечение способов индукции CTL, где такие способы предусматривают стадию совместного культивирования CD8-положительных Т-клеток с APC, которые презентируют на своей поверхности комплекс HLA-антигена и пептида по настоящему изобретению, стадию совместного культивирования CD8-положительных Т-клеток с экзосомами, презентирующими на их поверхности комплекс HLA-антигена и пептида по настоящему изобретению, или стадию введения полинуклеотида/полинуклеотидов, кодирующих полипептиды субъединиц T-клеточного рецептора (TCR), где TCR, образованный полипептидами субъединиц, может связываться с пептидом по настоящему изобретению. CTL, получаемые такими способами, находят применение при лечении и/или профилактике злокачественных опухолей, более конкретно AML, рака мочевого пузыря, рака молочной железы, рака шейки матки, холангиоцеллюлярного рака, колоректального рака, рака желудка диффузного типа, NSCLC, лимфомы, остеосаркомы, рака предстательной железы, рака почки, SCLC и опухоли мягких тканей. Таким образом, настоящее изобретение относится к способам индукции CTL, а также CTL, получаемые такими способами. Еще одной задачей настоящего изобретения является предоставление выделенных APC, которые презентируют на поверхности комплекс HLA-антигена и пептида по настоящему изобретению. Кроме того, настоящее изобретение относится к выделенным CTL, которые направлены на пептиды по настоящему изобретению. Такие APC и CTL можно использовать для иммунотерапии злокачественных опухолей.
[0017] Еще одной задачей настоящего изобретения является предоставление способов индукции иммунной реакции против злокачественной опухоли у нуждающегося в этом индивидуума, где такие способы включают стадию введения индивидууму композиции, которая содержит по меньшей мере один компонент, выбранный из пептида по настоящему изобретению, полинуклеотида, кодирующего такой пептид, экзосом или APC, презентирующих такие пептиды, и CTL, которые могут распознавать клетки, презентирующие такие пептиды на своей поверхности.
[0018] Применимость настоящего изобретения распространяется на любое из ряда заболеваний, связанных со сверхэкспрессией TOPK или возникающих в результате сверхэкспрессии TOPK, такие как злокачественные опухоли с экспрессией TOPK, примеры которых включают, но не ограничиваются ими, AML, рак мочевого пузыря, рак молочной железы, рак шейки матки, холангиоцеллюлярный рак, колоректальный рак, рак желудка диффузного типа, NSCLC, лимфому, остеосаркому, рак предстательной железы, рак почки, SCLC и опухоль мягких тканей.
Задачи и признаки изобретения станут более понятными при чтении приведенного ниже подробного описания совместно с сопровождающими фигурами и примерами. Однако следует понимать, что как предыдущий раздел "Сущность настоящего изобретения", так и следующее ниже подробное описание, являются только иллюстративными вариантами осуществления и не являются ограничивающими настоящее изобретение или другие альтернативные варианты осуществления настоящего изобретения.
[0019] В частности, хотя изобретение описано в настоящем описании со ссылкой на ряд конкретных вариантов осуществления, следует понимать, что описание является иллюстративным описанием изобретения, и его не следует понимать как ограничивающее изобретение. Специалисты в данной области могут находить различные модификации и применения, не выходя за рамки сущности и объема изобретения, как описано в прилагаемой формуле изобретения. Подобным образом, другие задачи, признаки, эффекты и преимущества будут очевидными из описанных ниже сущности изобретения и определенных вариантов осуществления, и специалист в данной области легко поймет их. Такие задачи, признаки, эффекты и преимущества изобретения станут понятны из указанного выше совместно с сопровождающими примерами, данными, фигурами и разумными выводами, извлеченными из них, отдельно или с рассмотрением включенных в настоящее описание ссылок.
Краткое описание чертежей
[0020] Различные аспекты и применения настоящего изобретения станут очевидными специалисту в данной области после рассмотрения краткого описания фигур и подробного описания настоящего изобретения и его предпочтительных вариантов осуществления, которые следуют далее.
[0021] Фиг. 1. Фигура 1 состоит из ряда фотографий, (a)-(j), отображающих результаты анализа иммуноферментных пятен (ELISP0T) интерферона (IFN)-гамма на CTL, которые индуцировали пептидами, получаемыми из TOPK. CTL в лунке №8, индуцируемые TOPK-А2 4-9-230 (SEQ ID NO: 2) (a), в №3 индуцируемые TOPK-А24-9-130 (SEQ ID NO: 3) (b), в №3 индуцируемые TOPK-А24-9-232 (SEQ ID NO: 6) (c), в №2 индуцируемые TOPK-А24-10-288 (SEQ ID NO: 27) (d) и в №4 индуцируемые TOPK-А24-10-289 (SEQ ID NO: 28) (е) показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке этих изображений означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, как это характерно для отрицательных данных, не наблюдали специфической продукции IFN-гамма CTL, стимулированными TOPK-А24-9-289 (SEQ ID NO: 1) (f). На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0022] Фиг. 2-1. Фигура 2 состоит из ряда фотографий, (a)-(о), отображающих результаты анализа иммуноферментных пятен (ELISP0T) интерферона (IFN)-гамма на CTL, которые индуцировали пептидами, получаемыми из TOPK. CTL в лунке №7, индуцируемые TOPK-А02-9-240 (SEQ ID NO: 42) (a), в №4 индуцируемые TOPK-А02-9-19 (SEQ ID NO: 45) (b), в №2 индуцируемые TOPK-А02-9-183 (SEQ ID NO: 47) (c), в №8 индуцируемые TOPK-А02-9-235 (SEQ ID NO: 50) (d) и в №4 индуцируемые TOPK-А02-9-12 (SEQ ID NO: 51) (е), в №3 индуцируемые TOPK-А02-9-285 (SEQ ID NO: 53) (f), в №3 индуцируемые TOPK-А02-9-47 (SEQ ID NO: 54) (g), в №5 индуцируемые TOPK-А02-10-236 (SEQ ID NO: 62) (h), в №3 индуцируемые TOPK-А02-10-231 (SEQ ID NO: 63) (i), в №8 индуцируемые TOPK-А02-10-47 (SEQ ID NO: 64) (j), в №1 индуцируемые TOPK-А02-10-272 (SEQ ID NO: 71) (l) показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке этих изображений означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, как это характерно для отрицательных данных, не наблюдали специфической продукции IFN гамма CTL, стимулированными TOPK-А02-9-55 (SEQ ID NO: 41) (о). На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0023] Фиг. 2-2. Фигура 2 состоит из ряда фотографий, (a)-(о), отображающих результаты анализа иммуноферментных пятен (ELISPOT) интерферона (IFN)-гамма на CTL, которые индуцировали пептидами, получаемыми из TOPK. CTL в №4 индуцируемые TOPK-А02-10-88 (SEQ ID NO: 72) (m) и в №4 индуцируемые TOPK-А02-10-142 (SEQ ID NO: 76) (п) показали эффективную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке этих изображений означает, что клетки из соответствующей лунки размножали для получения линий CTL. В противоположность этому, как это характерно для отрицательных данных, не наблюдали специфической продукции IFN-гамма CTL, стимулированными TOPK-А02-9-55 (SEQ ID NO: 41) (о). На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами.
[0024] Фиг. 3. Фигура 3 состоит из ряда фотографий, (a)-(e), отображающих продукцию IFN-гамма линиями CTL, стимулируемыми TOPK-А24-9-230 (SEQ ID NO: 2) (a), TOPK-А24-9-130 (SEQ ID NO: 3) (b), TOPK-А24-9-232 (SEQ ID NO: 6) (c), TOPK-A24-10-288 (SEQ ID NO: 27) (d) и TOPK-A24-10-289 (SEQ ID NO: 28) (e). Количество IFN-гамма, который продуцировали CTL, измеряли твердофазным иммуноферментным анализом (ELISA) для IFN-гамма. Результаты демонстрируют, что линии CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (линии CTL) к клеткам-стимуляторам.
[0025] Фиг. 4. Фигура 4 состоит из ряда линейных графиков, (a)-(c), отображающих продукцию IFN-гамма клонами CTL, получаемыми лимитирующим разведением из линий CTL, стимулированных TOPK-А24-9-130 (SEQ ID NO: 3) (a), TOPK-А24-10-288 (SEQ ID NO: 27) (b) и TOPK-А24-10-2 8 9 (SEQ ID NO: 28) (c). Результаты демонстрируют, что клоны CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (клона CTL) к клеткам-стимуляторам.
[002 6] Фиг. 5-1. Фигура 5-1 состоит из ряда линейных графиков, (a)-(f), отображающих продукцию IFN-гамма линиями CTL, стимулированными TOPK-А02-9-240 (SEQ ID NO: 42) (a), TOPK-А02-9-19 (SEQ ID NO: 45) (b), TOPK-А02-9-235 (SEQ ID NO: 50) (c), TOPK-А02-9-12 (SEQ ID NO: 51) (d), TOPK-A02-9-285 (SEQ ID NO: 53) (e) и TOPK-А02-9-47 (SEQ ID NO: 54) (f). Количество IFN-гамма, который продуцировали CTL, измеряли твердофазным иммуноферментным анализом (ELISA) для IFN-гамма. Результаты демонстрируют, что линии CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (линии CTL) к клеткам-стимуляторам.
[0027] Фиг. 5-2. Фигура 5-2 состоит из ряда линейных графиков, (g)-(k), отображающих продукцию IFN-гамма линиями CTL, стимулированными TOPK-А02-10-236 (SEQ ID NO: 62) (g), TOPK-А02-10-231 (SEQ ID NO: 63) (h), TOPK-A02-10-47 (SEQ ID NO: 64) (i), TOPK-A02-10-239 (SEQ ID NO: 66) (j) и TOPK-A02-10-88 (SEQ ID NO: 72) (k). Количество IFN-гамма, который продуцировали CTL, измеряли твердофазным иммуноферментным анализом (ELISA) для IFN-гамма. Результаты демонстрируют, что линии CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (линии CTL) к клеткам-стимуляторам.
[0028] Фиг. 6. Фигура 6 состоит из ряда линейных графиков, (a) и (b), отображающих продукцию IFN-гамма клонами CTL, получаемыми лимитирующим разведением из линий CTL, стимулированных TOPK-А02-9-240 (SEQ ID NO: 42) (a) и TOPK-А02-9-285 (SEQ ID NO: 53) (b). Результаты демонстрируют, что клоны CTL, получаемые стимуляцией каждым пептидом, демонстрируют эффективную продукцию IFN-гамма по сравнению с контролем. На фигурах "+" означает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и "-" означает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных какими-либо пептидами. Отношение R/S означает отношение числа иммунокомпетентных клеток (клона CTL) к клеткам-стимуляторам.
[0029] Фиг. 7. Фигура 7 представляет собой линейный график, изображающий специфическую активность CTL клонов CTL против клеток-мишеней, которые экспрессируют TOPK и HLA-A*2402. В качестве контроля получали клетки COS7, трансфицированные HLA-А*2402 или полноразмерным геном TOPK. Клон CTL, получаемый с использованием TOPK-А02-9-240 (SEQ ID NO: 42), демонстрировал специфическую активность CTL против клеток COS7, трансфицированных TOPK и HLA-A*2402 (ромб). С другой стороны, не детектировали значимой специфической активности CTL против клеток COS7, трансфицированных HLA-A*2402 (треугольник) или TOPK (кружок).
[0030] Фиг. 8. Фигура 8 представляет собой линейный график, изображающий специфическую активность CTL линий CTL против клеток-мишеней, которые экспрессируют TOPK и HLA-A*0201. В качестве контроля получали клетки COS7, трансфицированные HLA-А*0201 или полноразмерным геном TOPK. Линия CTL, получаемая с использованием TOPK-А02-9-240 (SEQ ID NO: 42), демонстрировала специфическую активность CTL против клеток COS7, трансфицированных TOPK и HLA-A*0201 (ромб). С другой стороны, не детектировали значимой специфической активности CTL против клеток-мишеней, экспрессирующих HLA-A*0201 (треугольник) или TOPK (кружок).
Описание вариантов осуществления
[0031] Дополнительно к разделу "Сущность изобретения" задачей настоящего изобретения является предоставить:
[1] Выделенный пептид, обладающий способностью к индукции CTL, где пептид состоит из аминокислотной последовательности TOPK или ее иммунологически активного фрагмента.
[2] Выделенный пептид по [1], где пептид содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 3, 6, 27, 28, 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 76.
[3] Выделенный пептид, выбранный из группы, состоящей из (i) и (ii), как указано ниже:
(i) выделенного пептида (a) или (b), как указано ниже:
(a) выделенного пептида, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 3, 6, 27 и 28,
(b) выделенного пептида, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 3, 6, 27 и 28, в которой 1, 2 или несколько аминокислот заменены, введены, удалены и/или добавлены, где пептид обладает способностью к индукции CTL,
(ii) выделенного пептида (c) или (d), как указано ниже:
(c) выделенного пептида, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 76,
(d) выделенного пептида, содержащего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 76, в которой 1, 2 или несколько аминокислот заменены, введены, удалены и/или добавлены, где пептид обладает способностью к индукции CTL.
[4] Выделенный пептид по [3], где пептид обладает одной или обеими следующими характеристиками:
(a) вторая аминокислота от N-конца аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, 3, 6, 27 и 28, заменена на аминокислоту, выбранную из группы, состоящей из фенилаланина, тирозина, метионина и триптофана, и
(b) C-концевая аминокислота аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 2, 3, 6, 27 и 28, заменена на аминокислоту, выбранную из группы, состоящей из фенилаланина, лейцина, изолейцина, триптофана и метионина.
[5] Выделенный пептид по [3], где пептид обладает одной или обеими следующими характеристиками:
(a) вторая аминокислота от N-конца аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 76, заменена на аминокислоту, выбранную из группы, состоящей из лейцина и метионина, и
(b) C-концевая аминокислота аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 76, заменена на аминокислоту, выбранную из группы, состоящей из валина и лейцина.
[6] Выделенный пептид по любому из [1]-[5], где указанный пептид обладает способностью связываться с HLA-антигеном.
[7] Выделенный пептид по [6], где указанный HLA-антиген представляет собой HLA-A24 или HLA-A2.
[8] Выделенный пептид по любому из [1]-[7], где указанный пептид представляет собой нонапептид или декапептид.
[9] Выделенный полинуклеотид, кодирующий выделенный пептид по любому из [1]-[8].
[10] Композиция для индукции CTL, где композиция содержит один или несколько пептидов по любому из [1]-[8] или один или несколько полинуклеотидов по [9].
[11] Фармацевтическая композиция, содержащая:
(a) один или несколько пептидов по любому из [1]-8],
(b) один или несколько полинуклеотидов по [9],
(c) одну или несколько APC, которые презентируют комплекс пептида по любому из [1]-[8] и HLA-антигена на своей поверхности;
(d) одну или несколько экзосом, которые презентируют комплекс пептида по любому из [1]-[8] и HLA-антигена на своей поверхности, или
(е) один или несколько CTL, которые могут распознавать клетку, презентирующую комплекс пептида по любому из [1]-[8] и HLA-антигена на своей поверхности, в комбинации с фармацевтически приемлемым носителем,
где фармацевтическая композиция составлена для лечения и/или профилактики злокачественной опухоли, профилактики послеоперационного рецидива рака и/или индукции иммунной реакции против злокачественной опухоли.
[12] Фармацевтическая композиция по [11], где указанная фармацевтическая композиция составлена для введение индивидууму, HLA-антиген которого представляет собой HLA-A24 или HLA-A2.
[13] Способ индукции антигенпрезентирующей клетки (APC) со способностью к индукции CTL, где указанный способ включает стадию, выбранную из группы, состоящей из:
(a) приведения APC в контакт с пептидом по любому из [1]-[8] in vitro, ex vivo или in vivo, и
(b) введения полинуклеотида, кодирующего пептид по любому из [1]-[8], в APC.
[14] Способ индукции CTL, где указанный способ включает стадию, выбранную из группы, состоящей из:
(a) совместного культивирования CD8-положительной T-клетки с APC, которая презентирует на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[8],
(b) совместного культивирования CD8-положительной T-клетки с экзосомой, которая презентирует на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[8], и
(c) введения в CD8-положительную Т-клетку полинуклеотида/полинуклеотидов, кодирующих полипептиды субъединиц T-клеточного рецептора (TCR), где TCR, образованный указанными полипептидами субъединиц TCR, способен связываться с комплексом HLA-антигена и пептида по любому из [1]-[8] на клеточной поверхности.
[15] Выделенная APC, которая презентирует на своей поверхности комплекс HLA-антигена и пептида по любому из [1]-[8].
[16] Выделенная APC по [15], которую индуцируют способом по [13].
[17] Выделенный CTL, который нацелен на пептид по любому из [1]-[8].
[18] CTL по [17], который индуцируют способом по [14].
[19] Способ индукции иммунной реакции против злокачественной опухоли у нуждающегося в этом индивидуума, где указанный способ включает стадию введения индивидууму композиции, содержащей пептид по любому из [1]-[8], его иммунологически активный фрагмент или полинуклеотид, кодирующий указанный пептид или указанный фрагмент.
[20] Антитело или его иммунологически активный фрагмент против пептидов по любому из [1]-[8].
[21] Вектор, содержащий нуклеотидную последовательность, кодирующую пептид по любому из [1]-[8].
[22] Клетка-хозяин, трансформированная или трансфицированная вектором по [21].
[23] Диагностический набор, содержащий пептид по любому из [1]-[8], нуклеотид по [9] или антитело по [20].
[24] Способ скрининга пептида, обладающего способностью индуцировать CTL, который обладает специфической цитотоксической активностью против клетки, которая презентирует фрагмент, получаемый из TOPK, где способ включает стадии:
(i) предоставления последовательности-кандидата, состоящей из аминокислотной последовательности, модифицированной заменой, удалением, встраиванием и/или добавлением одного, двух или нескольких аминокислотных остатков к исходной аминокислотной последовательности, где исходная аминокислотная последовательность выбрана из группы, состоящей из SEQ ID NO: 2, 3, 6, 27, 28, 42, 45, 47, 50, 51, 53, 54, 62, 63, 64, 66, 71, 72 и 7 6;
(ii) отбора последовательности-кандидата, которая не обладает по существу значительной гомологией с пептидами, получаемыми из любых известных продуктов генов человека, отличных от TOPK;
(iii) приведения пептида, состоящего из последовательности-кандидата, отобранной на стадии (ii), в контакт с антигенпрезентирующей клеткой;
(iv) приведения антигенпрезентирующей клетки стадии (c) в контакт с CD8-положительной Т-клеткой, и
(v) идентификации пептида, способность к индукции CTL которого является такой же, как у пептида, состоящего из исходной аминокислотной последовательности, или более высокой.
[0032] Хотя любые способы и материалы, подобные или эквивалентные способам и материалам, описанным в настоящем описании, можно использовать в практике или тестировании вариантов осуществления настоящего изобретения, теперь описываются предпочтительные способы, устройства и материалы. Однако перед описанием этих материалов и способов следует понимать, что эти описания являются лишь иллюстративными и не предназначены для ограничения. Также следует понимать, что настоящее изобретение не ограничивается описанными в настоящем описании конкретными размерами, формами, размерностями, методологиями, протоколами и т.д., так как они могут варьироваться в соответствии с рутинным экспериментированием и оптимизацией. Также следует понимать, что терминология, используемая в описании, предназначена только для цели описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемой формулой изобретения.
[0033] Описание каждой публикации, патента или заявки на патент, указанные в этом описании изобретения, конкретно полностью включено в настоящем описании посредством ссылки. Однако ничто в настоящем описании не следует понимать как признание того, что это изобретение не дает права на датирование задним числом такого раскрытия на основании предыдущего изобретения.
Если нет другого определения, все технические и научные термины, используемые в настоящем описании, имеют то же самое значение, что и значение, как правило, понимаемое специалистом в области, к которой принадлежит настоящее изобретение. В случае противоречия, данное описание изобретения, в том числе определения, будет служить контролем. Кроме того, эти материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
[0034] I. Определения
Как используют в настоящем описании, если конкретно не указано иное, термины в форме единственного числа означают "по меньшей мере один".
Термины "выделенный" и "очищенный", используемые в отношении вещества (например, пептида, антитела, полинуклеотида и т.д.), указывают, что вещество является по существу свободным от по меньшей мере одного вещества, которое может еще содержаться в природном источнике. Таким образом, выделенным или очищенным пептидом называют пептид, который по существу не содержит клеточный материал, такой как углевод, липид или другие загрязняющие белки из источника клеток или ткани, из которого получен пептид, или по существу не содержит химических предшественников или других химических веществ при химическом синтезе.
[0035] Термин "по существу не содержит клеточный материал" включает препараты пептида, в которых пептид отделен от клеточных компонентов тех клеток, из которых он изолирован или рекомбинантно получен. Таким образом, пептид, который по существу не содержит клеточный материал, включает препараты полипептида, содержащие менее чем приблизительно 30%, 20%, 10% или 5% (в расчете на сухую массу) гетерологичного белка (также называемого "загрязняющим белком"). При рекомбинантно получаемом пептиде, он также предпочтительно по существу не содержит культуральной среды, которая включает препараты пептида с культуральной средой в количестве приблизительно 20%, 10% или 5% объема этого пептидного препарата. При получении пептида химическим синтезом, он предпочтительно по существу не содержит химических предшественников или других химических веществ, включающих препараты пептида с химическими предшественниками или другими химическими веществами, участвующими в синтезе этого пептида, в количестве менее чем приблизительно 30%, 20%, 10%, 5% (в расчете на сухую массу) объема этого пептидного препарата. То, что конкретный пептидный препарат содержит выделенный или очищенный пептид, может быть показано, например, появлением единственной полосы после электрофореза препарата белка в (ДСН)-полиакриламидном геле и окрашиванием Кумасси бриллиантовым синим или т.п.этого геля. В одном предпочтительном варианте осуществления пептиды и полинуклеотиды по настоящему изобретению являются выделенными или очищенными.
[0036] Термины "полипептид", "пептид" и "белок" используются в настоящем описании взаимозаменяемо для ссылки на полимер аминокислотных остатков. Термины применяют к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой модифицированный остаток(-и) или не встречающийся в природе остаток, такой как искусственный химический миметик соответствующей встречающейся в природе аминокислоты(-от), а также к встречающимся в природе полимерам аминокислот.
Термин "олигопептид", используемый иногда в этом описании изобретения, используется для ссылки на пептиды, которые имеет длину 20 аминокислотных остатков или менее, как правило, 15 аминокислотных остатков или менее и, как правило, состоят из от приблизительно 8 до приблизительно 11 аминокислотных остатков, часто из 9 или 10 аминокислотных остатков. Последний называют в настоящем описании "нонапептидом" и "декапептидом", соответственно.
[0037] Термин "аминокислота" в данном контексте относится к встречающимся в природе и синтетическим аминокислотам, а также аминокислотным аналогам и миметикам аминокислот, которые функционируют сходно с встречающимися в природе аминокислотами. Аминокислоты могут представлять собой L-аминокислоты или D-аминокислоты. Встречающиеся в природе аминокислоты представляют собой аминокислоты, кодируемые в генетическом коде, а так