Зонд и способ детекции полиморфизма, используя таковой
Иллюстрации
Показать всеИзобретение относится к зонду для детекции полиморфизма V600 в гене BRAF. Изобретение представляет собой флуоресцентно меченый олигонуклеотид (Р1), который, по меньшей мере, на 80% идентичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1, в котором основание, соответствующее основанию 237, представляет собой цитозин, меченный флуоресцентным красителем, причем олигонуклеотид распознает полиморфизм, по меньшей мере, в одном из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1, при условии, что олигонуклеотид отличается от олигонуклеотида, указанного в SEQ ID NO:7 или 19. 5 н. и 6 з.п. ф-лы, 4 ил., 7 табл., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет в соответствии с 35 USC 119 японской патентной заявки № 2012-096558, поданной 20 апреля 2012 года, и японской патентной заявки № 2013-081858, поданной 10 апреля 2013 года. Содержание этих заявок приводится в настоящем документе в качестве ссылки в полном объеме. Все публикации, патентные заявки и технические стандарты, указанные в настоящем описании, приводятся в настоящем документе в качестве ссылки в той же мере, как если бы каждая отдельная публикация, патентная заявка или технический стандарт конкретно и отдельно указывались как приведенные в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к зонду для детекции полиморфизма, способу детекции полиморфизма, способу оценки эффективности лекарственного средства и набору реагентов для детекции полиморфизма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ген BRAF кодирует белок BRAF, который участвует в передаче сигнала внутри клетки и клеточном росте. Известно, что внутриклеточная передача сигнала становится постоянно активированной при мутировании гена BRAF, когда 600ая аминокислота белка BRAF мутирует из валина (V) в глутаминовую кислоту (Е). Такой мутант с активированным геном BRAF называют «V600E» и обнаруживают в около 7% злокачественных опухолей человека и около 60% злокачественных меланом (смотри, например, статью Nature. (2010) Dec 16; 468(7326): 973-7). Кроме того, также было сообщено, что прогрессирующая меланома с мутацией V600E эффективно лечится с помощью, например, ингибитора киназы BRAF вемурафениба. При введении ингибитора киназы BRAF вемурафениба из соображений эффективности и безопасности необходимо предварительно определить наличие или отсутствие мутации V600E.
Были разработаны способы, с помощью которых в короткое время недорогим и простым путем точно определяют мутацию V600E (смотри, например, патент WO2011/071046 и выложенную японскую патентную заявку (JP-A) 2009-77712). Кроме того, также известны способы определения мутации в гене BRAF, используя способ PCR-RFLP, способ прямого секвенирования и способ HRMA или подобные (смотри, например, статьи Endocr J. (2007) Jun 54(3): p.399-405; Yonsei Med. J. (2009) Apr 30, 50(2): p.266-72; Am. J. Clin. Pathol. (2008) Aug, 130(2): p247-53).
На сегодняшний день помимо мутации V600E известны мутации V600K, V600R и V600D, в которых 600ая аминокислота мутирует из валина в лизин (К), аргинин (R) и аспарагиновую кислоту (D), соответственно (смотри, например, статью J. Transl. Med. (2010) Jul 14, 8: p67). Кроме того, также известны мутации V600G и V600M, в которых 600ая аминокислота мутирует в глицин (G) и метионин (М), соответственно.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
До настоящего времени не был известен способ, который был бы способен одновременно идентифицировать две или больше мутаций, отличных от V600E, представляющих собой V600K, V600R и V600D.
Поэтому желательна дальнейшая технологическая разработка для создания способа упрощенной детекции мутации V600E наряду с другими мутациями (V600K, V600R и/или V600D) с высокой чувствительностью.
Целью настоящего изобретения является создание зонда для детекции полиморфизма, который позволяет без труда с высокой чувствительностью определять полиморфизм V600 в гене BRAF. Другой целью настоящего изобретения является создание способа детекции полиморфизма, используя зонд по изобретению.
СРЕДСТВА РЕШЕНИЯ ДАННЫХ ПРОБЛЕМ
Настоящее изобретение заключается в следующем.
<1> Зонд для детекции полиморфизма V600 в гене BRAF, который представляет собой следующий флуоресцентно меченый олигонуклеотид Р1:
(Р1) олигонуклеотид, который, по меньшей мере, на 80% идентичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1, где основание, соответствующее основанию 237, представляет собой цитозин, меченный флуоресцентным красителем, причем олигонуклеотид распознает полиморфизм, по меньшей мере, в одном из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1, при условии, что олигонуклеотид отличается от олигонуклеотида, указанного в SEQ ID NO:7 или 19.
<2> Зонд по п.<1>, где вышеописанный флуоресцентно меченый олигонуклеотид представляет собой следующий флуоресцентно меченый олигонуклеотид Р1’:
(P1’) олигонуклеотид, который, по меньшей мере, на 80% идентичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1, где основание, соответствующее основанию 237, представляет собой цитозин; по меньшей мере, два из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1, отличаются от указанных в SEQ ID NO:1; и описанный выше цитозин, соответствующий основанию 237 метят флуоресцентным красителем.
<3> Зонд по п.<1> или <2>, в котором вышеописанный флуоресцентно меченый олигонуклеотид имеет основание, меченное флуоресцентным красителем по любой из позиций с первой по третью от 3’-конца.
<4> Зонд по одному из пп.<1>-<3>, где вышеописанный флуоресцентно меченый олигонуклеотид имеет основание, меченное флуоресцентным красителем на 3’-конце.
<5> Зонд по одному из пп.<1>-<4>, где интенсивность флуоресценции вышеописанного флуоресцентно меченого олигонуклеотида при гибридизации с последовательностью-мишенью снижается или возрастает по сравнению с отсутствием гибридизации с последовательностью-мишенью.
<6> Зонд по одному из пп.<1>-<5>, где интенсивность флуоресценции вышеописанного флуоресцентно меченого олигонуклеотида при гибридизации с последовательностью-мишенью падает по сравнению с отсутствием гибридизации с последовательностью-мишенью.
<7> Зонд по одному из пп.<1>-<6>, где длина вышеописанного флуоресцентно меченого олигонуклеотида составляет 10-40 оснований.
<8> Зонд по одному из пп.<1>-<7>, где длина вышеописанного флуоресцентно меченого олигонуклеотида составляет 10-30 оснований.
<9> Зонд по одному из пп.<1>-<8>, который представляет собой зонд для анализа кривой плавления. Это можно альтернативно выразить как применение зонда по одному из пп.<1>-<8> для анализа кривой плавления.
<10> Зонд по одному из пп.<1>-<9>, где основание, соответствующее основанию 228 последовательности оснований, указанной в SEQ ID NO:1, представляет собой гуанин или аденин; основание, соответствующее 229 последовательности оснований, указанной в SEQ ID NO:1, представляет собой аденин или гуанин; и основание, соответствующее 230 последовательности оснований, указанной в SEQ ID NO:1, представляет собой гуанин или тимин.
<11> Способ определения полиморфизма в локусе V600 гена BRAF, который включает применение зонда по какому-либо из пп.<1>-<10>.
<12> Способ по п.<11>, который включает стадии:
(I) приведения зонда по одному из пп.<1>-<10> в контакт с одноцепочечной нуклеиновой кислотой, содержащейся в образце, для гибридизации вышеописанного флуоресцентно меченого олигонуклеотида с вышеописанной одноцепочечной нуклеиновой кислотой, таким образом, получая гибрид;
(II) диссоциации вышеописанного гибрида посредством изменения температуры образца, содержащего гибрид, для оценки изменения флуоресцентного сигнала, вызванного диссоциацией гибрида;
(III) определения величины Tm, которая представляет собой температуру диссоциации гибрида, на основе вышеописанного изменения флуоресцентного сигнала; и
(IV) определения, исходя из вышеописанной величины Tm, наличия мутации в локусе V600 гена BRAF.
<13> Способ по п.<1> или <12>, который дополнительно включает стадию амплификации нуклеиновой кислоты перед или одновременно с вышеописанной стадией (I) получения гибрида.
<14> Способ оценки эффективности лекарственного средства, который включает стадии:
определения мутации в локусе V600 гена BRAF с помощью способа по одному из пп.<11>-<13>; и
определения (или прогноза) толерантности в отношении лекарственного средства или эффективности лекарственного средства на основе наличия или отсутствия идентифицированной мутации. Указанный способ может быть осуществлен на образце от индивидуума (например, человека) в отношении которого должна быть проведена оценка. Образец (использованный в настоящем документе) содержит нуклеиновую кислоту (например, ДНК), которая может содержать указанную мутацию/полиморфизм.
<15> Реагент для определения полиморфизма, который включает зонд по одному из пп.<1>-<10>.
<16> Набор для определения полиморфизма, который включает:
зонд по одному из пп.<1>-<10>; и
праймер, способный осуществить амплификацию, используя в качестве матрицы область последовательности оснований, указанной в SEQ ID NO:1, содержащую последовательность, с которой гибридизуется вышеописанный зонд.
<17> Набор по п.<16>, где дополнительно включает праймер, способный осуществить амплификацию, используя в качестве матрицы область длиной 50-1000 оснований, включающую основания 228-230 последовательности оснований, указанной в SEQ ID NO:1. Изобретение также относится к применению реагента или набор по пп.<15>-<17> или зонда по пп.<1>-<10> для детекции указанного полиморфизма в гене BRAF.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет зонд для детекции полиморфизма, который дает возможность без труда с высокой чувствительностью детектировать полиморфизм V600 в гене BRAF, и способ детекции полиморфизма, используя зонд.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1А представлен пример графика плавления смеси нуклеиновых кислот, и на фиг.1В представлен пример дифференциальной кривой плавления смеси нуклеиновых кислот.
На фиг.2А-2J представлены дифференциальные кривые плавления образцов согласно примеру 1 и сравнительному примеру 1 настоящего изобретения.
На фиг.3А-3J представлены дифференциальные кривые плавления образцов согласно примеру 2 и сравнительному примеру 1 настоящего изобретения.
На фиг.4А-4О представлены дифференциальные кривые плавления образцов согласно сравнительному примеру 2 настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Зонд для детекции полиморфизма V600 в гене BRAF по настоящему изобретению (далее в настоящем документе для краткости обозначаемый как «зонд для детекции полиморфизма») представляет собой зонд для детекции полиморфизма V600 в гене BRAF, который представляет собой следующий флуоресцентно меченый олигонуклеотид Р1:
(Р1) олигонуклеотид, который, по меньшей мере, на 80% гомологичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1, где основание, соответствующее основанию 237, представляет собой цитозин, меченный флуоресцентным красителем, причем олигонуклеотид распознает полиморфизм, по меньшей мере, в одном из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1 при условии, что олигонуклеотид отличается от указанного в SEQ ID NO:7 или 19.
Способ определения полиморфизма V600 в гене BRAF по настоящему изобретению представляет собой способ, который включает детекцию полиморфизма в гене BRAF, используя, по меньшей мере, один зонд для детекции полиморфизма V600 в гене BRAF, описанный выше.
Способ оценки эффективности лекарственного средства по настоящему изобретению представляет собой способ, который включает детекцию полиморфизма V600 в гене BRAF с помощью вышеописанного способа детекции полиморфизма V600 в гене BRAF и оценку (например, определение или прогноз) толерантности в отношении лекарственного средства или эффективности лекарственного средства, исходя из детектированного наличия или отсутствия полиморфизма.
Набор реагентов для определения полиморфизма по настоящему изобретению представляет собой набор, который включает зонд для детекции полиморфизма V600 в гене BRAF.
«Ген BRAF» в настоящем изобретении уже известен, и его последовательность оснований доступна под номером доступа NCBI № NG007873.
В настоящем изобретении последовательность оснований SEQ ID NO:1 соответствует основаниям 176201-176700 последовательности под номером доступа NCBI NG007873, и она составлена номерами оснований 1-500, таким образом, что номер оснований 1 соответствует 176201 последовательности оснований под номером доступа NCBI NG007873.
В настоящем изобретении, если не указано другого, описание последовательностей оснований, детектируемой нуклеиновой кислоты образца в образце и зонда или праймера для детекции полиморфизма также должно применяться для комплементарных им последовательностей оснований, соответственно. Кроме того, при использовании описания определенной последовательности оснований для комплементарной ей последовательности оснований по настоящему изобретению должны быть использованы описания последовательностей оснований, распознаваемых определенной последовательностью оснований, при условии, что распознавание определенной последовательностью оснований заменяют на распознавание комплементарной последовательностью оснований определенной последовательности оснований в диапазоне общеизвестных технических сведений специалистов в данной области.
По настоящему изобретению термин «величина Tm» определяется как температура, при которой двухцепочечная нуклеиновая кислота диссоциирует (температура диссоциации: Tm), и, как правило, определяется как температура, при которой оптическая плотность при 260 нм повысилась на 50% от общего повышения оптической плотности, получаемого при полной диссоциации двухцепочечной нуклеиновой кислоты. Конкретнее, при нагреве раствора, содержащего двухцепочечную нуклеиновую кислоту, такую как двухцепочечная ДНК, оптическая плотность при 260 нм двухцепочечной нуклеиновой кислоты постепенно возрастает. Это происходит потому, что при нагреве разрываются водородные связи между обеими цепями двухцепочечной ДНК, таким образом, разделяя двухцепочечную ДНК на одноцепочечные ДНК (плавление ДНК). При полной диссоциации двухцепочечной ДНК до одноцепочечной ДНК у одноцепочечной ДНК наблюдается оптическая плотность, которая в около 1,5 раз выше оптической плотности при начале нагрева (т.е. оптической плотности, когда вся ДНК существует в форме двухцепочечной ДНК), что служит индикатором завершения плавления. Величина Tm определяется, исходя из этого явления.
В настоящем описании рамки термина «процесс» или «стадия» включают не только отдельный процесс/стадию, но также процесс/стадию, которые не могут быть четко отграничены от другого процесса/стадии при условии достижения ожидаемого эффекта интересующего процесса/стадии.
В настоящем описании любой числовой диапазон, выраженный, используя «до» относится к диапазону, включающему численные значения до и после «до» как минимальные и максимальные величины, соответственно.
При указании в настоящем изобретении количества компонента, который может быть включен в композицию, когда существует большое число веществ, соответствующих компоненту в композиции, если другое не оговорено, указанное количество означает общее количество большого числа веществ, присутствующих в композиции.
В настоящем изобретении при использовании фразы «основания 1-3 с 3’-конца» в сочетании с олигонуклеотидной последовательностью полагают, что основание на 3’-конце олигонуклеотидной цепи представляет собой первое основание с 3’-конца.
Настоящее изобретение описывается ниже.
<Зонд для детекции полиморфизма V600 в гене BRAF>
Зонд для детекции полиморфизма V600 в гене BRAF по настоящему изобретению (далее в настоящем документе для краткости обозначаемый как «зонд для детекции полиморфизма») представляет собой зонд для детекции полиморфизма V600 в гене BRAF, который представляет собой следующий флуоресцентно меченый олигонуклеотид Р1:
(Р1) олигонуклеотид, который, по меньшей мере, на 80% гомологичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1, где основание, соответствующее основанию 237, представляет собой цитозин, меченый флуоресцентным красителем, причем олигонуклеотид распознает полиморфизм, по меньшей мере, в одном из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1, при условии, что олигонуклеотид отличается от указанного в SEQ ID NO:7 или 19.
Вышеописанный флуоресцентно меченый олигонуклеотид Р1 по настоящему изобретению представляет собой зонд, способный идентифицировать полиморфизм, по меньшей мере, одного основания, выбранного из группы, состоящего из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1.
Конкретнее, вышеописанный флуоресцентно меченый олигонуклеотид Р1 по настоящему изобретению представляет собой последовательность, которая включает основания, соответствующие основаниям 228-237 последовательности оснований, указанной в SEQ ID NO:1.
Помимо условия, что основание, соответствующее основанию 237 последовательности оснований, указанной в SEQ ID NO:1, представляет собой цитозин (С), флуоресцентно меченый олигонуклеотид Р1 по настоящему изобретению должен быть, по меньшей мере, на 80% гомологичен последовательности оснований длиной от 10 до 50 оснований, включающей основания 228-237 последовательности оснований, указанной в SEQ ID NO:1. Здесь отмечается, что «последовательность оснований длиной от 10 до 50 оснований, включающая основания 228-237 последовательности оснований, указанной в SEQ ID NO:1» далее в настоящем документе может обозначаться как «специфическая определенная последовательность оснований» и указанные от 10 до 50 оснований представляют собой непрерывные основания SEQ ID NO:1, которые включают основания 228-237 последовательности оснований.
Из соображений чувствительности детекции, у такого флуоресцентно меченного олигонуклеотида также может наблюдаться гомология не меньше чем 85%, не меньше чем 90%, не меньше чем 95%, не меньше чем 96%, не меньше чем 97%, не меньше чем 98% или не меньше чем 99%.
При гомологии между вышеописанным флуоресцентно меченым олигонуклеотидом Р1 по настоящему изобретению и последовательностью оснований с такими же основаниями как в SEQ ID NO:1, за исключением того, что основание, соответствующее основанию 237, представляет собой С (цитозин), меньше чем 80% чувствительность детекции нуклеиновой кислоты образца, содержащей ген BRAF мутантного типа, становится низкой.
Альтернативно, вышеописанный флуоресцентно меченый олигонуклеотид Р1 по настоящему изобретению также может представлять собой олигонуклеотид (Р1’), по меньшей мере, на 80% гомологичный вышеописанной специфической определенной последовательности оснований, в котором основание, соответствующее основанию 237, представляет собой цитозин; по меньшей мере, два основания, соответствующих основаниям 228-230 последовательности оснований, указанной в SEQ ID NO:1, отличаются от указанных в SEQ ID NO:1; и вышеописанный цитозин, соответствующий основанию 237, метят флуоресцентным красителем.
При условии, что в олигонуклеотиде, по меньшей мере, два из оснований 228-230 последовательности оснований, указанной в SEQ ID NO:1, отличаются от указанных в SEQ ID NO:1, флуоресцентно меченый олигонуклеотид Р1’ имеет тенденцию к повышенной чувствительности детекции нуклеиновой кислоты образца, содержащей ген BRAF мутантного типа.
Если, по меньшей мере, два основания, соответствующие основаниям 228-230 последовательности оснований, указанной в SEQ ID NO:1, отличаются от оснований в SEQ ID NO:1, то, по меньшей мере, два основания могут представлять собой, например, два или больше оснований, выбранных из группы, состоящей из следующего списка:
(1) основание, соответствующее основанию 228 последовательности оснований, указанной в SEQ ID NO:1, который представляет собой гуанин или аденин;
(2) основание, соответствующее 229 последовательности оснований, указанной в SEQ ID NO:1, который представляет собой аденин или гуанин; и
(3) основание, соответствующее 230 последовательности оснований, указанной в SEQ ID NO:1, который представляет собой гуанин или тимин.
Далее, в качестве конкретной комбинации, по меньшей мере, двух оснований, к примерам этого относятся случаи, когда основания, соответствующие основаниям 228, 229 и 230, представляют собой, соответственно, аденин, аденин и гуанин; аденин, аденин и тимин; аденин, гуанин и тимин; аденин, гуанин и гуанин; гуанин, аденин и тимин; и гуанин, гуанин и тимин.
Из соображений одновременной детекции двух или больше оснований, в качестве комбинации, по меньшей мере, двух оснований, соответствующие основаниям 228, 229 и 230 могут представлять собой, соответственно, аденин, аденин и гуанин; аденин, гуанин и гуанин; или гуанин, аденин и тимин.
Далее, вышеописанный флуоресцентно меченый олигонуклеотид Р1 или Р1’ по настоящему изобретению также может представлять собой флуоресцентно меченый олигонуклеотид, где основание, соответствующее основанию 228 последовательности оснований, указанной в SEQ ID NO:1, представляет собой гуанин или аденин; основание, соответствующее основанию 229 последовательности оснований, указанной в SEQ ID NO:1, представляет собой аденин или гуанин; и основание, соответствующее основанию 230 последовательности оснований, указанной в SEQ ID NO:1, представляет собой гуанин или тимин.
У такого флуоресцентно меченого олигонуклеотида наблюдается заметное отличие в величине Tm между диким типом и мутантным типом; поэтому тест с использованием флуоресцентно меченого олигонуклеотида будет точно идентифицировать мутацию и, таким образом, является высоконадежным и может определять мутацию в образце с высокой чувствительностью.
По настоящему изобретению вышеописанный флуоресцентно меченый олигонуклеотид Р1 или Р1’ также охватывает флуоресцентно меченый олигонуклеотид, который гибридизуется в жестких условиях с комплементарной цепью последовательности оснований с такими же основаниями, как вышеописанная специфическая определенная последовательность оснований, за исключением того, что основание, соответствующее основанию 237, представляет собой С (цитозин).
Гибридизация может быть осуществлена (в жестких условиях) согласно известному способу или способу, соответствующему таковому, такому как способ, описанный в руководстве Molecular Cloning 3rd (J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001). Этот документ приводится в настоящем документе в качестве ссылки.
Под термином «жесткие условия» понимают условия, при которых образуются специфические гибриды, а неспецифические гибриды не образуются. К характерным примерам жестких условий относятся, например, условия, при которых гибридизацию осуществляют при концентрации калия от около 25 мМ (например, 25 мМ) до около 50 мМ (например, 50 мМ) и концентрации магния от около 1,0 мМ (например, 1,0 мМ) до около 5,0 мМ (например, 5,0 мМ). Одним из примеров условий по настоящему изобретению являются условия, при которых гибридизацию осуществляют в растворе трис-HCl (pH 8,6), 25 мМ KCl и 1,5 мМ MgCl2, но примеры условий по настоящему изобретению этими не ограничиваются. Другие примеры жестких условий описаны в руководстве Molecular Cloning 3rd (J. Sambrook et al., Cold Spring Harbor Lab. Press, 2001). Этот документ приводится в настоящем документе в качестве ссылки. Специалист в данной области может без труда выбрать такие условия, изменяя реакцию гибридизации и/или концентрацию солей раствора для проведения реакции гибридизации.
Более того, флуоресцентно меченые олигонуклеотиды Р1 и Р1’ по настоящему изобретению охватывают флуоресцентно меченый олигонуклеотид с последовательностью, в которой основание(я) вставлено(ы), удалено(ы) и/или замещено(ы) в флуоресцентно меченых олигонуклеотидах Р1 или Р1’.
Флуоресцентно меченый олигонуклеотид с последовательностью, в которой основание(я) вставлено(ы), удалено(ы) и/или замещено(ы), не ограничивается особым образом при условии, что у олигонуклеотида наблюдается эффект, аналогичный таковому у флуоресцентно меченных олигонуклеотидов Р1 или Р1’; и в случаях вставки, делеции и/или замены основания(ий) позиция(и) вставки(ок), делеции(й) и/или замены(н) не ограничивает(ют)ся особым образом. Количество оснований, которые вставили, удалили и/или заместили, может составлять, например, 1 основание или 2 или больше оснований, как например, от 1 основания до 10 оснований и от 1 основания до 5 оснований, хотя это может меняться в зависимости от полной длины флуоресцентно меченного олигонуклеотида.
Среди этих флуоресцентно меченых олигонуклеотидов, имеющих последовательность, в которой основание(я) вставлено(ы), удалено(ы) и/или замещено(ы), описанное выше флуоресцентно меченый олигонуклеотид Р1 или Р1’ по настоящему изобретению может представлять собой, например, олигонуклеотид, имеющий последовательность, в которой основание(я) замещено(ы). Позиция замены не ограничивается особым образом. Из соображений чувствительности детекции, например, может быть замещено основание, которое отличается от оснований 231-237 последовательности, указанной в SEQ ID NO:1. Количество оснований, которые замещаются, может составлять, например, 1 основание или 2 или больше оснований. Несмотря на то, что количество оснований, которые замещаются, изменяется в зависимости от полной длины флуоресцентно меченого олигонуклеотида, оно составляет, например, от 1 до 5 оснований или от 1 до 3 оснований.
Олигонуклеотиды в вышеописанных флуоресцентно меченых олигонуклеотидах также охватывают олигонуклеотиды, а также модифицированные олигонуклеотиды.
К примерам структурной единицы вышеописанного олигонуклеотида относятся рибонуклеотиды, дезоксирибонуклеотиды и искусственные нуклеиновые кислоты. К примерам искусственных нуклеиновых кислот относятся ДНК, РНК, LNA (замкнутые нуклеиновые кислоты), которые представляют собой аналоги РНК, PNA (пептидные нуклеиновые кислоты), которые представляют собой пептидные нуклеиновые кислоты, BNA (мостиковые нуклеиновые кислоты), которые представляют собой перекрестно-связанные нуклеиновые кислоты и подобное.
Вышеописанные олигонуклеотиды могут быть составлены одним или большим числом типов структурных единиц, описанных выше.
Необходимо, чтобы вышеописанные флуоресцентно меченые олигонуклеотиды Р1 и Р1’ по настоящему изобретению были в длину 10-50-мерами. При длине флуоресцентно меченых олигонуклеотидов Р1 и Р1’ короче, чем 10 или длиннее, чем 50 оснований чувствительность детекции полиморфизма с гене BRAF снижается.
Далее, флуоресцентно меченые олигонуклеотиды Р1 и Р1’ по настоящему изобретению могут быть в длину 10-50-мерными, 10-40-мерными или 10-30-мерными. При длине в диапазоне от 10-мера до 50-мера, например, чувствительность детекции будет увеличиваться.
При изменении длины оснований флуоресцентно меченых олигонуклеотидов Р1 и Р1’ величина Tm, которая представляет собой температуру диссоциации гибрида, образованного между флуоресцентно мечеными олигонуклеотидами и соответствующими им комплементарными цепями (последовательностями-мишенями), может быть доведена до желаемой величины.
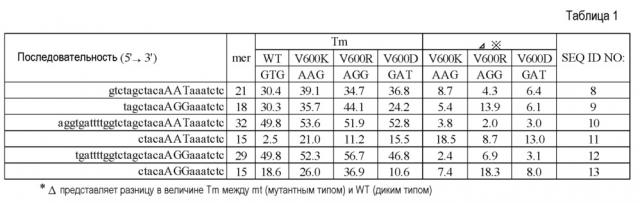
Примеры последовательности оснований флуоресцентно меченого олигонуклеотида Р1 или Р1’ по настоящему изобретению представлены в таблице 1 ниже, но настоящее изобретение ими не ограничивается.
В настоящем документе отмечается, что в таблице 1 каждый из оснований, соответствующих основаниям 228-230 последовательности оснований, представленной в SEQ ID NO:1, указан с большой буквы. Кроме того, в таблице 1 также представлены величины Tm гибридов, которые образуются между каждым флуоресцентно меченным олигонуклеотидом и олигонуклеотидом, в котором основания, соответствующие основаниям 228, 229 и 230 SEQ ID NO:1, представляют собой, соответственно, аденин, аденин и гуанин; аденин, гуанин и гуанин; или гуанин, аденин и тимин.
Величины Tm рассчитывали, используя программное обеспечение MeltCalc© 99 FREE (http://www.meltcalc.com/), и при сочетании условий: концентрация олигонуклеотидов в [мкМ] 0,2 и равновесная концентрация Na в [мМ] 50.
По настоящему изобретению разница между величиной Tm, измеренной при гибридизации вышеописанного флуоресцентно меченного олигонуклеотида Р1 или Р1’ с ДНК, имеющей последовательность оснований, комплементарную таковому, (Tm (V600K, V600R или V600D) в таблице 1) и величиной Tm, измеренной при гибридизации последовательности оснований, соответствующей основаниям 228-230 последовательности оснований, указанной в SEQ ID NO:1, с ДНК, имеющей последовательность, комплементарную таковой, (Tm (WT) в таблице 1) составляет, например, не меньше чем 3°С. Если вышеописанная разница в величине Tm составляет 3°С или больше, например, мутация в основаниях 228-230 последовательности оснований, указанной в SEQ ID NO:1, может быть идентифицирована с более высокой чувствительностью.
Кроме того, вышеописанная разница в величине Tm может составлять, например, не меньше чем 3°С, не меньше чем 5°С или не меньше чем 7°С.
К примерам способа увеличения разницы в величине Tm относится способ, в котором зонд содержит основание, которое не комплементарно последовательности оснований, соответствующей области, с которым зонд гибридизуется. К конкретным примерам относятся способы, описанные в статье Nature Biotech (1997) vol. 15, pp. 331-335 и подобные.
Кроме того, флуоресцентно меченный олигонуклеотид Р1 или Р1’ по настоящему изобретению необходимо пометить флуоресцентным красителем на его основании, соответствующем основанию 237 (цитозину).
В флуоресцентно меченном олигонуклеотиде Р1 или Р1’ флуоресцентно меченое основание, соответствующий основанию 237, может находиться в любой из положений 1-3 с 3’-конца флуоресцентно меченного олигонуклеотида Р1 или Р1’. Альтернативно, флуоресцентно меченое основание может находиться на 3’-конце флуоресцентно меченного олигонуклеотида Р1 или Р1’. Таким образом, например, чувствительность детекции полиморфизма дополнительно улучшается. Кроме того, флуоресцентно меченный олигонуклеотид Р1 или Р1’ может быть получен с хорошей производительностью (или эффективностью).
Вышеописанный флуоресцентно меченый олигонуклеотид по настоящему изобретению может представлять собой флуоресцентно меченый олигонуклеотид, в котором интенсивность флуоресценции во время гибридизации олигонуклеотида с последовательностью, включающей основания 228-230 последовательности оснований, указанной в SEQ ID NO:1, (последовательностью-мишенью) снижается (гасится) или возрастает по сравнению с интенсивностью флуоресценции при отсутствии гибридизации олигонуклеотида с последовательностью-мишенью. В частности, флуоресцентно меченый олигонуклеотид по настоящему изобретению может представлять собой флуоресцентно меченный олигонуклеотид, в котором интенсивность флуоресценции во время гибридизации олигонуклеотида со своей последовательностью-мишенью снижается по сравнению с интенсивностью флуоресценции при отсутствии гибридизации олигонуклеотида со своей последовательностью-мишенью.
Зонд, в котором используется «явление гашения флуоресценции», описанное выше, как правило, обозначают как гуаниновый зонд гашения и он известен как ЗОНД Q®. Среди таких зондов особенно предпочтителен олигонуклеотид, который создали так, чтобы его 3’ или 5’-конец представлял собой цитозин (С) и который пометили флуоресцентным красителем так, чтобы снизить излучение флуоресценции, когда С на 3’ или 5’-конце приближается к гуанину (G). При использовании такого зонда гибридизация и диссоциация зонда может быть без труда зарегистрирована за счет изменения его сигнала.
Также может быть применен известный способ детекции, отличный от способа детекции с использованием ЗОНДА Q®. К примерам такого способа детекции относятся способ с зондом TAQ-MAN, способ с зондом для гибридизации, способ с молекулярным маяком и способ с зондом MGB.
Флуоресцентный краситель не ограничивается особым образом, и к примерам флуоресцентного красителя относятся флуоресцеин, фосфор, родамин и полиметиновые красители. К примерам коммерчески доступных продуктов таких флуоресцентных красителей относятся Pacific Blue, BODIPY FL, FluorePrime, Fluoredite, FAM, Cy3 и Cy5 и TAMRA.
Условия детекции флуоресцентно меченого олигонуклеотида особо не ограничиваются и могут быть выбраны должным образом в соответствии с используемым флуоресцентным красителем. Например, Pacific Blue может быть определен при длине волны для детекции от 445 нм до 480 нм, TAMRA может быть определен при длине волны для детекции от 585 нм до 700 нм, и BODIPY FL может быть определен при длине волны для детекции от 520 нм до 555 нм.
При использовании зонда, имеющего такой флуоресцентный краситель, гибридизация и диссоциация зонда может быть без труда подтверждена, исходя из изменения его флуоресцентного сигнала. Присоединение флуоресцентного красителя к олигонуклеотиду может быть осуществлено согласно принятому способу, такому как способ, описанный в JP-A № 2002-119291.
Необходимо отметить, что по настоящему изобретению для мечения одного или нескольких олигонуклеотидов может быть использован один и тот же флуоресцентный краситель или альтернативно могут быть использованы различные флуоресцентные красители.
Кроме того, флуоресцентно меченый олигонуклеотид может иметь, например, фосфатную группу, добавленную к его 3’-концу. Добавление фосфатной группы к 3’-концу флуоресцентно меченного олигонуклеотида супрессирует элонгацию самого зонда при реакции амплификации гена. Как описано ниже, ДНК, в которой необходимо определить наличие или отсутствие мутации, (ДНК-мишень) может быть получена, используя способ генной амплификации, такой как ПЦР. При использовании флуоресцентно меченого олигонуклеотида, который имеет фосфатную группу, добавленную к его 3’-концу, реакция амплификации может быть осуществлена даже при наличии олигонуклеотида в реакционном растворе для проведения реакции амплификации.
Подобный эффект может быть получен также путем добавления к 3’-концу вещества-метки (флуоресцентного красителя), описанного выше.
Ниже представлены конкретные примеры олигонуклеотида, имеющего описанную выше последовательность оснований, в которой С на 3’-конце метят флуоресцентным красителем (Основания, указанные с большой буквы, представляют позиции мутации, и “(PB)”, “(FL)” и “(TAMRA)” соответствуют соответствующим флуоресцентным красителям, описанным выше). Тем не менее, флуоресцентно меченый олигонуклеотид по настоящему изобретению не ограничивается следующими олигонуклеотидами.
Описанные выше флуоресцентно меченные олигонуклеотиды Р1 и Р1’ могут быть использованы в качестве зонда для детекции полиморфизма V600 в гене BRAF.
Кроме того, описанные выше флуоресцентно меченные олигонуклеотиды Р1 и Р1’ могут быть использованы в качестве зонда для анализа графика плавления.
Кроме того, описанные выше флуоресцентно меченные олигонуклеотиды Р1 и Р1’ также могут быть использованы в реагенте для детекции полиморфизма. При этом реагент для детекции полиморфизма по настоящему изобретению способен без труда с высокой чувствительностью идентифицировать полиморфизм в основаниях, соответствующих основаниям 228-230 последовательности оснований, указанной в SEQ ID NO:1.
Флуоресцентно меченный олигонуклеотид Р1 и Р1’ по настоящему изобретению может быть получен согласно принятому способу, известному как способ синтеза олигонуклеотида, такому как способ, описанный в JP-A № 2002-119291, за исключением того, что основания используют таким образом, чтобы основание, соответствующее основанию 237 в последовательности оснований, указанной в SEQ ID NO:1, представлял собой цитозин и основание, соответствующее основанию 237, метят флуоресцентным красителем.
<Праймер>
В описанном ниже способе детекции полиморфизма в гене BRAF для амплификации последовательности, имеющей полиморфизм в гене BRAF, определяемый способом ПЦР, используют праймеры.
Праймеры, которые могут быть использованы по настоящему изобретению, особо не ограничиваются при условии, что они способны амплифицировать нуклеиновую кислоту, содержащую основания, соответствующие основаниям 228-230 последовательности оснований, указанной в SEQ ID NO:1, которая представляет собой сайт детектируемого полиморфизма в гене BRAF.
Праймер, используемый в способе ПЦР, особо не ограничивается при условии, что он способен амплифицировать область, с которым может быть гибридизован зонд по настоящему изобретению. Такой праймер может быть создан специалистом в данной области на основе последовательн