Способ молекулярно-генетической детекции устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда (фторхинолонам, аминогликозидам и капреомицину)
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и медицине. Предложены способ определения устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда - фторхинолонам, аминогликозидам и капреомицину, наборы зондов детекции и праймеров амплификации и применение способа для подтверждения клинического диагноза туберкулеза с широкой лекарственной устойчивостью. Способ включает одновременную детекцию мутаций в ДНК микобактерий туберкулеза биологического образца, приводящих к устойчивости микроорганизмов к противотуберкулезным препаратам второго ряда в участках гена gyrA (кодоны 89, 90, 91, 94), гена gyrB (кодоны 538, 539, 540), гена rrs (позиции 1401, 514, 517) и промоторной области eis (позиции -10, -12, -37), посредством МПЦР в режиме реального времени с использованием праймеров для амплификации и зондов детекции, комплементарных указанным участкам генов. Способ обеспечивает одновременное и быстрое определение устойчивости микобактерий туберкулеза к препаратам второго ряда и может быть использован в диагностике туберкулеза с широкой лекарственной устойчивостью. 4 н. и 7 з.п. ф-лы, 5 табл., 3 пр.
Реферат
Область техники, к которой относится изобретения
Предлагаемая модель относится к области медицины, в частности к области лечения туберкулеза, и касается способа детекции мутаций на основе технологии мультиплексной ПЦР в режиме реального времени для экспресс-определения устойчивости микобактерий туберкулеза (МБТ) в биологических образцах к противотуберкулезным препаратам второго ряда, таким как фторхинолоны (офлоксацин, моксифлоксацин) и инъекционные противотуберкулезные препараты резервного ряда (канамицин, амикацин и капреомицин) (далее - препараты второго ряда).
Предпосылки изобретения
Туберкулез является одной из наиболее существенных проблем глобальной безопасности в области здравоохранения. Несмотря на общую тенденцию снижения заболеваемости туберкулезом, доля туберкулеза в структуре смертности населения России от инфекционных и паразитарных болезней остается основной, и составляет около 56,0% по данным на 2012 г. (Нечаева О.Б., Бирагова O.K. 2013 Эпидемическая ситуация по туберкулезу в Российской Федерации [Электронный ресурс]. URL:http://vestnik.mednet.ru/content/view/514/30/lang,ru/ (дата обращения 26.11.2015)).
В последнее время возникла угроза распространения крайне опасной формы туберкулеза - туберкулеза с устойчивостью к противотуберкулезным препаратам (ПТП), таким как рифампицин и изониазид, известной как туберкулез с множественной лекарственной устойчивостью (МБТ МЛУ) (WHO. Global Tuberculosis Control, 2011). Эпидемиологическая ситуация еще более усугубляется распространением туберкулеза с широкой лекарственной устойчивостью (ШЛУ), т.е. сочетанием МЛУ с устойчивостью, по крайней мере, к одному из препаратов фторхинолонового ряда и одному из инъекционных ПТП резервного ряда (канамицин, амикацин и капреомицин). Ежегодно в мире регистрируется более 30000 новых ШЛУ случаев. Более того, появились данные о случаях абсолютно устойчивого туберкулеза, т.е. формы, устойчивой ко всем существующим на сегодняшний день противотуберкулезным препаратам (Fattorini L., Migliori G.B., Cassone А. 2007. Extensively drug-resistant (XDR) tuberculosis: an old and new threat. - Ann. Ist. Super. Sanita, 43 (4), p. 317-319; Haydel S.E. 2010. Extensively Drug-Resistant Tuberculosis: A Sign of the Times and an impetus for Antimicrobial Discovery. - NIH Public Access Author Manuscript. Pharmaceuticals (Basel), V. 3 (7), p. 2268-2290).
Основной причиной ухудшения эпидемиологической обстановки по туберкулезу, устойчивому к ПТП, является широкая географическая распространенность высоковирулентных и высокотрансмиссивных лекарственно-устойчивых штаммов М. Tuberculosis генотипов Beijing (Lopez В. et al. 2003 A marked difference in pathogenesis and immune response induced by different Mycobacterium tuberculosis genotypes. Clin Exp Immunol. 2003 Jul; 133(l):30-7; Нарвская О.В., Мокроусов И.В., Лимещенко Е.В. и др. Молекулярная эпидемиология туберкулеза // БЦЖ. - 2000. №7-8. - С. 4-6; Нарвская О.В., Мокроусов И.В., Лимещенко Е.В. и др. Молекулярно-генетическая характеристика микобактерий туберкулеза, выделенных в Северо-Западном регионе России // Туберкулез сегодня: проблемы и перспективы. М., 2000. - С. 210-21).
Туберкулез с МЛУ и ШЛУ плохо поддается лечению существующими ПТП, для лечения требуется проведение длительной (18-24 месяца) комплексной дорогостоящей терапии, вызывающей серьезные побочные эффекты (Haydel S.E. Extensively Drug-Resistant Tuberculosis: A Sign of the Times and an Impetus for Antimicrobial Discovery. Pharmaceuticals (Basel). 2010 Jul 1; 3 (7): 2268-2290). Набор препаратов выбора в случае лекарственно-устойчивого туберкулеза существенно ограничен, поэтому особенно актуальна быстрая и точная диагностика чувствительности МБТ к ПТП, в частности к препаратам резервного ряда. Кроме того, лечение ШЛУ туберкулеза крайне длительно и дорогостояще.
Таким образом, проблема устойчивости МБТ к лекарственным препаратам создает большую угрозу для борьбы с туберкулезом и остается предметом серьезной озабоченности в отношении глобальной безопасности в области здравоохранения.
Анализ лекарственной устойчивости МБТ в основном проводится методами культивирования с антибиотиками на плотной и/или жидкой питательной среде. Проведение анализа на лекарственную устойчивость МБТ данными методами крайне длительно, и занимает от 1 до 3 месяцев от начала исследования диагностического материала и до лечения больного. При этом анализ устойчивости к препаратам второго ряда возможен только в крайне ограниченном числе лабораторий.
Основными препаратами выбора при лечении МЛУ-МБТ являются препараты фторхинолонового ряда, такие как: офлоксацин, моксифлоксацин, левофлоксацин и другие, которые показали высокую активность в отношении микобактерий туберкулезного комплекса с МЛУ [Chan E.D et al. Treatment and outcome analysis of 205 patients with multidrug-resistant tuberculosis // AJRCCM. - 2004. - p. 26].
По литературным данным отмечены случаи первичной устойчивости МБТ к препаратам фторхинолоного рада [Delgado М.В., Telenti A. In: Selected PCR protocols for Emerging Infectious Diseases / Persing D.H, ed., Washington, 1996], что подчеркивает актуальность своевременного определения резистентности МБТ к данной группе препаратов, особенно до начала лечения.
Мишенью действия фторхинолонов в МБТ является АТФ-зависимая ДНК-топоизомераза II типа (ДНК-гираза), которая катализирует образование суперспирали ДНК [Blanchard J.S. Molecular mechanisms of drug resistance in Mycobacterium tuberculosis // Annu. Rev. Biochem. - 1996. - V. 65. - P. 215-239], и состоит из двух субъединиц GyrA и двух субъединиц GyrB [Chen FJ, Lo HJ (2003) Molecular mechanisms of fluoroquinolone resistance. J Microbiol Immunol Infect 36: 1-9.]. Мутации в участке гена gyrA, ограниченного кодонами 88 и 94, который обусловливает резистентность МБТ к фторхинолонам (главным образом, к офлоксацину и моксифлоксацину) в 64%-79% штаммов МБТ Пекинского происхождения. Превалирующими мутациями, вызывающими кросс-резистентность к фторхинолонам, являются замены в кодоне 94G и 90V гена gyrA [Maruri F et al. 2012 [Электронный ресурс]. URL:http://www.ncbi.nlm.nih.gov/pubmed/22279180 (дата обращения 26.11.2015), Singh Р et al. 2015 [Электронный ресурс]. URL:http://www.ncbi.nlm.nih.gov/pubmed/25052485/ (дата обращения 26.11.2015); Willby М. et al. 2015 Correlation between GyrA mutations and ofloxacin, levofloxacin and moxifloxacin cross-resistance in Mycobacterium tuberculosis]. Ген gyrA содержит также нейтральный полиморфизм в кодоне 95. По данным секвенирования замена в кодоне 95 обуславливает кодирование либо серина (AGC) в штаммах M. tuberculosis H37Rv и H37Ra, либо треонина (АСС) в M. tuberculosis Beiging, Erdman, M. bovis BCG, M. africanum. Однако данные замены не связаны с резистентностью к фторхинолонам [Takiff Н.Е et al. Cloning and nucleotide sequence of Mycobacterium tuberculosis gyrA and gyrB genes and detected of quinolone resistance mutations // Antimicrob. Agents a Chemotherapy. - 1994. - V. 38. - р. 773-780]. Следовательно детекция данного полиморфизма S95T предложенная в некоторых диагностикумах, например, в биочипах [Zimenkov D. et al. 2013 Detection of second-line drug resistance in Mycobacterium tuberculosis using oligonucleotide microarrays] может приводить к ложноположительным результатам.
Мутации в гене gyrB встречаются в 5-10% фторхинолон-устойчивых штаммов, причем только три мутации в кодонах N538D, T539N, E540V, определяют устойчивость микобактерий туберкулеза ко всем фторхинолонам [13. Singh Р et al. 2015, 16. S. Malik et al. 2012 [Электронный ресурс]. URL:http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0039754 (дата обращения 26.11.2015)].
Также известно о механизме развития устойчивости МБТ к инъекционным противотуберкулезным препаратам (канамицин, амикацин и капреомицин) через возникновение мутации в рибосомальном гене 16S-pPHK (rrs) в позициях 1401, 514 и 517 (16.S. Georghiou et al. 2012 Evaluation of Genetic Mutations Associated with Mycobacterium tuberculosis Resistance to Amikacin, Kanamycin and Capreomycin: A Systematic Review. PLoS One. 2012; 7(3): e33275).
Замена A1401G в гене rrs наиболее часто встречается в канамицин-устойчивых штаммах, и приводит к наиболее высокому уровню устойчивости к канамицину с минимальной ингибирующей концентрацией (MIC) ≥80 мкг/мл и кросс-резистентности к амикацину и капреомицину (17. Maus СЕ, Plikaytis ВВ, Shinnick ТМ. Molecular analysis of cross-resistance to capreomycin, kanamycin, amikacin, and viomycin in Mycobacterium tuberculosis. Antimicrob Agents Chemother. 2005 Aug; 49 (8): 3192-3197). Данная мутация является наиболее диагностически значимой, т.к. была обнаружена в более чем 84% Пекинских штаммах МБТ, устойчивых к канамицину (KAN). Кроме того, мутация A1401G также приводит к кросс-устойчивости к амикацину и капреомицину в приблизительно около 50% устойчивых к АМК и САР штаммах. [Электронный ресурс]. URL:(http://www.ncbi.nlm.nih.gov/pubmed/23948547 (дата обращения 26.11.2015). Мутации устойчивости к канамицину и амикацину в позициях 514 и 517 гена rrs являются более редкими, и были выявлены в основном в штаммах МБТ непекинского происхождения.
Влияние мутаций в промоторной области гена eis на развитие устойчивости МБТ к невысоким дозам канамицина было показано М.А. Zaunbrecher и соавт. в 2009 году (Zaunbrecher MA, Sikes RD Jr, Metchock В et al. Overexpression of the chromosomally encoded aminoglycoside acetyltransferase eis confers kanamycin resistance in Mycobacterium tuberculosis. Proc Natl Acad Sci USA. 2009 Nov 24; 106 (47): 20004-20009 [Электронный ресурс]. URL:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2785282/ (дата обращения 26.11.2015). Ген eis кодирует ацетилтрансферазу Eis, которая специфически ацетилирует канамицин и амикацин, однако скорость ацетилирования канамицина значительно выше, что объясняет отсутствие перекрестной устойчивости к амикацину у штаммов с мутациями в промоторной области гена eis. Появление мутаций в промоторной области гена приводит к многократному увеличению его экспрессии и, следовательно, к накоплению фермента и нарастанию его эффекта, т.е., в конечном счете, к инактивации антибиотика.
Встречаемость мутаций в позициях -10, -12 и -14 промоторной области eis в канамицин-устойчивых штаммах оценивается в некоторых работах не выше 10% [M. Gicalo et al. 2012 [Электронный ресурс]. URL:http://jac.oxfordjoumals.org/content/67/9/2107.long (дата обращения 26.11.2015)]. Мутация в позиции -37 гена eis была обнаружена в некоторых штаммах МБТ, однако диагностическая значимость данной мутации устойчивости к канамицину ранее не обсуждалось [Casali N. et al. 2012]. По нашим данным мутация -37 гена eis встречается с частотой более 8% только в канамицин-устойчивых штаммах ШЛУ Пекинского происхождения, не несущих другие мутации в гене eis или мутацию 1401 гена rrs. Следовательно, мутация -37 гена eis является независимым маркером устойчивости к канамицину.
Таким образом, детекция мутаций устойчивости в гене eis может повысить общую выявляемость устойчивости к канамицину в штаммах ШЛУ с текущих 58-63% до 82-87%.
Определение известных, в основном, точковых мутаций, ассоциированных с устойчивостью к фторхинолонам и препаратам резервного ряда (канамицин, амикацин и капреомицин), методами молекулярно-генетической детекции и анализа в состоянии обеспечить экспресс-диагностику устойчивости МБТ к ПТП.
Существующие молекулярно-генетические методы определения устойчивости или чувствительности МБТ к конкретным ПТП основаны на детекции известных мутаций в генах МБТ методом ПЦР-амплификации, в частности ПЦР-амплификацией в режиме реального времени. ПЦР-амплификацией нарабатывается необходимое количество копий исследуемой ДНК, после чего мутации детектируют с помощью одного из таких методов детекции, как: мультиплексный ПЦР-анализ с гибридизационными зондами, аллель-специфический ПЦР-анализ, гибридизация на чипах или стрипах, анализ по кривым плавления, конформационный анализ одноцепочечных фрагментов в денатурирующим градиентным гель-электрофорезом и др. (Victor Т.С, Jordan A.M. Detection of mutation in drug resistance genes of M. tuberculosis by a dot-blot hibridization strategy // Int. J. Tubercle and Lung Disease. - 1999. - V. 2. - P. 346-349; 23. Ramaswamy S, Musser J. Molecular genetic basis of antimicrobial agent resistance in M. tuberculosis // Tubercle and Lung Disease. - 1998 - V. 79 - P. 3-29). Сейчас все перечисленные методы, за исключением ПЦР-анализа, наряду с преимуществами обладают общим недостатком, который заключается в применении их только для научно-исследовательских целей и в условиях высококвалифицированных и оснащенных лабораторий. По той же причине в практику молекулярно-генетической диагностики по определению мутаций устойчивости к ПТП до сих пор не внедрен метод секвенирования, в том числе пиросеквенирования, в силу высокой стоимости и низкой производительности.
Молекулярно-генетические методы на основе ПЦР-анализа и соответствующие тест-системы (Xpert, GenoType MTBDRplus/GenoType MTBDRsl и др.) успешно внедряются в лабораторную диагностику туберкулеза, и являются перспективными как с позиции высокой диагностической чувствительности, высокой производительности (число анализов за постановку), так и по эксплуатационным характеристикам, и быстродействию (несколько часов). Однако ни в одной из современных тест-систем не реализована возможность детекции мутаций в гене eis, чтобы выявлять все известные на сегодня мутации устойчивости к канамицину, амикацину и капреомицину. Кроме того, ни в одном из предлагаемых способов на основе ПЦР-амплификации не реализован вариант детекции мутаций в близко расположенных кодонах 89, 90, 91 и 94 участка гена gyrA.
Прототипом предлагаемого изобретения является способ определения мутаций в гене rpoB, ответственных за резистентность МБТ к рифампицину и изониазиду методом мультиплексной ПЦР-амплификации с использованием гибридизационных зондов (L. Welebob, публикация WO 2013132447 А1 от 12.09.2013), где под мультиплексной ПЦР понимается одновременное проведение нескольких реакций в одних температурных условиях с одновременным амплифицированием и детекцией мишеней, в данном случае нуклеотидных замен в определенных позициях генов МБТ.
В прототипе применяются только олигонуклеотидные зонды, комплементарные участкам генов rpoB, katG и промоторной области гена inhA, для детекции мутаций устойчивости к антибиотикам первого ряда, рифампицину и изониазиду. В прототипе нет информации о принципах подбора зондов для проведения ПЦР-детекции мутаций устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда (канамицину, амикацину и капреомицину). В прототипе не сообщается о проведении всех ПЦР-реакций в одном температурном режиме и эффективной гибридизации зондов к матрицам (ампликонам).
Таким образом, существует потребность в простом способе определения устойчивости микобактерий туберкулеза к препаратам второго ряда путем детекции всех известных диагностически значимых мутаций устойчивости к указанным препаратам.
Сущность изобретения
Настоящее изобретение относится к способу определения устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда, отличающийся тем, что указанный способ включает одновременную детекцию мутаций в ДНК микобактерий биологического образца, приводящих к устойчивости микроорганизмов к противотуберкулезным препаратам второго ряда в участках генов gyrA, gyrB, rrs и промоторной области eis посредством мультиплексной полимеразной цепной реакции в режиме реального времени с использованием праймеров для амплификации и зондов детекции, которые комплементарны указанным участкам генов gyrA, gyrB, rrs и промоторной области eis, где противотуберкулезные препараты второго ряда представляют собой фторхинолоны, аминогликозиды и капреомицин.
В частности, фторхинолоны представляют собой офлоксацин, моксифлоксацин, левофлоксацин, а аминогликозиды представляют собой, в частности, канамицин и амикацин.
В предпочтительном варианте осуществления изобретения все реакции детекции мутаций устойчивости к противотуберкулезным препаратам второго ряда осуществляется в одном температурном режиме амплификации
В следующем варианте осуществления изобретения биологический образец представляет собой непосредственно материал клинического образца или предварительно выращенную культуру микроорганизмов.
В предпочтительном варианте осуществления изобретения клинический образец представляет собой мокроту, экссудат, смыв или бронхо-альвеолярный лаваж.
В еще одном варианте осуществления изобретения способ проводят для более чем одного биологического образца
Согласно следующему варианту осуществления изобретения участки генов выбраны из группы, включающей кодоны 89, 90, 91 и 94 гена gyrA, кодоны 539 и 540 гена gyrB, позиции 1401, 514 и 517 гена rrs, позиции -10, -12 и -37 промоторной области гена eis или их комбинации.
В другом варианте осуществления изобретения зонды детекции представляют собой олигонуклеотидные последовательности длиной 19-24 нуклеотида, меченные флуорофорами и гасителями, применяемые для детекции мутаций в кодонах 89, 90, 91 и 94 гена gyrA и в кодонах 538, 539 и 540 гена gyrB для выявления мутаций устойчивости к фторхинолонам.
В следующем варианте осуществления изобретения зонды детекции представляют собой олигонуклеотидные последовательности длиной 19-22 нуклеотида, меченные флуорофорами и гасителями, применяемые для детекции мутаций в позициях -10, -12 и -37 промоторной области гена eis для выявления мутаций устойчивости к канамицину, амикацину и /или капреомицину.
В еще одном варианте осуществления изобретения указанные зонды детекции представляют собой олигонуклеотидные последовательности длиной 20-22 нуклеотида, применяемые для детекции мутаций в позиции 1401, 514 и 517 гена rrs для выявления мутаций устойчивости к канамицину, амикацину и /или капреомицину.
В предпочтительном варианте осуществления изобретения указанные зонды включают нуклеотидные последовательности, представленные в SEQ ID NO: 7-14б 17-19, 26-31 или их комбинации.
В следующем предпочтительном варианте осуществления праймеры для амплификации включают нуклеотидные последовательности, представленные в SEQ ID NO: 1-6, 15 и 16, 16, 20-25 или их комбинации.
Настоящее изобретение также относится к применению способа по изобретению для подтверждения клинического диагноза туберкулеза с широкой лекарственной устойчивостью.
Дополнительно, настоящее изобретение относится к набору зондов детекции для осуществления способа по изобретению, в котором указанные зонды включают нуклеотидные последовательности, выбранные из представленных в SEQ ID NO: 7-14, 17-19, 26-31 или их комбинации.
Кроме того, настоящее изобретение относится к набору праймеров амплификации для осуществления способа по изобретению, в котором указанные праймеры включают нуклеотидные последовательности, выбранные из группы, состоящей из представленных в SEQ ID NO: 1-6,15, 16, 20-25 или их комбинации.
Согласно настоящему изобретению предложен способ быстрой и надежной детекции устойчивости к противотуберкулезным препаратам мутантных форм микобактерий туберкулеза за счет одновременного выявления мутаций в генах gyrA и gyrB, rrs и eis в ходе проведения мультиплексной ПЦР-амплификации с набором гибридизационных зондов, дальнейшего анализа по кривым накопления специфичных продуктов реакции, простой и однозначной интерпретации результатов.
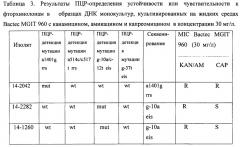
Техническим результатом настоящего изобретения является одновременное и быстрое определение устойчивости микобактерий туберкулеза биологических образцов к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда с высокой выявляемостью мутаций в ДНК биологических образцов (в частности, более 90% обнаружения мутаций устойчивости к фторхинолонам и более 82% мутаций устойчивости к канамицину, амикацину и капреомицину в клинических образцах мокроты). Важным является также то, что определение устойчивости микобактерий туберкулеза можно проводить не только на ДНК, выделенной из выросших культур МБТ, но также выделенной непосредственно из клинических образцов (мокрота, бронхоальвеолярный лаваж (БАЛ)), полученных от больных разными формами туберкулеза.
Также техническим результатом является возможность быстрого анализа больших количеств образцов ДНК микобактерий туберкулеза на наличие генотипической устойчивости как к препаратам второго ряда фторхинолонам, так и резервного ряда (канамицин, амикацин и капреомицин), в частности, до шестидесяти восьми образцов за постановку на 96-луночной ПЦР-плашке, а также возможность одновременной постановки двух реакционных смесей на определение устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда, что только ограничивается емкостью 96-луночной ПЦР-плашки.
Дополнительным техническим результатом является возможность детекции мутаций в близко расположенных кодонах 89, 90, 91 и 94 участка гена gyrA для определения устойчивости штаммов МБТ к фторхинолонам при помощи проведения мультиплексной ПЦР-амплификации с использованием минимального числа, только двух гибридизационных зондов, комплементарных или одной, или обеим цепям анализируемого участка ДНК, выбранным для гибридизации в одном температурном режиме.
Также техническим результатом изобретения является введение в способ определения устойчивости микобактерий туберкулеза дополнительной мишени детекции, соответствующей мутациям в позициях -10, -12 и -37 в промоторной области гена eis, которая является новой мишенью для выявления мутаций устойчивости к канамицину, амикацину и /или капреомицину.
Дополнительно, способ определения устойчивости микобактерий туберкулеза по изобретению, использующий гибридизационные зонды к обеим цепям ДНК-мишени, является достаточно воспроизводимым, не требующим больших затрат и позволяющим выявлять мутации в обоих исследуемых фрагментах ДНК, что упрощает и ускоряет получение результата.
Способ согласно настоящему изобретению является безопасным, достаточно доступным для проведения в условиях специализированной лаборатории и более быстрым по сравнению со способами определения устойчивости, известными из уровня техники (менее одного дня).
Еще одним техническим результатом изобретения является упрощение и минимализация числа необходимых последовательных шагов при проведении ПЦР-анализа в одной пробирке и уменьшение таким образом возможной внутрилабораторной контаминации.
Подробное описание изобретения
Настоящее изобретение относится к способу определения устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда, отличающийся тем, что указанный способ включает одновременную детекцию мутаций в ДНК микобактерий биологического образца, приводящих к устойчивости микроорганизмов к противотуберкулезным препаратам второго ряда в участках генов gyrA, gyrB, rrs и промоторной области eis посредством мультиплексной полимеразной цепной реакции в режиме реального времени с использованием праймеров для амплификации и зондов детекции, которые комплементарны указанным участкам генов gyrA, gyrB, rrs и промоторной области eis, где противотуберкулезные препараты второго ряда представляют собой фторхинолоны, аминогликозиды и капреомицин.
Противотуберкулезные препараты второго ряда представляют собой препараты, которые применяются у больных туберкулезом, имеющих устойчивость микобактерий туберкулеза к препаратам первого ряда. Противотуберкулезные препараты второго и резервного ряда широко известны из предшествующего уровня техники и представляют собой, например, фторхинолоны, аминогликозиды и полипептид капреомицин. В частности, фторхинолоны представляют собой офлоксацин, моксифлоксацин, левофлоксацин, а аминогликозиды представляют собой, в частности, канамицин и амикацин.
Принцип способа по изобретению основан на использовании процесса мультиплексной ПЦР-амплификации ДНК, заключающегося в повторяющихся циклах температурной денатурации одной или нескольких разных матриц ДНК, отжига праймеров с комплементарными последовательностями и последующей элонгации полинуклеотидных цепей с этих праймеров Taq-полимеразой. В смесь для амплификации вносятся гибридизационные зонды, содержащие флуоресцентные метки и гасители, позволяющие детектировать генетические варианты дикого типа в кодонах 89, 90, 91 и 94 гена gyrA, в кодонах 539 и 540 гена gyrB, в позициях 1401, 514 и 517 гена rrs, в позициях -10, -12 и -37 промоторной области гена eis. Нуклеотидный состав, размер и ориентация зондов подобраны таким образом, чтобы обеспечить гибридизацию всех зондов с матрицей ДНК при одинаковом температурном режиме.
Об отсутствии генетической мутации (вариант дикого типа) судят по наличию кривой накопления с высокой эффективностью прироста флуоресценции при экспоненциальным росте кривой специфического продукта с эффективностью прироста флуоресценции не менее 90%. Отсутствие кривой накопления, либо низкая эффективность прироста флуоресценции в пробе свидетельствуют о наличии мутации определенного типа. Положительные контроли дикого типа свидетельствуют о детекции набором вариантов дикого типа и позволяют исключить ложноположительные результаты. Для одновременной детекции наличия или отсутствия мутаций все реакции ПЦР-амплификации проводятся в одном температурном режиме. Положительные контроли мутаций позволяют выявлять образцы МТВ, содержащие мутации определенного типа, и свидетельствуют об отсутствии ложноотрицательных результатов. Отрицательные контроли позволяют исключить кросс-контаминацию образцов и неспецифические реакции. В образцах, не содержащих ДНК МТВ, результат должен быть отрицательным.
Таким образом, настоящее изобретение позволяет проводить одновременную ПЦР-детекцию наличия или отсутствия мутаций устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам непосредственно после выделения ДНК МБТ из биологического образца, одновременно определяя наличие или отсутствие мутаций в двенадцати позициях четырех генов, и снизить процент ложноотрицательных результатов за счет детекции дополнительных мутаций (в частности, мутаций в позициях 89, 91 в гене gyrA, позициях 539 или 540 в гене gyrB и позиции -37 в промоторной области гена eis), а также позволяет снизить себестоимость анализа и сократить время его проведения.
В предпочтительном варианте осуществления изобретения устойчивость микобактерий туберкулеза к противотуберкулезным препаратам второго ряда определяется одновременной на участках генов, выбранных из группы, включающей кодоны 89, 90, 91 и 94 гена gyrA, кодоны 539 и 540 гена gyrB, позиции 1401, 514 и 517 гена rrs, позиции -10, -12 и -37 промоторной области гена eis или их комбинации.
В настоящем изобретении биологический образец представляет собой непосредственно материал клинического образца или предварительно выращенную культуру микроорганизмов. В частности, клинический образец представляет собой мокроту, экссудат, смыв или бронхо-альвеолярный лаваж.
Способ по изобретению можно проводить для более чем одного биологического образца, например для 45 или 68 образцов, по сути, количество образцов за постановку определяется только емкостью 96-луночной ПЦР машины и возможностью одновременной постановки двух реакционных смесей на определение устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда (канамицин, амикацин и капреомицин). Предпочтительно, количество образцов за постановку составляет от нескольких до 43-45 (в зависимости от числа контролей) при постановке на все мутации одновременно (устойчивость к фторхинолонам и к канамицину, амикацину и капреомицину) для ПЦР-машин с 96-луночной плашкой. В случае постановки только на мутации к фторхинолонам или только к канамицину, амикацину и капреомицину, то число образцов может доходить до 91.
Настоящее изобретение относится также к способу, в котором все реакции детекции мутаций устойчивости к противотуберкулезным препаратам второго ряда осуществляются в одном температурном режиме амплификации.
В результате варьирования температурами отжига праймеров и зондов, временем каждого цикла и количеством циклов, подбором оптимальной Taq-полимеразы был подобран оптимальный режим амплификации, единый для обеих реакционных смесей детекции устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда (канамицин, амикацин и капреомицин). Условия первичной денатурации и инициализации были выбраны в зависимости от выбора химически модифицированной Taq-полимеразы, такой как AmpliTaqGold (Roche, US) или Taq ДНК полимераза (MBI Fermentas), и были определены в диапазоне 6-12 мин. при температуре 95°С-96°С. Температура отжига праймеров была подобрана при помощи программы выбора праймеров Primer 3 (version 0.4.0) в диапазоне 60°С-64°С, с оптимально заданной 62°С.
Температура гибридизации пробспецифичных зондов была подобрана в диапазоне 64°С-67°С, с заданной оптимальной температурой - 66°С-67°С.
Продолжительность времени элонгации принималась в диапазоне 20-30 сек. при температуре 72°С, что определялось диапазоном длин ампликонов 130-220 п.о.
Также из-за разной бактериальной нагрузки анализируемых образцов, а значит и разным количеством вносимой ДНК матрицы для ПЦР-амплификации, предпочтительной оказалась схема постановки мультиплексной ПЦР-амплификации с использованием преамплификации в количестве не менее девяти-пятнадцати циклов без чтения сигналов детекции, и последующими 30-38 циклами с чтением сигналов детекции при повышенной температуре отжига (65°С-67°С).
Окончательно был выбран следующий оптимальный режим мультиплексной ПЦР-амплификации, единый для обеих реакционных смесей детекции устойчивости к фторхинолонам и инъекционным противотуберкулезным препаратам резервного ряда (канамицин, амикацин и капреомицин), представляющий собой следующий: 1-й этап -95°С - 6-8 мин; 2-й этап - 95°С - 15 сек, 62°С - 20 сек, 72°С - 25-30 сек (9 циклов); 3-й этап: 95°С - 15 сек, 66°С - 40-45 сек (30-35 циклов с чтением).
В способе определения устойчивости микобактерий туберкулеза к противотуберкулезным препаратам второго ряда по настоящему изобретению применяются праймеры для амплификации и зонды детекции, которые комплементарны указанным участкам генов gyrA, gyrB, rrs и eis. Гибридизационными зондами могут детектироваться и дифференцироваться и мутантные, и дикие типы патогенов, а также близко расположенные мутации устойчивости к фторхинолонам. Зонды могут быть комплементарны участкам генов gyrA, gyrB, rrs и eis, не содержащим мутацию, но могут также содержать мутации в тех случаях, когда они применяются для подтверждения определенных мутаций. Предлагаемые зонды, содержащие мутации, метятся другим флуорофором в отличие от зондов, не включающих в свою последовательность мутацию, т.е. дикий тип, в тех случаях, когда важно проверить и подтвердить наличие определенных мутаций, как например, основной мутации устойчивости к аминогликазидам и капреомицину a1401g rrs или c-12t промоторной области гена eis.
Указанные праймеры применяются для амплифицирования коротких специфических фрагментов, ампликонов генов gyrA и gyrB (в случае определения устойчивости к фторхинолонам) и гена rrs и промоторной области гена eis (в случае определения устойчивости к канамицину, амикацину и капреомицину) для проведения специфичной ПЦР-детекции участков этих генов с последующей детекцией наличия или отсутствия мутаций устойчивости к указанным антибиотикам в образцах ДНК микобактерий туберкулеза.
Зонды детекции представляют собой модифицированные олигонуклеотиды длиной обычно 18-27 нуклеотидов, которые несут флуорофор, пришитый к 5'-концу зонда и гаситель, пришитый к 3'-концу. Флуоресцирование зонда, а значит и детекция продукта ПЦР-амплификации, происходит в ходе ПЦР-реакции после гибридизации зонда с комплементарными участками ДНК, при этом флуорофор испускает сигнал, и гаситель пространственно отделен от флуорофора только при гибридизации и в результате использования Taq полимеразы с 5'-экзонуклеазной активностью.
В способе согласно настоящему изобретению указанные зонды детекции могут представлять собой олигонуклеотидные последовательности длиной 19-24 нуклеотида, применяемые для детекции мутаций в кодонах 89, 90, 91 и 94 гена gyrA и в кодонах 538, 539 и 540 гена gyrB для выявления мутаций устойчивости к фторхинолонам.
Кроме того, в способе согласно настоящему изобретению указанные зонды детекции могут представлять собой олигонуклеотидные последовательности длиной 19-22 нуклеотида, применяемые для детекции мутаций в позициях -10, -12 и -37 промоторной области гена eis для выявления мутаций устойчивости к канамицину, амикацину и /или капреомицину.
В одном из вариантов осуществления изобретения указанные зонды детекции представляют собой олигонуклеотидные последовательности длиной 20-22 нуклеотида, применяемые для детекции мутаций в позиции 1401, 514 и 517 гена rrs для выявления мутаций устойчивости к канамицину, амикацину и /или капреомицину.
Указанные олигонуклеотидные последовательности могут быть мечены флуорофорами и гасителями.
Для выявления мутаций в генах gyrA и gyrB микобактерий туберкулеза были подобраны пары праймеров и гибридизационные зонды для амплифицирования специфичных фрагментов генов gyrA и gyrB. Была подобрана программа ПЦР-амплификации для проведения ПЦР-реакций и гибридизации зондов в одном температурном режиме, а также был предложен способ дифференцирования близкорасположенных однонуклеотидных замен двумя зондами в четырех кодонах 89, 90, 91 и 94 гена gyrA.
Для решения проблемы детекции и дифференции близкорасположенных мутаций в генах gyrA и gyrB впервые были разработаны условия для каждой из стадий способа:
Для синтеза ДНК МБТ гена gyrA были выбраны праймеры с использованием компьютерной программы "Primer3" и "BioEdit":
Были выбраны праймеры для амплификации участка гена gyrA, спанирующего участок с кодонами 88-95, не более 140 п. о.:
SEQ ID NO 1: Прямой 5'-CCGAGACCATGGGCAACTAC-3'
SEQ ID NO 2: Обратный 5'-GCTTCGGTGTACCTCATCG-3'
или
SEQ ID NO 3: Прямой 5'-GAGACCATGGGCAACTACCA-3'
SEQ ID NO 4: Обратный 5'-ATGACCCACCGGCGGCGATG-3'
Для амплификации участка гена gyrB были выбраны праймеры, фланкирующие участок гена между кодонами 516 и 550:
SEQ ID NO 5: grB PRIMER 5'-TTCGATGTTCCAGGCGATAC-3'
SEQ ID NO 6: grB PRIMER 5'-TCTTGTGGTAGCGCAGCTTG-3'
Для обеспечения видоспецифичности выбранных праймеров проводили сравнительный анализ нуклеотидных последовательностей с базой данных GenBank с помощью программы BLAST и e-PCR. Было установлено отсутствие кросс-реакций при использовании выбранных праймеров с ДНК других видов микроорганизмов и человека.
Далее были выбраны гибридизационные зонды для постановки мультиплексной ПЦР-амплификации вместе с выбранными праймерами для выявления мутаций в кодонах 90-94 участка гена gyrA. Зонды выведены как в прямом, так и обратном направлении для обеспечения гибридизации в температурном интервале: 64-67°С.
SEQ ID NO 7: 94 FL1 -5'-ACGCGTCGATCTACGACACCCTG-BHQ1
SEQ ID NO 8: 94-c FL1 -5'-AGGGTGTCGTAGATCGACGCG-BHQ1
Чтобы избежать пространственных осложнений при гибридизации близкорасположенных зондов, к позициям 91 и 94 был выбран более предпочтительный вариант, при котором используются зонды, комплементарные (-) цепи ДНК матрицы в позициях 89 и 90.
Зонды для специфичной гибридизации с кодонами 89-91 участка гена gyrA, оптимизированные по температуре гибридизации в том же температурном интервале 64-67°С, предложены следующие:
SEQ ID NO 9: 90-91-с FL2-5'-TAGATCGACGCGTCGCCGT-3'-BHQ2
SEQ ID NO 10: 91-90 FL2-5'-ACGGCGACGCGTCGATCTACG-3'-BHQ2
Принцип дифференциальной детекции основных мутаций в гене gyrA реализуется таким образом, что например, мутация в 94 кодоне гена gyrA детектируется по отсутствию кривой накопления по одному каналу узнавания флуорофора, например, FAM с одновременным присутствием кривой накопления по другому каналу узнавания флуорофора, например, ROX с эффективностью прироста флуоресценции близкой к 100%. Мутации в кодоне 91 гена gyrA выявляются по одновременному отсутствию кривых накопления по обоим каналам узнавания флуорофоров.
Отсутствие мутаций в кодонах 89 и 90 гена gyrA определяется по наличию кривых накопления по обоим каналам, например, FAM и ROX, с эффективностью прироста флуоресценции близкой к 100%.
Мутации в кодоне 94 детектируются по отсутствию кривой накопления по каналу FAM с эффективностью прироста флуоресценции менее 10%.
Мутации в кодонах 89 и 90 гена gyrA детектируются по присутствию кривой накопления по одному каналу, например, FAM, с эффективностью прироста флуоресценции близкой к 100% и менее 40% соответственно, тогда как по другому каналу, например, ROX для обеих мутаций характерно отсутствие кривой накопления. Наличие полиморфизма в кодоне 95 определяется также гибридизацией с зондом, комплементарным участку с кодоном 94, и выявляется по кривой накопления с эффективностью прироста флуоресценции близкой к 70%, что не влияет на способность дифференцировать мутантные и дикие формы по кодону 94.
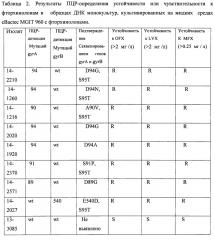
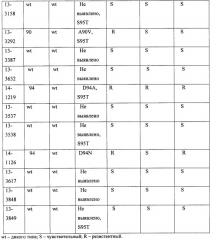
Интерпретация результатов детекции мутаций в кодонах 89, 90, 91 и 94 гена gyrA по амплитуде сигнала детекции для двух зондов представлена в таблице 1.
Таким образом, предлагаемый нами вариант детекции мутаций в близко расположенных кодонах 89, 90, 91 и 94 участка гена gyrA обеспечивается проведением мультиплексной ПЦР-амплификации с использованием только двух гибридизационных зондов, комплементарных или одной, или обеим цепям анализируемого участка ДНК, но выбранным для гибридизации в одном температурном диапазоне 64-67°С.
Кроме того, используемый подход позволяет избегать детекции близкорасположенного однонуклеотидного полиморфизма в кодоне 95, тем самым детектируя только мутации устойчивости к фторхинолонам.
Был также выбран гибридиз