Способы обработки летучей золы
Иллюстрации
Показать всеИзобретение относится к способам обработки материалов промышленных отходов, а именно к способам обработки летучей золы. Способ включает выщелачивание летучей золы с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия, ионы железа и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания. Затем осуществляют реакцию продукта выщелачивания с HCl с получением жидкости, содержащей ионы железа, и осадка, содержащего ионы алюминия в форме AlCl3. Отделяют осадок от жидкости. Нагревают осадок в условиях, обеспечивающих превращение AlCl3 в Al2O3, и необязательно извлекают образующийся при этом газообразный HCl. Обеспечивается экономичный способ получения чистого оксида алюминия с одновременным получением других продуктов высокой степени чистоты и высокого качества. 3 н. и 250 з.п. ф-лы, 7 ил., 38 табл., 10 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по заявке США 61/617,422, поданной 29 марта 2012; и US 61/706,028, поданной 26 сентября 2012. Эти документы полностью включены в настоящий текст посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее описание относится к улучшениям в области способов обработки материалов промышленных отходов. Настоящее изобретение относится к улучшениям в области способов обработки промышленных отходов. Например, оно относится к способам обработки летучей золы. Например, эти способы могут обеспечивать экстрагирование из летучей золы различных материалов, таких как оксид алюминия и оксиды различных металлов, двуокись кремния и редкоземельные элементы и т.д.
ПРЕДПОСЫЛКИ СОЗДАНИЯ
[0003] Летучая зола представляет собой один из остатков, образующихся при сжигании. Она содержит мелкие частицы, которые поднимаются вместе с отходящими газами. Зола, которая не поднимается, называется зольным остатком (шлаком). Материал летучей золы может уплотняться в процессе суспендирования в отходящих газах и тогда его собирают с использованием электростатических пылеуловителей или мешочных фильтров. Поскольку в процессе суспендирования уплотняются, частицы летучей золы могут иметь в целом сферическую форму и размер от 0.5 мкм до 100 мкм. Летучая золя может содержать диоксид кремния (SiO2) (который может присутствовать в двух формах: аморфной, которая является округлой и гладкой, и кристаллической, имеющей острые грани и углы и опасной), оксид алюминия (Al2O3) и оксид железа (Fe2O3). Летучие золы могут также содержать оксид кальция (СаО). Летучие золы могут быть высоко гетерогенными. Они могут содержать смесь стекловидных частиц с различными идентифицируемыми.
[0004] Например, летучей золой может называться зола, образующаяся в процессе сжигания угля. Компоненты летучей золы значительно варьируют в зависимости от источника и состава сжигаемого угля.
[0005] Раньше летучая зола обычно выбрасывалась в атмосферу, но в настоящее время оборудование для контроля загрязнения окружающей среды, ставшее в последние десятилетия обязательным, требует обязательного улавливания золы перед выбросом. Летучая зола обычно улавливается электростатическими пылеуловителями или другим оборудованием для фильтрации частиц до того как дымные газы достигают труб углесжигающих электростанций и в этом случае вместе с топочной золой из пода топки называются угольной золой. Например, в США летучую золу обычно складируют на угольных электростанциях или помещают на полигоны для отходов. Повторно используется приблизительно 43 процента,[3] она часто используется в качестве добавки к портландцемент в производстве бетона. Однако, некоторые исследователи выражают в связи с этим озабоченность, касающуюся проблем здравоохранения.
[0006] Раньше летучая зола, образующаяся в результате сжигания угля, просто увлекалась дымовыми газами и рассеивалась в атмосфере. Это создавало экологические и здравоохранительные проблемы, которые подтолкнули создание законов по снижению выбросов летучей золы до уровня ниже 1 процента от образующейся золы. Более 65% летучей золы, производимой угольными электростанциями в мире, отправляется на свалки и в золоотстойники. Переработка летучей золы стала в последние годы растущей проблемой из-за роста затрат на свалки и современного интереса к устойчивому развитию. Сообщалось, что в 2005 г. углесжигающие заводы в США произвели 71.1 миллионов тонн летучей золы, из которых 29.1 миллионов тонн было повторно использовано по различным назначениям. Если бы почти 42 миллиона тонн неиспользованной летучей золы было переработано, это снизило бы потребность в приблизительно 27,500 акрофутах (33,900,000 м3) территории для полигонов.
[0007] Соответственно, существует потребность в по меньшей мере альтернативном способе переработки и/или полезного применения летучей золы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В соответствии с одним аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией выше азеотропной концентрации HCl (20.2 массовых %) и осуществление реакции композиции с дополнительным количеством алюминийсодержащего материала, в результате чего происходит его выщелачивание.
[0009] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от приблизительно 25 до приблизительно 45 массовых %, и осуществление реакции композиции с дополнительным количеством алюминийсодержащего материала, в результате чего происходит его выщелачивание.
[0010] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от приблизительно 25 до приблизительно 45 массовых %, и применение этой композиции для выщелачивания алюминийсодержащего материала.
[0011] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3 и извлечение образующегося при этом HCl; и
повторное использование полученного в способе газообразного HCl путем приведения его в контакт со продуктом выщелачивания, что приводит к преципитации ионов алюминия в форме AlCl3⋅6H2O.
[0012] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3.
[0013] В соответствии с другим аспектом предложен способ получения оксида алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3, и необязательно извлечение образующегося при этом газообразного HCl.
[0014] В соответствии с одним аспектом предложен способ получения алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3; и
превращение Al2O3 в алюминий.
[0015] В соответствии с другим аспектом предложен способ получения алюминия и возможно других продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала с использованием HCl с получением продукта выщелачивания, содержащего ионы алюминия и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3, и отделение осадка от жидкости;
нагревание осадка в условиях, обеспечивающих превращение AlCl3 в Al2O3, и необязательно извлечение образующегося при этом газообразного HCl; и
превращение Al2O3 в алюминий.
[0016] В соответствии с другим аспектом предложен способ получения различных продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала, содержащего первый металл, с использованием HCl, в результате чего получают продукт выщелачивания, содержащий ионы первого металла, и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
осуществление реакции продукта выщелачивания с HCl, в результате чего получают жидкость и осадок, содержащий хлорид первого металла, и отделение осадка от жидкости; и
нагревание осадка в условиях, обеспечивающих превращение хлорида первого металл в оксид первого металла.
[0017] В соответствии с другим аспектом предложен способ получения различных продуктов, причем указанный способ включает:
выщелачивание алюминийсодержащего материала, содержащего первый металл, кислотой, в результате чего получают продукт выщелачивания, содержащий ионы первого металла, и твердое вещество, и отделение указанного твердого вещества от продукта выщелачивания;
по существу селективное удаление ионов первого металла из продукта выщелачивания, в результате чего получают композицию; и
по существу селективное удаление ионов первого металла из композиции.
[0018] В соответствии с другим аспектом предложен способ обработки алюминийсодержащего материала, включающий:
выщелачивание летучей золы кислотой, в результате чего получают продукт выщелачивания и твердый остаток, и отделение продукта выщелачивания от твердого остатка;
по меньшей мере частичное удаление ионов железа из продукта выщелачивания путем по существу селективного осаждения ионов железа при pH выше 10 путем осуществления реакции продукта выщелачивания с основанием и по меньшей мере частичного удаления осажденных ионов железа из продукта выщелачивания, в результате чего получают богатую Al композицию, содержащую ионы Al3+;
необязательно очистку ионов Al3+; и
превращение ионов Al3+в оксид алюминия.
[0019] В соответствии с другим аспектом предложен способ обработки алюминийсодержащего материала, включающий:
выщелачивание алюминийсодержащего материала кислотой, в результате чего получают продукт выщелачивания и твердый остаток, и отделение продукта выщелачивания от твердого остатка;
по меньшей мере частичное удаление ионов железа из продукта выщелачивания путем по существу селективного осаждения ионов железа при pH от приблизительно 3 до приблизительно 6 путем осуществления реакции продукта выщелачивания с основанием и по меньшей мере частичного удаления осажденных ионов железа из продукта выщелачивания, в результате чего получают богатую Al композицию, содержащую ионы Al3+;
необязательно очистку ионов Al3+; и
превращение ионов Al3+ в оксид алюминия.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] На представленных ниже чертежах, которые приведены исключительно в качестве примера, показаны различные варианты реализации описанного решения:
[0021] На Фиг. 1 показана блок-схема примера процесса получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием;
[0022] Фиг. 2 представляет собой кривую экстракции для Al и Fe, на которой процентная доля экстракции представлена как функция времени выщелачивания в способе согласно одному из примеров, описанных в настоящей заявке;
[0023] На Фиг. 3 показана блок-схема другого примера способа получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием;
[0024] Фиг. 4 представляет собой схему примера способа очистки/концентрирования HCl в соответствии с настоящим описанием;
[0025] Фиг. 5 представляет собой схему примера способа очистки/концентрирования HCl в соответствии с настоящим описанием;
[0026] На Фиг. 6 показана другая блок-схема примера способа получения оксида алюминия и различных других продуктов в соответствии с настоящим описанием; и
[0027] На Фиг. 7 показана другая блок-схема примера способа получения оксида и различных других продуктов в соответствии с настоящим описанием.
ПОДРОБНОЕ ОПИСАНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0028] Приведенные ниже неограничивающие примеры дополнительно иллюстрируют методику, раскрытую в настоящем описании.
[0029] Алюминийсодержащий материал может быть, например, выбран из алюминийсодержащих руд (могут использоваться такие как алюмосиликатные минералы, глины, аргиллит, нефелин, мадстоун, берилл, криолит, гранат, шпинель, боксит, каолин или их смеси). Алюминийсодержащий материал также может представлять собой повторно используемый алюминийсодержащий материал, такой как шлак, красный шлам или летучая зола.
[0030] Выражение "красный шлам" в настоящем тексте относится, например, к побочному продукту производства, образующемуся в ходе получения оксида алюминия. Например, такой побочный продукт может включать двуокись кремния, алюминий, железо, кальций и, возможно, титан. Он также может содержать ряд минорных компонентов, таких как Na, K, Cr, V, Ni, Ва, Cu, Mn, Pb, и/или Zn и т.д.. Например, красный шлам может содержать от приблизительно 15 до приблизительно 80% по массе Fe2O3, от приблизительно 1 до приблизительно 35% по массе Al2O3, от приблизительно 1 до приблизительно 65% по массе SiO2, от приблизительно 1 до приблизительно 20% по массе Na2O, от приблизительно 1 до приблизительно 20% по массе СаО, и от 0 до приблизительно 35% по массе TiO2. В соответствии с другим примером красный шлам может содержать от приблизительно 30 до приблизительно 65% по массе Fe2O3, от приблизительно 10 до приблизительно 20% по массе Al2O3, от приблизительно 3 до приблизительно 50% по массе SiO2, от приблизительно 2 до приблизительно 10% по массе Na2O, от приблизительно 2 до приблизительно 8% по массе СаО и от 0 до приблизительно 25% по массе TiO2.
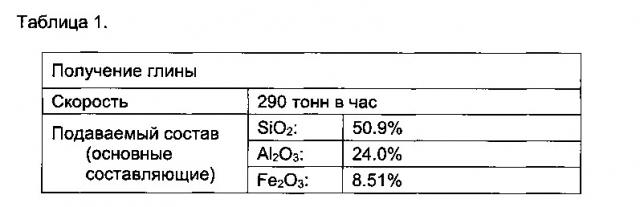
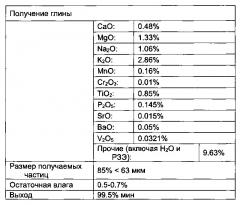
[0031] Выражение "летучие золы" или "летучая зола" в настоящем тексте относится, например, к побочному продукту производства, образующемуся при сжигании. Например, такой побочный продукт может содержать различные элементы, такие как двуокись кремния, кислород, алюминий, железо, кальций. Например, летучая зола может содержать диоксид кремния (SiO2) и оксид алюминия (Al2O3). Например, летучая зола может дополнительно содержать оксид кальция (СаО) и/или оксид железа (Fe2O3). Например, летучая зола может содержать тонкие частицы, которые поднимаются с дымовыми газами. Например, летучая зола может образовываться в ходе сжигания угля. Например, летучая зола может также содержать по меньшей мере один элемент, выбранный из мышьяка, бериллия, бора, кадмия, хрома, хрома IV, кобальта, свинца, магния, ртути, молибдена, селена, стронция, таллия и/или ванадия. Например, летучая зола может также содержать редкоземельные элементы и редкие металлы. Например, летучая зола может рассматриваться как алюминийсодержащий материал. Например, летучая зола может содержать от приблизительно 40 до приблизительно 50% по массе SiO2, ль приблизительно 20 до приблизительно 30% по массе Al2O3, ль приблизительно 15 приблизительно 25% по массе Fe2O3, ль приблизительно 1 до приблизительно 6% по массе Ca2O, ль приблизительно 0 до приблизительно 2% по массе MgO, ль приблизительно 0 до приблизительно 2% Na2O и приблизительно 1 до приблизительно 4% K2O
[0032] Выражение "редкоземельный элемент" (также обозначаемый "РЗЭ") в настоящем тексте относится, например, к редкомк элементу, выбранному из скандия, иттрия, лантан, церия, празеодим, неодим, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия и лютеция. Выражение "редкие металлы" в настоящем тексте относится, например, к редким металлам, выбранным из индия, циркония лития и галлия. Эти редкоземельные элементы и редкие металлы могут присутствовать в различных формах, таких как элементарная форма (или металлическая форма), в форме хлоридов, оксидов, гидроксидов и т.д.. Выражение "редкоземельные" в настоящем тексте употребляется как синоним "редкоземельных элементов и редких металлов", которые описаны выше.
[0033] Выражение "по меньшей мере один хлорид железа" в настоящем тексте относится к FeCl2, FeCl3 или их смеси.
[0034] Термин «гематит» в настоящем тексте относится, например, к соединению, содержащему α-Fe2O3, γ-Fe2O3, β-FeO.OH или их смеси.
[0035] Выражение "ионы железа" в настоящем тексте относится, например, к ионам, включающим по меньшей мере один тип ионов железа, выбранный из всех возможных форм ионов Fe. Например, по меньшей мере один тип ионов железа может представлять собой Fe2+, Fe3+ или их смесь.
[0036] Выражение "ионы алюминия" в настоящем тексте относится, например, к ионам, включающим по меньшей мере один тип ионов алюминия, выбранный из всех возможных форм ионов Al. Например, по меньшей мере один тип ионов алюминия может представлять собой Al+3.
[0037] Выражение "по меньшей мере один ион алюминия" в настоящем тексте относится, например, к по меньшей мере одному типу ионов алюминия, выбранному из всех возможных форм ионов Al. Например, по меньшей мере ион алюминия может представлять собой Al+3.
[0038] Выражение "по меньшей мере один ион железа", в настоящем тексте относится, Например, к по меньшей мере одному типу ионов железа, выбранному из всех возможных форм ионов Fe. Например, по меньшей мере один ион железа может представлять собой Fe2+, Fe3+ или их смесь.
[0039] Выражение "по меньшей мере один осажденный ион железа" в настоящем тексте относится, например, к по меньшей мере одному типу ионов железа, выбранному из всех возможных форм ионов Fe, осажденному в твердой форме. Например, по меньшей мере один ион железа, присутствующий в таком осадке, может представлять собой Fe2+, Fe3+ или их смесь.
[0040] Термины, обозначающие степень, такие как "приблизительно" и "приблизительно" в настоящем тексте обозначают разумное значение отклонения от термина, к которому они относятся, при котором не происходит значительного изменения конечного результата. Предполагается, что эти термины степени включают отклонение, равное по меньшей мере ±5% или по меньшей мере ±10% от значения, к которому они относятся, если такое отклонение не противоречит истинности значения слова, к которому оно относится.
[0041] Например, материал может быть подвергнут выщелачиванию с использованием HCl в концентрации от приблизительно 10 до приблизительно 50 массовых %, приблизительно 15 до приблизительно 45 массовых %, от приблизительно 18 до приблизительно 45 массовых %, от приблизительно 18 до приблизительно 32 массовых %, от приблизительно 20 до приблизительно 45 массовых %, от приблизительно 25 до приблизительно 45 массовых %, от приблизительно 26 до приблизительно 42 массовых %, от приблизительно 28 до приблизительно 40 массовых %, от приблизительно 30 до приблизительно 38 массовых %, или от 25 до 36 массовых %. Например, может использоваться HCl в концентрации приблизительно 18 масс. % или приблизительно 32 масс. %.
[0042] Выщелачивание также может быть осуществлено путем добавления сухой высоко концентрированной кислоты (Например, 85%, 90% или 95%) в газовой фазе в водном растворе. В альтернативном варианте выщелачивание может также быть осуществлено с использованием слабого раствора кислоты (например, <3 масс %).
[0043] Например, выщелачивание может быть осуществлено с использованием HCl с концентрацией от приблизительно 18 до приблизительно 32 масс. % в первом реакторе, и затем с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразная) во втором реакторе.
[0044] Например, выщелачивание может быть осуществлено с использованием HCl с концентрацией от приблизительно 18 до приблизительно 32 масс. % в первом реакторе, затем с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразного) во втором реакторе; и с использованием HCl с концентрацией от приблизительно 90 до приблизительно 95% (газообразной) в третьем реакторе.
[0045] Например, выщелачивание может быть осуществлено в атмосфере инертного газа (например, аргона или азота).
[0046] Например, выщелачивание может быть осуществлено в атмосфере NH3.
[0047] Например, выщелачивание материала может осуществляться при температуре от приблизительно 125 до приблизительно 225°C, от приблизительно 150 до приблизительно 200°C, от приблизительно 160 до приблизительно 190°C, от приблизительно 185 до приблизительно 190°C, от приблизительно 160 до приблизительно 180°C, от приблизительно 160 до приблизительно 175°C, или от приблизительно 165 до приблизительно 170°C.
[0048] Например, выщелачивание материала может осуществляться при давлении от приблизительно 4 до приблизительно 10 бар по манометру, от приблизительно 4 до приблизительно 8 бар по манометру, или от приблизительно 5 до приблизительно 6 бар по манометру.
[0049] Выщелачивание может быть осуществлено под давлением (например, выше атмосферного давления) в автоклаве. Например, оно может быть осуществлено под давлением от приблизительно 5 КПа до приблизительно 850 КПа, от приблизительно 50 КПа до приблизительно 800 КПа, от приблизительно 100 КПа до приблизительно 750 КПа, от приблизительно 150 КПа до приблизительно 700 КПа, от приблизительно 200 КПа до приблизительно 600 КПа или от приблизительно 250 КПа до приблизительно 500 КПа. Выщелачивание может быть осуществлено при температуре, равной по меньшей мере 80°C, по меньшей мере 90°C или от приблизительно 100°C до приблизительно 110°C. В некоторых случаях, оно может осуществляться при более высоких температурах.
[0050] Выщелачивание также может осуществляться под давлением. Например, давление может составлять от приблизительно 100 до приблизительно 300 или от приблизительно 150 до приблизительно 200 фунтов на квадратный дюйм по манометру. Выщелачивание можно осуществлять в течение от приблизительно 30 минут до приблизительно 5 часов. Оно может быть осуществлено при температуре от приблизительно 60°C до приблизительно 200°C.
[0051] Например, способы могут дополнительно включать повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых % или от 25 до приблизительно 45 массовых %.
[0052] Например, способы могут дополнительно включать повторное использование полученного в способе газообразного HCl путем приведения его в контакт с водой, в результате чего получают композицию с концентрацией от приблизительно 18 до приблизительно 45 массовых %, от приблизительно 26 до приблизительно 42 массовых %, от приблизительно 28 до приблизительно 40 массовых %, от приблизительно 30 до приблизительно 38 массовых %, от 18 до 36 массовых %, от 19 до 36 массовых %, от 25 до 36 массовых % или от приблизительно 25 до приблизительно 45 массовых % и возможно использование этой композиции для выщелачивания материала.
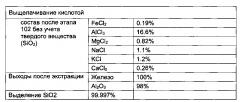
[0053] Например, жидкость может содержать хлорид железа. Хлорид железа может включать по меньшей мере один из FeCl2, FeCl3, и из смесь.
[0054] Например, концентрация хлорида железа в жидкости может составлять по меньшей мере 30% по массе; и жидкость может быть затем гидролизована при температуре от приблизительно 155 до приблизительно 350°C.
[0055] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; после чего хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа (III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечение указанного гематита.
[0056] Например, концентрация негидролизуемых элементов с гематитом может быть повышена обратно до концентрации от приблизительно 0.125 до приблизительно 52% масс. в циркуляционном контуре ввиду селективной экстракции.
[0057] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; и затем гидролизовать при температуре от приблизительно 155 до приблизительно 350°C.
[0058] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; после чего этот по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита.
[0059] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа, равной по меньшей мере 30% по массе; после чего по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и извлечение редкоземельных элементов и/или редких металлов из жидкости.
[0060] Например, по меньшей мере один хлорид железа может быть гидролизован при температуре от приблизительно 150 до приблизительно 175, от 155 до приблизительно 170 или от 165 до приблизительно 170°C.
[0061] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; после чего хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит; извлечение гематита; и извлечение редкоземельных элементов и/или редкие металлы из жидкости.
[0062] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, что обеспечивает осаждение MgCl2, и его извлечение.
[0063] Например, способы могут дополнительно включать прокаливание MgCl2 в MgO и возможно повторное использование образующегося при этом HCl.
[0064] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, и по существу селективное осаждение Na2SO4. Например, Na2SO4 может быть осажден путем осуществление реакции жидкости с H2SO4.
[0065] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, осуществление реакции жидкости с HCl, и по существу селективное осаждение K2SO4. Например, преципитация K2SO4 может быть осуществлена путем добавления H2SO4.
[0066] Например, жидкость можно концентрировать с получением концентрированной жидкости, концентрация хлорида железа в которой составляет по меньшей мере 30% по массе; и затем этот хлорид железа может быть гидролизован при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и осуществление реакции жидкости с HCl. Например, такие способы могут дополнительно включать осуществление реакции жидкости с H2SO4, в результате чего происходит по существу селективное осаждение Na2SO4. Способы могут также включать далее осуществление реакции жидкости с H2SO4, что обеспечивает по существу селективное осаждение K2SO4.
[0067] Например, способы могут включать осуществление реакции отдельных сухих солей (например, солей Na или K), полученных в способах, с H2SO4 и извлечение HCl с одновременным получением пригодных к продаже K2SO4 и Na2SO4 и извлечением хлороводородной кислоты в количестве 15 до приблизительно 90% масс.
[0068] Например, хлорид натрия, получаемый в способах, может вступать в химические реакции с серной кислотой, в которых чего получают сульфат натрия и регенерированную соляную кислоту. Хлорид калия может вступать в химическую реакцию с серной кислотой, в результате чего получают сульфат калия и регенерированную соляную кислоту. В альтернативном варианте, насыщенный раствор хлорида натрия и калия может быть загружаемым материалом для маленьких хлорощелочных электролизеров. В последнем случае образуются обычные основания (NaOH и KOH) и гипохлориты (NaOCl и KOCl).
[0069] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение NaCl из жидкости, осуществление реакции NaCl с H2SO4, и по существу селективное осаждение Na2SO4.
[0070] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение KCl из жидкости, осуществление реакции KCl с H2SO4, и по существу селективное осаждение K2SO4.
[0071] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение NaCl из жидкости, проведение электролиза, в результате чего образуются NaOH и NaOCl.
[0072] Например, способы могут дополнительно включать, после извлечения редкоземельных элементов и/или редких металлов, извлечение KCl из жидкости, осуществление реакции KCl, проведение электролиза, в результате чего образуются KOH и KOCl.
[0073] Например, жидкость можно концентрировать с получением концентрированной жидкости с концентрацией по меньшей мере одного хлорида железа по меньшей мере 30% по массе; и затем по меньшей мере один хлорид железа гидролизуют при температуре от приблизительно 155 до приблизительно 350°C при поддержании концентрации хлорида железа(III) на уровне по меньшей мере 65% по массе, с получением композиции, содержащей жидкость и осажденный гематит, и извлечением указанного гематита; извлечение гематита; и экстракцию NaCl и/или KCl из жидкости.
[0074] Например, способы могут дополнительно включать осуществление реакции NaCl с H2SO4, в результате чего происходит по существу селективное осаждение Na2SO4.
[0075] Например, способы могут дополнительно включать осуществление реакции KCl с H2SO4, в результате чего происходит по существу селективное осаждение K2SO4.
[0076] Например, способы могут дополнительно включать осуществление электролиза NaCl с получением NaOH и NaOCl.
[0077] Например, способы могут дополнительно включать осуществление электролиза KCl с получением KOH и KOCl.
[0078] Например, способы могут включать отделение твердого вещества от продукта выщелачивания и промывку твердого вещества, в результате чего получают диоксид кремния, степень чистоты которого составляет по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99.5% или по меньшей мере 99.9%.
[0079] Например, AlCl3 может быть представлен в форме AlCl3⋅6H2O.
[0080] Например, способы могут включать осуществление реакции продукта выщелачивания с газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0081] Например, способы могут включать осуществление реакции продукта выщелачивания с сухим газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0082] Например, способы могут включать осуществление реакции продукта выщелачивания с кислотой, по меньшей мере 30% масс. которой было извлечено, регенерировано и/или очищено как описано в настоящем тексте, в результате чего получают жидкость и осадок, содержащий ионы алюминия в форме AlCl3⋅6H2O.
[0083] Например, способы могут включать осуществление реакции продукта выщелачивания с газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия, причем указанный осадок образуется в результате кристаллизации AlCl3⋅6H2O.
[0084] Например, способы могут включать осуществление реакции продукта выщелачивания с сухим газообразным HCl, в результате чего получают жидкость и осадок, содержащий ионы алюминия, причем указанный осадок образуется в результате кристаллизации AlCl3⋅6H2O.
[0085] Например, ионы алюминия могут осаждаться в форме AlCl3 (например, AlCl3⋅6H2O) в кристаллизаторе, например, в результате добавления HCl с концентрацией от приблизительно 26 до приблизительно 32 масс. % или от приблизительно 24 до приблизительно 26% масс.
[0086] Например, концентрация HCl в газообразной HCl может составлять по меньшей мере 85% масс. или по меньшей мере 90% масс.
[0087] Например, концентрация HCl в газообразной HCl может составлять от приблизительно 90% масс. или приблизительно 90% до приблизительно 95% масс.
[0088] Например, в процессе кристаллизации AlCl3⋅6H2O концентрация HCl в жидкости может поддерживаться на уровне от приблизительно 25 до приблизительно 35% по массе, от приблизительно 30 до приблизительно 32% по массе или от приблизительно 23 до приблизительно 26% по массе.
[0089] Например, кристаллизация может осуществляться при температуре от приблизительно 45 до приблизительно 65°C и