Способ диагностики рака легкого
Иллюстрации
Показать всеИзобретение относится к области диагностической медицины. Образец цельной крови, собранный в антисвертывающий раствор, центрифугируют. Отбирают плазму. Из плазмы выделяют внДНК, которые модифицируют при помощи бисульфита натрия. Проводят МС-ПЦР с использованием специально подобранных праймеров и зондов для контрольного гена FDPS и аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21. Далее проводят сравнительный анализ результатов ПЦР с учетом полученного Ct для выявляемых генов. Если значение Ct≤35,1 для гена FDPS и Ct≤41 для генов RARbeta2 и/или RASSF1A и/или Ct≤42,5 для гена TCF 21, то делают заключение о наличии рака легкого у пациента. Технический результат заключается в упрощении известного способа, повышении его чувствительности и специфичности. 2 з.п. ф-лы, 5 табл., 1 ил., 3 пр.
Реферат
Изобретение относится к области диагностической медицины, а именно к молекулярно-генетической диагностике, и предназначено для малоинвазивной диагностики рака легкого путем выявления аберрантно-метилированных маркерных генов в составе внеклеточной ДНК (внДНК) плазмы крови.
Актуальной задачей онкодиагностики является своевременное и точное выявление первичных опухолей и рецидивов опухолевого процесса. Разработка высокоточных и малоинвазивных тестов на маркеры первичных признаков канцерогенеза, использующих в качестве биологического материала легкодоступные биологические жидкости организма (кровь, моча, лимфа, бронхоальвеолярные смывы, и др.), представляет особый интерес в связи с возможностью скринингового анализа пациентов. Анализ образцов, который не требует присутствия пациента, может выполняться как в современных диагностических лабораториях по месту жительства, так и в специализированных центрах, анализирующих присылаемые образцы биологических жидкостей.
Использование для диагностики опухолей аберрантно-метилированных маркерных генов, циркулирующих в составе внДНК плазмы или сыворотки крови, представляется особенно перспективным. Аберрантным считают метилирование тех участков генома, которые в норме не должны подвергаться метилированию. Аберрантное метилирование маркерных генов опухолевой супрессии характерно практически для всех типов опухолей, наблюдается уже на ранних стадиях злокачественной трансформации клеток, аберрантно-метилированные гены легко детектировать в присутствии большого избытка неметилированной формы этих же генов, поэтому эти формы гены могут выступать в роли потенциальных маркеров рака (1).
К настоящему времени получены данные о профиле метилирования более чем 40 генов опухолевой супрессии в клетках злокачественных опухолей легкого (2, 3). Как правило, это гены, участвующие в регуляции клеточного цикла, адгезии, апоптозе, сигнальной трансдукции и регулируемые по механизму метилирования. К сожалению, в силу гетерогенностей опухолей, пока не обнаружено единого маркерного гена, который был бы аберрантно метилирован в опухолях всех доноров. Тем не менее, выявление хотя бы одного из аберрантно-метилированных маркерных генов, включенных в одну диагностическую панель, позволяет определить наличие клеток опухоли в исследуемом образце опухолевой ткани с практически 100-процентной чувствительностью и специфичностью (4). Серьезной проблемой является тот факт, что частота выявления потенциальных аберрантно-метилированных маркерных генов в образцах опухолевой ткани разных больных, как правило, существенно выше, чем выявление этих же генов в образцах внДНК крови, взятых у этих же пациентов (5). Несмотря на это, известно несколько способов выявления рака легкого, основанных на анализе внДНК крови.
Известен способ выявления аберрантно-метилированных маркерных генов в сыворотке крови больных немелкоклеточным раком легкого (6), включающий следующие стадии: получение сыворотки крови больных с гистологически подтвержденным немелкоклеточным раком легкого (n=61), выделение ДНК из образцов сыворотки при помощи коммерческого набора QIAamp DNA Mini Kit (Qiagen NV, Голландия), модификацию выделенной ДНК бисульфитом натрия в соответствии со стандартным протоколом (7), постановку флуоресцентной ПЦР, специфичной к метилированию (F-MSP) с использованием праймеров для аберрантно-метилированных маркерных генов p16INK4A и CDH13, хорошо зарекомендовавших себя при анализе ДНК из ткани опухоли при раке легкого (чувствительность и специфичность маркеров в образцах ткани составляют - 92% и 100%, соответственно); сравнительный анализ полученных данных. Чувствительность известного способа составляет всего 39% (метилированные формы p16INK4A и CDH13 встречаются у больных раком легкого в 26% и 23% случаев соответственно).
Недостатком данного способа является низкая чувствительность способа (менее 50%), что делает его непригодным для внедрения в клинические лаборатории для скрининговых исследований.
Известен способ диагностики рака легкого (8), включающий следующие стадии: получение сыворотки крови пациентов с выявленными отклонениями после бронхоскопии, выделение ДНК из образцов сыворотки при помощи коммерческого набора QIAamp DNA Blood Midi kit (Qiagen NV, Голландия), бисульфитную модификацию выделенной внДНК при помощи коммерческого набора CpGenome DNA Modification kit (Intergen Ltd, США), постановку метил-специфичной ПЦР (МС-ПЦР), с использованием праймеров для 5 аберрантно-метилированных маркерных генов RARβ, pl6INK4a, DAPK, RASSF1A, и MGMT, электрофоретический анализ ПЦР продуктов, сравнительный анализ полученных данных. Чувствительность известного способа составляет 49,5%, а специфичность - 85,5%.
Недостатками известного способа являются низкая чувствительность и специфичность, а также высокая трудоемкость, поскольку помимо ПЦР реакции на метилированную форму гена для каждого маркера необходимо проводить контрольную ПЦР реакцию, независимую от метилирования (контроль на ложноотрицательный результат), что почти вдвое увеличивает расход реагентов и трудозатраты персонала клинических лабораторий, а также удваивает конечную цену проведения исследования и делает его менее доступным.
Наиболее близким к заявленному способу - прототипом, является способ диагностики рака легкого (9), включающий следующие стадии: сбор крови, получение плазмы крови больных с гистологически подтвержденным немелкоклеточным раком легкого, выделение внДНК из образцов плазмы при помощи коммерческого набора QIAamp DNA Mini Kit или QIAamp Blood Mini Kit (Qiagen NV, Голландия); бисульфитную модификацию выделенной внДНК при помощи коммерческого набора EZ-DNA methylation Gold Kit (Zymo Research PC, США); постановку МС-ПЦР с использованием праймеров для 5 аберрантно-метилированных маркерных генов АРС, RASSF1A, CDH13, KLK10 и DLEC1; разделение ПЦР продуктов при помощи электрофореза; сравнительный анализ полученных данных и составление заключения о наличии или отсутствии онкологического заболевания. Показано, что исследование образцов внДНК плазмы крови позволяет обнаружить опухоль с чувствительностью 83,64%, и специфичностью - 74,0%.
Недостатками прототипа являются невысокая чувствительность и специфичность способа, а также его высокая трудоемкость, поскольку способ включает выполнение контрольной ПЦР, независимой от метилирования, что увеличивает затраты времени и стоимость теста. Кроме этого, известный способ основан на методе неколичественной ПЦР, что сильно затрудняет анализ результатов теста.
Задачей изобретения является разработка более чувствительного и специфичного, менее трудоемкого способа с простым и ясным алгоритмом анализа получаемых количественных данных.
Технический результат: уменьшение трудоемкости способа, повышение его чувствительности и специфичности.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Проводят сбор крови при помощи вакутейнеров или других пробирок для сбора и консервирования крови. Кровь разделяют на плазму и клеточную фракцию при помощи центрифугирования. Далее проводят выделение внДНК из плазмы крови, объемом не менее 3 мл, любым известным способом, например, с помощью микроколонок со стекловолокнистыми фильтрами в присутствии хаотропных солей (10). Полученную внДНК модифицируют бисульфитом натрия при помощи коммерческого набора в полном соответствии с рекомендациями производителя (например, EZ DNA Methylation-Gold Kit, ZYMO Research PC, США). Далее осуществляют выявление аберрантно-метилированных маркерных генов RARbeta2, RASSF1A, TCF21 и контрольного гена FDPS с помощью количественной МС-ПЦР (11) с использованием уникальных праймеров и зондов, специфичных только для выбранных генов и представленных в табл. 1, где F - прямой праймер, R - обратный праймер, Probe - флуоресцентный зонд, FAM - флуоресцентный репортерный краситель, FQ - тушитель флуоресценции.
МС-ПЦР проводят в следующих условиях: начальная денатурация 3 мин при 95°C; затем 50 циклов, каждый из которых включает денатурацию при 95°C - 20 сек, отжиг праймеров при температуре 60°C - 10 сек и элонгацию при 72°C - 35 сек (каждый цикл сопровождается регистрацией флюоресцентного сигнала в диапазоне, соответствующем интервалам флюоресценции флюорофора FAM).
Далее проводят сравнительный анализ полученных результатов МС-ПЦР согласно значениям Ct (Threshold Cycle - пороговый цикл реакции) для аберрантно-метилированных маркерных генов и контрольного гена, и если значение Ct≤35,1 для гена FDPS, Ct≤41 для гена RARbeta2 и/или RASSF1A и/или Ct≤42,5 для гена TCF 21, то делают заключение о том, что пациент болен раком легкого, а, если значение Ct≤35,1 для гена FDPS, Ct≥41 для гена RARbeta2 и/или RASSF1A и/или Ct>42,5 для гена TCF 21, т.е. ниже достоверного уровня детекции для каждого из генов-мишеней, то делают заключение о том, что пациент здоров (т.е. у него нет злокачественных новообразований в легких).
Диагностическая чувствительность анализа, основанного на количественной МС-ПЦР для аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21, составляет не менее 92,3%, специфичность - не менее 95,2%.
Диапазоны значений Ct, позволяющие достоверно детектировать наличие аберрантно-метилированных маркерных генов в крови пациента, рассчитаны на основе предварительно проведенных экспериментов и представлены в Таблице 2, где Ct - пороговый цикл соответствующего маркерного гена.
Определяющими отличительными признаками предлагаемого способа, по сравнению с прототипом, являются:
1. ВнДНК выделяют из плазмы крови, взятой в объеме не менее 3 мл, что необходимо для получения достаточного количества внДНК и позволяет достоверно детектировать наличие/отсутствие аберрантно-метилированной (опухолевой) ДНК. Использование для анализа менее 3 мл плазмы крови приводит к повышению среднего значения Ct для контрольного гена FDPS до 35,2 и выше, что, в свою очередь, значительно снижает диагностическую чувствительность разработанных МС-ПЦР систем для аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21 на 15,5%, т.е. увеличивает долю ложноотрицательных результатов и снижает диагностическую эффективность предлагаемого способа.
2. В качестве маркерных выявляют гены RARbeta2, RASSF1A и TCF21, вовлеченные в молекулярные механизмы канцерогенеза легкого, что позволяет упростить способ вследствие подбора минимально значимого количества аберрантно-метилированных маркерных генов, а также повысить чувствительность и специфичность диагностики за счет того, что каждый из выбранных маркерных генов выявляется при раке легкого в не менее 50% случаев (12).
3. Выявление аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21 проводят в комплексе с контрольным геном FDPS, позволяющим оценить, достаточно ли в образце внДНК для достоверного анализа. Для этого гена подобраны специальные, независимые от метилирования, последовательности праймеров и зонда, что позволяет в случае (Ct) для гена FDPS>35,1 исключить исследуемый образец из дальнейшего анализа на маркерные гены (RARbeta2, RASSF1A и TCF21), свести к минимуму вероятность получения ложноотрицательных результатов по аберрантно-метилированным маркерным генам, а также делает разработанный способ менее трудоемким и более дешевым, поскольку нет необходимости проводить МС-ПЦР для неметилированных форм каждого маркерного гена, как в способе-прототипе.
4. МС-ПЦР проводят с использованием уникальных последовательностей праймеров и зондов, специфичных только для аберрантно-метилированных генов RARbeta2, RASSF1A и TCF21 и приведенных в табл. 1. Это позволяет дополнительно повысить специфичность диагностики за счет того, что разработанные системы праймеров/проб специфичны только к аберрантно-метилированной ДНК выбранных генов, не используют в качестве матрицы для ПЦР нормально метилированную ДНК, даже в условии ее 1000-кратного избытка.
5. МС-ПЦР проводят при оптимальных условиях амплификации для выбранных маркерных генов: начальная денатурация 3 мин при 95°C; затем 50 циклов, включающих денатурацию при 95°C - 20 сек, отжиг праймеров при температуре 60°C - 10 сек и последующую элонгацию при 72°C - 35 сек, что позволяет повысить чувствительность МС-ПЦР, которая составляет 2, 3, 4 копии метилированных генов RARbeta2, RASSF1A и TCF21 в 1000-кратном избытке неметилированных копий гена, соответственно.
6. Сравнительный анализ полученных результатов МС-ПЦР проводят согласно значениям порогового цикла (Ct) для маркерных и контрольного генов и при значении Ct≤35,1 для контрольного гена FDPS, Ct≤41 для генов RARbeta2 и/или RASSF1A и/или Ct≤42,5 для гена TCF 21 делают заключение о наличии у пациента онкологического заболевания, что позволяет обеспечить чувствительность диагностики не менее 92,3%, а специфичность - не менее 95,2, что превосходит прототип по чувствительности и специфичности на 8,7% и 21,2% соответственно.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1
Группу из 27 некурящих здоровых доноров-мужчин в возрасте от 33 до 44 лет обследовали заявляемым способом на наличие аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF2. Работа проводилась с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (указ Президента РФ от 24.12.1993 №2288) и с разрешения этических комитетов ИХБФМ СО РАН и Новосибирского института патологии кровообращения им Е.Н. Мешалкина. У всех здоровых доноров-добровольцев взяли кровь при помощи вакутейнера с антикоагулянтом (Vacuette, Greiner Bio-one, Австрия). Цельную кровь центрифугировали в течение 15 мин при 400 g. Плазму переносили в новую пробирку объемом 13 мл и повторно центрифугировали 20 мин при 400 g. Из полученной плазмы (3 мл) выделили внДНК с помощью набора для выделения ДНК из плазмы крови (ООО «БиоСилика», Россия) в полном соответствии с рекомендациями производителя. Далее полученную внДНК модифицировали бисульфитом натрия при помощи коммерческого набора EZ DNA Methylation-Gold Kit (Zymo Research PC, США) в соответствии с рекомендациями производителя. Модифицированную внДНК анализировали при помощи количественных МС-ПЦР на наличие аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21 и контрольный ген FDPS с использованием специально подобранных праймеров и зондов, специфичных только для выбранных генов и представленных в табл. 1.
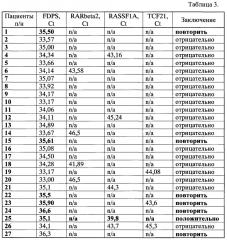
МС-ГЦР проводили в следующих условиях: начальная денатурация 3 мин при 95°C; затем 50 циклов, включающих денатурацию при 95°C - 20 сек, отжиг праймеров при температуре 60°C - 10 сек и последующую элонгацию при 72°C - 35 сек. Результаты исследования представлены в Таблице 3.
Из табл. 3 видно, что у пациента под №25 выявлена абберантно-метилированная форма гена RASSF1A (Ct=39,8), что указывает на высокую вероятность наличия рака легкого и необходимость прохождения дополнительного исследования, подтверждающего предварительный диагноз.
Также из табл. 3 видно, что предлагаемый способ обеспечивает специфичность анализа 95,2%. В шести случаях (22,2% от общего количества пациентов) образцы содержали недостаточное количество внДНК и для них требовался повторный анализ плазмы крови.
Пример 2
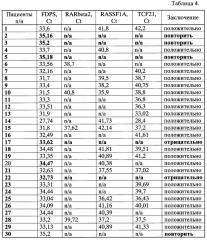
Группу из 30 человек, первично обратившихся по поводу заболевания раком легкого, обследовали заявляемым способом на наличие аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF2. Средний возраст исследуемых составил 63,6±9,3 лет, на момент выполнения исследования все включенные в исследование имели верифицированный диагноз рак легкого на стадиях от T2N0M0 до T4N2M1. У всех больных взяли кровь при помощи вакутейнера и получили плазму при помощи центрифугирования, как описано в примере 1. Из полученной плазмы (3 мл) выделили внДНК, которую немедленно модифицировали бисульфитом натрия так же, как описано в примере 1. Модифицированную внДНК анализировали при помощи количественных МС-ПЦР на наличие аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21 и контрольный ген FDPS, аналогично примеру 1. Результаты исследования представлены в Таблице 4, а на фиг. 1 изображен ROC-анализ (график зависимости истинно положительных от ложноположительных результатов) результатов, представленных в таблицах 3 и 4.
Из табл. 4 видно, что только у двух пациентов (№17 и №22) не выявлено аберрантно-метилированных маркерных генов, что обеспечивает чувствительность предлагаемого способа на уровне 92,3%.
Также из табл. 4 и фиг. 1 видно, что использование предлагаемого способа обеспечивает специфичность анализа 95,2%. В четырех случаях (13,3% от общего количества пациентов) образцы содержали недостаточное количество цирДНК и для них требовался повторный анализ плазмы крови.
Пример 3
Для подтверждения пригодности предлагаемого способа для раннего выявления рака легкого в группе пациентов с хроническими обструктивными заболеваниями легкого (ХОБЛ) (n=12; некурящие; возраст от 35 до 63 лет; средний возраст 48,5 года) было проведено скрининговое исследование с целью выявления потенциальных носителей опухоли. У всех пациентов группы взяли кровь при помощи вакутейнера с антикоагулянтом и получили плазму при помощи центрифугирования, аналогично примеру 1. Выделение и модификацию внДНК выполняли так же, как описано в примере 1. Модифицированную внДНК анализировали при помощи количественных МС-ПЦР на наличие аберрантно-метилированных маркерных генов RARbeta2, RASSF1A и TCF21 и контрольный ген FDPS, аналогично примеру 1. Результаты исследования представлены в Таблице 5.
Из табл. 5 видно, что с помощью предлагаемого способа в группе пациентов с ХОБЛ выявили двух носителей аберрантно-метилированного маркерного гена (№5 и №9), что позволило вовремя направить этих пациентов на дополнительное обследование, по результатам которого у одного был подтвержден рак легкого, а у второго пациента на момент исследования опухолевого процесса не обнаружено, но он находится под наблюдением врачей.
Данный пример иллюстрирует, что разработанный способ может быть успешно использован для раннего выявления опухоленосителей в группах риска по раку легкого.
Разработанный способ обладает высокой чувствительностью и специфичностью, четкой алгоритмизацией анализа данных и может быть использован при скриннинговых медицинских обследованиях в районах/производствах, неблагополучных по раку легкого, а также для мониторинга эффективности противоопухолевой терапии после операционного вмешательства.
Источники информации
1. Fleischhacker М., Schmidt В. Circulating nucleic acids (CNAs) and cancer - a survey. // Biochim Biophys Acta. - 2007. - V. 1775(1). P. 181-232.
2. Nikolaidis G., Raji O.Y., Markopoulou S. et al. DNA methylation biomarkers offer improved diagnostic efficiency in lung cancer. // Cancer Res. - 2012. - V. 72(22). P. 5692-5701.
3. Liloglou Т., Bediaga N.G., Brown B.R. et al. Epigenetic biomarkers in lung cancer. // Cancer Lett. - 2014. - V. 342(2). P. 200-212.
4. Nawaz I., Qiu X., Wu H. et al. Development of a multiplex methylation specific PCR suitable for (early) detection of non-small cell lung cancer. // Epigenetics. - 2014.- V. 9(8). P.1138-1148.
5. Usadel H., Brabender J., Danenberg K.D. et al. Quantitative adenomatous polyposis coli promoter methylation analysis in tumor tissue, serum, and plasma DNA of patients with lung cancer. // Cancer Res. - 2002. - V. 62(2). P. 371-375.
6. Ulivi P., Zoli W., Calistri D. et al. pl6INK4A and CDH13 hypermethylation in tumor and serum of non-small cell lung cancer patients. // J Cell Physiol. - 2006. V. 206(3). P. 611-615.
7. Herman J.G., Graff J.R., S. et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. // Proc Natl Acad Sci U S A. - 1996. - V. 93(18). P. 9821-9826.
8. Fujiwara K., Fujimoto N., Tabata M. et al. Identification of epigenetic aberrant promoter methylation in serum DNA is useful for early detection of lung cancer. // Clin Cancer Res. - 2005. - V. 11(3). P. 1219-1225.
9. Zhang Y., Wang R., Song H. et al. Methylation of multiple genes as a candidate biomarker in non-small cell lung cancer. // Cancer Lett. - 2011. - V. 303(1). P. 21-28.
10. Boom R., Sol C.J.A. Rapid and simple method for purification nucleic acids // J. Clin. Microbiol. 1990. V. 28. P. 495-503.
11. Harden S.V., Tokumaru Y., Westra W. et al. Gene promoter hypermethylation in tumors and lymph nodes of stage I lung cancer patients. // Clin Cancer Res. - 2003. - V. 9(4). P. 1370-1375.
12. Hsu H.S., Chen T.P., Hung C.H. et al. Characterization of a multiple epigenetic marker panel for lung cancer detection and risk assessment in plasma // Cancer. 2007. Vol. 110(9). P. 2019-2026.
1. Способ диагностики рака легкого, включающий сбор крови, получение плазмы крови при помощи центрифугирования, выделение внДНК из плазмы, модификацию внДНК бисульфитом натрия с последующим выявлением аберрантно-метилированных маркерных генов при помощи МС-ПЦР с использованием праймеров и зондов, специфичных для выбранных генов, сравнительным анализом результатов ПЦР и составлением заключения о наличии онкологического заболевания, отличающийся тем, что для выделения внДНК используют не менее 3 мл плазмы крови, в качестве аберрантно-метилированных маркерных генов выявляют гены RARbeta2, RASSF1A и TCF21, а также контрольный ген FDPS, сравнительный анализ полученных результатов МС-ПЦР проводят согласно значениям порогового цикла (Ct) для маркерных и контрольного генов и при значении Ct≤35,1 для гена FDPS, Ct≤41 для генов RARbeta2 и/или RASSF1A и/или Ct≤42,5 для гена TCF21 делают заключение о наличии рака легкого у пациента
2. Способ по п. 1, отличающийся тем, что внДНК выделяют из плазмы крови при помощи стекловолокнистых фильтров в присутствии хаотропных солей.
3. Способ по п. 1, отличающийся тем, что ПЦР амплификацию внДНК проводят в следующих условиях: начальная денатурация 3 мин при 95°C; затем 50 циклов, каждый из которых включает денатурацию при 95°C - 20 сек, отжиг праймеров при температуре 60°C - 10 сек и элонгацию при 72°C - 35 сек.