Дейтерированный фениламинопиримидин и фармацевтическая композиция, содержащая такое соединение
Иллюстрации
Показать всеИзобретение относится к дейтерированному фениламинопиримидину формулы (I) или его фармацевтически приемлемым солям:
.
В формуле (I) R1, R2, R13, R14, R15, R16, R17, R18, R19, R20, R21 и R22 представляют собой каждый независимо водород или дейтерий; R3, R4, R5, R6, R7, R8, R9, R10 и R11 представляют собой каждый независимо водород; R12 представляет собой водород; при условии, что по меньшей мере один из R1, R2, R13, R14, R15, R16, R17, R18, R19, R20, R21 или R22 являются дейтерированным или дейтерием. Изобретение также относится к фармацевтической композиции для ингибирования JAK-киназы и к применению соединений для получения фармацевтической композиции. Технический результат: получены новые соединения формулы (I), обладающие свойствами ингибитора JAK-киназы. 3 н. и 6 з.п. ф-лы, 1 ил., 4 табл., 13 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области фармацевтики. В частности настоящее изобретение относится к новому соединению из ряда дейтерированных фениламинопиримидинов или фармацевтическим композициям, которые включают указанное соединение.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
JAK (Янус киназа) является одним из типов семейства не-рецепторных тирозинкиназ, включающим 4 члена, которыми являются JAK1, JAK2, JAK3 и TYK1, соответственно. Они не содержат SH2 или SH3 в структуре, и на их С-концах находятся два соединенных участка киназы. Субстратом JAK является STAT, то есть проводники сигнала и активаторы транскрипции. STAT димеризуется после фосфорилирования с помощью JAK, и проходит через ядерную мембрану в ядро для регуляции экспрессии соответствующих генов, этот путь передачи сигнала называется JAK-STAT путь, и он играет важную роль в обеспечении связи кроветворных клеток и иммунных клеток. Эффективные и специфические ингибиторы четырех JAK-киназ, известные в настоящее время, могут быть использованы для лечения рака, воспаления и других заболеваний. Селективный ингибитор JAK3, тофацитиниб (название продукта: Кселянз, Xeljanz), от Пфайзер, утвержден Управлением по контролю за продуктами питания и лекарственными средствами США для применения в лечении ревматоидного артрита в декабре 2012 года.
Фениламинопиримидиновые соединения и производные являются видом ингибиторов не-рецепторных тирозинкиназ, таких как JAK-киназы. В WO 2008109943 и US 2011212077 раскрыт ряд фениламинопиримидиновых производных, в которых пиримидиновое кольцо было 2,4-бис-замещенным. Среди этих производных, соединение CYT387 является селективным ингибитором JAK1 и JAK2-киназы, с химическим названием N-(цианометил)-4-(2-(4-морфолино-фениламино)пиримидин-4-ил)бензамид, и используется в лечении рака, миелопролиферативных заболеваний и других родственных заболеваний. Это соединение сейчас находится во II фазе клинических испытаний лечения миелопролиферативных заболеваний.
Хотя целевое ингибирование различных протеинкиназ является полезным для лечения заболеваний, связанных с киназой, открытие новых соединений, которые специфически ингибируют определенные протеинкиназы и имеют потенциал к использованию в качестве лекарства, такой как отличная пероральная биодоступность, все еще представляет собой сложности. Кроме того, существуют некоторые побочные эффекты и проблемы лекарственной устойчивости для некоторых из ингибиторов протеинкиназы, доступных в настоящее время на рынке.
Таким образом, в данной области все еще существует потребность в разработке соединений, обладающих ингибирующей JAK-киназу активностью, или имеющих лучшие фармакодинамические свойства.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение класса новых соединений, обладающих ингибирующей JAK киназы активностью и лучшими фармакодинамическими свойствами, и их применение.
В первом аспекте настоящего изобретения оно предлагает дейтерированный фениламинопиримидин формулы (I), или его кристаллическую форму, фармацевтически приемлемую соль, гидрат или сольват:
где R1, R2, R13, R14, R15, R16, R17, R18, R19, R20, R21 и R22 представляют собой каждый независимо водород или дейтерий;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 представляют собой каждый независимо водород, дейтерий, галоген, недейтерированный C1-C6 алкил или C1-C6 алкокси, моно- или полидейтерированный или полностью дейтерированный C1-C6 алкил или C1-C6 алкокси, или моно- или полигалогенированный или полностью галогенированный C1-C6 алкил или C1-C6 алкокси;
R12 выбран из группы, состоящей из водорода, дейтерия, галогена, OR23, COOR23, COSR23, CONHR23 или CON(R23)2; причем R23 выбран из группы, состоящей из водорода, дейтерия, замещенного или незамещенного C1-C6-алкил или С3-С8-циклоалкил, при этом заместитель выбран из группы, состоящей из следующих: галоген, циано, C1-C6-алкил или C1-C6-алкокси;
при условии, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14, R15, R16, R17, R18, R19, R20, R21 или R22 являются дейтерированным или дейтерием.
В другом предпочтительном варианте реализации содержание изотопа дейтерия в дейтерии в дейтериево-замещенном положении является по меньшей мере выше, чем содержание природного изотопного дейтерия (около 0,015%), предпочтительно на 30%, более предпочтительно 50%, более предпочтительно 75%, более предпочтительно 95%, более предпочтительно 99%.
В другом предпочтительном варианте реализации соединение формулы (I) содержит по меньшей мере один атом дейтерия, более предпочтительно два атома дейтерия, более предпочтительно четыре атома дейтерия, более предпочтительно шесть атомов дейтерия.
В еще одном предпочтительном варианте реализации R1 и R2 представляют собой водород или дейтерий.
В другом предпочтительном варианте реализации, R12 представляют собой водород или дейтерий.
В другом предпочтительном варианте реализации, R13, R14, R15 или R16 представляют собой водород или дейтерий.
В другом предпочтительном варианте реализации, R17, R18, R19 или R20 представляют собой водород или дейтерий.
В другом предпочтительном варианте реализации, R13, R14, R15, R16, R17, R18, R19 или R20 представляют собой дейтерий.
В другом предпочтительном варианте реализации, R3, R4, R5, R6, R7 или R8 каждый независимо выбран из группы, состоящей из водорода, дейтерия, моно- или полидейтерированного или полностью дейтерированного метила или метоксила, или моно- или полидейтерированного или полностью дейтерированного этила или этоксила.
В другом предпочтительном варианте реализации R3, R4, R5, R6, R7 или R8 каждый независимо выбран из группы, состоящей из: монодейтерированного метили, дидейтерированного метила, тридейтерированного метила, монодейтерированного метоксила, дидейтерированного метоксила, тридейтерированного метоксила, монодейтерированного этила, дидейтерированного этила, тридейтерированного этила, тетрадейтерированного этила, пентадейтерированного этила, монодейтерированного этоксила, дидейтерированного этоксила, тридейтерированного этоксила, тетрадейтерированного этоксила и пентадейтерированного этоксила.
В еще одном предпочтительном варианте реализации соединение представляет собой соединение, выбранное из группы, состоящей из следующих веществ или их фармацевтической приемлемой соли:
N-(циано(d2-метил))-4-(2-(4-(d8-морфолино)фениламино)пиримидин-4-ил)бензамид;
N-(циано(d2-метил))-4-(2-(4-(2',2',6',6'-d4-морфолино)фениламино)пиримидин-4-ил)бензамид;
N-(циано(d2-метил))-4-(2-(4-(3',3',5',5'-d4-морфолино)фениламино)пиримидин-4-ил)бензамид;
N-(цианометил)-4-(2-(4-(d8-морфолино) фениламино)пиримидин-4-ил)бензамид;
N-(цианометил)-4-(2-(4-(2',2',6',6'-d4-морфолино)фениламино)пиримидин-4-ил)бензамид;
N-(цианометил)-4-(2-(4-(3',3',5',5'-d4-морфолино)фениламино)пиримидин-4-ил)бензамид;
N-(циано(d2-метил))-4-(2-(4-морфолинфениламино)пиримидин-4-ил)бензамид;
В другом предпочтительном варианте реализации, соединение представляет собой
которое имеет следующие характеристики:
MS вычисленное: 422; MS найденное: 423 (М+Н)+, 445 (M+Na)+.
В другом предпочтительном варианте реализации, соединение представляет собой
которое имеет следующие характеристики:
MS вычисленное: 424; MS найденное: 425 (М+Н)+, 447 (M+Na)+.
Еще в одном предпочтительном варианте реализации, соединение представляет собой
которое имеет следующие характеристики:
MS вычисленное: 416; MS найденное: 417 (М+Н)+, 439 (M+Na)+.
В следующем предпочтительном варианте реализации соединение представляет собой
которое имеет следующие характеристики:
MS вычисленное: 418; MS найденное: 419 (М+Н)+, 441 (M+Na)+.
В другом предпочтительном варианте реализации соединение представляет собой
которое имеет следующие характеристики:
MS вычисленное: 420; MS найденное: 421 (М+Н)+, 443 (M+Na)+.
В другом предпочтительном варианте реализации, соединение не содержит недейтерированных соединений.
В другом предпочтительном варианте реализации, недейтерированное соединение представляет собой N-(цианометил)-4-(2-(4-морфолинофениламино)пиримидин-4-ил)бензамид.
В другом предпочтительном варианте реализации соединение получают способом, описанным в Примерах 1-8.
Во втором аспекте настоящего изобретения предложен способ получения фармацевтических композиций, включающий следующий этап: смешивание соединения согласно первому аспекту настоящего изобретения, или его кристаллической формы, фармацевтически приемлемой соли, гидрата или сольвата и фармацевтически приемлемого носителя, для получения фармацевтической композиции.
В третьем аспекте настоящего изобретения предлагается фармацевтическая композиция, которая содержит фармацевтически приемлемый носитель и соединение по первому аспекту настоящего изобретения, или его кристаллическую форму, фармацевтически приемлемую соль, гидрат или сольват.
В другом предпочтительном варианте реализации фармацевтическая композиция представляет собой раствор для инъекций, капсулу, таблетку, пилюлю, порошок или гранулу.
В другом предпочтительном варианте реализации фармацевтическая композиция далее содержит дополнительный терапевтический агент, который является лекарством для лечения рака, сердечно-сосудистых заболеваний, воспаления, иммунных заболеваний, миелопролиферативных заболеваний, вирусных болезней, болезней обмена веществ или трансплантации органов.
Более предпочтительно, дополнительный терапевтический агент содержит (но не ограничивается этим): 5-фторурацил, Avastin™ (авастин, бевацизумаб), Bexarotene (бексаротен), бортезомиб (бортезомиб), кальцитриол (кальцитриол), канертиниб (канертиниб), капецитабин (капецитабин), карбоплатин (карбоплатин), целекоксиб (целекоксиб), цетуксимаб (цетуксимаб), цисплатин (цисплатин), дазатиниб (дазатиниб), дигоксин (дигоксин), энзастаурин, Эрлотиниб (Эрлотиниб), этопозид (этопозид), эверолимус (эверолимус), фулвестрант (фулвестрант), гефитиниб (гефитиниб), 2,2-дифтор-дезоксицитидин (гемцитабин), генистеин (генистеин), иматиниб (иматиниб), иринотекан (иринотекан), лапатиниб (лапатиниб), леналидомид (леналидомид), летрозол (летрозол), фолиновую кислоту (лейковорин), матузумаб (матузумаб), оксалиплатин (оксалиплатин), Таксол (паклитаксел), панитумумаб (панитумумаб), пегилированный гранулоцитарный колониестимулирующий фактор (пегфилграстин), пегилированный альфа-интерферон (пегилированный альфа-интерферон), пеметрексед (пеметрексед), Полифенон® Е (Polyphenon® Е), сатраплатин (сатраплатин), сиролимус (сиролимус), сунитиниб (сутент, сунитиниб), сулиндаковую кислоту (сулиндак), Таксотер (таксотер), темозоломид (темодар, темозомоломид), Торисел (Torisel), Темсиролимус (темсиролимус), типифарниб (типифарниб), трастузумаб (трастузумаб), вальпроевую кислоту (вальпроевая кислота), дитартрат (дитартрат), волоциксимаб (Volociximab), вориностат (Vorinostat), сорафениб (Сорафениб), амбрисентан (амбрисентан), CD40- и/или СР154-специфичные антитела, гибридные белки, NF-κВ ингибиторы, нестероидные противовоспалительные препараты, β-агонисты, такие как ингибиторы сальметерол и ингибиторы фактора свертывания крови FXa (например, ривароксабан и т.д.), анти-ФНО (TNF) антитело, препараты простагландина или монтелукаст (монтелукаст).
В четвертом аспекте настоящего изобретения предложено применение соединения согласно первому аспекту настоящего изобретения, или его кристаллической формы, фармацевтически приемлемой соли, гидрата или сольвата для приготовления фармацевтической композиции для ингибирования протеинкиназ (например, JAK-киназ).
В другом предпочтительном варианте реализации фармацевтическую композицию применяют для лечения и профилактики следующих заболеваний: рак, миелопролиферативные заболевания, воспаление, иммунные заболевания, трансплантация органов, вирусные заболевания, сердечно-сосудистые заболевания или метаболические заболевания.
В другом предпочтительном варианте реализации рак включает (но не ограничивается этим): немелкоклеточный рак легкого, рак матки, рак прямой кишки, рак толстой кишки, рак мозга, рак головы, рак шеи, рак мочевого пузыря, рак простаты, рак молочной железы, рак почки, лейкоз, рак печени, рак желудка, рак щитовидной железы, рак носоглотки или рак поджелудочной железы.
В другом предпочтительном варианте реализации миелопролиферативные заболевания включают (но не ограничиваются этим): спонтанную тромбоцитемию (ЕТ), идиопатический миелофиброз (МФМ, IMF), хронический миелолейкоз (ХМЛ, CML), первичный миелофиброз, хронический нейтрофильный лейкоз (ХНЛ, CNL) или истинную полицитемию (ИП, PV).
В другом предпочтительном варианте реализации воспаление или иммунные заболевания включают (но не ограничиваются этим): ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагру, астму, бронхит, ринит, хроническое обструктивное заболевание легких, кистозный фиброз (муковисцидоз).
В пятом аспекте настоящего изобретения предложен способ ингибирования протеинкиназы (например, JAK-киназы) или лечения заболеваний (таких как рак, миелопролиферативные заболевания, воспаление, иммунные заболевания, трансплантация органов, вирусные заболевания, сердечнососудистые заболевания или заболевания обмена веществ), причем способ включает следующий этап: введение субъекту, нуждающемуся в этом, соединения по первому аспекту настоящего изобретения, или его кристаллической формы, фармацевтически приемлемой соли, гидрата или сольвата, или введение субъекту, нуждающемуся в этом, фармацевтической композиции по третьему аспекту настоящего изобретения.
Следует понимать, что в пределах объема настоящего изобретения, каждый из технических признаков, конкретно описанных выше и ниже (например, описанные в Примерах), могут быть объединены друг с другом, тем самым составляя новые или предпочтительные технические решения, которые нет необходимости подробно описывать снова в данном документе.
ВАРИАНТЫ РЕАЛИЗАЦИИ ДЛЯ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
В ходе исследования изобретатель неожиданно обнаружил, что дейтерированные фениламинопиримидины или их фармацевтически приемлемые соли по настоящему изобретению удивительно превосходят недейтерированные соединения по фармакокинетическим и/или фармакодинамическим свойствам, и, следовательно, больше подходят для использования в качестве ингибиторов JAK-киназы и, таким образом, больше подходят для применения при производстве лекарственных средств для лечения рака и заболеваний, связанных с JAK-киназами. На этой основе было выполнено настоящее изобретение.
ОПРЕДЕЛЕНИЯ
Как здесь использовано, термин "галоген" относится к F, Cl, Br и I. Более предпочтительно атом галогена выбирают из F, Cl и Br.
Как здесь использовано, термин "C1-C6-алкил" относится к прямой или разветвленной алкильной группе, которая включает от 1 до 6 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил или аналогичным группам.
Как здесь использовано, термин "C1-C6-алкокси" относится к прямой или разветвленной алкоксигруппе, которая содержит от 1 до 6 атомов углерода, такой как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, или аналогичным группам.
Как здесь использовано, термин "С3-С8-циклоалкил" относится к циклоалкильной группе, которая включает от 3 до 8 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил, или аналогичным группам.
Как здесь использовано, термин «дейтерированный» означает, что один или несколько водородов в соединении или группе замещены на дейтерий. "Дейтерированный" может быть монозамещенным, дизамещенным, полизамещенным или полностью замещенным. Термин "один или более дейтерированный" и "моно- или полидейтерированный" может быть использован взаимозаменяемо.
Как здесь использовано, термин «недейтерированное соединение» относится к соединению, которое имеет процентное содержание атома дейтерия не выше, чем природное изотопное содержание дейтерия (около 0,015%).
В другом предпочтительном варианте реализации, содержание изотопа дейтерия в дейтерий-замещенном положении больше, чем природный изотопный дейтериевый состав (0,015%), более предпочтительно больше, чем природный изотопный состав дейтерия на 50%, более предпочтительно 75%, более предпочтительно 95%, более предпочтительно 97%, более предпочтительно 99%, более предпочтительно 99,5%.
В другом предпочтительном варианте реализации соединение формулы (I) содержит по меньшей мере 2 атома дейтерия, более предпочтительно 4 атома дейтерия, более предпочтительно 6 атомов дейтерия, более предпочтительно от 8 атомов дейтерия.
Предпочтительно, в соединении формулы (I), N является 14N и/или О является 16O.
В другом предпочтительном варианте реализации в соединении содержание 14N изотопа в положении атома азота составляет ≥95%, предпочтительно ≥99%.
В другом предпочтительном варианте реализации в соединении, содержание 16O изотопа в положении атома кислорода составляет ≥95%, предпочтительно ≥99%.
ОПРЕДЕЛЕНИЯ
Как используется здесь, термин «соединение по настоящему изобретению» относится к соединению формулы (I). Этот термин также включает кристаллические формы, фармацевтически приемлемые соли, гидраты или сольваты соединения формулы (I).
Там, где используется термин "фармацевтически приемлемая соль», он относится к соли, образованной соединением по настоящему изобретению и кислотой или основанием, которое пригодно для применения в качестве лекарственного средства. Фармацевтически приемлемые соли включают неорганические и органические соли. Предпочтительным типом солей являются соли, образованные соединением по настоящему изобретению и кислотой. Подходящие солеобразующие кислоты включают, но не ограничиваются: неорганические кислоты, такие как соляная кислота, бромоводородная кислота, фтороводородная кислота, серная кислота, азотная кислота, фосфорная кислота; органические кислоты, такие как муравьиная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, пикриновая кислоты, бензойная кислоты, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота, нафталинсульфокислоты и тому подобное; и аминокислоты, такие как пролин, фенилаланин, аспарагиновая кислота, глутаминовая кислота. Другим предпочтительным типом солей являются соли, образованные соединением по настоящему изобретению и основанием, например, соли щелочных металлов (например, натриевые или калиевые соли), соли щелочно-земельных металлов (например, кальциевые или магниевые соли), аммониевые соли (например, аммониевые соли низших алканолов или другие фармацевтически приемлемые соли аминов), например, соли метиламина, соли этиламина, соли пропиламина, соли диметиламина, соли триметиламина, соли диэтиламина, соли триэтиламина, соли трет-бутил аминов, соли этилендиамина, соли гидроксиэтиламина, соли дигидроксиэтиламина, соли тригидроксиэтиламина и соли аминов, образованных морфолином, пиперазином, и лизином, соответственно.
Термин «сольват» относится к комплексу конкретного соотношения, образованному путем комплексообразования между соединением по настоящему изобретению и молекулой растворителя. Термин «гидрат» относится к комплексу, образованному путем комплексообразования между соединением по настоящему изобретению и водой.
Кроме того, соединения по настоящему изобретению дополнительно включают пролекарства фениламинопиримидиновых соединений формулы (I). Термин "пролекарство" включает класс соединений, которые имеют биологическую активность или отсутствие активности и преобразуются в соединение формулы (I) путем обмена веществ (метаболизма) или химических реакций в организме человека при введении с помощью подходящих методов, или его соль или раствор, образованный соединением формулы (I). Пролекарства включают (но не ограничиваются) сложный эфир карбоновой кислоты, угольной кислоты, фосфат, нитрат, сульфат, сульфоновый эфир, сульфоксид эфиры, аминосоединения, карбаматы, азосоединения, фосфорамиды, глюкозид, эфир, ацеталь соединения, и т.д.
СПОСОБ ПОЛУЧЕНИЯ
Далее более подробно описано получение соединений формулы (I), но такие специфические способы не являются какими-либо ограничениями для настоящего изобретения. Соединения по изобретению могут также быть легко получены с помощью возможного комбинирования различных методов синтеза, приведенных в данном описании или известных в данной области. Такие комбинации могут быть легко выполнены специалистом с обычной квалификацией в данной области, согласно настоящему изобретению.
Способы получения соединений недейтерированного фениламинопиримидина и их физиологически приемлемых солей, используемые в настоящем изобретении, известны в данной области. Получение соответствующих дейтерированных соединений ряда фениламинопиримидина может быть проведено с помощью соответствующего дейтерированного соединения в виде исходного реагента и синтеза аналогичным путем. Например, соединение формулы (I) по настоящему изобретению может быть получено в соответствии со способом, описанным в WO 2008109943, за исключением того, что используют дейтерированный реагент вместо недейтерированного реагента.
Как правило, в процессе подготовки, каждую реакцию обычно проводят в инертном растворителе, при комнатной температуре до температуры дефлегмации (например, 0°C~80°C, предпочтительно от 0°C~50°C). Время реакции обычно составляет от 0,1 часа до 60 часов, предпочтительно от 0,5 до 48 часов.
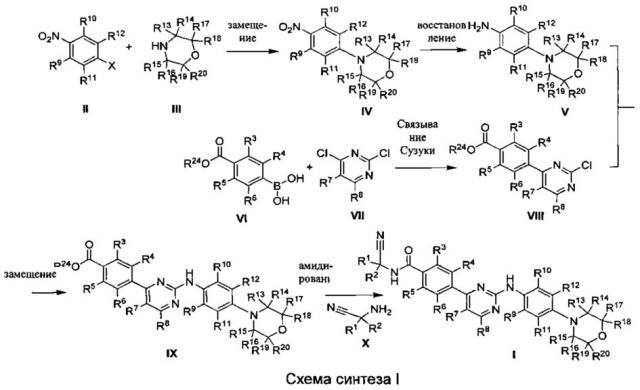
Следующий общий препаративный путь может быть использован при синтезе компонентов формулы (I) по настоящему изобретению.
где X выбран из F, Cl, Br, I; определения R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19 или R20 такие, как указано выше; R24 выбран из водорода, и C1-C6 алкила.
Как показано на схеме синтеза I, нитробензольное соединение II и соединение морфолина III реагируют с образованием 4-морфолинозамещенных нитробензолов соединения IV, которое затем восстанавливают для получения 4-морфолинозамещенного фениламинового соединения V. Соединение фенилборной кислоты VI и соединение 2,4-дихлорпиримидина VII продуцируют соединение VIII посредством реакции Сузуки. Соединение VIII реагирует с соединением V с образованием фениламинопиримидинового соединения IX. Соединение IX и аминоацетонитрилсоединение X реагируют с получением Соединения I по настоящему изобретению с помощью амидирования. Вышеуказанные реакции проводят в инертных растворителях, таких как дихлорметан, дихлорэтан, ацетонитрил, n-гексан, толуол, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид, и т.д., и при температуре от 0°C до 200°C.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ВВЕДЕНИЯ
Соединения по настоящему изобретению обладают выдающейся активностью по ингибированию протеинкиназы (такой как JAK-киназы). Таким образом, соединения по настоящему изобретению, и различные кристаллические формы, фармацевтически приемлемые неорганические или органические соли, гидраты или сольваты, и фармацевтическая композиция, содержащая соединение по настоящему изобретению в качестве основного активного ингредиента, может быть использована для лечения, профилактики и облегчения заболеваний, опосредованных протеинкиназами (например, JAK-киназами). На основании предшествующего уровня техники, соединения по настоящему изобретению могут лечить следующие заболевания: рак, миелопролиферативные заболевания, воспаления, иммунные заболевания, трансплантации органов, вирусные заболевания, сердечно-сосудистые заболевания или заболевания обмена веществ и т.д.
Фармацевтическая композиция по настоящему изобретению включает соединение по настоящему изобретению или его фармацевтически приемлемые соли в безопасном и эффективном количестве и фармацевтически приемлемые наполнители или носители. При этом термин "безопасная и эффективная дозировка» относится к количеству соединения, которое является достаточным для улучшения состояния пациента без каких-либо серьезных побочных эффектов. Как правило, фармацевтическая композиция содержит 1-2000 мг соединения по изобретению на дозу, предпочтительно, 10-200 мг соединения по изобретению на дозу (per dose). Предпочтительно "на дозу" («per dose») означает одну капсулу или таблетку.
"Фармацевтически приемлемый носитель" означает один или несколько совместимых твердых или жидких наполнителей или гелеподобных материалов, которые пригодны для использования человеку, и который должен иметь достаточную чистоту и достаточно низкую токсичность. "Совместимость" здесь означает, что компоненты композиций могут быть смешаны с соединениями по настоящему изобретению или друг с другом, и не будут значительно уменьшать эффективность соединений. Некоторые примеры фармацевтически приемлемых носителей включают целлюлозу и ее производные (например, натрий карбоксиметилцеллюлоза, натрий этилцеллюлоза, ацетатцеллюлозы и т.д.), желатин, тальк, твердые смазки (например, стеариновая кислота, стеарат магния), сульфат кальция, растительные масла (например, соевое масло, кунжутное масло, арахисовое масло, оливковое масло и т.д.), полиолы (такие как пропиленгликоль, глицерин, маннит, сорбит и т.д.), эмульгаторы (например, Твин, Tween®), смачивающий агент (например, додецилсульфат натрия), красящие агенты, ароматизирующие агенты, стабилизаторы, антиоксиданты, консерванты, апирогенная вода, и т.д.
Не существует особых ограничений для режимов введения соединений или фармацевтических композиций по настоящему изобретению, и репрезентативный способ введения включает (но не ограничивается ими): пероральное, внутриопухолевое, ректальное, парентеральное (внутривенное, внутримышечное или подкожное), и местное введение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах, активные соединения смешивают по меньшей мере с одним из общепринятых инертных наполнителей (или носителей), таких как цитрат натрия или CaHPO4, или смешивают с любым из следующих компонентов: (а) наполнители или агенты, улучшающие совместимость, например, крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; (b) связующие, например, гидроксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; (с) увлажнитель, такой как глицерин; (d) дезинтегрирующие агенты, такие как агар, карбонат кальция, картофельный крахмал или тапиоковый крахмал, альгиновая кислота, некоторые композиционные силикаты, и карбонат натрия; (е) замедляющие растворение агенты, такие как парафин; (f) ускорители абсорбции, например, четвертичные аммониевые соединения; (g) смачивающие агенты, такие как цетиловый спирт, моностеарат глицерина (h) адсорбенты, например, каолин; и (i) смазывающие вещества, такие как тальк, стеарин кальциевый, стеарат магния, твердый полиэтиленгликоль, лаурилсульфат натрия, или их смеси. В капсулах, таблетках и пилюлях, дозированные формы могут также содержать буферные агенты.
Твердые дозированные формы, такие как таблетки, сахарные пилюли, капсулы, пилюли и гранулы, могут быть получены с использованием материалов для покрытий и оболочки, таких как кишечнорастворимые покрытия и любых других материалов, известных в данной области техники. Они могут содержать матирующий агент. Высвобождение активных соединений или соединений в композициях может происходит в замедленном режиме в определенной части желудочно-кишечного тракта. Примеры покрывающих компонентов включают полимеры и воски. При необходимости активные соединения и один или более из указанных выше наполнителей могут образовывать микрокапсулы.
Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы или настойки. В дополнение к активным соединениям, жидкие лекарственные формы могут содержать любые традиционные инертные разбавители, известные в данной области, такие как вода или другие растворители, солюбилизаторы и эмульгаторы, например, этанол, изопропанол, этиловый карбонат, этилацетат, пропиленгликоль, 1,3-бутандиол, диметилформамид, а также масло, в частности, хлопковое масло, арахисовое масло, кукурузное масло, оливковое масло, касторовое масло и кунжутное масло, или их комбинации.
Помимо этих инертных разбавителей композиции могут также содержать добавки, такие как смачивающие агенты, эмульгаторы и суспендирующие средства, подслащивающие, вкусовые агенты и ароматизаторы.
В дополнение к активным соединениям, суспензия может содержать суспендирующий агент, например, этоксилированный изооктадеканол, полиоксиэтиленсорбит и сложные эфиры сорбита, микрокристаллическую целлюлозу, метанол алюминия и агар, или их комбинации.
Композиции для парентерального введения, могут включать физиологически приемлемые стерильные водные или безводные растворы, дисперсии, суспензии или эмульсии, и стерильные порошки, которые могут быть повторно растворены в стерильных инъекционных растворах или дисперсиях. Подходящие водные и неводные носители, разбавители, растворители или наполнители включают воду, этанол, полиолы и их любые подходящие смеси.
Лекарственные формы для местного введения соединений по настоящему изобретению включают мази, порошки, аэрозоли, пластыри, и ингаляторы. Активные ингредиенты смешивают с физиологически приемлемыми носителями и любыми консервантами, буферами или пропеллентами, в случае необходимости, в стерильных условиях.
Соединения по настоящему изобретению можно вводить отдельно или в сочетании с любыми другими фармацевтически приемлемыми соединениями.
Когда фармацевтические композиции используют, безопасное и эффективное количество соединения по настоящему изобретению вводят млекопитающему (например, человеку), который в этом нуждается, при этом доза введения является фармацевтически эффективной дозой. Для человека, весящего 60 кг, суточная доза обычно составляет от 1 до 2000 мг, предпочтительно от 20 до 500 мг. Конечно, конкретная доза должна зависеть от различных факторов, таких как способ введения, состояния здоровья пациента, что находится в компетенции опытного врача.
По сравнению с недейтерированными соединениями, известными в предшествующем уровне техники, соединения по настоящему изобретению обладают рядом преимуществ. Основные преимущества настоящего изобретения включают:
(1) Соединения по настоящему изобретению обладают превосходной ингибирующей активностью по отношению к протеинкиназе (например, JAK-киназе).
(2) Метаболизм дейтерированных соединений в организме изменяют с помощью технологии дейтерирования, таким образом, придавая соединениям улучшенные фармакокинетические параметры. В этом случае доза может варьироваться и может быть получен препарат длительного действия, с улучшением применимости.
(3) В соединениях водород был замещен дейтерием, лекарственная концентрация соединения у животных может быть повышена за счет влияния дейтериевого изотопа, тем самым повышая эффективность препарата.
(4) Водород в соединениях был замещен дейтерием, и так как некоторые метаболиты подавлены, то безопасность соединений может быть повышена.
Настоящее изобретение будет дополнительно проиллюстрировано ниже со ссылкой на конкретные примеры. Следует понимать, что эти примеры приведены только для иллюстрации настоящего изобретения, но не для ограничения объема изобретения. Экспериментальные методы без конкретных условий, описанные в следующих примерах, как правило, выполняют в соответствии с общепринятыми условиями, или в соответствии с инструкциями производителя. Если не указано иное, то части и проценты вычисляются по весу. В настоящем изобретении "биотин" означает биотин.
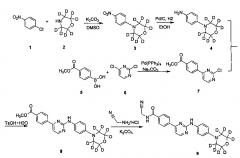
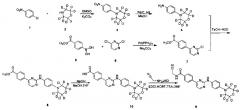
Пример 1: получение N-(цианометил)-4-(2-(4-(d8-морфолино)фениламино)пиримидин-4-ил)бензамида (соединение 9)
1. Получение 4-(4-нитрофенил)(d8-морфолин) (соединение 3)
Соединение 4-хлорнитробензол (3,53 г, 22,4 ммоль), d8-морфолин (2,35 г, 24,6 ммоль) и карбонат калия (6,07 г, 44 ммоль) последовательно добавляли в колбу, и добавляли диметилсульфоксид (40 мл). После этого смесь нагревали до 100°C и перемешивали в течение 16 ч. ТСХ анализ (этилацетат / петролейный эфир = 1/10) показал, что реакция завершена. Затем ее охлаждали до комнатной температуры, и реакцию гасили добавлением воды (100 мл). Смесь экстрагировали дихлорметаном (100 мл) дважды. Объединенный органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с помощью роторного испарителя с получением сырого продукта. Его кристаллизовали в смешанном растворителе из этилацетата и н-гексана (1/5, об/об, 18 мл), с получением желтого твердого желаемого продукта (3,92 г, выход 81%); MS вычислено: 216; MS найдено: 217 (М+Н)+.
2. Получение 4-(d8-морфолино)фениламин (соединение 4)
4-(4-нитрофенил)(d8-морфолино) (3,80 г, 17,6 ммоль), этанол (30 мл) и воду (3 мл) добавляли в колбу для гидрирования. 10% палладий на угле (0,19 г) добавляли в атмосфере азота. Реакционную систему заменяли водородом 3-4 раза, и перемешивали под давлением 10 атм. давлении водорода, и перемешивают для реагирования при 40°C в течение 10 часов. С помощью ВЭЖХ определяли, что реакция завершена, и затем реакционный раствор охлаждали до комнатной температуры и фильтровали через Цеолит. Остаток промывали этанолом. Фильтрат объединяли и концентрировали под вакуумом с помощью роторного испарителя, получая желаемый продукт, беловатое твердое вещество (3,11 г, выход: 95%). MS вычислено: 186; MS найдено: 187 (М+Н)+.
3. Получение 4-(2-хлорпиримидин-4-ил) метил бензоата (соединение 7)
Соединение 4-(метоксикарбонил)фенилборную кислоту (4,28 г, 23,78 ммоль), 2,4-дихлорпиримидин (3,72 г, 24,97 ммоль), толуол (40 мл) и водный раствор карбоната натрия (2н, 11,9 мл) последовательно добавляли в колбу. Тетракис(трифенилфосфин) палладий (1,10 г, 0,95 ммоль) в атмосфере азота, нагревали до 80°C и перемешивали в течение ночи. После охлаждения до комнатной температуры, воду (10 мл) и этилацетат (50 мл) добавляли для разбавления реакционного раствора, перемешивали в течение 15 мин и расслаивали. Затем этилацетат (30 мл) использовали для экстрагирования водного слоя два раза. Объединенный органический слой промывали водой и солевым раствором. Сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме с помощью роторного испарителя с получением сырого продукта. Сырой продукт суспендировали в метаноле (10 мл) и измельчали 30 минут, отфильтровывали и промывали метанолом. Сушили в вакууме с п