Пиримидил-ди(диазадиспироалкан)ы с противовирусной активностью
Иллюстрации
Показать всеИзобретение относится к новым производным пиримидил-ди(диазадиспироалкан)ов, которые соответствуют общей формуле I или их фармацевтически приемлемым солям. Соединения обладают широким спектром противовирусной активности и могут найти применение при лечении и/или профилактике заболеваний, вызываемых папилломавирусной инфекцией, инфекцией, вызванной вирусом иммунодефицита, цитомегаловирусом или вирусом гепатита В или C. В общей формуле I
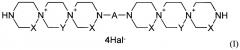
X=СН2, Y=СН2СН2 или X=СН2СН2, Y=СН2; А означает пиримидин-4,6-диил или пиримидин-2,4-диил, который может иметь в качестве заместителей Н, NO2, CHO, ОН, OAlk, атом галогена, NH(Alk), N(Alk)2 группу; где Alk означает линейный или разветвленный заместитель имеющий от 1 до 4 атомов углерода; Hal означает атом галогена, или Х=Y=СН2; А означает пиримидин-4,6-диил или пиримидин-2,4-диил, который имеет в качестве заместителя атом Cl, Br, СН3, ОН; Hal означает атом галогена, хлор или бром. Предпочтительны соединения формулы (I), где X=СН2СН2, Y=СН2 или X=СН2, Y=СН2СН2,А = пиримидин-4,6-диил, который может иметь в качестве заместителей Н, NO2, Alk группу; Hal = хлор или бром и Alk = метил. 9 н. и 2 з.п. ф-лы, 2 ил., 2 табл., 13 пр.
Реферат
Изобретение относится к новым биологически активным соединениям производным пиримидил-ди(диазадиспироалканов) общей формулы (I), их фармацевтически приемлемым солям, проявляющим активность в отношении различных вирусов, способу их получения и их применению в качестве противовирусных лекарственных средств.
Проблема поиска новых противовирусных средств обусловлена значительным распространением вирусных инфекций у человека и животных. Это связано с понижением иммунной защиты у человеческой популяции, а также с широким развитием резистентности у вирусов к имеющимся на рынке лекарственным препаратам. Проблема быстрого развития резистентности обусловлена тем, что в основном многие используемые известные противовирусные препараты представляют собой производные одного класса соединений, а также недостаточной эффективностью и токсичностью препаратов.
Перспективным направлением в поиске нового эффективного противовирусного соединения считается узкая специфичность воздействия на компоненты жизненного цикла вируса. Один из уникальных механизмов воздействия на процесс инвазии вируса в клетку-хозяина основан на процессе адсорбции вируса к клетки-мишени за счет специфического блокирования гепарансульфатных рецепторов (HS). После открытия роли гепарансульфатных рецепторов в клеточных взаимодействиях все больше научных работ посвящено поискам различных способов блокирования данного механизма вирусной адсорбции за счет конкурентного связывания с рецепторами клетки-хозяина. Возможность применения данного механизма воздействия была изучена для целого ряда вирусов: HSV-1, 2 (Shukla D., Spear P.G. Herpesviruses and heparan sulfate: an intimate relationship in aid of viral entry. J Clin Invest. 2001, 108(4), 503-10) HPV (Selinka HC, Giroglou T, Sapp M. Analysis of the infectious entry pathway of human papillomavirus type 33 pseudovirions, Virology, 2002, 1, 279-287; Selinka HC, Giroglou T, Nowak T, Christensen ND, Sapp M. Further evidence that papillomavirus capsids exist in two distinct conformations, J Virol, 2003, 77, 12961-7), HCMV (Paeschke R., Woskobojnik I., Makarov V., Schmidtke M., Bogner E. DSTP-27 prevents entry of human cytomegalovirus. Antimicrob Agents Chemother. 2014, 58(4): 1963-1971), нек. HIV (Patel V, Ferguson M, Minor PD. Antigenic sites on type 2 poliovirus, Virology, 1993, 192, 361-4), RSV (Hallak LK, Spillmann D, Collins PL, Peeples ME. Glycosaminoglycan sulfation requirements for respiratory syncytial virus infection, J Virol., 2000, 74, 10508-13; Donalisio M, Rusnati M, Cagno V, Civra A, Bugatti A, Giuliani A, Pirri G, Volante M, Papotti M, Landolfo S, Lembo D., Inhibition of human respiratory syncytial virus infectivity by a dendrimeric heparan sulfate-binding peptide, Antimicrob Agents Chemother., 2012, 56, 5278-88), HBV, HCV (Jiang YF, He B, Ma J, Li NP, Gong GZ, Cheng D. Comparison of the antiviral effects of entecavir and adefovir dipivoxil in chronic HBV infection: a randomized control trial, Acta Gastroenterol Belg., 2012, 75, 316-21), нек. Enterovirus (Tan CW, Chan YF. Enterovirus 71 receptors: promising drug targets?, Expert Rev Anti Infect Ther. 2013, 11, 547-9) и др. Механизм действия диазониадиспироалканов был изучен на примере производного 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана. Было доказано, что он связан со специфическим свойством соединения связываться с гепарансульфатными глюкоконьюгатами, что приводит к невозможности прикреплению вируса к клетке хозяина, невозможности продолжать свой жизненный цикл и в конечном итоге уменьшению титра вируса. Показано, что присоединение диазониадиспироалкана антагонизируется гепарином. Мишенью для диазониадиспироалканов являются две сульфатные группы, расположенные в соседних сахаридных остатках, так, например, для GlcA2S-GlcNS6S, GlcA2S-GlcNS3S, IdoA2S-GlcNAc6S, IdoA2S-GlcNH23SS6S, IdoA2S-GlcNS6S, and IdoA2SGlcNS3S и наблюдается хорошее электростатическое взаимодействие между отрицательными зарядами на сульфатных группах и положительно заряженными атомами азота диазониадиспироалканов. Так же показано, что аналогичного рода взаимодействие может происходить и с карбоксильной группой октасахарида ΔUA-GlcNSIdoUA2S-GlcNAc-UA2S-GlcNS-IdoUA2S-GlcNH23S, являющимся одним из ключевых участков гепарансульфатных глюкоконьюгатов для проникновения вирусов в клетку хозяина (Schmidtke М., Riabova О., Dahse Н.-М., Stelzner A., Makarov V., Synthesis, Cytotoxicity and Antiviral Activity of N,N’-bis-5-nitropyrimidyl Derivatives of Dispirotripiperazine, Antiviral Research, 2002, 55, 117-127; Schmidtke, M., Wutzler, P., Makarov, V. Novel opportunities to study and block interactions between viruses and cell surface heparan sulfates, Lett. Drug Design Discov., 2004, 1, 35-44; Artemenko, A.G., Muratov, E.N., Kuz’min, V.E., Kovdienko, N.A., Hromov, A.I., Makarov, V.A., Riabova, O.B., Wutzler, P., Schmidtke, M.,. Identification of individual structural fragments of N,N’-(bis-5-nitropyrimidyl)dispirotripiperazine derivatives for cytotoxicity and antiherpetic activity allows the prediction of new highly active compounds. Journal of Antimicrobial Chemotherapy, 2007, 60, 68-77; Paeschke R., Woskobojnik I., Makarov V., Schmidtke M., Bogner E. DSTP-27 prevents entry of human cytomegalovirus. Antimicrob Agents Chemother. 2014, 58, 1963-1971). Лекарственных препаратов, использующих такой механизм действия, в настоящее время в мире не существует.
Задача настоящего изобретения состоит в изыскании новых фармакологически активных соединений в отношении вирусных инфекций, в том числе, к штаммам резистентным к существующим в настоящее время лекарственным препаратам, которые при этом имели бы низкую токсичность и не вызывали бы побочных эффектов в отношении теплокровных живых организмов, а по механизму действия влияли бы на процесс инвазии вируса в клетку-хозяина за счет блокирования гепарансульфатных рецепторов клетки мишени.
Данная задача была решена путем синтеза производных пиримидил-ди(диазадиспироалканов), которые имеют в своем составе центральный пиримидиновый фрагмент, связанный с двумя диазадиспироалкановыми остатками, соответствующими общей структурной формуле I.
где
X=Y=СН2 или X=СН2, Y=СН2СН2 или X=СН2СН2, Y=СН2;
А означает пиримидин-4,6-диил или пиримидин-2,4-диил, который может иметь в качестве заместителей Н, NO2, СНО, ОН, OAlk, атом галогена, NHAlk, NAlk2 группу; где Alk означает линейный или разветвленный заместитель имеющий от 1 до 4 атомов углерода;
Hal означает атом галогена.
Преимущественными являются соединения общей формулы (I), где
X=Y=СН2 или X=СН2, Y=СН2СН2 или X=СН2СН2, Y=СН2;
А означает пиримидин-4,6-диил или пиримидин-2,4-диил, который имеет в качестве заместителя атом Cl, Br, СН3, ОН;
Hal означает атом галогена, хлор или бром.
Примерами таких соединений являются
соединение согласно формуле (I) где X=СН2СН2, Y=СН2; А = пиримидин-4,6-диил, который может иметь в качестве заместителей Н, NO2, Alk группу; Hal = хлор или бром и Alk = метил,
или соединение согласно формуле (I) где X=СН2, Y=СН2СН2, А = пиримидин-4,6-диил, который может иметь в качестве заместителей Н, NO2, Alk группу; Hal = хлор или бром и Alk = метил.
Соединения 3,3'-(5-нитропиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан тетрахлорид и и 3,3'-(2-метил-5-нитропиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониадиспиро[5.2.5.2] - гексадекан тетрахлорид полученны нами ранее и их незначительная противогерпетическая активность описана (Schmidtke М., Riabova О., Dahse Н.-М., Stelzner A., Makarov V., Synthesis, Cytotoxicity and Antiviral Activity of N,N’-bis-5-nitropyrimidyl Derivatives of Dispirotripiperazine, Antiviral Research, 2002, 55, 117-127; Artemenko A.G., Muratov E.N., Kuz’min V.E., Kovdienko N.A., Hromov A.I., Makarov V.A., Riabova O.B., Wutzler P., Schmidtke M.,. Identification of individual structural fragments of N,N’-(bis-5-nitropyrimidyl)dispirotripiperazine derivatives for cytotoxicity and antiherpetic activity allows the prediction of new highly active compounds. Journal of Antimicrobial Chemotherapy, 2007, 60(1), pp. 68-77).
Изобретение также относится к фармацевтически приемлемым кислотным солям указанных соединений.
Соединения могут быть получены и использованы в кристаллическом виде.
Синтезированные соединения общей формулы I и их фармацевтически приемлемые кислотно- или основно-аддитивные соли исследованы в отношении патогенных вирусов и могут быть использованы для получения лекарственных средств на их основе для лечения или профилактики вирусных заболеваний, например, вызываемых вирусом иммунодефицита человека, цитомегаловирусом, вирусом гепатита С или В, вирусов герпеса 1 и 2 типов, папилломатоза.
Термин «фармацевтически приемлемые соли соединения формулы (I)» означает любые соли неорганической или органической кислоты или основания, которые обладают необходимой фармакологической активностью исходного соединения. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединения формулы (I) или приготовлены специально.
Фармацевтически аддитивные соли с кислотами характеризуются тем, что содержат терапевтически активные нетоксичные аддитивные солевые формы с кислотами, которые способны образовывать соединения формулы I. Указанные аддитивные соли с кислотами могут быть получены обработкой соединения в виде оснований, представленных общей формулой I подходящими кислотами, например неорганическими кислотами: галогенводородной кислотой, в частности хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, азотной или фосфорной кислотой; органическими кислотами, например: уксусной кислотой, гидроксиуксусной кислотой, протионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, малеиновой или фумаровой кислотой, яблочной, винной или лимонной кислотой.
Изобретение также относится к применению соединений общей формулы I и их фармацевтически приемлемым кислотноаддитивным солям возможно в кристаллическом виде или фармацевтической композиции на их основе для приготовления лекарственных средств для предупреждения и лечения вирусных инфекций.
Объектом изобретения является также способ предупреждения или лечения вирусной инфекции, включающий введение или нанесение субъекту соединения формулы I, фармацевтически приемлемой кислотно-аддитивной соли или фармацевтических композиций на их основе в эффективном количестве. Способ лечения с использованием соединений изобретения, фармацевтических композиций или лекарственных средств на их основе эффективен также к штаммам резистентным к существующим в настоящее время лекарственным препаратам.
В экспериментах in vitro показана высокая активность представителей пиримидил-ди(диазадиспироалканов) в отношении группы штаммов вирусов герпеса 1 и 2 типов, папилломатоза, гепатита С, цитомегаловируса.
Ниже показаны примеры получения соединений по изобретению.
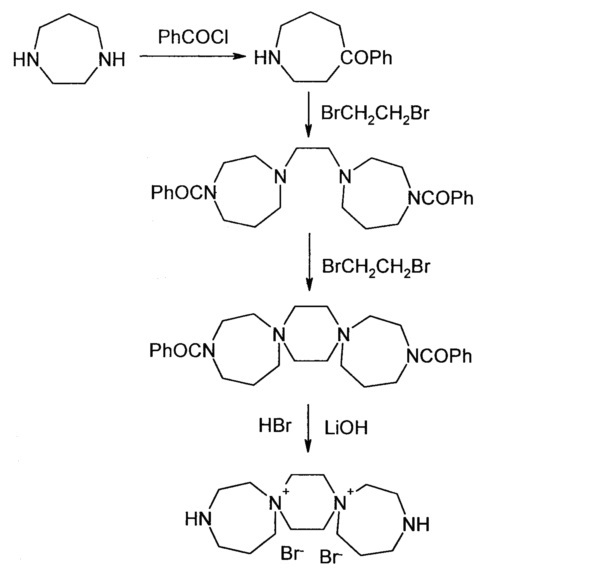
А. Производные 3,12-диаза-6,9-диазониадиспиро-[5.2.5.2]гексадекана дихлорида
Синтез исходного 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида был осуществлен по приведенной ниже схеме.
К раствору 15.2 г (0.133 мол) 1-формилпиперазина 3 в 267 мл хлороформа добавляют 12.26 г (0.146 мол) бикарбоната натрия. Смесь охлаждают водой до 10°C и в течение 0.5 ч прикапывают раствор 17 мл (0.146 мол) бензоилхлорида в 27 мл хлороформа. Перемешивают при комнатной температуре 16 ч (оставляют на ночь). Затем реакционную массу промывают водой 2 раза по 150 мл, органический слой высушивают над сульфатом натрия при перемешивании в течение 0.5 ч. Хлороформ упаривают, к остатку добавляют 200 мл гексана, перемешивают при охлаждении до 4°C, гексан декантируют. Операцию повторяют еще раз. После добавления 3-ей порции гексана смесь перемешивают 0.5 ч. Образовавшийся осадок отфильтровывают, промывают 20 мл гексана и 20 мл эфира. Сушат на воздухе. Получают 22.4 г (77%) 4-бензоилпиперазин-1-карбальдегида, т.пл. 87°C.
Растворяют 10.9 г (0.05 моль) 4-бензоилпиперазин-1-карбальдегида в 60 мл смеси МеОН и конц. HCl (соотношение HCl и МеОН 1:11) и перемешивают при комнатной температуре 24 ч. Выпавший осадок отфильтровывают, промывают 2×5 мл метанола и 2×10 мл ацетона. Сушат в сушильном шкафу при 90°C 4 ч. Получают 7.55 г (63%) гидрохлорида 1-бензоилпиперазина, т.пл. 315°C.
К раствору 5.34 г (0.0954 моль) КОН в 55 мл этанола добавляют 18 г (0.0795 моль) гидрохлорида бензоилпиперазина и перемешивают 0.5 ч при 20-22°C. Затем вносят 13.3 мл (0.199 моль) этиленхлоргидрина и в течение 1 ч прикапывают раствор 11.6 г (0.207 моль) КОН в 98 мл этанола (ректификата), не допуская увеличения температуры в массе выше 20°C. Через 20 ч образующийся KCl отфильтровывают, промывают 25 мл абс. этанола. Фильтрат охлаждают до 10°C и медленно приливают 58 мл 12% HCl/EtOH (контроль рН 2-3), перемешивают 1 ч при 5°C, затем оставляют на ночь в холодильнике. Осадок отфильтровывают, промывают 2×10 мл абсолютного этанола, сушат или на воздухе в течение 2 суток, или в сушильном шкафу при 50-55°C 4-5 ч. Получают 15.6 г (73%) гидрохлорида 1-бензоил-4-(β-оксиэтил)пиперазина, т.пл. 215°C.
К суспензии 13.5 г (0.05 моль) гидрохлорида 1-бензоил-4-(β-оксиэтил)пиперазина в 96 мл хлороформа прикапывают при перемешивании в течение 0.5 ч 8 мл SOCl2, при этом повышая температуру реакционной массы до 45°C нагреванием на масляной бане. Выдерживают при этой температуре 0.5 ч, затем нагревают до 55°C, выдерживают 0.5 ч, затем нагревают до 70°C и перемешивают 3 ч. После этого реакционную массу охлаждают до 20°C и оставляют в холодильнике на 16 ч. Осадок отфильтровывают, промывают 2×30 мл хлороформа и сушат 3 ч при 40-45°C в сушильном шкафу. Получают 11.7 г (81%) гидрохлорида 1-бензоил-4-(β-хлорэтил)пиперазина, т.пл. 230°C.
К суспензии 7.35 г (0.0254 моль) гидрохлорида 1-бензоил-4-(β-хлорэтил)пиперазина в 15 мл этанола (ректификата) приливают раствор 1.12 г (0.028 моль) NaOH в 19 мл 96% этанола и перемешивают при 20-25°C 1.5 ч. Затем NaCl отфильтровывают, промывают 2×5 мл абс. этанола. Фильтрат кипятят при перемешивании 1 ч, а затем упаривают на роторном испарителе при 80°C в бане досуха. Остаток нагревают при 120°C 16 ч. Охлаждают, добавляют 15 мл дистиллированной воды и перемешивают при кипении до полного растворения. К раствору прибавляют 0.7 г активированного угля, кипятят 10 мин. Уголь отфильтровывают и промывают 2×5 мл горячей воды. Маточный раствор охлаждают и оставляют на 16 ч в холодильнике. Выпавший осадок отфильтровывают, промывают водой (2×5 мл) и спиртом (2×5 мл). Сушат 2 ч при 100°C. Получают 3.1 г (45%) дихлорида N,Nʺ-дибензоил-N’,Nʺ-диспиротрипиперазиния в виде дигидрата, т.пл.>360°C (с. разл.).
Смесь 3.1 г (0.0057 моль) дихлорида N,Nʺ-дибензоил-N’,Nʺ-диспиротрипиперазиния в виде дигидрата и 20 мл 10% соляной кислоты, полученной смешением 7 мл концентрированной соляной кислоты и 13 мл дистиллированной воды, кипятят при перемешивании 4 ч. Реакционную смесь охлаждают в бане со льдом до 10-15°C, выпавшую бензойную кислоту отфильтровывают и промывают водой. Фильтрат упаривают досуха на роторном испарителе. Твердый остаток перемешивают с 10 мл метанола, осадок отфильтровывают и промывают 5 мл метанола. Сушат 2 ч при 100°C. Получают 1.9 г (82%) дихлорида N’,Nʺ-диспиротрипиперазиния дигидрохлорид дигидрат, т.пл.>330°C (с разл.).
К раствору 1.9 г (0.0047 моль) дихлорида N’,Nʺ-диспиротрипиперазиния дигидрохлорид дигидрат в 3.2 мл воды добавляют небольшими порциями 0.26 г (0.0108 моль) LiOH при перемешивании и 20°C (рН 9). Затем добавляют 0.17 г активированного угля, перемешивают 0.5 ч, уголь отфильтровывают и промывают 2×1 мл воды. Маточный раствор разбавляют 30 мл метанола и оставляют на 16 ч при 5°C в холодильнике. Выпавший осадок отфильтровывают и промывают на фильтре 5 мл метанола. Сушат при 100°C 2 ч.. Получают 1.1 г (79%) 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида, т.пл. 350°C (с разл.)
Пример 1
3,3'-(5-Формилпиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониади-спиро[5.2.5.2]гексадекан тетрахлорид (Соединение 1)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0.001 моль) в 3 мл воды добавили раствор 4,6-дихлор-5-формил пиримидина (0.0005 моль) в 4 мл этилового спирта. Кипятили раствор при перемешивании 2 ч. Добавили триэтиламин (0.002 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Раствор упарили досуха, добавили 35 мл метанола. Выпавший осадок отфильтровали, промыли метанолом, ацетоном. Получили 0.17 г продукта. Сушили при 100°C 20 ч.
Выход: 46%. Желтое кристаллическое вещество.
ESI-MS/MS - 663
Элементный анализ C29H52Cl4N10O:
Calc: С, 49.86; Н, 7.50; N, 20.05
Found: C, 49.36; Н, 7.84; N, 20.33
Пример 2
3,3'-(2-Фенил-5-формилпиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан тетрахлорида (Соединение 2)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0.001 моль) в 2 мл воды добавили раствор 4,6-дихлор-2-фенил-5-формил-пиримидина (0.0005 моль) в 6 мл диоксана. Кипятили реакционную массу при перемешивании 3,5 ч. Постепенно из раствора выпадает новый осадок. Добавили триэтиламин (0.002 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 20 мл метанола, осадок отфильтровали, промыли этанолом, ацетоном. Получили 0.29 г продукта. Сушили при 100°C 20 ч.
Выход: 37%. Белое кристаллическое вещество.
ESI-MS/MS - 737.
Элементный анализ C35H56Cl4N10O:
Calc: С, 54.26; Н, 7.29; N, 18.08
Found: С, 53.57; Н, 7.26; N, 18.07
Пример 3
3,3'-(5-Формил-6-гидроксипиримидин-2,4-диил)бис-3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан тетрахлорида (Соединение 3)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида (0.001 моль) в 2 мл воды добавили раствор 2-метилсульфанил-5-формил-4,6-дихлорпиримидина (0.0005 моль) в 7 мл диоксана. Кипятили раствор при перемешивании 4 ч. Из реакционной массы выпадает масло. Добавили триэтиламин (0.002 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Декантировали раствор, в оставшееся масло добавили 20 мл метанола и 5 мл ацетона, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.12 г продукта. Сушили при 100°C 20 ч.
Выход: 17%. Белое кристаллическое вещество.
ESI-MS/MS - 677.
Элементный анализ C29H52Cl4N10O2:
Calc: С, 48.74; Н, 7.33; N, 19.60
Found: С, 49.07; Н, 7.37; N, 19.62
Б. Производные 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептодекана дибромида
Синтез исходного 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гептодекана дибромида был осуществлен по приведенной ниже схеме аналогично синтезу 3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекана дихлорида, приведенному выше.
1-Формилпиперазин 1 (0,1 моль) растворяют в хлороформе (200 мл) и к полученному раствору добавляют бикарбонат натрия (0,11 моль) и медленно прикапывают раствор бензоил хлорида (0,11 моль) в 20 мл хлороформа. Перемешивают при комнатной температуре 16 ч. Затем экстрагируют водой 2 раза по 100 мл, высушивают над сульфатом натрия. Упаривают хлороформ, добавляют гексан и охлаждают при 4°C. Выпавший осадок отфильтровывают и промывают эфиром. Выход 4-бензоилпиперазин-1-карбальдегида 71%.
4-Бензоилпиперазин-1-карбальдегид 2 (0,005 моль) растворяют в 10 мл раствора, приготовленного из 5,5 мл концентрированной соляной кислоты и 60 мл метанола и перемешивают при комнатной температуре 24 ч. Выпавший осадок отфильтровывают и промывают метанолом 3 раза. Выход 1-бензоил пиперазина гидрохлорида 60%.
1-Бензоил пиперазина гидрохлорида 3 (0,014 моль) суспендируют в 5 мл этанола и добавляют раствор NaOH (0,017 моль) в 15 мл этанола. Перемешивают 1 ч. Отфильтровывают NaCl, маточный раствор упаривают, добавляют хлороформ, еще раз отфильтровывают NaCl и упаривают хлороформ. Получают 1-бензоил пиперазин в виде масла, выход 95%.
Смесь 1-бензоил пиперазина (0,035 моль) 4, 1,3-дибромпропана (0,0175 моль) и бикарбоната натрия (0,056 моль) кипятят в 60 мл этанола в течение 16 ч. Горячую реакционную массу отфильтровывают от NaBr, упаривают досуха, добавляют хлороформ, отфильтровывают от примеси NaBr, снова упаривают досуха. Получают 1,1'-пропан-1,3-диилбис(4-бензоилпиперазин) в виде масла, выход 60%.
Смесь 1,1'-пропан-1,3-диилбис(4-бензоилпиперазина) (0,005 моль) и 1,2-дибромэтана (0,05 моль) нагревают при 110°C в течение 6 ч. Охлаждают, выпавший осадок отфильтровывают, промывают эфиром. Выход 3,12-дибензоил-3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида 69%.
3,12-Дибензоил-3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромид (0,005 моль) кипятят с 18 мл 10% бромистоводородной кислотой в течение 4 ч. Охлаждают, отфильтровывают бензойную кислоту, маточный раствор упаривают до густой суспензии. Добавляют 40 мл метанола и 10 мл ацетона, выпавший осадок отфильтровывают, промывают ацетоном. Выход 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекана дибромида дибромгидрата 70%.
3,12-Диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромид дибромгидрат 7 (0,003 моль) обрабатывают раствором LiOH (0,006 моль) в 3 мл воды. Затем добавляют активированный уголь, перемешивают 20 мин, уголь отфильтровывают, в маточный раствор добавляют 25 10 мл ацетона и 20 мл метанола. Выпавший осадок отфильтровывают, промывают ацетоном. Выход 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида 88%. Тпл=258°-262°C
Пример 4
3,3'-(5-Нитропиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониади-спиро[5.2.5.3]гептадекан тетрабромид (Соединение 4)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.00075 моль) в 2 мл воды добавили раствор 4,6-дихлор-5-нитропиримидина (0.000375 моль) в 4 мл этилового спирта. Кипятили реакционную массу при перемешивании 3 ч. Добавили триэтиламин (0.0015 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 25 мл метанола. Затирали, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.13 г продукта. Сушили при 100°C 20 ч.
Выход: 37%. Желтое кристаллическое вещество.
ESI-MS/MS - 838.
Элементный анализ C30H55Br4N11O2:
Calc.: C, 39.10; Н, 6.02; N, 18.91
Found: С, 39.08; Н, 6.40; N, 18.91
Пример 5
3,3'-(2-метил-5-нитропиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониа-диспиро[5.2.5.3]гептадекан тетрабромид (Соединение 5)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.001 моль) в 3 мл воды добавили раствор 2-метил-4,6-дихлор-5-нитропиримидина (0.0005 моль) в 4 мл этилового спирта. Кипятили реакционную массу при перемешивании 3 ч. Постепенно из реакционной массы выпадает масло. Добавили триэтиламин (0.002 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 30 мл метанола. Затирали, декантировали раствор, в оставшееся масло добавили 15 мл метанола и 5 мл ацетона, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.36 г продукта. Сушили при 100°C 20 ч.
Выход: 77%. Желтое кристаллическое вещество.
ESI-MS/MS - 856.
Элементный анализ C31H57Br4N11O2:
Calc: С, 39.10; Н, 6.14; N, 16.50
Found: С, 39.23; Н, 6.19; N, 16.35
Пример 6
3,3'-(5-Формилпиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониади-спиро[5.2.5.3]гептадекан тетрабромид (Соединение 6)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.001 моль) в 3 мл воды добавили раствор 5-формил-4,6-дихлорпиримидина (0.0005 моль) в 4 мл этилового спирта. Кипятили раствор при перемешивании 2 ч. Добавили триэтиламин (0.002 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Раствор упарили досуха, добавили 30 мл метанола. Выпавший осадок отфильтровали, промыли метанолом, ацетоном. Получили 0.23 г продукта. Сушили при 100°C 20 ч.
Выход: 51%. Желтое кристаллическое вещество.
ESI-MS/MS - 821
Элементный анализ C31H56Br4N10O:
Calc: С, 41.17; H, 6.24; N, 15.49
Found: С, 41.69; H, 6.26; N, 15.37
Пример 7
3,3'-(6-Гидрокси-5-формилпиримидин-2,4-диил)бис-3,12-диаза-6,9-диазо-ниадиспиро[5.2.5.3]гептадекан тетрабромид (Соединение 7)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.00075 моль) в 2 мл воды добавили раствор 2-метилсульфанил-5-формил-4,6-дихлор-пиримидина (0.000375 моль) в 6 мл диоксана. Кипятили раствор при перемешивании 4,5 ч. Из реакционной массы выпадает масло. Добавили триэтиламин (0.0015 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Декантировали раствор, в оставшееся масло добавили 15 мл метанола и 5 мл ацетона, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.16 г продукта. Сушили при 100°C 20 ч.
Выход: 23%. Белое кристаллическое вещество.
ESI-MS/MS - 835
Элементный анализ C31H56Br4N10O2:
Calc: С, 41.69; Н, 6.29; N, 15.17
Found: С, 40.95; Н, 6.13; N, 15.22
Пример 8
3,3'-(2-Фенил-5-формилпиримидин-2,4-диил)бис-3,12-диаза-6,9-диазониа-диспиро[5.2.5.3]гептадекан тетрабромид (Соединение 8)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.00075 моль) в 2 мл воды добавили раствор 2-фенил-5-формил-4,6-дихлорпиримидина (0.000375 моль) в 6 мл диоксана. Кипятили раствор при перемешивании 3 ч. Из реакционной массы выпадает масло. Добавили триэтиламин (0.0015 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Декантировали раствор, в оставшееся масло добавили 15 мл метанола и 5 мл ацетона, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.15 г продукта. Сушили при 100°C 20 ч.
Выход: 40%. Желтое кристаллическое вещество.
ESI-MS/MS - 897.
Элементный анализ C37H60Br4N10O:
Calc: С, 45.32; Н, 6.17; N, 14.28
Found: С, 45.29; Н, 6.67; N, 15.27
Пример 9.
3,3'-(2-Хлоропиримидин-4,6-диил)бис-3,12-диаза-6,9-диазониади-спиро[5.2.5.3]гептадекан тетрабромид (Соединение 9)
К раствору 3,12-диаза-6,9-диазониадиспиро[5.2.5.3]гептадекан дибромида (0.0005 моль) в 2 мл воды добавили раствор 5-нитро-2,4,6-трихлорпиримидина (0.00025 моль) в 4 мл метилового спирта. Кипятили раствор при перемешивании 3 ч. Добавили триэтиламин (0.001 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 25 мл метанола. Затирали, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.07 г продукта. Сушили при 100°C 20 ч.
Выход: 30%. Светло желтое кристаллическое вещество
ESI-MS/MS - 875.
Элементный анализ C30H54Br4ClN11O2:
Calc: С, 37.69; Н, 5.69; N, 16.12
Found: С, 37.58; Н, 5.62; N, 16.17
В. Производные 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекана дибромида
Синтез исходного 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекана дибромида был осуществлен по приведенной ниже схеме.
К гомопиперазину в количестве 5.37 г (0.0537 моль) при охлаждении ледяной водой приливают 25 мл ледяной уксусной кислоты, при этом температура возрастает до 40-50°C. После того как температура снизится до 20°C, охлаждение убирают. Суспензию перемешивают до полного растворения гомопиперазина (~2 ч). Затем раствор охлаждают до 5°C (ледяная баня) и медленно (45 мин) прикапывают 6.27 мл (0.0537 моль) бензоилхлорида с такой скоростью, чтобы температура в массе не превышала 10°C. Далее раствор перемешивают при комнатной температуре 3 ч. Уксусную кислоту отгоняют на роторном испарителе при 80°C. Объем отгона примерно 15-16 мл, что соответствует 2/3 объема уксусной кислоты, взятой в реакцию. К остатку, представляющему собой густое масло, добавляют 50 мл воды, охлаждают в бане со льдом до 15°C и при перемешивании подщелачивают 40% раствором NaOH (10 мл) до рН 8-8.5. Выпавший побочный продукт 1,4-дибензоилдиазепина отфильтровывают, а маточный раствор экстрагируют хлороформом 3×40 мл. Проверяют рН водного слоя. При рН<7 опять подщелачивают до рН 8-8.5 и экстрагируют хлороформом 2×40 мл. Объединенные хлороформенные экстракты сушат над Na2SO4. Хлороформ упаривают и получают 7.13 г (65%) 1-бензоил-1,4-диазепина в виде масла.
Смесь 7.13 г (0.035 моль) 1-бензоил-1,4-диазепина, 60 мл этанола, 1.51 мл (0.0175 моль) 1,2-дибромэтана и 4.7 г (0.056 моль) бикарбоната натрия перемешивают при кипении в течение 16 ч. Реакционную массу охлаждают, неорганический осадок отфильтровывают, промывают 10 мл спирта. Маточный раствор упаривают досуха, добавляют 100 мл воды и экстрагируют хлороформом 3×70 мл. Сушат над Na2SO4 при перемешивании 0.5 ч. Хлороформ упаривают досуха. Получают 8 г (100%) 1,1'-этан-1,2-диилбис(4-бензоил-1,4-диазепина) в виде масла.
Смесь 8 г (0.0183 моль) 1,1'-этан-1,2-диилбис(4-бензоил-1,4-диазепина) и 16 мл 1,2-дибромэтана перемешивают и нагревают при 120°C в течение 4 ч. Густую пасту охлаждают до 20°C, добавляют 50 мл эфира, перемешивают, осадок отфильтровывают, промывают 2×10 мл эфира. Затем пасту на фильтре промывают с перемешиванием 3×50 мл хлороформа и 2×10 мл эфира. Осадок в виде пасты сушат на воздухе 16 ч. Получают 7.2 г (63.4%) 3,13-дибензоил-3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекана дибромида, т.пл.~320°C.
Смесь 15.5 г (0.025 моль) 3,13-дибензоил-3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекана дибромида и 100 мл 10% бромистоводородной кислоты перемешивают при кипении 4 ч. Охлаждают, выпавшую бензойную кислоту отфильтровывают и промывают водой. К маточному раствору добавляют 1.5 г активированного угля, перемешивают 20 мин, фильтруют. Осветленный раствор упаривают на роторном испарителе досуха. К остатку добавляют 210 мл метанола и 60 мл ацетона. Перемешивают 0.5 ч. Осадок отфильтровывают, промывают ацетоном 2×50 мл. Сушат в сушильном шкафу при 100°C. Получают 12.66 г (88%) дигидробромид 3,13-диаза-7,10-диазониадиспиро-[6.2.6.2]октадекандибромида, т.пл. 310-315°C.
К раствору 12.66 г (0.022 моль) дигидробромид 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекандибромида в 22 мл воды добавляют 1.06 г (0.044 моль) LiOH при перемешивании и 20°C (рН 10). Затем добавляют 1.3 г активированного угля, перемешивают 20 мин, уголь отфильтровывают и промывают 3 мл воды. Маточный раствор разбавляют 145 мл ацетона и 75 мл метанола. Выпавший творожистый осадок отфильтровывают на слабом вакууме и промывают на фильтре с перемешиванием 2×30 мл ацетона и еще 1 раз без перемешивания. Сушат на воздухе. Получают 6.4 г (70%) 3,13-Диаза-7,10-диазониадиспиро[6.2.6.2]октадекан дибромид, т.пл. 280°C.
Пример 10
3,3'-(5-Нитропиримидин-4,6-диил)бис-3,13-диаза-7,10-диазониади-спиро[6.2.6.2]октадекан тетробромид (Соединение 10)
К раствору 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекан дибромида (0.00072 моль) в 2 мл воды добавили раствор 5-нитро-4,6-дихлорнитропиримидина (0.00036 моль) в 5 мл этилового спирта. Кипятили реакционную массу при перемешивании 4 ч. Добавили триэтиламин (0.0014 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 25 мл метанола. Затирали, выпавший осадок отфильтровали, промыли метанолом, тетрагидрофураном, ацетоном. Получили 0.1 г продукта. Сушили при 100°C 20 ч.
Выход: 69%. Желтое кристаллическое вещество.
ESI-MS/MS - 870.
Элементный анализ C32H59Br4N11O2:
Calc: С, 40.48; Н, 6.26; N, 16.23
Found: С, 41.19; Н, 6.28; N, 16.84
Пример 11
3,3'-(2-Метил-5-нитропиримидин-4,6-диил)бис-3,13-диаза-7,10-диазониа-диспиро[6.2.6.2]октадекан тетрабромид (Соединение 11)
К раствору 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекан дибромида (0.00072 моль) в 3 мл воды добавили раствор 2-метил-5-нитро-4,6-дихлорнитропиримидина (0.00036 моль) в 4 мл этилового спирта. Кипятили реакционную массу при перемешивании 3,5 ч. Постепенно из реакционной массы выпадает масло. Добавили триэтиламин (0.0014 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Добавили 30 мл метанола. Затирали, выпавший осадок отфильтровали, промыли метанолом, ацетоном. Получили 0.13 г продукта. Сушили при 100°C 20 ч.
Выход: 37%). Желтое кристаллическое вещество.
ESI-MS/MS - 880.
Элементный анализ C33H61Br4N11O2:
Calc: С, 41.44; Н, 6.58; N, 15.99
Found: С, 40.52; Н, 6.52; N, 16.08
Пример 12
3,3'-(5-Формилпиримидин-4,6-диил)бис-3,13-диаза-7,10-диазониа-диспиро[6.2.6.2]октадекан тетрабромид (Соединение 12)
К раствору 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекан дибромида (0.00072 моль) в 2 мл воды добавили раствор 2-формил-4,6-дихлорпиримидина (0.00036 моль) в 4 мл этилового спирта. Кипятили раствор при перемешивании 2 ч. Добавили триэтиламин (0.0014 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Раствор упарили досуха, добавили 20 мл метанола. Выпавший осадок отфильтровали, промыли метанолом, ацетоном. Получили 0.27 г продукта. Сушили при 100°C 20 ч.
Выход: 40%. Бежевое кристаллическое вещество.
ESI-MS/MS - 853.
Элементный анализ C33H60Br4N10O:
Calc: С, 42.50; Н, 6.46; N, 15.02
Found: С, 42.67; Н, 6.43; N, 15.04
Пример 13
3,3'-(2-Фенил-5-формилпиримидин-4,6-диил)бис-3,13-диаза-7,10-диазо-ниадиспиро[6.2.6.2]октадекан тетрабромид (Соединение 13).
К раствору 3,13-диаза-7,10-диазониадиспиро[6.2.6.2]октадекан дибромида (0.00048 моль) в 1 мл воды добавили раствор 2-фенил-5-формил-4,6-дихлорпиримидина (0.00024 моль) в 5 мл диоксана. Кипятили реакционную массу при перемешивании 4 ч. Постепенно из раствора выпадает масло. Добавили триэтиламин (0.00096 моль). Через 20 мин обогрев выключили. Охладили до комнатной температуры. Упарили досуха. Добавили 20 мл метанола, осадок отфильтровали, промыли этанолом, ацетоном. Получили 0.03 г продукта. Сушили при 100°C 20 ч. Выход: 6%. Бежевое кристаллическое вещество.
ESI-MS/MS - 929.
Элементный анализ C39H64Br4N11O:
Calc: С, 46.44; Н, 6.40; N, 13.89
Found: С, 46.48; Н, 6.24; N, 13.32
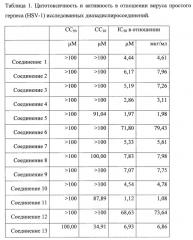
Описание цитотоксичности и противовирусной активности соединений по изобретению.
Исследование цитотоксичности синтезированных соединений производных диспиротрипиперазиния в отношении GMK клеток
2×104 клеток GMK высевали в лунку 96-луночных плоскодонных микротитрационных планшетов (Falcon 3075). Цитотоксичность исследуемых композиций определялась по конфлюентным монослоям клеток GMK, образовавшимся в 60 лунках (5% СО2, 37°C). После извлечения из питательной среды в девять вдвое разбавленных композиций добавляли 100 л питательной среды и инкубировали в течение 72 часов при 37°C в атмосфере 5% СО2. Клетки из шести лунок без обработки были использованы для контроля. Система иммуноанализа Dynex (DIAS, Гернси, Великобритания), разработанная для автоматизированного метода ELISA, была использована для бережной очистки, окрашивания, измерения и оценки жизнеспособности монослоев клеток в цитотоксичном препарате, также как в противовирусном исследовании. Окрашивание для оценки цитотоксической активности TNF- проводилось с использованием кристаллического фиолетового, как описано Nain et al. (1990). Сначала надосадочная жидкость аспирировалась и монослои клеток трижды промывали 300 л физиологического раствора поваренной соли для удаления отмерших клеток. Затем клетки фиксировались и промывались один раз в течение 10 минут с использованием 50 л 0,03% раствора кристаллического фиолетового (вес/об) в 20% метаноле. После шести последующих промываний с использованием 100 л воды монослои обрабатывались 100 л буфера для лизиса (раствор 0,8979 г цитрата натрия и 1,25 мл 1 Н HCl в 98,05 мл 47,5% этанола) в течение 20 минут для элюирования кристаллического фиолетового. Далее спектрофотометрически была определена оптическая плотность отдельных лунок при 540/630 нм и проанализирована с помощью DIAS. Жизнеспособность клетки определялась как процентное отношение к среднему значению оптической плотности по результатам измерения шести лунок, которое принималось за 100%. Цитотоксическая концентрация, снижающая жизнеспособность клеток на 50% (СС50) рассчитывалась по кривой доза-эффект по средним значениям двух параллельных проб в трех исследованиях.
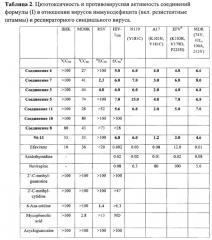
Исследование противовирусной активности синтезированных соединений производных пиримидил-ди(диазадиспироалканов) формулы (I)
Исследование противовирусной активности было проведено по методу, описанному ранее (М. Schmidtke, U. Schnittler, В. Jahn, Н.-М. Dahse, А. Stelzner, A rapid assay for evaluation of antiviral activity against coxsackie virus B3, influenza virus A, and herpes simplex virus type 1, Journal of Virological Methods 95 (2001) 133-143). После извлечения клеток из ростового раствора, образовавшиеся в течение двух дней конфлюентные монослои клеток в 6-луночных планшетах (FALCON 3046) были засеяны 1 мл взвесью соответствующего вируса в питательной среде на клетках GMK, содержащей примерно 100 бляшкообразующих единиц (БОЕ) в отсутствии и присутствии вдвое разбавленных исследуемых композиций. После адсорбции в течение 1 часа при 37°C посевной материал был аспирирован и смешан с 2 мл соответствующего ростового раствора, содержащего 0,4% агара, и с соответствующей концентрацией лекарственного препарата. Три необработанные контрольные пробы вирусов и одна неинфицированная необработанная контрольная клетка также были исследованы. Концентрации компонентов определялись по дублирующим измерениям. Пробы инкубировались при 37°C в течение 72 часов пока не были обнаружены тромбоциты, затем фиксировались и промывались раствором 0,4% кристаллического фиолетового в смеси формалина (3% об/об) и этанола (1,67% об/об) в воде. Число тромбоцитов было посчитано посредством негатоскопа после извлечения из агаровой аппликации. Была построена зависимость среднего числа тромбоцитов в двух сравниваемых обработанных лунках при каждой концентрации от числа тромбоцитов в трех необработанных зараженных вирусом лунках. Концентрация, при которой количество тромбоцитов снижается на 50% (IC50), рассчитывалась по кривой доза-эффект по наименьшим значениям трех испытаний редукции тромбоцитов.
Результаты активно