Способ диагностики пищевой аллергии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к аллергологии и иммунологии, и может быть использовано для диагностики аллергии. Для этого осуществляют подготовку пробы биологического материала (копрофильтрат) с последующей спектрофотометрией при 405 нм. При этом берут утреннюю пробу фекалий в количестве 1 г, растворяют ее в 9 мл фосфатно-солевого буфера с 0,05% Твином 20 (ФСБТ) рН=7,2. Затем перемешивают до однородной консистенции. После чего центрифугируют в течение 10-20 мин при 3500 об/мин. Отбирают надосадочную жидкость и проводят иммуноферментный анализ на наличие аллергенспецифических IgE-антител к пищевым аллергенам с последующей спектрофотометрией. При определении оптической плотности 0,15 ед. оптической плотности и более диагностируют аллергию к конкретному аллергену. А при определении оптической плотности менее 0,15 ед. диагностируют отсутствие аллергии к конкретному аллергену. Изобретение позволяет повысить точность диагностики пищевой аллергии на 10-12%. 3 пр.
Реферат
Изобретение относится к области медицины, а именно к аллергологии и иммунологии, и используется для диагностики пищевой аллергии.
Известен способ диагностики аллергии («Performance of the PROTIA™ Allergy-Q® System in the Detection of Allergen-specific IgE: A Comparison With the ImmunoCAP® System». Allergy Asthma Immunol Res. 2015 Nov; 7(6): 565-572. Published online, 2015. May 26. doi: 10.4168/aair.2015.7.6.565 PMCID: PMC4605929), включающий забор 5 мл цельной крови в вакуумные пробирки, получение сыворотки крови путем центрифугирования при 3000 об/мин в течение 5 мин, проведение иммуноферментного анализа с определением концентрации аллергенспецифических IgE-антител, по которой судят о наличии или отсутствии аллергии.
Недостатком этого способа является возможный ложноотрицательный результат в ряде исследований при наличии клинической симптоматики пищевой аллергии, за счет элиминации аллергенспецифических антител из крови в ткани органов-мишеней (легкие, кишечник, кожа и т.д.), а так же инвазивный характер получения биоматериала.
Известен способ диагностики аллергии к конкретному аллергену (Патент РФ 2222814, МПК G01N 33/533, опубл. 2004). Сущность способа: в стрип-планшеты, сенсибилизированные мКАД, добавляют лимфоциты периферической крови, планшеты инкубируют при (37±2)°С в течение 1 ч 30 мин, промывают от клеток, затем в лунки вносят флуоресцирующие иммуноглобулины против иммуноглобулинов G человека или иммуноглобулинов Е человека, выдерживают 30 мин при (37±2)°С, трехкратно промывают лунки, отмытые стрипы просматривают в люминесцентном микроскопе и при выявлении зон локальной флуоресценции мКАД диагностируют аллергию к конкретному аллергену.
Недостатками этого способа являются невысокая точность исследования за счет отсутствия стандартизации содержания лимфоцитов в крови больного, что не исключает возможное получение ложноположительных и ложноотрицательных результатов при ряде физиологических состояний, сопутствующих вирусных, бактериальных и аутоиммунных заболеваниях, а также субъективная оценка исследователем флюоресценции и инвазивный характер получения биоматериала.
Известен способ диагностики пищевой аллергии (патент РФ, МПК G01N 33/48, опубл. 2011), сущность которого заключается в том, что до проведения диагностического элиминационного теста и на 4-5 день теста проводится определение секреторного IgA в слюне и по изменению его показателей (в сторону увеличения или уменьшения) более 30% диагностируют пищевую аллергию.
Недостатками этого метода являются отсутствие специфичности диагностики конкретного причинно-значимого пищевого аллергена, обязательное проведение элиминационного теста и необходимость исключения заболеваний ЛОР-органов у пациента перед проведением теста, что может привести в ряде случаев ложноположительного или ложноотрицательного результата.
Наиболее близкий способ диагностики аллергии к предлагаемому (Патент РФ 2027193 G01N 33/68, опубл. 1995) включает подготовку пробы биологического материала с последующей спектрофотометрией при 450 нм. Берут сыворотку крови, разводят ее забуференным физиологическим раствором в соотношении 1:4, затем к 0,1 мл разбавленной сыворотки добавляют 2 мл 6% ПЭГ-6000, смесь инкубируют в течение 1 ч при комнатной температуре с последующей спектрофотометрией при 450 нм и при значении оптической плотности смеси менее 1,2 ед. диагностируют аллергию.
Недостатками этого способа является недостаточная точность при пищевой аллергии, поскольку отсутствует специфичность диагностики конкретного причинно-значимого пищевого аллергена, так как метод выявляет лишь иммунные комплексы в крови, а также инвазивный характер получения биоматериала.
Задачей предлагаемого изобретения является устранение указанных недостатков, повышение точности диагностики пищевой аллергии к конкретному причинно-значимому аллергену за счет использования в качестве биоматериала копрофильтрата, как субстрата, отражающего функциональное состояние кишечника, являющегося органом-мишенью при пищевой аллергии, с исключением инвазивного характера получения биоматериала.
Для решения поставленной задачи при диагностике аллергии, включающей подготовку пробы биологического материала с последующей спектрофотометрией при 405 нм, предложено в качестве биологического материала исследовать копрофильтрат. При этом берут утреннюю пробу фекалий в количестве 1 г, растворяют в 9 мл фосфатно-солевого буфера с 0,05% Твином 20 (ФСБТ) рН=7,2, перемешивают до однородной консистенции, центрифугируют в течение 10-20 мин при 3500 об/мин, отбирают надосадочную жидкость, проводят иммуноферментный анализ на наличие аллергенспецифических IgE-антител к пищевым аллергенам с последующей спектрофотометрией. При определении оптической плотности 0,15 ед. и более диагностируют аллергию к конкретному аллергену, а при определении оптической плотности менее 0,15 ед. диагностируют отсутствие аллергии к конкретному аллергену.
Подготовка пробы биологического материала для исследования в предлагаемом режиме позволяет получить надосадочную жидкость, содержащую аллергенспецифческие антитела и вместе с тем имеющую низкие уровни субстанций, способных к неспецифическому связыванию и перекрестному реагированию на стадии проведения иммуноферментного анализа.
В связи с увеличением распространенности и числа опасных для жизни случаев пищевая аллергия стала одной из основных проблем здравоохранения. Классический иммунный ответ при пищевой аллергии характеризуется продукцией аллергенспецифических IgE антител и развитием сенсибилизации, а в эффекторной фазе проявляется реакцией гиперчувствительности на пищевые продукты с развитием клинической симптоматики аллергического воспаления. Согласно современным представлениям иммуноглобулин Е (IgE) – это класс иммуноглобулинов, обнаруживаемый в норме в незначительных количествах в сыворотке крови и секретах. По физико-химическим свойствам IgE представляет гликопротеин с молекулярной массой 190000 дальтон и синтезируется главным образом плазматическими клетками, локализующимися в слизистых оболочках. Биологическая роль IgE характеризуется способностью связываться с поверхностью тучных клеток и базофилов человека, вызывая их дегрануляцию в момент присоединения антигена, что запускает каскад реакций, ведущих к выбросу медиаторов воспаления. При пищевой аллергии происходит синтез аллергенспецифических IgE-антител к пищевым продуктам, при этом с одной стороны аллергенспецифические IgE-антитела выступают в качестве компонента патологического процесса, а с другой могут являться надежным диагностическим маркером. Современные методы диагностики пищевой аллергии предусматривают выявление аллергенспецифических IgE-антител в сыворотке крови, на основании чего делается заключение о наличии причинно-значимого аллергена, однако возможны состояния, при которых не выявляется системная циркуляция аллергенспецифических IgE-антител за счет их элиминации в органы мишени (кишечник). Таким образом, обнаружение аллергенспецифических IgE-антител в материале, характеризующем функциональное и иммунное состояние кишечника, расширяет возможности аллергодиагностики для выявления причинно-значимого пищевого продукта.
Способ высокочувствительный, имеет неинвазивный характер получения исследуемого биоматериала, в результате чего становится возможным нивелировать психоэмоциональное напряжение у больных.
Способ осуществляется следующим образом.
При подозрении на пищевую аллергию больному назначается аллергодиагностическое исследование по предлагаемому способу.
Пробу фекалий весом 1 г растворяют в 9 мл фосфатно-солевого буфера с 0,05% Твином 20 (ФСБТ) с рН=7,2. Полученную суспензию тщательно перемешивают, преимущественно с использованием вортекса, что позволяет получить однородную консистенцию материала, после чего ее центрифугируют в течение 10-20 мин при 3500 об/мин. Надосадочная жидкость отбирается в необходимом количестве по 50 мкл на каждый аллерген.
Затем осуществляется иммуноферментный анализ по известной методике: в 96 луночных микропланшетах, в которых в качестве твердой фазы находятся химически активированные бумажные диски с ковалентно присоединенными аллергенами. В лунки микропланшета вносится по 50 мкл копрофильтрата, полученного по предлагаемому способу. Специфическое связывание антител с аллергеном происходит в течение 1 часа, при 37°С, после чего проводится 4-кратная промывка лунок микропланшета ФСБТ. Следующая инкубация в течение 1 часа при 37°С происходит при внесении 50 мкл раствора антител к человеческому иммуноглобулину Е, меченных щелочной фосфатазой в лунки микропланшета, с последующей 4-кратной промывкой лунок микропланшета ФСБТ. Затем в лунки добавляется 200 мкл раствора хромогенного субстрата р-нитрофенил-фосфата (pNPP), который, прореагировав с щелочной фосфатазой, дает характерное окрашивание. Остановка реакции осуществляется через 45 минут путем добавления в лунки микропланшета 50 мкл 1N раствора NaOH.
Учет реакции проводится на вертикальном спектрофотометре для каждой лунки, в которой находится бумажный диск с ковалентно присоединенным аллергеном, с использованием длины волны 405 нм (опорная длина волны 620 нм).
Таким образом, при наличии аллергенспецифических антител в исследуемом копрофильтрате к конкретному причинно-значимому аллергену, фиксированному на бумажном диске, происходит образование их комплекса, а добавление антител к человеческому иммуноглобулину Е, меченных щелочной фосфатазой, и хромогенного субстрата р-нитрофенил-фосфата приводит к увеличению оптической плотности реакционной смеси в лунке микропланшета с исследуемым аллергеном.
При определении оптической плотности 0,15 ед. и более диагностируют аллергию к конкретному аллергену, а при определении оптической плотности менее 0,15 ед. диагностируют отсутствие аллергии к конкретному аллергену.
Пример 1
Больной К., 1 год 3 мес., поступил с эритематозными бляшками с границами неправильной формы, с наличием чешуек, везикул, мокнутия, корок и экскориаций на сгибательных поверхностях рук и ног, и на лице. Со слов матери больного высыпания появились после употребления в пищу адаптированной молочной смеси на основе коровьего молока, творога, мяса индейки, пюре из яблока и моркови.
Исследование проведено с использованием заявляемого метода, при этом была взята утренняя проба фекалий больного в количестве 1 г, растворена в 9 мл фосфатно-солевого буфера с 0,05% Твином 20 (ФСБТ) рН=7,2 с использованием вортекса и последующим центрифугированием в течение 10 мин при 3500 об/мин. Для последующего иммуноферментного анализа использовалась надосадочная жидкость, при этом в лунках микропланшета находились химически активированные бумажные диски с ковалентно присоединенными аллергенами белка коровьего молока, белка козьего молока, α-лактальбумина, β-лактоглобулина, казеина, яблока, мяса индейки, моркови.
После инкубации в течение 1 ч при 37°С, последующей 4-кратной промывки лунок микропланшета ФСБТ. Следующая инкубация в течение 1 ч при 37°С происходила при внесении 50 мкл раствора антител к человеческому иммуноглобулину Е, меченных щелочной фосфатазой в лунки микропланшета, с последующей 4-кратной промывкой лунок микропланшета ФСБТ. Затем в лунки было добавлено 200 мкл раствора хромогенного субстрата р-нитрофенил-фосфата (pNPP), который, прореагировав с щелочной фосфатазой, дал характерное окрашивание. Остановка реакции была произведена через 45 мин путем добавления в лунки микропланшета 50 мкл 1N раствора NaOH. Учет реакции проводился на вертикальном спектрофотометре при длине волны 405 нм (опорная длина волны 620 нм). Были получены следующие результаты:
белок коровьего молока - 0,020 ед. оптической плотности;
белок козьего молока - 0,018 ед. оптической плотности;
α-лактальбумин - 0,014 ед. оптической плотности;
β-лактоглобулин - 0,658 ед. оптической плотности;
казеин - 0,018 ед. оптической плотности;
яблоко- 1,584 ед. оптической плотности;
мясо индейки - 0,092 ед. оптической плотности;
морковь - 0,031 ед. оптической плотности.
Диагностирована аллергия на β-лактоглобулин (0,658>0,150) и яблоко (1,584>0,150). Из питания ребенка были исключены яблоки, продукты на основе коровьего молока, которые были заменены на молочные смеси на основе козьего молока. Через 6 месяцев диетотерапии клинические проявления аллергии исчезли.
Пример 2
Пациент Б., 42 года, жалобы на диспептические явления после употребления говядины, колбас и пельменей в течение года. После исключения гастроинтестинальной патологии больному выполнен анализ предложенным способом.
При этом в лунках находились химически активированные бумажные диски с ковалентно присоединенными аллергенами белка говядины, белка баранины, белка свинины, мяса индейки и мяса кролика. Были получены следующие результаты:
белок говядины - 1,890 ед. оптической плотности;
белок баранины - 0,054 ед. оптической плотности;
белок свинины - 0, 168 ед. оптической плотности;
мясо индейки - 0,020 ед. оптической плотности;
мясо кролика - 0,018 ед. оптической плотности.
Диагностирована аллергия на белок говядины (1,890>0,150) и белок свинины (0,168>0,150). Из питания пациента исключены продукты на основе говядины и свинины, которые были заменены на продукты из мяса индейки, кролика и баранины.
Через 1 месяц у больного исчезли диспептические проявления.
Пример 3
Больная Ш., 10 лет. Поступила с жалобами на кожный зуд рук и ног, диспептические явления в виде вздутия живота и жидкого стула в течение месяца, снижение аппетита. Со слов родителей, диспептические явления и зуд усиливались после употребления в пищу трески, томатов и яблок. У больной было проведено исследование уровня общего IgE в крови, который составил 865 МЕ/мл (при норме до 100 МЕ/мл), на основании чего был поставлен диагноз пищевой аллергии. Однако через 2 мес диетотерапии с исключением рыбы, томатов и яблок жалобы сохранялись. Было принято решение провести аллергодиагностику предложенным методом для подтверждения диагноза пищевой аллергии на основании выявления причинно-значимого пищевого продукта. Произведен забор образца фекалий весом 1 г и исследован предложенным методом, при этом в лунках микропланшета находились химически активированные бумажные диски с ковалентно присоединенными аллергенами мяса трески, томатов и яблока. Были получены следующие результаты:
мясо трески - 0,023 ед. оптической плотности;
томаты - 0,011 ед. оптической плотности;
яблоко - 0,065 ед. оптической плотности.
Таким образом, пищевая аллергия к указанным продуктам не выявлена.
На основании сохраняющихся жалоб и полученных данных диагноз пищевой аллергии был снят, было проведено исследование на гельминтозы методом иммуноферментного анализа, при котором были выявлены антитела к аскаридам. Диагноз аскаридоза был подтвержден копрологическим исследованием. Через 2 недели после противогельминтной терапии (левомизол, 75 мг, двукратно) клиническая симптоматика исчезла.
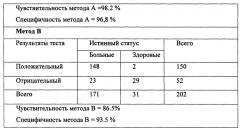
Предложенным способом обследовано 126 детей с клиническими проявлениями пищевой аллергии, в возрасте от 2-х мес до 2-х лет, и 45 взрослых пациентов. Контрольную группу составили 15 практически здоровых детей и 16 взрослых. У детей и взрослых, страдающих пищевой аллергией, заболевание было подтверждено данными анамнеза и кожными тестами (прик-тестами). У этих групп больных было проведено сравнение чувствительности и специфичности предложенного метода диагностики (А) с иммуноферментным методом диагностики аллергии на основе выявления аллергенспецифических IgE-антител в сыворотке крови (В).
Таким образом, предложенный способ позволяет повысить точность диагностики пищевой аллергии на 10-12%, обеспечить своевременное выявление причинно-значимого аллергена (причинно-значимого пищевого продукта) для определения тактики проведения диетотерапии, безопасен для больного, обладает возможностью использования одной пробы для различных комбинаций аллергенов, имеет неинвазивный характер получения биоматериала, что исключает осложнения при медицинских манипуляциях, связанных с забором крови, а также связанных с ними психоэмоционального напряжения больного (в том числе детей) и личного присутствия пациента.
Способ диагностики аллергии, включающей подготовку пробы биологического материала с последующей спектрофотометрией при 405 нм, отличающийся тем, что в качестве биологического материала исследуют копрофильтрат, при этом берут утреннюю пробу фекалий в количестве 1 г, растворяют в 9 мл фосфатно-солевого буфера с 0,05% Твином 20 с рН=7,2, перемешивают до однородной консистенции, центрифугируют в течение 10-20 мин при 3500 об/мин, отбирают надосадочную жидкость, проводят иммуноферментный анализ на наличие аллергенспецифических IgE-антител к конкретным пищевым аллергенам с последующей спектрофотометрией, и при определении оптической плотности 0,15 единиц оптической плотности и более диагностируют аллергию к конкретному пищевому аллергену, а при определении оптической плотности менее 0,15 единиц диагностируют отсутствие аллергии к конкретному пищевому аллергену.