Способ лечения злокачественных новообразований с помощью магнитной гипертермии и фармацевтические композиции для применения в указанном способе
Иллюстрации
Показать всеГруппа изобретений относится медицине, а именно к онкологии, и может быть использована для лечения злокачественных новообразований с помощью магнитной гипертермии. Для этого предложено применение Zn-замещенных магнитных наночастиц на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), средний размер которых составляет менее 40 нм, температура Кюри составляет от 39 до 550°С, и коэрцитивная сила составляет от 5 до 250 Э. Предложена также фармацевтическая композиция, содержащая указанные Zn-замещенные магнитные наночастицы и фармацевтически приемлемый носитель. Предложен также способ лечения злокачественных новообразований с помощью магнитной гипертермии, включающий следующие стадии (i) и (ii). Стадия (i) включает доставку в область опухоли магнитных наночастиц в эффективной концентрации, выбранных из группы магнитных оксидов металлов, включающей Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), средний размер которых составляет менее 40 нм, температура Кюри составляет от 39 до 550°С, и среднее значение коэрцитивной силы составляет от 5 до 250 Э. Стадия включает (ii) подвергание области опухоли воздействию магнитного поля переменного тока (ПТ) с амплитудой от 14 до 300 Э и частотой от 80 до 1000 кГц, где время воздействия указанного магнитного поля при температуре от 38 до 51°С составляет от 15 до 60 минут. Кроме того предложен способ экспериментального повреждения опухолевых клеток с помощью магнитной гипертермии, включающий следующие стадии (i), (ii), (iii). Причём стадия (i) включает обеспечение магнитных наночастиц, выбранных из группы магнитных оксидов металлов, включающей Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), средний размер которых составляет менее 40 нм, температура Кюри составляет от 39 до 550°С, и среднее значение коэрцитивной силы составляет от 5 до 250 Э. Стадия (ii) включает добавление указанных магнитных наночастиц в клеточную культуру. Стадия (iii) включает подвергание указанной клеточной культуры воздействию магнитного поля ПТ с амплитудой от 14 до 300 Э и частотой от 80 до 1000 кГц, где время воздействия указанного магнитного поля при температуре от 38 до 51°С составляет от 15 до 60 минут. Способ обеспечивает повышение эффективности лечения за счёт равномерного нагрева опухолевой ткани при снижении нежелательных явлений в результате сопутствующего или последующего селективного повреждения или по меньшей мере частичного разрушения опухолевых клеток в области опухоли без повреждения здоровой окружающей ткани. 4 н. и 32 з.п. ф-лы, 10 ил., 4 табл., 7 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу лечения злокачественных новообразований с помощью магнитной гипертермии и применению в указанном способе магнитных наночастиц из группы магнитных оксидов металлов, включающей ферриты, обладающих повышенной теплопроизводительностью и оптимальным значением удельного коэффициента поглощения (Specific Absorption Rate, SAR). Способ обеспечивает селективный нагрев области опухоли и последующее повреждение или разрушение раковых клеток или злокачественных новообразований без повреждения здоровой окружающей ткани. Кроме того, изобретение относится к фармацевтической композиции для магнитного гипертермического лечения злокачественных новообразований, содержащей магнитные наночастицы.
УРОВЕНЬ ТЕХНИКИ
Магнитная гипертермия (МГ) представляет собой перспективный метод лечения рака, включающий подвергание всего тела, его локальной области или ткани повышенным температурам под воздействием электромагнитного поля для повреждения или уничтожения раковых клеток или для разрушения опухолей. Два различных подхода к гипертермическому нагреву включают (а) гипертермические способы с использованием температур между 41 и 45°С и (b) способы термоабляции с повышением температуры выше 45°С для локальной индукции некроза ткани [1].
Различные технологии и способы МГ включают локальную гипертермию, регионарную гипертермию и гипертермию всего тела. Гипертермия всего тела может быть вызвана эндогенными или экзогенными источниками тепла и, как правило, обеспечивает нагрев всего тела до температур, составляющих примерно 39-43°С [1, 2]. Такой способ обычно используется для лечения карцином с отдаленными метастазами [1, 3]. Регионарная гипертермия воздействует на область тела человека или целый орган. Как правило, целью такого лечения является ослабление раковых клеток, облегчающее их уничтожение с помощью облучения и химиотерапевтических препаратов [3]. Способы локальной гипертермии, как правило, включают введение ферромагнитных или металлических частиц в область опухоли с последующим подверганием воздействию магнитного или электромагнитного поля: высокой частоты (ВЧ), ультравысокой частоты (УВЧ), сверхвысокой частоты (СВЧ), постоянного магнитного поля и т.д. Согласно некоторым вариантам, при локальной МГ вводимые частицы объединяют или присоединяют к другим противораковым лекарственным средствам или лигандам, специфичным для раковых клеток. Основные проблемы, связанные с доступными на сегодняшний день способами индукции гипертермии, включают необходимость локализации лечебного воздействия в области-мишени, а также максимального повышения нагрева в пределах патологически измененной ткани без повреждения нормальной ткани и снижения токсических побочных эффектов [2].
Магнитные наночастицы (МНЧ) привлекали внимание в качестве, например, контрастирующих агентов для магнитно-резонансной визуализации (МРВ), носителей систем доставки лекарственных средств и источников тепла при гипертермии для различных способов биомедицинского применения [4]. Они обладают уникальными свойствами, такими как способность к магнитной транспортировке, магнитному выделению и самонагреванию в магнитном поле переменного тока (ПТ) [5].
Применение МНЧ в качестве минимально инвазивных агентов впервые было описано Джилкристом и соавторами (Gilchrist et al.) в 1957, что привело к появлению способов МГ [6]. При подвергании воздействию магнитного поля ПТ магнитные наночастицы могут проявлять выраженные термические эффекты, связанные с потерями в ходе перемагничивания частиц [7]. Помимо обеспечения возможности сильно локализованного теплообразования применение МНЧ дает возможность самоограничения повышения температуры путем использования магнитного материала с подходящей температурой Кюри [7]. Одной из основных проблем, связанных с применением магнитных наночастиц в способах МГ, является необходимость максимально возможного высвобождения тепла при наименьшей дозе частиц (из-за их возможных токсических эффектов на живые организмы).
Наночастицы можно разделить на основе их размера на многодоменные МНЧ, размер которых составляет более чем примерно 40 нм в зависимости от параметров магнитного поля, и однодоменные наночастицы, или «суперпарамагнитные наночастицы», с диаметром менее 40 нм. В зависимости от указанных выше типов наночастиц за доставку тепла отвечают два различных механизма. В случае многодоменных магнитных наночастиц тепло доставляется в результате смещения границы домена (гистерезисные потери) [1]. Однодоменные частицы вызывают нагрев в результате потерь при переориентации векторов намагниченности в магнитном поле, или потерь на трение, где указанная наночастица способна вращаться в окружающей среде [1, 8].
Широкий диапазон синтезируемых в настоящее время магнитных наночастиц включает, среди прочих, МНЧ на основе металлов (Fe, Со, Ni), МНЧ на основе ферритов (MgFe2O4, CoPt, MnAl, CoFe2O4 и т.д.) и наночастицы типа оксида железа. Наночастицы типа оксида железа, несмотря на их относительно слабые магнитные свойства, широко используются в биомедицине в качестве гипертермических агентов благодаря низкой токсичности и стабильным магнитным характеристикам. Например, наночастицы на основе Fe3O4 были одобрены Управлением по контролю за продуктами питания и лекарственными средствами США (FDA) для применения в гипертермических способах. Однако наночастицы на основе Fe3O4 склонны к фазовому превращению в α-Fe2O3, γ-Fe3O4 или кристаллы Fe3O4 в зависимости от окружающих условий, при этом характеристики теплообразования и, соответственно, магнитные характеристики таких наночастиц меняются, что ограничивает их клиническое применение [9]. Кроме того, несмотря на то что наночастицы на основе Со, Ni или Mg также исследовались, их нельзя применять для тела человека из-за низкой температуры теплообразования (Со: 25°С, другие: ниже 25°С). В частности, частицы на основе MgFe2O4 трудно синтезировать, и они имеют низкую температуру теплообразования из-за низкой магнитной анизотропии [9]. Таким образом, существует необходимость в наночастицах, применимых в качестве новых высоко функциональных гипертермических агентов.
При разработке наночастиц для магнитной гипертермии следует учитывать следующие параметры:
- размер;
- форма;
- токсичность и биосовместимость;
- способность модифицировать поверхность;
- сложность синтеза и воспроизводимость полученных свойств;
- теплоотдача (SAR);
- требуемое внешнее магнитное поле и скорость реакции на воздействие указанного поля;
- стоимость.
Одним из наиболее важных параметров при создании магнитных наночастиц для МГ является SAR, или удельный коэффициент поглощения [6, 10]. SAR дает количественную оценку эффективности превращения магнитной энергии в тепло коллоидами МНЧ. Указанный параметр определяется как поглощенная энергия, нормированная к массе МНЧ, в переменном магнитном поле определенной частоты и интенсивности Н0 [6]:
SAR является критичным параметром, влияющим на температуру ткани во время гипертермического лечения. Перегрев опухоли может приводить к серьезному повреждению окружающих здоровых клеток или неконтролируемому некрозу. С другой стороны, желаемый терапевтический эффект не может быть достигнут при недостаточно высоком подъеме температуры. SAR МНЧ сильно зависит от частоты и интенсивности прилагаемого магнитного поля, а также от химических, физических и магнитных свойств материала [6].
Основные недостатки способов гипертермии на основе наночастиц включают:
- возможный перегрев (должна быть рассчитана точная продолжительность воздействия);
- токсичность лекарственных форм;
- сложность селективной доставки к области применения;
- неравномерное распределение МНЧ в области опухоли;
- высокая стоимость изготовления.
Таким образом, последние разработки способов МГ, включающих применение МНЧ, направлены на обеспечение быстрого и равномерного нагрева злокачественных опухолей со снижением риска термального повреждения здоровой ткани и повышением селективности лечения гипертермией. Другая существенная проблема заключается в создании новых типов магнитных частиц и наночастиц, обеспечивающих повышенную биосовместимость и эффективность лечения и облегчение тяжелых неблагоприятных явлений благодаря повышению значений SAR и снижению дозы указанных частиц, а также в разработке наночастиц, комбинированных или присоединенных к противораковым лекарственным средствам, лигандам или антителам, специфичным к раковым клеткам.
Согласно публикации патента США 4983159 [11] описан способ, обеспечивающий некроз новообразований у теплокровных животных в результате гипертермии, включающий инъекцию частиц в околоопухолевую область тела теплокровных животных. Частицы способны к гистерезисному нагреву при подвергании воздействию переменного магнитного поля. Кроме того, размер частиц составляет по меньшей мере два микрона или более для невозможности их внутриклеточной абсорбции в любой жизнеспособной или неопластической ткани животного. После инъекции частиц в опухолевую ткань область опухоли подвергают воздействию переменного магнитного поля. Частота указанного поля превышает частоту, достаточную для индукции какой-либо поддающейся выявлению нервно-мышечной реакции в ответ на переменное магнитное поле, но ниже частоты, способной вызывать какой-либо неблагоприятный нагрев жизнеспособной здоровой ткани теплокровного животного, вызванный вихревым током и/или диэлектрическим нагревом. Опухоль находится в пределах поля в течение времени, достаточного для нагрева частиц и опухоли, с которой связаны указанные частицы, до температуры, составляющей по меньшей мере 42°С, для индукции некроза указанной опухоли. Однако относительно большие частицы нельзя вводить путем инъекции в солидные опухоли, а применение более мелких ферромагнитных частиц неэффективно из-за отсутствия их нагрева в поле ВЧ. Кроме того, указанный подход не обеспечивает равномерный нагрев опухолевой ткани, что вызывает риск последующей стимуляции опухолевого роста.
Согласно другому подходу в евразийском патенте ΕА 019412 [12] описан способ локальной гипертермии злокачественных опухолей на основе поглощения энергии переменного магнитного поля с использованием ферромагнитных частиц с высокой коэрцитивной силой, вводимых в область опухоли. Указанный способ можно использовать для термического разрушения опухолей без повреждения здоровой ткани. В частности, изобретение позволяет решить проблему эффективности повышения магнитной гипертермии с помощью контроля амплитуды поля с учетом изменения температуры опухоли в процессе гипертермии, а также взаимосвязанной оптимизации свойств частиц (размера и коэрцитивной силы) и параметров переменного магнитного поля (регуляция частоты и диапазона амплитуд). Однако контроль температуры нагреваемой области осуществляют с помощью инвазивных термопарных датчиков, при этом достоверные данные распределения температуры в нагреваемой области отсутствуют, поскольку измерение температуры опухоли происходит в непосредственной близости от сенсоров.
В изобретении согласно заявке на японский патент JP 2013256405 [13] описаны ферритные магнитные наночастицы на основе Ni-Zn для термотерапии, имеющие ядро, содержащее магнитные наночастицы Ni(1-i)ZniFe2O4 (0,2≤i≤0,6), и оболочку, содержащую аморфный SiO2 для покрытия указанного ядра. Средний размер частиц составляет 10-20 нм. Указанные наночастицы обеспечивают подъем температуры до 4-15°С при приложении магнитного поля ПТ с частотой 15 кГц и интенсивностью 210 Э. Однако указанные наночастицы имеют высокую стоимость изготовления. Кроме того, ранее было описано, что наночастицы на основе Ni имеют низкую температуру теплообразования, что ограничивает их применение в гипертермии [9].
Магнитная система, подходящая для доставки лекарственных средств с помощью гипертермии, описана в русском патенте RU 2481125 [14]. Структура указанной магнитной системы включает магнитные частицы наноразмеров формулы MIIM2IIIO4, где MII=Fe, Со, Ni, Ζn, Μn; MIII=Fe, Cr, или маггемит, фунционализированные бифункциональными соединениями формулы R1-(CH2)n-R2 (где n=2-20, R1 выбран из: CONHOH, CONHOR, PO(OH)2, PO(OH)(OR), СООН, COOR, SH, SR; R2 представляет собой внешнюю группу и выбран из: ОН, NH2, СООН, COOR; R представляет собой алкильную группу или щелочной металл, выбранный из C1-6-алкила и K, Na или Li соответственно). Структура также содержит полимер, необязательно содержащий фармакологически активную молекулу, которая может быть выбрана из противораковых агентов, противомикробных агентов, противовоспалительных агентов, иммуномодуляторов и молекул, действующих на центральную нервную систему или способных метить клетки для возможности их идентификации с помощью стандартных диагностических детекторов. Магнитная система характеризуется как биосовместимая и стабильная. Однако указанные магнитные системы и, в частности, магнитные наночастицы сильно варьируют по размеру (например, средний диаметр наночастиц может находиться в диапазоне от 4 до 200 нм). Известно, что указанные частицы малого размера находятся в однодоменном состоянии, и их способность нагреваться при конкретной амплитуде и частоте магнитного поля определяется магнитной восприимчивостью. Повышение размера частиц приводит к возникновению другого механизма нагрева на основе гистерезисных потерь, и значение нагрева определяется областью петли гестерезиса, т.е. намагниченностью насыщения и коэрцитивной силой. Кроме того, повышение диаметра частиц приводит к возникновению механизмов, опосредованных вязкостным трением во врем вращения и движения частиц в магнитном поле. Таким образом, для частиц различного размера характерны разные механизмы нагрева, что в свою очередь может приводить к определенным трудностям в контроле температуры и последующему неравномерному нагреву злокачественных опухолей.
Согласно другому подходу в русском патенте RU 2295933 [15] описан способ магнитного лечения злокачественных новообразований, включающий введение частиц в опухоль и последующий нагрев в результате магнетокалорического эффекта, вызванного энергией электромагнитного поля. Частицы состоят из вещества, имеющего высокое значение магнетокалорического эффекта, с температурой магнитного фазового перехода, близкой к температуре тела человека, и выбраны из группы, включающей щелочно-земельные, переходные и благородные металлы, а также их сплавы и интерметаллические соединения (например, частицы на основе сплава железо-родий, в частности, Fe0,49Rh0,51). Однако прилагаемое магнитное поле имеет высокое значение силы (до 60 Э и более), что может вызывать ряд негативных эффектов в живых организмах. Таким образом, применение такого магнитного поля в способах гипертермии нельзя считать абсолютно безопасным.
Согласно публикации патента США 7842281 [16] описана улучшенная композиция магнитных наночастиц, обеспечивающая внутренний регулятор температуры, для применения в магнитном нагреве, в частности, для применения в медицинском лечении с помощью магнитной гипертермии. Композиция содержит магнитные наночастицы, температура Кюри которых составляет между 40 и 46°С, и может дополнительно содержать полимерный материал и необязательно лекарственное средство или радиосенсибилизирующий агент. Указанная композиция уменьшает или устраняет проблему неравномерного нагрева и обладает способностью к саморегуляции максимальной достигаемой температуры, что делает способ магнитной гипертермии более перспективной терапевтической возможностью. Один из вариантов реализации изобретения относится к композиции, содержащей МНЧ, температура Кюри которых составляет 47°С, где указанная композиция наночастиц содержит сплав формулы Mn0,5Zn0,5Fe2O4, и эффективный средний диаметр наночастиц составляет между 10 нм и 400 нм.
Изобретение также обеспечивает способы гипертермического лечения пациента, нуждающегося в указанном лечении, включающие стадии введения пациенту композиции, содержащей МНЧ, температура Кюри которых составляет между 40 и 46°С; и подвергание МНЧ в теле пациента воздействию переменного магнитного поля, эффективного для индукции гистерезисного нагрева наночастиц. Однако размер указанных магнитных наночастиц существенно варьирует (эффективный средний диаметр частиц составляет между 10 нм и 400 нм). Как было упомянуто выше, для частиц различного размера характерны разные механизмами нагрева, что в свою очередь может приводить к определенным трудностям в контроле температуры, затрудняя, таким образом, равномерный нагрев злокачественных опухолей. Более того, указанный подход не учитывает характеристики опухоли, подлежащей лечению, такие как ее расположение, плотность и гидродинамические свойства.
Таким образом, существует необходимость в разработке улучшенных способов магнитного гипертермического лечения с устранением одного или более недостатков согласно предшествующему уровню техники. Авторы считают, что будущий успех в области разработки способов МГ и их применения для лечения рака зависит от возможности создавать индивидуальные протоколы для каждого типа рака, подлежащего лечению с помощью гипертермии у субъектов, вместо разработки общего универсального способа.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является улучшенный способ гипертермического лечения различных заболеваний и расстройств, в частности, злокачественных новообразований, обеспечивающий регулирование количества и локальной концентрации магнитных наночастиц в области опухоли в зависимости от желаемых предварительно определенных для каждого типа опухоли значений и равномерный нагрев и повышенную эффективность гипертермии при снижении нежелательных явлений. Авторы настоящего изобретения неожиданно обнаружили, что способ магнитного гипертермического лечения злокачественных новообразований, включающий стадии доставки в область опухоли магнитных наночастиц, выбранных из группы магнитных оксидов металлов, включающей ферриты, средний размер которых составляет менее 40 нм, и подвергания области опухоли воздействию магнитного поля ПТ с предварительно определенными параметрами, обеспечивает сопутствующее и/или последующее селективное повреждение или по меньшей мере частичное разрушение опухолевых клеток в области опухоли без повреждения здоровой окружающей ткани.
Согласно одному варианту реализации изобретения способ лечения злокачественных новообразований с помощью магнитной гипертермии включает следующие стадии:
(i) доставка в область опухоли магнитных наночастиц, выбранных из группы магнитных оксидов металлов, включающей Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), средний размер которых составляет менее 40 нм, температура Кюри составляет от 39°С до 550°С, и среднее значение коэрцитивной силы составляет от 5 до 250 Э, и
(ii) подвергание области опухоли воздействию магнитного поля ПТ с амплитудой от 14 Э до 300 Э и частотой от 80 кГц до 1000 кГц, где время подвергания указанному воздействию при температуре от 38°С до 51°С составляет от 15 до 60 мин, для обеспечения:
(iii) сопутствующего и/или последующего селективного повреждения или по меньшей мере частичного разрушения опухолевых клеток селективно в области опухоли без повреждения здоровой окружающей ткани.
Согласно одному варианту реализации изобретения сила и/или частота электромагнитного поля ПТ выбраны на основе предварительно определенной зависимости эффективности гипертермии от типа опухоли и доставляемой концентрации и/или типа наночастиц для обеспечения повреждения или частичного разрушения по меньшей мере от 80 до 90%, предпочтительно 95% опухолевых клеток.
Согласно одному варианту реализации изобретения магнитные наночастицы выбраны на основе предварительно определенной зависимости эффективности магнитной гипертермии для определенного типа опухоли по меньшей мере от одного параметра, выбранного из концентрации, среднего размера частиц, распределения частиц по размеру, температуры Кюри, среднего значения коэрцитивной силы и покрытия частиц, для обеспечения повреждения или частичного разрушения по меньшей мере от 80 до 90%, предпочтительно 95% опухолевых клеток.
Согласно одному варианту реализации изобретения продолжительность и количество циклов подвергания магнитной гипертермии выбраны на основе предварительно определенной зависимости эффективности гипертермии от типа опухоли и/или характеристик частиц для обеспечения повреждения или частичного разрушения по меньшей мере от 80 до 90%, предпочтительно 95% опухолевых клеток.
Согласно одному варианту реализации изобретения магнитные наночастицы представляют собой Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4, где x составляет 0-0,9. Согласно некоторым вариантам реализации изобретения частицы могут содержать защитную оболочку или покрытие, где указанная защитная оболочка или покрытие состоит из биосовместимого полимерного материала.
Согласно другому варианту реализации изобретения способ магнитного гипертермического лечения злокачественных новообразований включает стадию выбора параметров магнитного поля (сила, частота) и характеристик магнитных наночастиц (размер, форма) для каждого типа опухоли с обеспечением оптимальных значений SAR, коэрцитивной силы и температуры нагрева для повреждения или частичного разрушения по меньшей мере 50, предпочтительно от 75 до 90%, более предпочтительно 95% опухолевых клеток.
Согласно другому варианту реализации изобретения изобретение относится к применению Zn-замещенных магнитных наночастиц на основе феррита марганца формулы ZnxMn1-xFe2O4, где x равен 0-0,9, для лечения злокачественных новообразований с помощью магнитной гипертермии.
Согласно другому варианту реализации изобретения предложена фармацевтическая композиция для лечения злокачественных новообразований с помощью магнитной гипертермии, содержащая Ζn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), фармацевтически приемлемый носитель и необязательно биологически активную молекулу.
Согласно другому варианту реализации изобретения предложено применение Zn-замещенных магнитных наночастиц на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9) для магнитной гипертермии злокачественных новообразований. Согласно другому варианту реализации изобретения предложен способ экспериментального повреждения опухолевых клеток с помощью магнитной гипертермии, включающий следующие стадии:
(i) обеспечение магнитных наночастиц, выбранных из группы магнитных оксидов металлов, включающей Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4 (х=0-0,9), средний размер которых составляет менее 40 нм, температура Кюри составляет от 39°С до 550°С, и среднее значение коэрцитивной силы от 5 до 250 Э.
(ii) добавление магнитных наночастиц в клеточную культуру;
(iii) подвергание указанной клеточной культуры магнитному полю ПТ с амплитудой от 14 Э до 300 Э и частотой от 80 кГц до 1000 кГц, где время подвергания указанному воздействию при температуре от 38°С до 51°С составляет от 15 до 60 мин, для обеспечения:
(iv) сопутствующего или последующего повреждения или по меньшей мере частичного разрушения опухолевых клеток.
Указанные и другие варианты реализации изобретения подробно описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые графические материалы иллюстрируют варианты реализации описанного в настоящей заявке изобретения и вместе с описанием изобретения раскрывают некоторые из неограничивающих примеров изобретения.
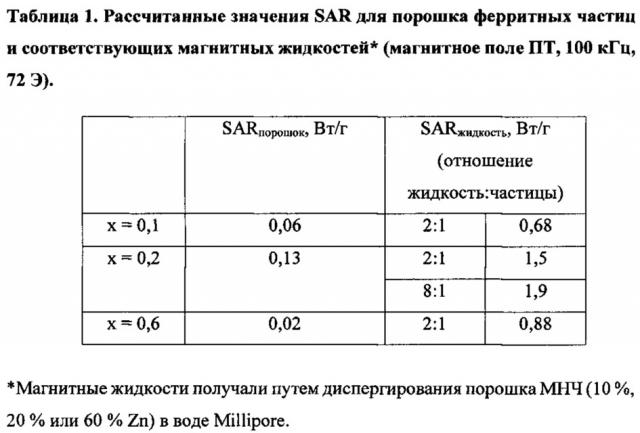
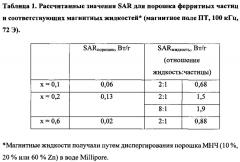
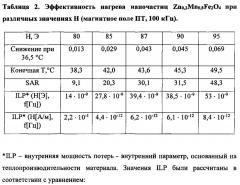
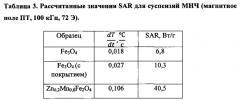
На Фигуре 1 показаны изображения образцов соединений ZnxMn1-xFe2O4 с различным содержанием Zn, полученные с помощью просвечивающей электронной микроскопии: а - ZnxMn1-xFe2O4, x=0; b - ZnxMn1-xFe2O4, x=0,1; с - ZnxMn1-xFe2O4, x=0,2; d - ZnxMn1-xFe2O4, x=0,4; e - ZnxMn1-xFe2O4, x=0,5; f - ZnxMn1-xFe2O4, x=0,6; g - ZnxMn1-xFe2O4, x=0,9.
На Фигуре 2 показано распределение по размеру наночастиц ZnxMn1-xFe2O4 в зависимости от степени Zn-замещения.
На Фигуре 3 показана конструкция экспериментального устройства с системой охлаждения воздуха для проведения экспериментов in vitro с использованием МГ (а) и его блок-схема (b): 1 - генератор, 2 - преобразователь, 3 - система охлаждения, 4, 5, 6 - источник питания, L - катушка.
На Фигуре 4 показаны результаты измерения намагниченности для ΖnxΜn1-xFe2O4 с различным содержанием Ζn (x) [18].
На Фигуре 5 показана зависимость коэрцитивности от концентрации Zn при комнатной температуре.
На Фигуре 6 показана эффективность нагрева образцов МНЧ ZnxMn1-xFe2O4 как график зависимости температуры от времени для различных концентраций Zn (x).
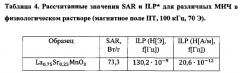
На Фигуре 7 показаны значения удельного коэффициента поглощения (SAR) в зависимости от размера МНЧ.
На Фигуре 8 показана эффективность нагрева частиц Zn0,2Mn0,8Fe2O4 как график зависимости температуры от времени для различных значений напряженности поля Η при частоте f=100 кГц.
На Фигуре 9 показан график зависимости температуры от времени, включающий отношение эффективности нагрева ZnxMn1-xFe2O4 МНЧ (х=0,1) к эффективности нагрева других композиций: покрытых полимером и не покрытых полимером магнитных частиц (Fe3O4) и частиц LSMO (LaxSr1-xMnO3, x=0,75); Η=95 Э.
На Фигуре 10 показаны изображения контрольных (а) и экспериментальных (b) клеток лейкемии линии K562, которые инкубировали при 37°С (а) и 43°С (b) в присутствии Zn-замещенных магнитных наночастиц на основе феррита марганца (10 мг). Исходное увеличение х250.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В целом, настоящее изобретение описывает способ лечения злокачественных новообразований или тканей-мишеней с помощью локальной гипертермии с использованием магнитных наночастиц, обладающих улучшенными характеристиками нагрева для повышения теплопроизводительности и снижения нежелательных явлений.
I. ОПРЕДЕЛЕНИЯ
На всем протяжении настоящей заявки и формулы изобретения термины «включает» и «содержит» и их вариации, такие как «содержащий», «включающий», «имеет» и «имеющий» следует интерпретировать как инклюзивные. Употребление предметов в единственном числе в контексте описанного изобретения относится как к единственному, так и множественному числу указанных предметов, если иное не указано в настоящей заявке или явно не следует и контекста.
Следует понимать, что каждый диапазон, описанный в настоящей заявке, представляет собой ряд чисел, принадлежащих указанному диапазону. Таким образом, каждый диапазон включает все и каждое значение, принадлежащее указанному диапазону, а также любой из его поддиапазонов. Если иное не указано, предполагается, что пограничные точки диапазона являются частью указанного диапазона.
При использовании в настоящей заявке термин «магнитная гипертермия» (аббревиатура «МГ») обозначает способ медицинского лечения, включающий подвергание всего тела, его локальной области или ткани повышенным температурам под воздействием электромагнитного поля для повреждения или уничтожения раковых клеток или для разрушения опухолей.
Термин «магнитные наночастицы» (аббревиатура «МНЧ») при использовании в настоящей заявке относится к классу наночастиц, которыми можно управлять с помощью градиентов магнитного поля. Согласно предпочтительному варианту реализации изобретения указанный термин относится к Zn-замещенным магнитным наночастицам на основе феррита марганца.
При использовании в настоящей заявке термины «магнитное поле переменного тока (ПТ)» или «переменное магнитное поле» означают магнитное поле, вызванное переменным током.
При использовании в настоящей заявке термины «злокачественная неоплазма», «злокачественное новообразование», «раковая клетка», «опухолевая клетка» или «опухоль» относятся к любому неопластическому росту у пациента, включая любые метастазы. Конкретные типы рака, которые можно лечить с использованием способов согласно настоящему изобретению, описаны в настоящей заявке.
В целом, термин «эффективность нагрева» означает отношение тепла, образующего в ходе процесса, к общей затраченной энергии или поглощенному теплу. При использовании в настоящей заявке указанный термин определяет способность магнитных наночастиц нагреваться до оптимальной температуры в описанном способе магнитной гипертермии. Указанная оптимальная температура обеспечивает быстрый и равномерный нагрев злокачественных новообразований, снижая риск термального повреждения здоровой ткани.
Термин «температура Кюри» (или «Тс») означает температуру, при которой конкретные материалы утрачивают свойства постоянного магнита с приобретением индуцированного магнетизма. Размер частиц в кристаллической решетке материала изменяет температуру Кюри. Благодаря малому размеру частиц колебания спина электрона становятся более значительными, что приводит, таким образом, к снижению Тс при снижении размера частиц, поскольку колебания вызывают разупорядоченность [17].
При использовании в настоящей заявке термин «удельный коэффициент поглощения» (или «SAR») представляет собой количество энергии, поглощаемой образцом на единицу массы. Частицы должны иметь высокие значения SAR для быстрого нагрева под воздействием прилагаемого переменного магнитного поля. SAR МНЧ сильно зависит от частоты и интенсивности прилагаемого магнитного поля, а также от химических, физических и магнитных свойств материала. Ожидается, что частицы, имеющие оптимальное значение удельного коэффициента поглощения (SAR), не вызывают перегрева опухолевой ткани при прилагаемом магнитном поле и обеспечивают желаемый терапевтический эффект благодаря достаточному подъему температуры.
Более конкретно, указанные частицы обеспечивают нагрев области опухоли до желаемой температуры, составляющей от примерно 40 до примерно 46°С, при использовании их низкой концентрации и без перегрева областей с высокой концентрацией частиц при минимальных значениях частоты и амплитуды прилагаемого поля.
Термины «коэрцитивная сила» или «коэрцитивность», используемые в отношении ферромагнитного материала, означают интенсивность прилагаемого магнитного поля, необходимую для снижения намагниченности указанного материала до нуля после доведения намагниченности образца до насыщения. Другими словами, указанный параметр измеряет устойчивость ферромагнитного материала к размагничиванию.
Термин «константа анизотропии» или «магнитная константа анизотропии» отражает реализацию эффекта магнитной анизотропии в материале, где расположение ядерных магнитных моментов в определенном направлении кристалла является энергетически более эффективным по сравнению с другими направлениями. Под воздействием прилагаемого магнитного поля магнитный момент однодоменной наночастицы может вращаться. В твердом теле вращение происходит внутри частицы (релаксация Нееля). В магнитной жидкости оно может происходить посредством броуновской диффузии. Важными факторами, влияющими на время релаксации Нееля, являются константа анизотропии Keff и объем частицы V. Когда диаметр частицы составляет менее 15 нм, доминирует быстрая релаксация Нееля. Если диаметр частицы составляет более 15 нм, на ее характеристики влияет медленная броуновская релаксация.
При использовании в настоящей заявке термины «селективно» и «селективность» (например, «селективность лечения») означают влияние с высоко специфичной активностью, обеспечивающее строго локализованный эффект. Термин «коэффициент повреждения клеток» означает процент раковых клеток, претерпевающих видимые морфологические изменения через 24 часа после их подвергания воздействию магнитного поля ПТ в присутствии магнитных наночастиц.
При использовании в настоящей заявке термин «введение» означает введение магнитных наночастиц в соответствии с изобретением или содержащей их фармацевтической композиции субъекту, нуждающемуся в указанном введении. Согласно предпочтительному варианту реализации изобретения указанный термин относится к внутривенному или внутриопухолевому введению.
Термины «субъект» и «пациент» используются в настоящей заявке взаимозаменяемо и относятся к животному, такому как млекопитающее, более предпочтительно к человеку.
При использовании в настоящей заявке термины «лечить» и «лечение» относятся к подавлению или снижению развития патологического состояния, расстройства или заболевания или его клинических симптомов с помощью конкретной терапии.
Термин «биологически активная молекула» используется для определения молекулы вещества, которую вводят субъекту, способной вызывать конкретный клеточный ответ. Согласно предпочтительному варианту реализации изобретения биологически активная молекула выбрана из противоракового агента, распознающего опухолевые клетки антитела или аптамера.
II. ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Согласно одному варианту реализации изобретения предложен способ лечения злокачественных новообразований с помощью магнитной гипертермии, включающий следующие стадии:
(i) доставка в место опухоли магнитных наночастиц, выбранных из группы магнитных оксидов металлов,
(ii) подвергание области опухоли магнитному полю ПТ,
(iii) последующее селективное повреждение или разрушение опухолевых клеток в области опухоли без повреждения здоровой окружающей ткани.
Согласно одному варианту реализации изобретения магнитные наночастицы представляют собой Zn-замещенные магнитные наночастицы на основе феррита марганца формулы ZnxMn1-xFe2O4, где x равен 0-0,9.
Согласно конкретным вариантам реализации изобретения магнитные наночастицы представляют собой Zn-замещенные магнитные наночастицы на основе феррита марганца формулы Zn0,2Mn0,8Fe2O4. Авторы настоящего изобретения неожиданно обнаружили в ходе эксперимента, что вводимые магнитные наночастицы обладают повышенной эффективностью нагрева и высоким значением удельного коэффициента поглощения (SAR). SAR МНЧ сильно зависит от частоты и интенсивности прилагаемого магнитного поля, наряду с химическими, физическими и магнитными свойствами материала. В результате исследования, проведенного изобретателями, было обнаружено, что наночастицы с оптимальным значением SAR, описанные согласно изобретению, обеспечивают желаемый терапевтический эффект благодаря достаточному подъему температуры без перегрева опухолевой ткани под воздействием прилагаемого магнитного поля. На основе экспериментального исследования изобретатели определили размер наночастиц для применения согласно настоящему изобретению для обеспечения максимального коэффициента повреждения клеток и выбора состава МНЧ, например, степени Zn-замещения, и параметров магнитного поля, таких как частота и/или сила магнитного поля. Размер измеряли, как показано в Примере 2.
Согласно одному варианту реализации изобретения предпочтительный средний размер наночастиц составляет менее 40 нм. Согласно некоторым вариантам реализации изобретения средний размер наночастиц находится в диапазоне от 1 до 100 нм, от 2 до 50 нм, от 4 до 40 нм или от 5 до 30 нм. Согласно предпочтительному варианту реализации изобретения средний размер наночастиц составляет от 5 до 25 нм. Авторы обнаружили, что указанный диапазон размеров является решающим фактором для повышения эффективности нагрева наночастиц.
Согласно одн