Способ получения производных (е)-2-(2-ацилвинил)бензофурана
Иллюстрации
Показать всеИзобретение относится к области органической химии – способу получения новых гетероциклических соединений - производных (Е)-2-(2-ацилвинил)бензофурана формулы I a-k, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения, который заключается во взаимодействии 2-гидроксибензиловых спиртов с N-тозил-фурфуриламином в ледяной уксусной кислоте в присутствии стехиометрических количеств соляной кислоты при температуре 120°С. 2 табл., 10 пр.
Реферат
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных (E)-2-(2-ацилвинил)бензофурана, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения.
Изобретение относится к разработке способа получения производных (E)-2-(2-ацилвинил)бензофурана общей формулы Ia-к, которые являются привлекательными объектами для медицинской химии, поскольку могут быть использованы в синтезе (E)-3-(бензофуран-2-ил)-3-фенилакриловых кислот, являющихся аллостерическими активаторами протеинкиназы PDK1, потенциальными противоопухолевыми, противовоспалительными и противодиабетическими лекарственными средствами [A. Stroba, F. Schaeffer, V. Hindie, L. Lopez-Garcia, I. Adrian, W. Frohner, R.W. Hartmann, R.M. Biondi, M. Engel J. Med. Chem. 2009, 52, 4683-4693].
Все известные методы синтеза производных (E)-2-(2-ацилвинил)бензофурана основаны на использовании исходных соединений, содержащих уже готовый бензофурановый каркас. В частности, (E)-2-(2-ацилвинил)бензофураны получают конденсацией бензофуран-2-карбальдегида с ацетоном [Н.М. Hassan, J. Wojtanis Indian J. Chem., Sect. B: Org. Chem. Inch Med. Chem. 1985, 24, 188-192], силиловыми эфирами енолов [V.R. Chintareddy, К. Wadhwa, J.G. Verkade J. Org. Chem. 2009, 74, 8118-8132] или илидами фосфора [J. L. Shih, T. S. Nguyen, J. A. May Ang. Chem. Int. Ed. 2015, 54, 9931-9935], а также конденсацией литиевой соли диэтил(дифторметил)фосфоната с 3-(2-бензофурил)акрилатом [К. Panigrahi, G.A. Applegate, G. Malik, D.В. Berkowitz J. Am. Chem. Soc. 2015, 137, 3600-3609]. Кроме того, производные (Е)-2-(2-ацилвинил)бензофурана получают палладий-катализируемым кросс-сочетанием бензофурана и метилвинилкетона [С. Jia, Т. Kitamura, Y. Fujiwara Org. Lett. 1999, 1, 2097-2100], бензофуран-2-илборной кислоты и 1-[(E)-3-оксобут-1-ен-1-ил]пиридиний тетрафторбората [K. Buszek, N. Brown Org. Lett. 2007, 9, 707-710]. Также описан метод, основанный на окислении 4-(бензофуран-2-ил)бутан-2-онов пербромидом бромида пиридиния [V.Т. Abaev, М.G. Kadieva, А.V. Butin, G.D. Krapivin, Е.Т. Oganesyan, V.Е. Zavodnik Chem. Heterocycl. Compd. 2000, 36, 1261-1271]. К недостаткам перечисленных методов необходимо отнести средние выходы целевых продуктов, необходимость использования труднодоступных исходных субстратов, токсичных реагентов и дорогостоящих катализаторов.
В основе заявляемого метода лежит описанный ранее способ получения производных 2-(2-ацилвинил)бензофурана взаимодействием соответствующего салицилового спирта с N-тозилфурфуриламином при кипячении в уксусной кислоте в присутствии ортофосфорной кислоты [А.V. Butin, S.К. Smirnov Tetrahedron Lett. 2005, 46, 8443-8445]. Недостатком данного способа является низкий выход целевого продукта реакции. Следует отметить, что данным способом был получен только один целевой 2-(2-ацил-винил)бензофуран.
Задача изобретения - оптимизация реакционных условий способа получения замещенных 2-(2-ацилвинил)бензофуранов и расширение номенклатуры целевых бензофуранов.
Техническим результатом является повышение выходов целевых бензофуранов за счет изменения условий проведения реакции и расширение номенклатуры целевых бензофуранов.
Технический результат достигается тем, что в способе получения производных (E)-4-(1-бензофуран-2-ил)бут-3-ен-2-она Ia-к смесь легкодоступных салициловых спиртов IIа-к [J. Fan, Z. Wang Chem. Commun. 2008, 5381-5383] и N-тозилфурфуриламина в ледяной уксусной кислоте нагревают при температуре 120°C в присутствии стехиометрических количеств HCl в течение 30 минут. Использование данных реакционных условий позволяет избежать осмоления реакционной смеси и повысить выходы целевых бензофуранов до 70%.
Полученный технический результат позволяет повысить выходы целевых (E)-4-(1-бензофуран-2-ил)бут-3-ен-2-онов Ia-к на 30-60% по сравнению с описанным способом [А.V. Butin, S.К. Smirnov Tetrahedron Lett. 2005, 46, 8443-8445] за счет изменения реакционных условий, а именно характера и количества кислотного инициатора. Кроме того, полученный технический результат существенно расширяет номенклатуру целевых (Е)-4-(1-бензофуран-2-ил)бут-3-ен-2-онов.
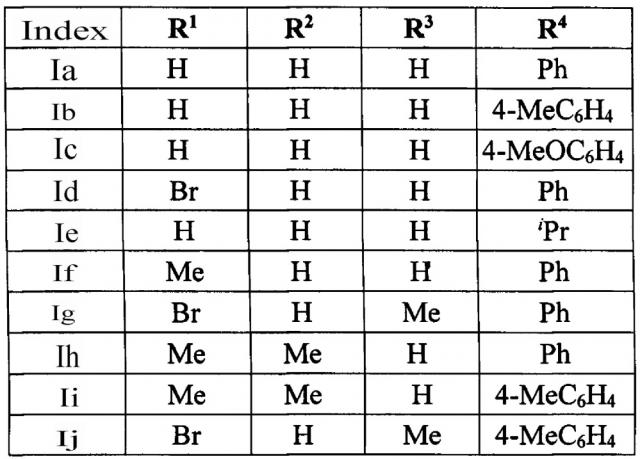
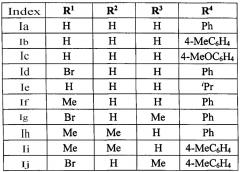
Выходы продуктов реакции и спектральное характеристики 2-(2-ацил-винил)бензофуранов Iб-к приведены в таблице 1.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-она 1а
Пример 1
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилфенилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют соляную кислоту (10 М, 50 мкл, 0.5 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 56% (73 мг).
Rƒ=0.46 этилацетат : петролейный эфир (1:4)
Спектр 1Н ЯМР (ДМСО-d6), (δ, м.д. и КССВ, J, Гц): 2.29 (с, 3Н, СН3), 6.85 (д, 3J=15.8 Гц, 1Н, =СН), 7.29-7.31 (м, 1Н, HAr), 7.36 (д, 3J=15.8 Гц, 1Н, =СН), 7.45-7.47 (м, 1Н, HAr), 7.49-7.52 (м, 1Н, НAr), 7.54-7.60 (м, 4Н, НAr), 7.62-7.65 (м, 2Н, НAr)
Спектр 13С ЯМР (ДМСО-d6), (δ, м. д.): 28.2, 111.5, 120.7, 123.8, 125.8, 127.0, 127.0, 127.4, 127.5, 128.5, 129.2 (2С), 129.2 (2С), 130.2, 147.6, 154.2, 196.9
Пример 2
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилфенилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют соляную кислоту (10 М, 100 мкл, 1 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 20% (26 мг).
Пример 3
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилфенилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют соляную кислоту (10 М, 200 мкл, 2 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (Е)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки KCK (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 21% (28 мг).
Пример 4
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют соляную кислоту (10 М, 50 мкл, 0.5 ммоль) и перемешивают при температуре 130°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (Е)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 48% (63 мг).
Пример 5
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют соляную кислоту (10 М, 50 мл, 0.5 ммоль) и перемешивают при температуре 140°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он ч очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 54% (71 мг).
Пример 6
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в толуоле (2.5 мл) добавляют соляную кислоту (10 М, 50 мкл, 0.5 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 31% (41 мг).
Пример 7
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в 1,4-диоксане (2.5 мл) добавляют соляную кислоту (10 М, 50 мкл, 0.5 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 37% (49 мг).
Пример 8
К раствору 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют Н3РО4 (28 мкл, 0.5 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 52% (68 мг).
Пример 9
К раствору 2-(гидрокси(фенил)метил)фенола (100.1 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (125.6 мг, 0.5 ммоль) в АсОН (2.5 мл) добавляют трифторуксусную кислоту (38 мкл, 0.5 ммоль) и перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - этилацетат : петролейный эфир (1:4). Выход 36% (47 мг).
Пример 10
Раствор 2-(гидрокси(фенил)метил)фенола (100 мг, 0.5 ммоль) и N-(фуран-2-илметил)-4-метилбензилсульфонамида (126 мг, 0.5 ммоль) в АсОН (2.5 мл) перемешивают при температуре 120°C в течение 30 минут. По окончании реакции растворитель удаляют при пониженном давлении. Целевой (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-он в данных условиях не образуется.
В таблице 2 приведены данные о влиянии условий проведения реакции на выход (Е)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-она (примеры 1-10).
Как видно из таблицы 2, результат, а именно получение (E)-4-(3-фенилбензофуран-2-ил)бут-3-ен-2-она, может быть достигнут при использовании стехиометрических количеств соляной кислоты в качестве кислотного инициатора. Увеличение количества кислотного инициатора приводит к снижению выхода целевого продукта. Оптимальная температура проведения реакции - 120°C, а оптимальным растворителем для проведения реакции является ледяная уксусная кислота.
Методом 1 получен ряд производных (E)-2-(2-ацилвинил)бензофурана 1a-к с выходами 35-70%.
Способ получения производных (E)-2-(2-ацилвинил)бензофурана общей формулы I,
характеризующийся тем, что смесь легкодоступных салициловых спиртов IIa-к и N-тозилфурфуриламина в ледяной уксусной кислоте нагревают при температуре 120°С в присутствии стехиометрических количеств HCl в течение 30 минут.