Способ получения производных (е)-4-(индол-2-ил)проп-2-ен-1-она
Иллюстрации
Показать всеИзобретение относится к области органической химии - синтезу гетероциклических соединений - производных (E)-4-(индол-2-ил)проп-2-ен-1-она, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения. Способ получения производных (E)-4-(индол-2-ил)проп-2-ен-1-она I заключается во взаимодействии доступных 2-(N-тозиламино)бензиловых спиртов с 2-замещенными фуранами с последующей обработкой реакционной смеси ацетатом палладия, пара-бензохиноном и молекулярным йодом в ледяной уксусной кислоте при нагревании. 2 табл., 10 пр.
Реферат
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных (E)-4-(индол-2-ил)проп-2-ен-1-она, представляющих интерес в качестве исходных соединений для синтеза веществ фармацевтического назначения.
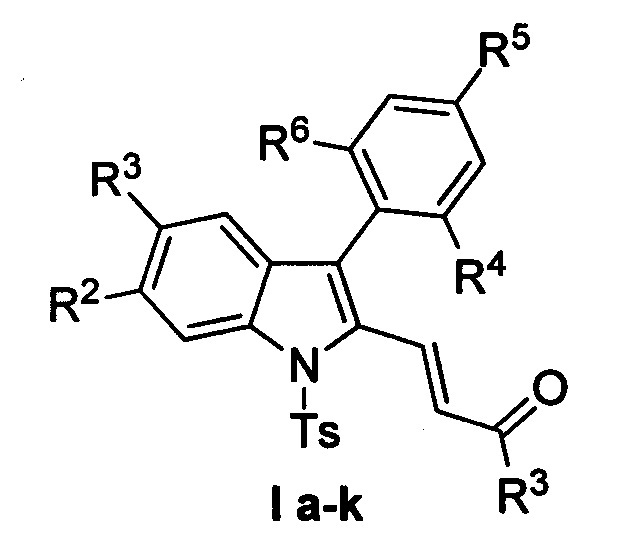
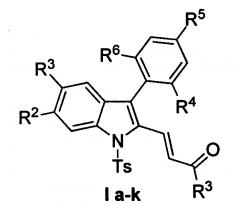
Изобретение относится к разработке способа получения производных (E)-4-(индол-2-ил)проп-2-ен-1-она общей формулы Ia-к, которые являются привлекательными объектами для медицинской химии. Данные соединения могут быть использованы в синтезе аналогов алкалоидов изоборреверина и диметилизоборреверина, обладающих противомалярийной активностью [D.Н. Dethe, R.D. Erande, A. Ranjan. / Org. Chem. 2013, 78, 10106-10120].
Известные методы получения производных (E)-4-(индол-2-ил)проп-2-ен-1-она условно можно разделить на две группы. Первая группа методов основана на функционализации уже готового индольного каркаса. Так, например, целевые (E)-4-(индол-2-ил)проп-2-ен-1-оны получают конденсацией 2-формилиндолов с соответствующими кетонами [J. Zhou, G. Geng, J.Н. Wu Invest. New Drugs 2010, 28, 291-298] или алкилиденфосфоранами [F. Sha, Y. Tao, C.-Y. Tang, F. Zhang, X-Y. Wu J. Org. Chem. 2015, 80, 8122-8133]. Также известны способы получения, основанные на палладий-катализируемых реакциях кросс-сочетания по Хеку [S. Jin, J. Gong, Y. Qin, Angew. Chem. Int. Ed., 2015, 54, 2228-2231] или Фудживаре [C-Y. Tang, Y. Tao, X.-Y. Wu, F. Sha, Adv. Synth. CataL, 2014, 356, 609-615; Z.-L. Yan, W.-L. Chen, Y.-R. Gao, S. Mao, Y.-L. Zhang, Y.-Q. Wang, Adv. Synth. CataL, 2014, 356, 1085-1092]. Кроме того, описан метод окисления 4-(индол-2-ил)пропан-1-онов в соответствующие (E)-4-(индол-2-ил)проп-2-ен-1-оны с использованием 2,3-дихлор-5,6-дициано-1,4-бензохинона [A. Kuznetsov, А. Makarov, А.Е. Rubtsov, А.V. Butin, V. Gevorgyan J. Org. Chem. 2013, 78, 12144-12153].
Ко второй группе следует отнести подходы, основанные на построении индольного фрагмента и одновременном введении требуемого набора заместителей. Например, производные (E)-4-(индол-2-ил)проп-2-ен-1-она получены рециклизацией 2-нитробензилфуранов в результате обработки хлоридом олова (II) [М.G. Uchuskin, N.V. Molodtsova, V.Т. Abaev, I.V. Trushkov, A.V. Butin Tetrahedron 2012, 68, 4252-4258], термолизом 2-азидобензилфуранов [V.Т. Abaev, A.Т. Plieva, P.N. Chalikidi, M.G. Uchuskin, I.V. Trushkov, A.V. Butin Org. Lett. 2014, 16, 4150-4153] или окислением 2-(N-тозиламино)бензилфуранов [A.S. Makarov, A.A. Merkushev, M.G. Uchuskin, I.V. Trushkov Org. Lett. 2016, 18, 2192-2195]. Кроме того, известен подход, основанный на рециклизации 2-(N-тозиламино)бензилфуранов, образующихся в результате взаимодействии 2-(тозиламино)бензиловых спиртов с замещенными фурфуриламинами [М.G. Uchuskin, N.V. Molodtsova, S.A. Lysenko, V.N. Strel'nikov, I.V. Trushkov, A.V. Butin Eur. J. Org. Chem. 2014, 2508-2515]. Также производные (E)-4-(индол-2-ил)проп-2-ен-1-она получены палладий-катализируемой реакцией кросс-сочетания фурфурилтозилгидразонов и 2-иоданилинов [В. Yin, X. Zhang, X. Zhang, Н. Peng, W. Zhou, В. Liu, H. Jiang, Chem. Commun., 2015, 51, 6126-6129]. К ограничениям вышеперечисленных методов необходимо отнести использование труднодоступных исходных соединений, токсичных реагентов, низкую вариативность и стереоселективность, а также умеренные выходы целевых индолов.
В основе заявляемого метода лежит описанная ранее реакция внутримолекулярного окислительного аминирования 2-аллиланилинов под действием ацетата палладия в ДМСО в атмосфере кислорода, приводящая к образованию замещенных индолов [R. Nallagona, М. Rehan, P. Ghorai Org. Lett. 2014,16, 4786-4789].
Задача изобретения - разработка нового эффективного метода получения производных (E)-4-(индол-2-ил)проп-2-ен-1-она Iа-к, позволяющего существенно расширить номенклатуру производных (E)-4-(индол-2-ил)проп-2-ен-1-она, представляющих интерес для синтеза биологически активных соединений.
Техническим результатом является создание простого и эффективного метода синтеза производных (E)-4-(индол-2-ил)проп-2-ен-1-она, позволяющего стереоселективно получать целевые продукты с высоким выходом, а также варьировать набор заместителей, что в итоге позволяет преодолеть ряд ограничений и недостатков известных методов.
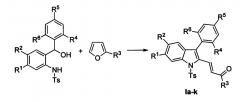
Технический результат достигается в результате кислотно-катализируемого взаимодействия 2-(N-тозиламино)бензиловых спиртов [Р. Kothandaraman, В.Q. Koh, Т.Т. Limpanuparb, H.Hirao, P.W.H. Chan Chem. Eur. J. 2013, 19, 1978-1985] и 2-замещенных фуранов с последующей обработкой реакционной смеси ацетатом палладия, пара-бензохиноном и молекулярным йодом в ледяной уксусной кислоте при нагревании.
Полученный технический результат позволяет получать целевые продукты Ia-к с высокими выходами, в виде исключительно E-изомеров. Метод имеет широкие границы применимости, что выражается в многочисленном наборе субстратов, которые могут быть использованы для синтеза различных замещенных (E)-4-(индол-2-ил)проп-2-ен-1-онов, являющихся потенциально биологически активными соединениями.
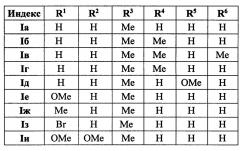
Выходы продуктов реакции и спектральные характеристики производных (E)-4-(индол-2-ил)проп-2-ен-1-она Iб-к приведены в таблице 1.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения (Е)-4-{3-фенил-1-[(4-метил фенил)сульфонил]-1H-индол-2-ил}бут-3-ен-2-она 1а
Пример 1
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют ацетат палладия (2.25 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 93% (77 мг).
Спектр 1Н ЯМР (400 МГц, CDCl3), (δ, м. д. и КССВ, J, Гц): 2.31 (с, 3Н, CH3), 2.34 (с, 3Н, CH3), 6.06 (д, 3J=16.5 Гц, 1H, =СН), 7.17-7.19 (м, 2Н, НAr), 7.22-7.30 (м, 4Н, HAr), 7.37-7.450 (м, 4Н, HAr), 7.60-.61 (м, 2Н, HAr), 8.13 (д, 3J=16.5 Гц, 1H, =СН), 8.28-8.30 (м, 1Н, HAr).
Спектр 13С ЯМР (100 MHz, CDCL3), (δ, м. д.): 22.6, 26.9, 115.5, 120.8, 124.5, 126.7 (3С), 128.3, 128.7, 129.1 (2С), 129.6 (2С), 129.8 (2С), 130.9, 131.5, 132.3,132.5 (2С), 134.8, 137.4, 145.2, 198.2.
Пример 2
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл толуола перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют ацетат палладия (2.25 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 88% (73 мг).
Пример 3
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл 1,4-диоксана перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют ацетат палладия (2.25 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 79% (66 мг).
Пример 4
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл 1,2-дихлорметана перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют ацетат палладия (2.25 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 80% (67 мг).
Пример 5
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют ацетат палладия (4.5 мг, 0.02 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 93% (73 мг).
Пример 6
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1,9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 5% (4 мг).
Пример 7
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1,9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют хлорид палладия (1.8 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 65% (54 мг).
Пример 8
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1,9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют (2.6 мг, 0.01 ммоль) бис(ацетонитрил)дихлорпалладий и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 90% (75 мг).
Пример 9
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют трифлат палладия (3.3 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир : этилацетат (20:1). Выход 89% (74 мг).
Пример 10
Смесь 2-(N-тозиламино)бензгидрола (70.7 мг, 0.2 ммоль), 2-метил-фурана (0.45 мл, 5 ммоль) и гидрата толуолсульфокислоты (1.9 мг, 8 мкмоль) в 3 мл ледяной уксусной кислоты перемешивают на магнитной мешалке при температуре 80°C в течение 4 часов. Затем к полученной смеси добавляют тетракис(трифенилфосфин)палладия (11.5 мг, 0.01 ммоль) и пара-бензохинон (54 мг, 5 ммоль) и перемешивают на магнитной мешалке при температуре 100°C в течение 16 часов. После этого к реакционной смеси добавляют молекулярный йод (2.5 мг, 0.01 ммоль) и перемешивают смесь при той же температуре в течение 2 часов. По окончании реакции растворитель удаляют при пониженном давлении, и выделяют целевой продукт методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - петролейный эфир:этилацетат (20:1). Выход 7% (6 мг).
В таблице 2 приведены данные о влиянии условий проведения реакции на выход (Е)-4-{3-фенил-1-[(4-метилфенил)сульфонил]-1H-индол-2-ил}бут-3-ен-2-она (примеры 1-10).
Как видно из таблицы 2, что результат, а именно, получение (Е)-4-{3-фенил-1-[(4-метилфенил)сульфонил]-1H-индол-2-ил}бут-3-ен-2-она, может быть достигнут при использовании ацетата палладия в качестве катализатора. Оптимальным количеством используемого катализатора является 5 мольных %. Отсутствие катализатора приводит к существенному снижению выхода соответствующего продукта, тогда как увеличение его количества не приводит к заметному увеличению выхода продукта. Другие катализаторы на основе соединений палладия не позволяют получить продукт с более высоким выходом. Оптимальным растворителем для осуществления обсуждаемого химического превращения является уксусная кислота. Использование других растворителей не приводит к образованию продукта с более высоким выходом.
Методом 1 получен ряд производных (E-4-(индол-2-ил)проп-2-ен-1-она 1а-к с выходами 45-93%.
Способ получения производных (E)-4-(индол-2-ил)проп-2-ен-1-она общей формулы I,
характеризующийся тем, что доступные 2-(N-тозиламино)бензиловые спирты конденсируют с 2-замещенными фуранами в результате обработки гидратом толуолсульфокислоты в ледяной уксусной кислоте при нагревании и дальнейшей последовательной обработкой реакционной смеси ацетатом палладия, пара-бензохиноном и молекулярным йодом.