Способ прогнозирования первичной слабости родовой деятельности
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для прогнозирования слабости родовой деятельности. На сроке доношенной беременности определяют показатели крови: общий белок, уровень альфа-глицерофосфатдегидрогеназы в лимфоцитах. Проводят молекулярно-генетический анализ полиморфизма генов: PPARA 2498, PPARGC1A S482G. Выполняют цервикометрию, ультразвуковое исследование фето-плацентарного комплекса с определением длины цервикального канала и плацентации по задней стенке матки. Присваивают балльные оценки показателям. Вычисляют прогностический индекс PI по заявленной формуле. При PI>0 прогнозируют низкий риск развития первичной слабости родовой деятельности, прогноз благоприятный. При PI≤0 - высокий риск развития первичной слабости родовой деятельности, прогноз неблагоприятный. Способ позволяет своевременно провести прогнозирование слабости родовой деятельности за счет оценки комплекса наиболее значимых показателей. 3 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к акушерству, и касается способа прогнозирования первичной слабости родовой деятельности у первородящих женщин.
Несмотря на большое число исследований, вопрос об этиологии, патогенезе и прогнозировании слабости родовой деятельности (СРД) находится в стадии научного поиска [Абрамченко В.В. Концепция энергетического дефицита и нарушение функции митохондрий. Журнал акушерства и женских болезней. 2001. - 4. - 46-52, Algovik М., Nilson E., Cnattingius S., Lichtenstein P. Genetic influence on dystocia. Acta. Obstet. Ginecol. Scand. 2004. - 83. - 9: 832-837, Крицкая И.А. Особенности течения раннего неонатального периода у новорожденных от матерей со слабостью родовой деятельности: автореф. дис. … канд. мед. наук. Москва, 2005, Подтетенев А.Д., Братчикова Т.В., Коктайш Г.А. Регуляция родовой деятельности. М.: РУДН. - 2004. - 53, Сидорова И.С. Физиология и патология родовой деятельности. - М.: МЕДпресс, 2006. - 318 с., Чернуха Е.А. Родовой блок. - М.: Триада-Х. - 1999. - 533 с]. Согласно данным статистики слабость родовой деятельности осложняет 9-12% родов и составляет 60-80% в структуре нарушений сократительной деятельности матки, в 70-80% случаев развивается у первородящих, соматически здоровых женщин. На основании вышесказанного приоритет нашего исследования был отдан первородящим женщинам. Значимость и сложность проблемы аномалий сократительной деятельности матки определяется не только частотой развития, но и влиянием их на тяжесть осложнений со стороны матери, плода, новорожденного [Абрамченко В.В. Концепция энергетического дефицита и нарушение функции митохондрий. Журнал акушерства и женских болезней. 2001. - 4. - 46-52, Algovik М., Nilson E., Cnattingius S., Lichtenstein P. Genetic influence on dystocia. Acta. Obstet. Ginecol. Scand. 2004. - 83. - 9: 832-837, Сидорова И.С. Физиология и патология родовой деятельности. - М.: МЕДпресс, 2006. - 318 с., Чернуха Е.А. Родовой блок. - М.: Триада-Х. - 1999. - 533 с]. Сложность и актуальность проблемы слабости родовой деятельности во многом обусловлена тем, что она находится на стыке ряда акушерских осложнений - гипотонические кровотечения, материнский и детский травматизм, септические послеродовые заболевания, а в целом - материнской и перинатальной заболеваемости и смертности.
Недостаточная изученность патогенетических механизмов формирования слабости родовой деятельности чрезвычайно затрудняет возможность целенаправленного прогнозирования, а, следовательно, и профилактики этого осложнения родов. Одной из современных научных теорий развития патологии сократительной активности матки является концепция энергетического дефицита и нарушение функции митохондрий. В митохондриях утеромиоцитов за несколько дней до родов над β-окислением жирных кислот и анаэробным гликолизом начинает преобладать более эффективный процесс производства АТФ - окислительное фосфорилирование (цикл Кребса). При участии фермента адениннуклеотидтранслоказы АТФ поступает в цитоплазму клетки, где он необходим для активного предродового синтеза сократительного аппарата ГМК. Недостаточность энергообеспечения на клеточном уровне способствует развитию неэффективной родовой деятельности. Выяснение роли генетических факторов в этиологии и патогенезе различных патологических состояний, доказательство генетической уникальности каждого индивида составляют научную основу молекулярной медицины и предопределяют ее предиктивную функцию, в том числе и в акушерстве. В современной литературе мы не встретили результатов исследований, посвященных молекулярно-генетическому анализу полиморфизма генов энергообмена в акушерстве.
Значительное количество диагностических и прогностических тестов, применяемых для прогнозирования особенностей родов (анамнестические, клинические, гистерографические, гормональные и другие) позволяют определить лишь степень риска развития аномалий родовой деятельности. Ранее предложенные способы прогнозирования течения родов не привели к существенному снижению частоты развития слабости родовой деятельности. Поэтому разработка новых методов прогнозирования неэффективной родовой деятельности является своевременной и актуальной. На современном этапе перспективным направлением научных исследований, проводимых с целью поиска прогностических критериев развития патологических состояний в родах, остается определение предикторных индексов развития слабости родовой деятельности. Наиболее востребованными являются биологические маркеры и их сочетания, определение которых возможно с использованием функциональных и малоинвазивных методов исследований.
Известен способ прогнозирования нарушений сократительной деятельности матки и формирования нарушений дистоции шейки матки в родах на основании определения ультразвуковой степени «зрелости» шейки матки накануне родов [Заявка №2008109463/14]. За 1-5 дней до родов проводят ультразвуковое трансвагинальное исследование с использованием трехмерного доплеровского режима. При показателе индекса васкуляризации менее 2% диагностируют «незрелую» шейку матки и прогнозируют нарушения сократительной деятельности матки и формирование дистоции шейки матки в предстоящих родах. Способ позволяет уменьшить степень субъективизма оценки параметров «зрелости» шейки матки, дает возможность многократного динамического исследования «зрелости» шейки матки и обладает высокой прогностической ценностью.
Недостатки известного способа: субъективность оценки результата, высокая вероятность ошибки; отсутствие данных о точности способа; способ не позволяет дифференцировать СРД и дискоординированную родовую деятельность (ДРД), что не позволяет проводить специфическую профилактику СРД.
Известен способ прогнозирования аномалий родовой деятельности (АРД) накануне родов, основанный на результатах ультразвуковой эхографии области тела матки на границе с нижним сегментом. При выявлении гиперэхогенной линии на фоне гипоэхогенного миометрия прогнозируют АРД [Патент №1591956, опубл. 1990 г.].
Недостатки способа: субъективность оценки результата, высокая вероятность ошибки (30%); способ не позволяет дифференцировать СРД и ДРД, что не позволяет проводить специфическую профилактику СРД.
Известен способ прогнозирования родовой деятельности, который состоит в том, что у обследуемой в дородовом периоде исследуют состояние радужной оболочки глаз и при выявлении лакун (дефектов, углублений) в зоне проекции матки прогнозируют нарушение родовой деятельности [Патент №132632, опубл. 1999 г.].
Недостатком данного способа является необходимость наличия специального оборудования и обученного медицинского персонала для проведения иридоскопии, что может быть не в каждом лечебном учреждении.
Прототипом заявляемого способа является способ прогнозирования слабости родовой деятельности, при котором определяют активность гидрооксибутират дегидрогеназы в амниотической жидкости и по ее величине прогнозируют аномальную родовой деятельности [Патент №2134418, опубл. 1999 г.]. К недостаткам этого способа прогнозирования относятся сложность исполнения анализа, его инвазивность, невозможность проведения при «незрелой» шейке матки и недоступность для большинства лабораторий практического здравоохранения.
В нашем изобретении мы используем генетические полиморфизмы как факторы риска слабости родовой деятельности. Анализ патентной литературы показал, что до сих пор не предложен способ прогнозирования слабости родовой деятельности на основе генетических исследований. Однако существуют способы прогнозирования и оценки степени риска развития других осложнений беременности и родов, основанные на исследовании соответствующих генов предрасположенности. Предложен способ прогнозирования риска развития гестоза на основе генетических маркеров, включающий выделение геномной ДНК обследуемой женщины, проведение ПЦР-исследования участков генов MTHFR и РАН путем смешивания компонент и добавления олигопраймеров с последующим анализом полиморфизма длин рестрикционных фрагментов и визуализацией электрофореграммы в полиакриламидном геле, отличающийся тем, что для амплификации с целью исследования участка гена MTHFR используют прямой праймер и обратный праймер с целью исследования участка гена РАН используют прямой праймер и обратный праймер и при выявлении генотипов MTHFR 677Т/Т и/или РАН -675 4G/4G прогнозируют риск развития гестоза [Патент №2431842, опубл. 2012 г.].
Задача изобретения заключается в разработке способа прогнозирования первичной слабости родовой деятельности в сроке доношенной беременности. Способ основан на биохимическом исследовании крови беременных женщин, проведении цервикометрии, ультразвукового исследования фето-плацентарного комплекса, проведении молекулярно-генетического анализа полиморфизма генов энергообмена в сроке доношенной беременности с последующим подсчетом прогностического индекса. В предлагаемом способе прогнозирования слабости родовой деятельности впервые в акушерстве использованы данные молекулярно-генетического анализа полиморфизма генов энергообмена. Технический результат - прогнозирование слабости родовой деятельности на основе генетических исследований
Заявляется способ прогнозирования первичной слабости родовой деятельности путем исследования крови, отличающийся тем, что после центрифугирования венозной крови в сыворотке определяют показатели общего белка; активность клеточного энергообмена определяют цитохимическим методом в лимфоцитах периферической крови по уровню альфа-глицерофосфатдегидрогеназы путем проведения молекулярно-генетического исследования методом пиросеквенирования в лимфоцитах периферической крови определяют показатели полиморфизма генов энергообмена в сроке доношенной беременности; путем проведения функциональных методов исследования цервикометрии определяют длину цервикального канала, ультразвукового исследования фето-плацентарного комплекса - локализацию плаценты с последующим вычислением прогностического индекса PI по формуле
PI = 4,436X1 - 1,063X2 - 2,794Х3 + 1,065X4 + 0,15X5 - 2,081X6 - 5,146,
где PI - прогностический индекс;
X1 - полиморфизм гена PPARA 2498 (генотип СС - 1, генотип GG или генотип GC - 0);
Х2 - длина цервикального канала, см;
Х3 - альфа ГФ, ед/л;
Х4 - наличие/отсутствие плацентации по задней стенке матки (1/0);
Х5 - общий белок, г/л;
Х6 - полиморфизм гена PPARGC1A S482G (генотип АА - 1; генотип GG или генотип GA - 0);
Константа = -5,146,
при PI>0 делают заключение о низком риске развития первичной слабости родовой деятельности, прогноз благоприятный, при PI≤0 делают заключение о высоком риске развития первичной слабости родовой деятельности, прогноз неблагоприятный.
Способ осуществляется следующим способом.
Исследование крови проводят натощак, в утреннее время. Материалом для исследования служит венозная и периферическая кровь, полученная из локтевой вены и пальца пациента стандартизированным способом, в количестве 5 мл.
Кровь для биохимического исследования крови центрифугируют при 3000 об/мин в течение 15 минут, сыворотку отделяют от эритроцитарной массы. Содержание общего белка определяют на любом биохимическом анализаторе. Объем анализируемой пробы зависит от производителя и указывается в методических рекомендациях. Процедуру измерения производят в соответствии с инструкцией к прибору и тест-системе.
Активность альфа-глицерофосфатдегидрогеназы в лимфоцитах периферической крови определяют цитохимическим методом в модификации Р.П. Нарциссова. Подсчет гранул диформазана производят в 100 лимфоцитах.
Ультразвуковое исследование плацентарного комплекса и матки, цервикометрия в нашем случае проведены на аппарате Voluson S6/S8 (GE Ultrasound Korea, Ltd), оснащенного 4 типами датчиков - конвексный, линейный, секторный, непрерывно-волновой допплер, real Time 4D.
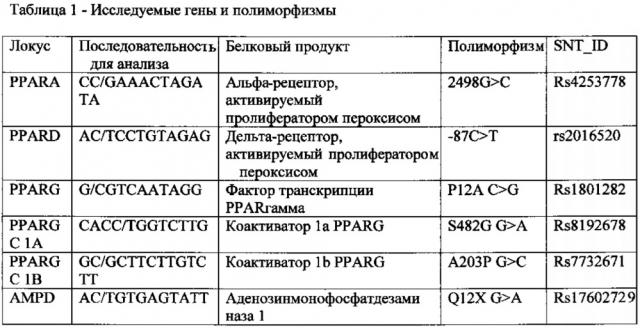
Молекулярно-генетическое исследование проводилось методом пиросеквинирования с применением системы генетического анализа серии PyroMark Q24. ДНК выделяли из лейкоцитов периферической крови, используя комплект реагентов «ДНК-сорб-В» производства ФГУН «Центрального НИИ эпидемиологии Роспотребнадзора». Далее проводились реакция аплификации с помощью комплекта праймеров АмплиСенсПироскрин производства ФГУН «Центрального НИИ эпидемиологии Роспотребнадзора» с последующей инкубацией ампликонов с частицами сефарозы, покрытыми стрептовидином. С использованием полуавтоматической вакуумно-фильтрационной станции (VacuumPrepWorkstation) проводилась щелочная денатурация ампликонов и серия отмывок с образованием одноцепочечного ПЦР-продукта, используемого как матрица для пиросеквинирующего синтеза. Впоследствии проводились реакция пиросеквинирования и анализ полученный результатов. Детекция реакции пиросеквинирующего синтеза проводилась автоматически в режиме реального времени с помощью пиросеквинатора серии QIAGEN PyroMark Q24 (Германия). В работе изучено 6 полиморфных вариантов локусов в генах энергообмена. Исследуемые локусы и полиморфизмы генов представлены в таблице 1.
Характеристика изучаемых генов и их полиморфных вариантов.
Важнейшими регуляторами мышечной силы являются гены транскрипционных факторов семейства PPAR и PPGC1A. Гены семейства PPAR - гены рецепторов активации пролиферации пероксисом - кодируют белки PPARα, PPARγ и PPARδ, которые специфически связываются с промоторами генов жирового и углеводного обменов и регулируют их транскрипцию. Гены, кодирующие эти белки, обозначаемые как PPARA, PPARG и PPARD соответственно, локализованы на разных хромосомах, но в целом имеют сходную молекулярную структуру.
Ген PPARA – альфа-рецептор активатора пероксисом, полиморфизм 2498 G>C, локализован на хромосоме 22 (22q13.31), экспрессируется в тех тканях, где происходит усиленный обмен жиров: мышцы, печень, сердце и бурый жир. В мышцах ген PPARA экспрессируется в 7 раз сильнее, чем в жировой ткани. Основная функция белка PPARα - регуляция обмена липидов, глюкозы и энергетического гомеостаза, а также веса тела посредством регуляции экспрессии генов, вовлеченных в пероксисомное и митохондриальное окисление. Выступая в качестве молекулярного сенсора эндогенных жирных кислот (ЖК) и их производных, рецептор PPARα - лиганд-активируемый фактор транскрипции - регулирует экспрессию генов, кодирующих ферменты и транспортные белки, которые контролируют гомеостаз липидов, что в итоге приводит к стимуляции окисления ЖК и улучшению метаболизма липопротеинов. Рецептор PPARα также обладает плейотропным противовоспалительным и антипролиферативным действием, а также подавляет проатерогенные эффекты накопления холестерина (ХС) в макрофагах путем стимуляции выхода ХС из клетки. Распространенность мутации в европейской популяции - 63%
Ген PPARGC1A - коактиватор 1 альфа-рецептора активатора пероксисом, полиморфизм Gly482Ser (G>A), является коактиватором многих ядерных рецепторов (транскрипционных факторов), таких как PPARα, PPARγ, α- и β-рецепторов эстрогена и минералокортикоидов. PPARGC1 локализуется на 4 хромосоме (4р15.1). Продукт экспрессии гена PPARGC1A играет ключевую роль в метаболизме клеток миокарда. Активация PGC-1A в миоцитах сердца ведет к индукции генов, кодирующих ферменты системы перекисного окисления липидов (Lehmanetal., 2000). Также PGC-1A активирует ряд транскрипционных факторов, таких как NRF-1, которые стимулируют биогенез митохондрий и усиливают экспрессию генов, кодирующих компоненты системы переноса электронов в митохондриях
Ген PPARG локализован в локусе 3р25. В результате альтернативного сплайсинга с этого гена образуется 4 транскрипта, отличающиеся по 5' концам с разным количеством нетранслируемых экзонов: PPARγ1, PPARγ2, PPARγ3 и PPARγ4. Функции этого транскрипционного фактора заключаются в регуляции генов, связанных с аккумуляцией жира (синтез триглицеридов), дифференцировкой адипоцитов и миобластов, чувствительностью к инсулину, активностью остеобластов и остеокластов (регуляция роста) [Генетический паспорт - основа индивидуальной и предиктивной медицины / под ред. B.C. Баранова - Санкт - Петербург: Н-Л, 2009. - 528 с.].
Ген PPARD локализован в локусе 6р21.1-р21.2, активно экспрессируется в жировой ткани и в медленных мышечных волокнах скелетных мышц. Продукт гена - белок PPAR8 - регулирует экспрессию генов, вовлеченных в окисление ЖК и обмен холестерина. Генами-мишенями транскрипционного фактора PPAR6 в мышечной ткани являются гены окислительного метаболизма, гены митохондриального дыхания и термогенеза, гены, определяющие функции медленных мышечных волокон (миоглобина, тропонина I медленного типа), гены транспорта и окисления ЖК в миокарде, в бурой и белой жировых тканях. Лигандами PPARδ выступают насыщенные и полиненасыщенные ЖК, конъюгированная линолевая кислота, синтетические и эндогенные эйкозаноиды.
Ген PPARGC1B - коактиватор 1а рецептора, активируемого пролифераторами пероксисом типа b, полиморфизм Ala203Pro, G>C, локализуется на 5 хромосоме 5q33.1. Ген PGC1B (peroxisomeproliferator-activated receptor gamma coactivator 1 beta) кодирует белок (PGC1-beta), активирующий транскрипционные факторы, вовлеченные в регуляцию жирового и углеводного обменов, а также состава мышечных волокон. PGC-1b экспрессируются в бурой жировой ткани, сердце, скелетных мышцах и почках. Продукт гена PPARGC1B - белок PGC1B коактивирует действие ряда транскрипционных факторов, регулирует митохондриальный биогенез и обмен веществ.
Ген AMPD1 локализован в локусе 1р13.1, контролирует синтез специфической скелетно-мышечной аденозинмонофосфатдезаминазы (АМФ-дезаминаза М-изоформа), которая, повышая эффективность синтеза АТФ, играет ключевую роль в регуляции энергетических процессов в скелетной мускулатуре. Во время интенсивных физических нагрузок содержание АТФ падает и накапливается АМФ. Реакция, катализируемая АМФ-дезаминазой, смещает равновесие миокиназной реакции в сторону образования АТФ за счет АМФ. Таким образом обеспечивается ресинтез АТФ при мышечном утомлении. 95% AMPD-M сконцентрировано в быстрых мышечных волокнах II типа (БВ). Причиной недостатка АМФ-дезаминазы является замена цитозина на тимин в 34 нуклеотиде кодирующей последовательности (С34Т), в результате чего глютаминовый кодон превращается в стоп-кодон. Нехватка АМФД - одна из наиболее распространенных причин метаболической и вызванной физическими нагрузками миопатии у человека [Генетический паспорт - основа индивидуальной и предиктивной медицины / под ред. B.C. Баранова - Санкт - Петербург: Н-Л, 2009. - 528 с.].
Прогностический индекс получен путем математической обработки результатов биохимических и общеклинических исследований методом кластерного и пошагового дискриминантного анализа с помощью пакетов прикладных программ SPSS, Statistica 10 [Иванов Ю.И., Погорелюк О.Н. Статистическая обработка результатов медико-биологических исследований. - М.: Медицина, 1990. - с. 117-141]. Были выделены информативные признаки и сформировано правило прогнозирования развития первичной слабости родовой деятельности у первородящих женщин, которое заключается в определении прогностического индекса (PI), по следующей формуле:
PI = 4,436X1 - 1,063Х2 - 2,794Х3 + 1,065X4 + 0,15Х5 - 2,081Х6 - 5,146,
где PI - прогностический индекс;
X1 - полиморфизм гена PPARA 2498 (генотип СС - 1, генотип GG или генотип GC - 0);
Х2 - длина цервикального канала, см;
Х3 – альфа-глицерофосфатдегидрогеназа, ед/л,
Х4 - наличие/отсутствие плацентации по задней стенке матки (1/0);
Х5 - общий белок, г/л;
Х6 - полиморфизм гена PPARGC1A S482G (генотип АА - 1; генотип GG или генотип GA - 0);
Константа = -5,146.
При PI>0 делают заключение о низком риске развития первичной слабости родовой деятельности, прогноз благоприятный, при PI≤0 делают заключение о высоком риске развития первичной слабости родовой деятельности, прогноз неблагоприятный.
В полученных матрицах клинико-лабораторных показателей проведен пошаговый дискриминантный анализ переменных в группах женщин, роды у которых протекали со слабой и координированной родовой деятельностью с целью выявления наиболее значимых предикторов (таблица 2).
Оценка эффективности предлагаемого способа прогнозирования оценивалась методом экзамена на независимой обучающей и контрольной выборках, сформированных датчиком случайных чисел. В обучающей выборке (174 женщины) правильное распознавание для координированной родовой деятельности составило 77,08% (специфичность способа) и для слабости родовой деятельности - 82,05% (чувствительность способа). Эффективность способа составила 79,3%.
Результаты экзамена приведены в таблице 3.
Предлагаемый способ дает вероятность правильной классификации 83,33% (специфичность метода) для нормы (координированная родовая деятельность), для патологии (роды, осложненные первичной слабостью родовой деятельности) -70,73% (чувствительность метода). Эффективность алгоритма 78,76.
Пример 1. Пациентка М., 26 лет. История № …, первобеременная поступила в отделение дородовой госпитализации в сроке гестации 39-40 недель для родоразрешения. Соматический анамнез спокойный. При проведении цервикометрии диагностирована длина цервикального канала 4,5 см. При ультразвуковом исследовании фето-плацентарного комплекса визуализирована плацентация по задней стенке матки. При исследовании биохимического анализа крови за 3-4 дня до предполагаемого срока родов получены результаты: общий белок 62,7 г/л, альфа-глицерофосфатдегидрогеназа 1,7 ед/л. После проведения молекулярно-генетического анализа полиморфизма генов энергообмена выявлено, что у данной пациентки имеется гомозиготный полиморфизм гена PPARA 2498 (генотип СС) и гомозиготный полиморфизм гена PPARGC1A S482G (генотип АА). При расчете прогностический индекс PI = -1,854. Через 4 дня после проведенного обследования у пациентки развилась спонтанная родовая деятельность, которая осложнилась развитием первичной слабости родовой деятельности, не поддающейся терапевтической коррекции окситоцином, длительным безводным периодом. Родильница была родоразрешена путем операции кесарево сечение.
Пример 2. Пациентка О., 25 лет. История № …, первобеременная поступила в отделение дородовой госпитализации в сроке гестации 39-40 недель для родоразрешения. Соматический анамнез спокойный. При проведении цервикометрии диагностирована длина цервикального канала 2,5 см. При ультразвуковом исследовании фето-плацентарного комплекса визуализирована плацентация по передней стенке матки. При исследовании биохимического анализа крови за 3-4 дня до предполагаемого срока родов получены результаты: общий белок 65,2 г/л, альфа-глицерофосфатдегидрогеназа - 1,9 ед./л. После проведения молекулярно-генетического анализа полиморфизма генов энергообмена выявлено, что у данной пациентки имеется гомозиготный полиморфизм гена PPARA 2498 (генотип СС) и гетерозиготный полиморфизм гена PPARGC1A S482G (генотип GA). При расчете прогностический индекс PI=1,104. Через 3 дня после проведенного обследования у пациентки развилась спонтанная координированная родовая деятельность, произошли вагинальные роды с благополучным исходом для матери и новорожденного.
Таким образом, предлагаемый способ диагностики дает возможность своевременного выявления беременных группы риска, прогнозирования слабости родовой деятельности, снизить перинатальную заболеваемость и смертность, а, следовательно, имеет медико-социальную значимость для первородящих женщин. Методика удобна в исполнении при использовании минимального количества исследуемого материала, обеспечивает быстрое получение необходимой информации, имеется возможность проведения молекулярно-генетического обследования и консультирования при планировании беременности.
Способ прогнозирования первичной слабости родовой деятельности путем исследования крови, отличающийся тем, что на сроке доношенной беременности определяют показатели крови: общий белок (X5, г/л), уровень альфа-глицерофосфатдегидрогеназы в лимфоцитах (X3, ед/л); проводят молекулярно-генетический анализ полиморфизма генов: PPARA 2498 (X1), PPARGC1A S482G (X6); выполняют цервикометрию, ультразвуковое исследование фето-плацентарного комплекса с определением длины цервикального канала (X2, см) и плацентации по задней стенке матки (X4); присваивают балльные оценки показателям: X1 оценивают как «1 балл» при генотипе СС, как «0 баллов» при генотипе GG или GC, X4 оценивают как «1 балл» при наличии плацентации по задней стенке матки, как «0 баллов» при отсутствии, Х6 оценивают как «1 балл» при генотипе АА, как «0 баллов» при генотипе GG или GА, далее вычисляют прогностический индекс PI по формуле
PI = 4,436X1 - 1,063Х2 -2,794Х3 + 1,065X4 + 0,15Х5 - 2,081Х6 - 5,146,
где -5,146 – константа,
и при PI>0 прогнозируют низкий риск развития первичной слабости родовой деятельности, прогноз благоприятный, при PI≤0 - высокий риск развития первичной слабости родовой деятельности, прогноз неблагоприятный.