Антиангиогенное лекарственное средство
Иллюстрации
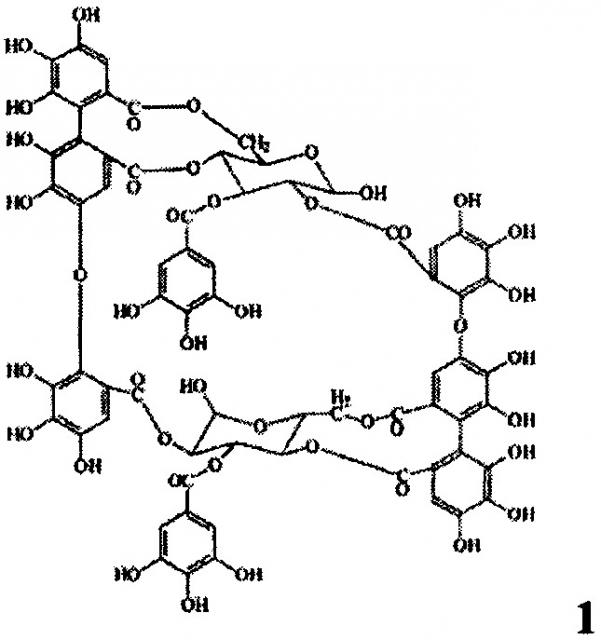
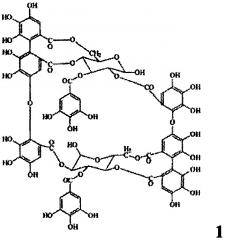
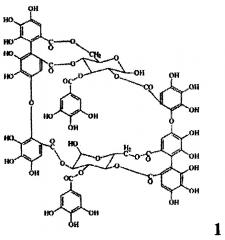
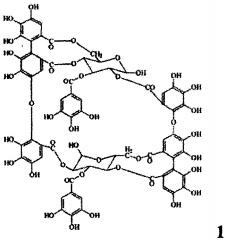
Показать всеИзобретение относится к фармацевтической промышленности, а именно к средству, обладающему антиангиогенным действием. Антиангиогенное лекарственное средство в качестве действующего вещества содержит димерный макроциклический танин, выделенный из побегов и соцветий Chamerion angustifolium, состава C68H48O44, с молекулярной массой 1568,1518 следующей формулы:
Вышеописанное средство обладает выраженной антиангиогенной и противоопухолевой активностью. 6 ил., 1 пр.
Реферат
Изобретение относится к медицине, онкологии и фармацевтической промышленности, а именно к созданию лекарственных средств, обладающих антиангиогенным действием.
Важная роль в развитии и метастазировании опухолей принадлежит ангиогенезу - процессу формирования новых кровеносных сосудов в опухоли. Ключевым моментом для инициации процесса ангиогенеза является повышение концентрации проангиогенных факторов, которые способствуют ускоренному формированию сосудистой сети новообразования. Основным из них является фактор роста эндотелия сосудов - VEGF (Vascular endothelial growth factor). Проангиогенное действие VEGF зависит от экспрессии его рецепторов VEGFR1 и VEGFR2 на эндотелиальных и опухолевых клетках.
Использование антиангиогенной терапии для лечения злокачественных новообразований позволяет снизить рост опухоли. Как правило, антиангиогенные препараты обладают более низкой степенью токсичности, что позволяет комбинировать их с другими противоопухолевыми препаратами для повышения эффективности терапии.
В настоящее время природные соединения являются одними из активно изучаемых классов при разработке новых антиангиогенных и противоопухолевых средств (Соломко Э.Ш., Степанова Е.В., Абрамов М.Е., Барышников А.Ю., Личиницер М.Р. Ингибиторы ангиогенеза растительного происхождения: перспективы использования в клинической онкологии. // Росс. биотерапевтический журнал 2010 Т. 9 С. 3-10.).
Среди соединений растительного происхождения наиболее перспективным источником новых антиангиогенных лекарственных средств являются танины, присутствующие в составе различных лекарственных растений. Ранее было показано, что танины, выделенные из растений, обладают противоопухолевой активностью (Miyamoto K., Murayama Т., Nomura М., et al. Antitumor activity and interleukin-1 induction by tannins. // Anticancer. Res. 1993. V. 13. P. 37-42.; Sakagami Н., Jiang Y., Kusama K., et al. Cytotoxic activity of hydrolyzable tannins against human oral tumor cell lines - a possible mechanism. // Phytomedicine. 2000. V. 7. P. 39-47.).
Известны антиангиогенные средства в виде полифенольных экстрактов из растительного материала, которые обладают способностью ингибировать миграцию эндотелиальных и опухолевых клеток (патент US 2006/0228426 A1, 2006 г.).
Недостатком данных средств является ограниченное антиангиогенное действие, выражающееся только в ингибировании активности матричных металлопротеиназ, что приводит к снижению миграционной активности эндотелиальных и опухолевых клеток.
Известны средства, представляющие экстракты из Rubus suavissimus, содержащие галловую кислоту и ее производные, которые обладают антиангиогенной активностью (патент US 8334000 B2).
Недостатком данных средств является отсутствие противоопухолевого действия.
Наиболее близким к заявляемому средству является антиангиогенное средство в виде фармацевтической композиции на основе высших танинов, имеющих формулу C76H52O46 и молекулярную массу 1690, обладающее способностью ингибировать пролиферацию эндотелиальных клеток и процессы неоваскуляризации в тканях (патент WO 2004/045380 A2).
Недостатком данного средства является отсутствие избирательного действия на рецепторы фактора роста эндотелия сосудов и отсутствие противоопухолевого действия.
Задачей заявляемого изобретения является создание нового лекарственного средства, обладающего антиангиогенным действием без недостатков прототипа.
Технический результат заявляемого изобретения состоит в том, что получено новое лекарственное средство с высокой антиангиогенной и противоопухолевой активностью при более низких концентрациях средства направленного действия в отношении рецептора фактора роста эндотелия сосудов 1-го типа.
Задача решается тем, что заявляемое средство создано на основе димерного гидролизуемого макроциклического танина, выделенного из побегов и соцветий Chamerion angustifolium (Кипрей узколистный, Иван-чай).
Заявляемое средство получают из измельченного растительного сырья - побегов и соцветий Chamerion angustifolium (Кипрея узколистного) путем экстракции водным раствором ацетона, фильтрации и упаривания в вакууме, осаждения полученного экстракта уксуснокислым свинцом, последовательной промывки дистиллированной водой и этиловым спиртом, обессоливания промывных вод при помощи катионита КУ-2-8 чС (H+), упаривания в вакууме, последовательной переэкстракции диэтиловым эфиром, этилацетатом и водой, разделением полученного экстракта методом колоночной хроматографии с полиамидом и лиофильного высушивания и получают лиофилизат димерного макроциклического танина состава C68H48O44, с молекулярной массой 1568,1518 (формула 1).
Подтверждением подлинности полученного заявляемого средства является наличие инфракрасных спектров и показателей удельного вращения.
Заявляемое изобретение иллюстрируется фиг. 1-6 и таблицей.
Заявляемое средство имеет характеристический инфракрасный (ИК) спектр, представленный на фиг. 1. Регистрацию ИК-спектров проводили на ИК-Фурье-спектрометре «Nicolet-iS10» (детектор DTGS, светоделитель KBr) с приставкой Smart OMNI-Transmission, оснащенного ZnSe-кристаллом с разрешением 4 см-1, среднее значение 32 сканов. ИК-спектры лекарственного средства в области от 4000 до 400 см-1 содержат полосы поглощения, связанные с различными колебаниями связей замещенных бензольных циклов [1616, 1508, 1452, 870, 833, 745, 729] см-1, полосы поглощения, связанные с углеводным циклом [1197, 1033, 600] см-1 и указывающие на присутствие в молекуле пиранозного кольца в конформации C1 [910, 765] см-1; в ИК-спектре лекарственного средства имеются полосы, соответствующие валентным и деформационным колебаниям связи O-H [3317, 1318, 1196, 1033] см-1, а также валентным колебаниям карбонильной группы, характерным для альдегидов, карбоновых кислот и сложных эфиров [1729] см-1. Антиангиогенное лекарственное средство является оптически активным веществом. Величина угла оптического вращения для 1%-ного раствора лекарственного средства в воде составляет +306,0°±1,0.
Изучение антиангиогенной активности заявляемого средства в отношении эндотелиальных клеток проводили методом ингибирования пролиферативной активности. Клетки SVEC-4-10 вносили в концентрации 15×103 клеток/мл в 96-луночный планшет в среде DMEM, содержащей 10% эмбриональной сыворотки, 2 мМ глутамина и 10 нг/мл VEGF. Спустя 24 часа вносили заявляемое средство в концентрациях от 1 до 50 мкг/мл. Клетки инкубировали с заявляемым средством в течение 72 часов, затем добавляли реагент МТТ в конечной концентрации 0,5 мг/мл и инкубировали 4 часа, затем среду отбирали, добавляли ДМСО для растворения формазана и проводили оценку реакции на планшетном фотометре при 540 нм. График зависимости «доза-эффект» представлен на фиг. 2.
Для оценки влияния антиангиогенного лекарственного средства на дифференцировку эндотелиальных клеток был использован метод формирования сосудоподобных структур из эндотелиальных клеток SVEC-4-10 на Матригеле. Охлажденный Матригель наносили на 24-луночные планшеты для культивирования клеток в концентрации 250 мкл/лунка и инкубировали в течение 30 мин при 37°C для полимеризации. Клетки SVEC-4-10 в концентрации 2×106/мл были ресуспендированы в полной среде DMEM с 10% ЭТС, содержащей заявляемое средство в концентрации 10 мкг/мл. В качестве контроля использовали DMEM с 10% ЭТС без добавления лекарственного средства. Суспензию клеток наносили на планшеты и инкубировали в течение 5 ч при 37°C. Добавление заявляемого средства в концентрации 10 мкг/мл ингибирует образование сосудоподобных структур из эндотелиальных клеток SVEC-4-10, что выражается в уменьшении длины структур и количества узлов ветвления (фиг. 3 (а, б): а - контрольная группа, б - опытная группа).
Противоопухолевая активность заявляемого средства in vivo изучали на модели перевиваемой аденокарциномы Льюиса, перевитой мышам BDF1 (C57Bl/6×DBA/2), самцам массой 20-25 г подкожно суспензией клеток в количестве 2×106 клеток/мышь в объеме 0,2 мл среды 199. Динамику роста перевитой LLC оценивали путем измерения размеров подкожной опухоли. Заявляемое средство вводили внутрибрюшинно в дозе 15 мг/кг в физиологическом растворе пятикратно. Противоопухолевый эффект оценивали по показателю торможению роста опухоли (ТРО), рассчитанному как соотношение средних объемов опухолей у мышей опытной и у мышей контрольной групп (в %). ТРО вычисляли по формуле (VK-VO)/VK×100, где VK - средний объем опухоли в контрольной группе (мм3); VO - средний объем опухоли в опытной группе (мм3). Объем опухолей у мышей вычисляли по формуле V (мм3)=a×b×c, где a, b, c - длина, ширина и высота опухоли (мм). ТРО перевитой LLC составляет 60,7% на 19-й день наблюдения (фиг. 4). Достоверность полученных результатов определяли по стандартному методу Фишера-Стьюдента. Различия считали достоверными при p<0,05.
Исследования количества микрососудов в опухолях проводили на гистологических срезах при помощи иммуногистохимического окрашивания с антителами к CD31 и VEGF в течение 18 часов при температуре +4°C. Проявку антител проводили при помощи Envision+ kit с последующим внесением раствора диаминобензидина (DAB). Срезы докрашивали гематоксилином и заключали под покровное стекло. Результаты иммуногистохимического окрашивания исследовали под микроскопом с фотокамерой при увеличении ×200. Количество окрашенных антителами CD31 и VEGF структур представлено в табл. и на фиг. 5 (а-г), где а, б - контрольная группа; в, г - опытная группа.
Согласно полученным данным введение мышам заявляемого средства вызывает снижение количества микрососудов экспрессии VEGF в ткани опухоли по сравнению с контрольной группой.
Пример 1.
Антиангиогенное действие заявляемого средства было изучено на мышах линии C57Bl/6 с имплантами Матригеля, содержащими гепарин 60 МЕ./мл и VEGF 50 нг/мл. Аликвоты Матригеля, приготовленные на льду, вводили мышам подкожно в проекции нижнего угла лопатки. Через 24 часа после образования импланта вводили заявляемого средство в дозе 15 мг/кг внутрибрюшинно в течение 5 дней. Через 24 часа после окончания введения заявляемого средства импланты Матригеля были извлечены и исследованы методом иммуногистохимического окрашивания.
При внутрибрюшинном введении заявляемого средства в дозе 15 мг/кг наблюдали выраженный антиангиогенный эффект: количество микрососудов в имплантах с VEGF было снижено на 55,7% (7,4±3,2) по сравнению с контрольной группой - 16,7±3,2 (в поле зрения).
Пример 2.
Изучение ингибирования экспрессии рецептора фактора роста эндотелия сосудов 1-го типа (VEGFR1) под действием заявляемого средства было проведено на культуре эндотелиальных клеток мыши SVEC-4-10. Эндотелиальные клетки, экспрессирующие VEGFR1, культивировали с заявляемым средством в концентрации от 10 до 50 мкг/мл на адгезионных культуральных стеклах в течение 24 часов, затем окрашивали флуоресцентным конъюгатом антител мыши к VEGFR1. Ядра клеток окрашивали красителем Hoechst 33258. Клетки обрабатывали полимерным фиксатором и исследовали под флуоресцентным микроскопом. Результаты исследования представлены на фиг. 6 (а-г), где а - эндотелиальные клетки без заявляемого средства; б, в, г - эндотелиальные клетки с добавлением заявляемого средства в концентрации 10, 25, 50 мкг/мл соответственно.
Показано, что при введении заявляемого средства в концентрации 50 мкг/мл снижается количество VEGFR1-положительных эндотелиальных клеток до 30% по сравнению с клетками без заявляемого средства.
Таким образом, заявляемое средство на основе димерного макроциклического танина, выделенного из побегов и соцветий Chamerion angustifolium, обладает выраженным антиангиогенным и противоопухолевым действием.
Антиангиогенное лекарственное средство на основе танинов, отличающееся тем, что в качестве действующего вещества содержит димерный макроциклический танин, выделенный из побегов и соцветий Chamerion angustifolium, состава C68H48O44, с молекулярной массой 1568,1518 (формула 1).