Наполнитель для капсульного ингалятора
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается капсул с порошковой фармацевтической ингаляционной композицией для лечения аутоиммунных заболеваний. Наполнитель для капсульного ингалятора содержит тимодепрессин в виде тонкодисперсных частиц респирабельных размеров в количестве 8,5–11,5 мас.% и инертный носитель – ингаляционную лактозу - остальное. Использование изобретения обеспечивает расширение арсенала лекарственных средств для ингаляционного введения при лечении аутоиммунных заболеваний, обеспечивающих доставку препарата в кровь в неизмененном виде. 3 ил., 3 пр.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается капсул с порошковой фармацевтической ингаляционной композицией для лечения аутоиммунных заболеваний.
Для достижения своевременного эффективного терапевтического результата при лечении аутоиммунных заболеваний необходимы инновационные способы доставки лекарственного вещества, одним из которых является ингаляционный путь введения лекарственного препарата с использованием специализированных устройств - ингаляторов (Злобин В.Н. и др. «Критерии эффективности и основные характеристики порошковых ингаляторов». Вестник РАМН, 2004 г., т. 1, с. 35-38).
В последнее время возрастает интерес к ингаляторам сухого порошка dry powder inhaler - DPI как средству ингаляционной доставки лекарственных форм. DPI активируются вдохом и не содержат хлорфторуглеродных пропеллентов и, таким образом, не разрушают озоновый слой (Злобин В.Н. и др. «Критерии эффективности и основные характеристики порошковых ингаляторов». Вестник РАМН, 2004 г., т. 1, с. 35-38; Swift D.L. "Apparatus and method of measuring regional distribution of therapeutic aerosols and comparing delivery sistems." J. Aerosol Sci. 1992; 23 (Suppl. 1): S495-S498).
Для достижения желаемого "уровня осаждения" препарата в легких требуется создание аэрозоля с определенными свойствами (с точки зрения аэродинамических характеристик частиц). Лекарственные субстанции для ингаляции должны иметь размер частиц от 1 до 10 мкм для обеспечения оптимальных аэродинамических свойств (Злобин В.Н. и др. «Критерии эффективности и основные характеристики порошковых ингаляторов». Вестник РАМН, 2004 г., т. 1, с. 35-38; Vanderbist F. at al. "Optimization of dry powder inhaler formulation of nacystelin, a new mucoactive agent" J. Pharm. Pharmacol. 1999; 51: 1229-1234).
Малый размер частиц порошка создает очень высокую адгезию между ними, образуя за счет ван-дер-ваальсового взаимодействия агломераты. Для обеспечения дозировки препарата и распределения частиц активной субстанции используются наполнители, которые также являются микронизированными веществами, более крупного размера. Они выполняют роль носителя, так как более мелкие частицы активной субстанции оседают на их поверхности.
При использовании DPI в качестве средства для ингаляционной доставки необходимо предварительно дозировать смесь активной субстанции и носителя, например, в виде капсул или блистеров, или поместить в большем количестве в ингалятор.
В Европейском патенте ЕР 0398631 описан способ получения смеси для ингаляции путем измельчения биологически активного вещества до частиц со средним диаметром 5-10 мкм с последующей обработкой одним из двух способов: смешением с твердыми, общепринятыми в фармацевтической технологии носителями, причем средний диаметр полученных частиц составляет 30-80 мкм или изготовлением шарообразных агломератов из частиц биологически активного вещества (так называемые мягкие пилюли), причем последние при ингаляции снова распадаются на первичные частицы. Способ получения мягких пилюль описан также в патентах Великобритании GB 1569,612 и GB 1,520,247. Однако при получении мягких пилюль необходимо регулировать количество влаги в биологически активном веществе.
В патентах Германии DE 2535258 и GB 1,520,247 описан способ наполнения капсул мягкими пилюлями. В экспериментах in vitro было показано, что при опорожнении таких капсул с помощью ингалятора распыляется по крайней мере 50% биологически активного вещества, содержащегося в капсуле. Однако процент диспергирования, установленный с помощью четырехкаскадного жидкостного импинджера при скорости потока 60 л/мин, невысок, и составляет 13,8-29,5% от номинальной дозы.
В патенте WO 91/11179 А1 описано применение в качестве материала носителя лактозы, полисахаридов и других соединений. Согласно описанию, размер частиц носителя составляет 5-1000 мкм. Получение порошка проводят путем простого смешения биологически активного вещества с материалом носителя. Недостатком этого способа является большой разброс величины диаметра частиц носителя.
В Европейском патенте ЕР 258356 описаны микрочастицы для ингаляции, представляющие собой агломерат из вспомогательных веществ, например лактозы, ксилита и маннита, причем размер агломерата составляет 30-150 мкм. Недостатком этого способа является относительно сложный процесс получения конгломерата вспомогательных веществ с определенным размером частиц.
Другой известный способ (DE 2229981) заключается в смешивании биологически активного вещества с водорастворимым носителем, применяемым при производстве лекарственных средств, причем размер носителя составляет от 80 до 150 мкм. Недостатком способа является плохая текучесть полученных композиций.
В патенте Германии DE 4140689 описан ингаляционный порошок, который состоит из физиологически совместимого вспомогательного вещества со средним размером частиц приблизительно 20 мкм и второго компонента с частицами меньшего размера, около 10 мкм. Этой смесью заполняют капсулы и проводят ингаляцию с помощью устройства, принцип действия которого описан в патенте Германии DE 3345722. Недостатком этого способа также является плохая текучесть полученной композиции.
В патенте WO 2008036003 Al описана фармацевтическая композиция для ингаляции, включающая тонкодисперсное биологически активное вещество в виде частиц респирабельных размеров и грубодисперсный биологически инертный носитель в виде частиц нереспирабельных размеров, отличающаяся тем, что биологически активное вещество включает глутарилгистамин с содержанием до 50%, что может вызывать нежелательные побочные реакции.
В патенте RU 2054932 предложен новый ингаляционный состав для лечения бронхиальной астмы, содержащий лекарственные средства, используемые при бронхиальной астме, а в качестве разбавителя - бензоат натрия. Содержание бензоата натрия в композиции от 20 до 99,8%. Полученные смеси микронизируют на струйной мельнице (размер 95% частиц не более 10 мкм), либо предварительно микронизируют до 5 микрон лекарственную основу, а затем смешивают с бензоатом натрия. Сухие смеси помещают в капсулы и ингалируют через спинхалеры или непосредственно в виде сухого порошка помещают в специальные ингаляторы.
Способ получения сухого порошка для ингаляции описан в патенте RU 2221552 В, который предусматривает смешивание ингредиентов композиции в барабанном смесителе. В этом способе изготовления можно добавлять порошкообразный стеарат магния, имеющий средний размер частиц приблизительно от 1 до 100 мкм, в частности приблизительно от 5 до 20 мкм. Недостатком этого способа является введение дополнительного вспомогательного вещества, что нежелательно при ингаляционном пути введения.
В патенте RU 2071317 описан лекарственный порошкообразный препарат для ингаляций, содержащий активное вещество и наполнитель, отличающийся тем, что в качестве активного вещества содержит будесонид или сальбутамол с размером частиц 2-15 мкм в количестве не менее 90% от массы вещества, а в качестве наполнителя - бензоат натрия или лактозу с размером частиц 50-400 мкм не менее 90% от массы наполнителя, при этом количество активного вещества составляет 0,5-10,0% от общей массы препарата.
В результате изучения процесса ингаляции сухих лекарственных препаратов, при помощи ингалятора типа "Циклохалер", было установлено, что частицы наполнителя размером более 400 мкм из ингаляционного прибора, при вдыхании препарата в большинстве случаев не извлекаются, а остаются в ингаляторе, что в свою очередь затрудняет дозирование и ингаляцию последующих доз лекарственного препарата, частицы препарата от 50-400 мкм оседают в полости рта, при этом респирабельная доза увеличивается.
В патенте RU 2140260 предложен способ смешивания биологически активного вещества или их смеси с носителем, применяемым в производстве лекарственных средств, со средним размером частиц 200-1000 мкм, предпочтительно 300-600 мкм, а размер частиц биологически активного вещества должен составлять 0,01-10 мкм.
Все перечисленные выше аналоги включают разные биологически активные вещества и носители или наполнители с различными размерами частиц. Однако проблема подбора состава ингредиентов, а также оптимизация размера частиц биологически активных веществ и носителей для порошковых фармацевтических ингаляционных композиций, применяемых при лечении аутоиммунных заболеваний, остается актуальной.
Для лечения аутоимунных заболеваний в патенте RU 2401123 представлен способ лечения псориаза у детей препаратом Тимодепрессин ингаляционно в дозах 0,5 мл 0,025% раствора на одну ингаляцию. При этом для внутрибронхиального введения используют аппарат, преобразующий лекарственное вещество в мелкодисперсную, туманообразную форму. Однако это изобретение предполагает использование тимодепрессина в форме раствора с дополнительным использованием аппаратов типа «небулайзера». В то время как инхалеры (ингаляторы сухого порошка) относятся к принципиально другим ингаляторам, удобным в применении благодаря своим малым размерам и портативности в отличие от небулайзеров, используемых в домашних условиях или в лечебных учреждениях.
Технической проблемой, решение которой обеспечивается при использовании изобретения, является расширение арсенала средств для ингаляционного введения при лечении аутоиммунных заболеваний, обеспечивающих доставку препарата в кровь в неизмененном виде.
Технический результат достигается тем, что наполнитель для капсульного ингалятора, содержащий тимодепрессин в виде тонкодисперсных частиц респирабельных размеров и инертный носитель при следующем соотношении ингредиентов:
тимодепрессин - 8,5-11,5%,
лактоза ингаляционная - остальное.
В качестве биологического инертного носителя наполнитель содержит ингаляционную лактозу.
Предложенный наполнитель в капсулах для использования в инхалере содержит тонкодисперсное биологически активное вещество в виде частиц респирабельных размеров от 1 до 5 мкм и микронизированный биологически инертный носитель более крупных размеров от 10 до 150 мкм. Фармацевтическая композиция для ингаляции содержит тимодепрессин, масса которого в композиции составляет от 8,5-11,5%. При этом тимодепрессин измельчают до частиц респирабельных размеров 1-5 мкм: 100% частиц по массе менее 5 мкм, 97% - менее 3 мкм, массовый медианный аэродинамический диаметр частиц составляет 1,0-1,5 мкм. Затем микронизированный порошок тимодепрессина смешивают с биологически инертным носителем - ингаляционной лактозой для ингаляции с частицами размером от 5 до 150 мкм: 100% частиц по массе менее 150 мкм, 90% - менее 200 мкм и не более 10% - менее 90 мкм, массовый медианный диаметр частиц составляет около 150 мкм. Полученной порошковой фармацевтической композицией для ингаляции с различными значениями массового содержания тимодепрессина (8,5, 10, 11,5%) наполняют гипромеллозные капсулы №3 белого цвета на капсулонаполняющей машине, оснащенной модулем для дозирования ингаляционных порошков. Средняя масса содержимого капсулы должна составлять 0,03 г. Лечебное применение капсул осуществляется при помощи порошкового ингалятора (инхалера).
Тимодепрессин ингибирует реакции гуморального и клеточного иммунитета, обратимо снижает общее количество лимфоцитов в периферической крови, вызывает пропорциональное снижение как хелперов, так и супрессоров. Препарат подавляет колониеобразование и вступление стволовых клеток-предшественников кроветворения в S-фазу, уменьшает количество маркеров активации на лимфоцитах, подавляет пролиферацию Т-клеток. Тимодепрессин угнетает спонтанную выработку фактора некроза опухолей, усиливает выработку интерлейкина 7, не влияет на выработку интерлейкина. Тимодепрессин снижает вероятность возникновения острой реакции «Трансплантат против хозяина», и на 90% снижает частоту хронической реакции при введении препарата донору и реципиенту. Препарат также способствует более быстрому и кооперативному выходу клеток-предшественников в пролиферативную фазу и восстановлению лейкопоэза.
Тимодепрессин обладает следующими преимуществами:
- избирательно воздействует на предшественники гемопоэза в костном мозге;
- не имеет побочных эффектов, присущих всем известным иммунодепрессантам;
- обладает высокой стабильностью в организме и длительностью эффекта;
- эффективен в широком интервале терапевтических доз;
- не токсичен в дозах, многократно превышающих терапевтические;
- не накапливается в организме и полностью выводится из организма;
- повышает качество жизни пациентов за счет улучшения их психического состояния.
Тимодепрессин представляет собой синтетический пептидный препарат, применяется у взрослых и детей с двухлетнего возраста, используется как в монотерапии, так и в комплексном лечении и профилактике рецидивов различных аутоиммунных заболеваний.
Химическое название: γ-D-глутамил-D-триптофана натриевая соль
Структурная формула
Эмпирическая формула: C16H18N3NaO7.
Молекулярная масса: 355,32.
По внешнему виду - белый или белый с желтоватым оттенком кристаллический порошок, со специфическим запахом. Легко растворим в воде, очень мало растворим в спирте этиловом 95%, практически не растворим в хлороформе.
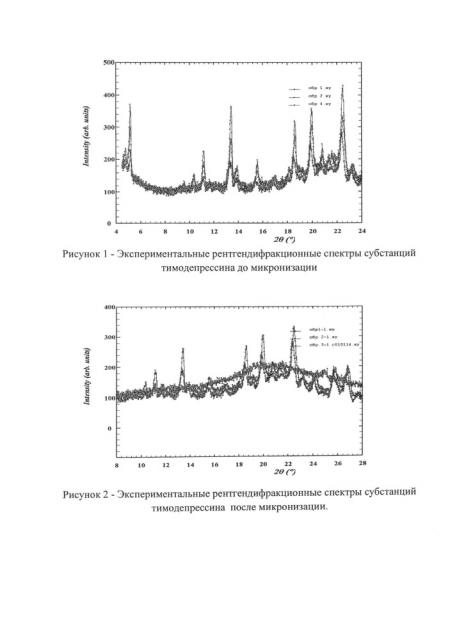
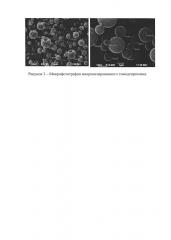
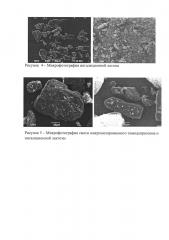
Достижение технического результата проиллюстрировано рисунками: на рис. 1 представлены рентгендифракционные спектры субстанций тимодепрессина до микронизации, а на рис. 2 - после микронизации, на рис. 3 представлены фотографии микронизированного тимодепрессина, на рис. 4 - фотографии ингаляционной лактозы, на рис. 5 - смеси микронизированного тимодепрессина и ингаляционной лактозы.
Пример 1
В предлагаемой фармацевтической композиции для ингаляции, массовое содержание тимодепрессина составляет 8,5%, при этом тимодепрессин измельчают до частиц респирабельных размеров от 1 до 5 мкм (респирабельная фракция). Затем микронизированный порошок тимодепрессина (от 1 до 5 мкм) смешивают с порошком биологически инертного носителя - лактозой ингаляционной, массовое содержание которого составляет 91,5%, с частицами нереспирабельных размеров от 5 до 150 мкм (нереспирабельная фракция). Полученной фармацевтической композицией для ингаляции, наполняют гипромеллозные капсулы №3 белого цвета, которые используют в порошковом ингаляторе инхалере.
Тимодепрессин респирабельных размеров получают при помощи распылительной сушки.
Микронизированный тимодепрессин после распылительной сушки представляет собой устойчивый в течение длительного времени рентгеноаморфный порошок, что было установлено рентгеноструктурным анализом на автоматическом рентгеновском дифрактометре в режиме пошагового сканирования. Интервал углов 2θ от 4.5° до 50°, шаг сканирования Δ2θ=0,02°, время экспозиции в точке - 5-10 с (в зависимости от рассеивающей способности образца). Использовалось CuKα-излучение, λ=1,5418 А, которое в последующем при обработке спектров раскладывалось на Kα1- и Кα2 - составляющие.
Рентгеновский спектр образца субстанции до микронизации на рис. 1 указывает на кристаллическое состояние образца, пики на рис. 2 соответствуют рентгеноморфной фазе вещества, так как наблюдается характерный рентгеноаморфный спектр.
Лактоза ингаляционная - специальный тип лактозы, предназначенный для использования в порошковых ингаляторах. В данном изобретении используется лактоза с размером частиц от 5 до 150 мкм (рис. 4).
Массу для капсулирования получают на универсальной лабораторной установке, в загрузочный бункер которого установки вначале загружают лактозу ингаляционную, затем тимодепрессин. Перемешивают 40 минут при скорости 150 об/мин.
В результате смешивания микронизированной субстанции тимодепрессина и лактозы происходит оседание микрочастиц тимодепрессина на поверхности частиц лактозы.
На рис. 5 видно, что сферические микрочастицы тимодепрессина находятся на поверхности частиц лактозы. В данном случае лактоза выступает носителем для микрочастиц тимодепрессина, обеспечивая необходимую для ингаляции аэродинамику.
Пример 2
В предлагаемой фармацевтической композиции для ингаляции, массовое содержание тимодепрессина составляет 10%, при этом тимодепрессин микронизируют до частиц респирабельных размеров, затем порошок тимодепрессина смешивают с грубодисперсным порошком биологически инертного носителя - лактозой, с массовым содержанием 90%, с частицами нереспирабельных размеров. Полученную фармацевтическую композицию для ингаляции, помещают в контейнер дозирующего порошкового ингалятора.
Пример 3
В предлагаемой фармацевтической композиции для ингаляции, массовое содержание тимодепресина составляет 11,5%, при этом тимодепрессин измельчают до частиц респирабельных размеров, затем микронизированный порошок тимодепрессина смешивают с грубодисперсным порошком биологически инертного носителя - лактозой с массовым содержанием 88,5%, с частицами нереспирабельных размеров. Полученную фармацевтическую композицию для ингаляции помещают в контейнер дозирующего порошкового ингалятора.
Предложенная фармацевтическая композиция для ингаляции, включающая биологически активное вещество тимодепрессин при его массовом содержании от 8.5 до 11,5%, позволяет вводить в легкие пациента терапевтически эффективные количества тимодепрессина при использовании дозирующих порошковых ингаляторов.
Предложена фармацевтическая композиция для ингаляции, в которой массовое содержание тонкодисперстных частиц биологически активного вещества респирабельных размеров в сочетании с частицами инертного носителя, обеспечивают максимальное значение величины респирабельной фракции при ингаляции, с учетом погрешности дозирования, при этом биологически активное вещество содержит отечественный синтетический пептид, который обладает выраженным иммуносупрессорным действием - тимодепрессин.
Предложенная фармацевтическая композиция для ингаляции обладает выраженной фармакологической активностью, подтвержденной исследованиями на спленоцитах и перитонеальных макрофагах экспериментальных животных. Влияние тестируемого препарата (порошок для ингаляции) при эндотрахеальном введении на неспецифический иммунный ответ оценивалось по поглощению перитонеальными макрофагами частиц латекса, конъюгированных с флуоресцеин-5-изотиоцианатом; оценивалось влияния препарата на пролиферативную активность Т- и В-лимфоцитов селезенки крысы. Экспериментальную патологию моделировали путем внутрибрюшинного введения провоспалительного агента 3% тиогликолевой среды. Тестируемый препарат в условиях многократного введения (7 дней) в дозах 0,24 и 0,72 мг/кг вызывал статистически значимое по сравнению с контролем снижение пролиферативной активности Т-лимфоцитов, выделенных из селезенки (0,557±0,040 против 0,746±0,039). Результаты изучения поглощения перитонеальными макрофагами частиц латекса, конъюгированных с флуоресцеин-5-изотиоцианатом, показали статистически значимое снижение индекса фагоцитарной активности перитонеальных макрофагов крыс после введения тестируемого препарата в дозах 0,24 и 0,72 мг/кг по сравнению с контрольными животными (2,5±0,10 против 3,6±0,28). В результате проведенного экспериментального исследования фармакологической активности лекарственного средства (порошок для ингаляции) на спленоцитах и перитонеальных макрофагах показано, что препарат в условиях многократного введения оказывает статистически значимое влияние на фагоцитарную активность перитонеальных макрофагов и пролиферативную активность Т-лимфоцитов, выделенных из селезенки, отличающиеся выраженной дозозависимостью, и может применяться для лечения аутоиммунных заболеваний. Таким образом, достигнут желаемый технический результат.
Наполнитель для капсульного ингалятора, содержащий тимодепрессин в виде тонкодисперсных частиц респирабельных размеров и инертный носитель при следующем соотношении ингредиентов, мас.%:
| Тимодепрессин | 8,5-11,5 |
| Лактоза ингаляционная | остальное |