Способ детекции аддуктов нуклеосом
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к лабораторной диагностике онкологических заболеваний. Предложено применение аддукта нуклеосома-белок в качестве биомаркера в образце крови, сыворотки или плазмы для диагностики рака, где белок, связанный с нуклеосомой, содержит фактор транскрипции или модифицирующий хроматин фермент. Также предложены возможность детекции или диагностирования рака у индивидуума, оценка индивидуума в отношении применимости медицинского лечения и мониторинг лечения индивидуума. Группа изобретений обеспечивает возможность диагностирования онкологических заболеваний, таких как: рак толстого кишечника, рак легких, рак поджелудочной железы, рак молочной железы, рак предстательной железы, за счет измерения уровня циркулирующих внеклеточных аддуктов нуклеосома-HMGB-1 и нуклеосома-EZH2 в биологическом образце крови, сыворотки или плазмы, полученном от индивидуума. 5 н. и 15 з.п. ф-лы, 11 ил., 12 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу детекции и измерению содержания аддуктов нуклеосома-белок и применению таких измерений для детекции и диагностики заболевания. Изобретение также относится к способу идентификации биомаркеров аддуктов нуклеосом для детекции и диагностики заболевания и к биомаркерам, идентифицируемым указанным способом.
Уровень техники, предшествующий изобретению
В организме человека содержится несколько сот типов клеток. Все эти типы клеток имеют одинаковый геном, но очень различные фенотипы и различные функции в организме. Такое фенотипическое разнообразие обусловлено дифференциальной экспрессией генома в различных типах клеток. Контроль дифференциальной экспрессии генов полностью не ясен, но основные механизмы включают регуляцию генов многими взаимосвязанными эпигенетическими сигналами, ассоциированными геном, включая регуляцию упаковки хроматина в виде эухроматина или гетерохроматина, регуляцию локализации хромосом и доступные для нуклеаз участки, метилирование ДНК и вариации структуры нуклеосом, вокруг которых обернута ДНК.
Нуклеосома представляет собой основную единицу структуры хроматина и состоит из белкового комплекса из восьми высококонсервативных коровых гистонов (содержащих пару каждого из гистонов H2A, H2B, H3 и H4). Вокруг этих комплексов обернуто приблизительно 146 пар оснований ДНК. Другой гистон H1 или H5 действует как линкер и участвует в уплотнении хроматина. ДНК оборачивается вокруг последовательных нуклеосом в структуре, для которой, как правило, говорят, что она похожа на «бусинки на нити», и это образует основную структуру открытого хроматина или эухроматина. В конденсированном хроматине или гетерохроматине эта нить спирально скручена и очень плотно спирально скручена в закрытую и сложную структуру (Herranz and Esteller, 2007).
Нормальная скорость обновления клеток у взрослых людей включает ежесуточное образование путем клеточного деления приблизительно 1011 клеток и гибель аналогичного числа, в основном путем апоптоза. Во время такого процесса апоптоза хроматин разрушается до мононуклеосом и олигонуклеосом, которые выделяются клетками. В нормальных условиях они удаляются, и уровень циркулирующих нуклеосом, выявляемый у здоровых индивидуумов, является низким. Повышенные уровни выявляют у индивидуумов с рядом патологических состояний, включая многие злокачественные опухоли, аутоиммунные заболевания, воспалительные состояния, инсульт и инфаркт миокарда (Holdenrieder & Stieber, 2009).
Мононуклеосомы и олигонуклеосомы можно детектировать твердофазным иммуноферментным анализом (ELISA), и опубликовано несколько способов (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003). В таких анализах, как правило, применяют антитело против гистона (например, против H2B, против H3 или против H1, H2A, H2B, H3 и H4) в качестве иммобилизованного антитела и антитело против ДНК или комплекса H2A-H2B-ДНК в качестве идентифицирующего антитела. Однако авторы обнаружили, что результаты таких анализов не согласуются друг с другом. Кроме того, хотя опубликовано, что большая часть циркулирующей ДНК в сыворотке или плазме существует в виде мононуклеосом и олигонуклеосом (Holdenrieder et al., 2001), измеряемые уровни нуклеосомы и ДНК в сыворотке или плазме согласуются плохо. Опубликовано, что коэффициент корреляции между результатами ELISA для клеточных уровней циркулирующих свободных нуклеосом и уровней циркулирующей ДНК, как определено ПЦР (полимеразной цепной реакцией) в реальном времени составляет r=0,531 в сыворотке и r=0,350 в плазме (Holdenrieder et al., 2005).
Способы определения нуклеосом ELISA используют на культурах клеток, преимущественно в качестве способа детекции апоптоза (Salgame et al., 1997; Holdenrieder et al., 2001; van Nieuwenhuijze et al., 2003), а также используют для измерения циркулирующих в клетках свободных нуклеосом в сыворотке и плазме (Holdenrieder et al., 2001). Уровни свободных нуклеосом в клетках сыворотки и плазмы, выделяемых в циркуляцию в результате деления клеток измеряли способами ELISA в исследованиях ряда различных злокачественных опухолей для оценки их использования в качестве потенциального биомаркера (Holdenrieder et al., 2001). Опубликовано, что средние уровни циркулирующих нуклеосом являлись повышенными в большинстве, но не во всех исследованиях злокачественных опухолей. Наиболее высокие уровни циркулирующих нуклеосом наблюдали у индивидуумов с раком легких. Самые низкие уровни наблюдали при раке предстательной железы, которые находились в нормальном диапазоне как у здоровых индивидуумов. Кроме того, было опубликовано, что у индивидуумов со злокачественными опухолями концентрации нуклеосом в сыворотке значительно варьируют, и было выявлено, что у некоторых индивидуумов с опухолевым заболеванием на поздней стадии уровни циркулирующих нуклеосом являются низкими в диапазоне, измеряемом у здоровых индивидуумов (Holdenrieder et al, 2001). Вследствие этого и ряда не относящихся к ракам причин повышения уровней нуклеосом уровни циркулирующих нуклеосом не используют в клинике в качестве биомаркера рака (Holdenrieder and Stieber, 2009).
Структура нуклеосом может изменяться в результате посттранскрипционной модификации (PTM) гистоновых белков и в результате включения вариантов гистоновых белков. PTM гистоновых белков, как правило, возникают на хвосте восьми коровых гистонов, и общераспространенные модификации включают ацетилирование, метилирование или убиквитинилирование остатков лизина, а также метилирование остатков аргинина и фосфорилирование остатков серина. Известно, что модификации гистонов вовлечены в эпигенетическую регуляцию экспрессии генов (Herranz and Esteller, 2007). Структура нуклеосомы также может изменяться путем включения альтернативным изоформ или вариантов гистонов, которые представляют собой различные продукты генов или продукты сплайсинга и содержат различные аминокислотные последовательности. Варианты гистонов можно классифицировать в ряд семейств, которые подразделяются на отдельные типы. Нуклеотидные последовательности большого числа вариантов гистонов известны и общедоступны, например, в базе данных гистонов NHGRI National Human Genome Research Institute (Marino-Ramfrez, L., Levine, K.M., Morales, М., Zhang, S., Moreland, R.T., Baxevanis, A.D., and Landsman, D. The Histone Database: an integrated resource for histones and histone fold-containing proteins. Database Vol. 2011. (подданный) и http://genome.nhgri.nih.gov/histones/complete.shtml), базе данных GenBank (генетическая последовательность NIH), базе данных нуклеотидных последовательностей EMBL и банке данных ДНК Японии (DDBJ).
Продемонстрировано, что вариант гистона и профили модификации гистонов, представленных в здоровых и пораженных клетках, различаются во многих (в основном иммуногистохимических) исследованиях (Herranz and Esteller, 2007). Один из недостатков иммуногистохимических способов для клинического применения заключается в том, что сбор образцов ткани является инвазивным, включая хирургическую операцию или биопсию.
В дополнение к эпигенетическому пути передачи сигналов, опосредованному структурой и локализацией нуклеосом, регуляция экспрессии генов в клетках также опосредована статусом метилирования ДНК (Herranz and Esteller, 2007). На протяжении некоторого времени в данной области известно, что ДНК может быть метилированной в 5 положении нуклеотидов цитозина с образованием 5-метилцитозина.
Еще в 1983 г. была опубликовано вовлеченность метилирования ДНК в развитие рака (Feinberg and Vogelstein, 1983). Паттерны метилирования ДНК, наблюдаемые в злокачественных клетках, отличаются от паттернов здоровых клеток. Опубликовано, что повторяющиеся элементы, в частности вкруг перицентромерных областей, при злокачественной опухоли являются гипометилированными по сравнению со здоровыми клетками, но также опубликовано, что промоторы конкретных генов являются гиперметилированными при злокачественной опухоли. Опубликовано, что равновесие этих двух эффектов приводит к общему снижению уровня метилирования ДНК в злокачественных клетках (Rodriguez-Paredes & Esteller, 2011).
Гиперметилирование определенных конкретных генов можно использовать в качестве диагностического биомаркера для злокачественных опухолей. Например, было опубликовано, что способом, описанным для детекции гиперметилирования гена Septin 9 ПЦР-амплификацией ДНК, выделяемой из плазмы, детектируют 72% случаев рака толстого кишечника с относительным числом ложно позитивных заключений 10% (Grutzmann et al, 2008). Статус метилирования ДНК конкретных генов или локусов, как правило, детектируют избирательным дезаминированием цитозина бисульфитом, но не 5-метилцитозина, до урацила, приводящим к изменению первичной последовательности ДНК, которое можно детектировать посредством секвенирования или другими способами (Allen et al., 2004).
Общее гипометилирование ДНК является признаком злокачественных клеток (Esteller, 2007 и Hervouet et al., 2010). Общее метилирование ДНК можно исследовать в клетках способами иммуногистохимии. Альтернативно, ДНК выделяют из клетки для анализа.
Многие годы известно, что наряду с нуклеиновой кислотой и гистоновыми белками хроматин содержит большое число негистоновых белков, связанных с составляющими его ДНК и/или гистонами (Yoshida and Shimura, 1972). Эти ассоциированные с хроматином белки относятся к широкому спектру типов и имеют различные функции, включая факторы транскрипции, факторы усиления транскрипции, факторы подавления транскрипция, ферменты модификации гистонов, белки репарации повреждений ДНК и многие другие. Исследование связанных с хроматином белков проводили преимущественно способами иммунопреципитации хроматина (ChIP). Эти способы хорошо известны в данной области, но являются сложными, трудновыполнимыми и дорогостоящими.
В характерном способе ChIP клеточный хроматин сшивают таким образом, что все компоненты белков и нуклеиновых кислот являются ковалентно связанными друг с другом. Затем хроматин расщепляют для получения препарата мононуклеосом и олигонуклеосом. К расщепленному хроматину добавляют антитело к представляющему интерес белку для иммунопреципитации таких фрагментов хроматина, содержащих белок. Антитело обычно присоединяют к твердой фазе (пример, пластиковым гранулам) для облегчения выделения комплекса хроматина, содержащего представляющий интерес белок. Затем обращают поперечные связи и удаляют белок расщеплением протеиназой. Выделяют связанный с ДНК комплекс хроматина и анализируют для определения последовательности ДНК, гена или локуса, ассоциированного со связыванием конкретного белка любым из ряда способов, включая ПЦР с последующим электрофорезом в геле, секвенированием ДНК (ChlP-Seq) или с использованием микропанелей ДНК (ChlP-на микропанеле).
Этими способами ChIP выявляют последовательности ДНК, ассоциированные с хроматином, связанным с гистоновыми белками. Для облегчения исследований ассоциации негистоновых белков с гистонами и нуклеосомами разработаны модифицированные варианты способа ChIP, включая, например, анализы ассоциаций гистонов (Ricke and Bielinsky, 2005). Многие белки, которые связываются с хроматином, вовлечены в механизмы развития злокачественной опухоли и другого заболевания, тем не менее, ранее не исследовали их относительное содержание в форме аддукта нуклеосом в кровотоке. Примеры включают белок Box 1 группы с высокой подвижностью (HMGB1), белок семейства polycomb Enhancer of Zeste Homolog 2 (EZH2) и белки группы ядерных рецепторов.
Белки группы с высокой подвижностью представляют собой компонент хроматина, составляющий приблизительно 3% от массы ДНК или гистонов. Они представляют собой структурные белки, которые связываются с нуклеосомами без какой-либо известной специфичности к лежащей в основе последовательности ДНК (Gerlitz et al., 2009). HMGB1 представляет собой архитектурный хромосомный белок и провоспалительный медиатор. Он участвует в гибели клеток, апоптозе и в различных заболеваниях, включая различные воспалительные и аутоиммунные патологические состояния, сепсис, менингит и нейродегенерацию. Сверхэкспрессия HMGB1 ассоциирована со всеми основными признаками злокачественной опухоли (Tang et al., 2010). HMGB1 плотно прикрепляется к хроматину апоптотических клеток. Исследования комплексов нуклеосома-HMGB1 выявили, что эти аддукты находят в кровотоке у индивидуумов, страдающих аутоиммунным заболеванием системной красной волчанкой (SLE), и что аддукты участвуют в индукции антиядерных антител, которые являются ключевым признаком SLE. Нуклеосомы, не связанные с HMGB1, не индуцируют иммунный ответ. Связывание HMGB1 с нуклеосомами в таких аддуктах было продемонстрировано иммунопреципитацией нуклеосом антителом, направленным к ДНК или гистонам, с последующим вестерн-блоттингом с использованием антитела против HMGB1 для демонстрации наличия HMGB1 в иммунопреципитированных нуклеосомамх (Urbonaviciute et al., 2008).
Белки HMGB взаимодействуют со многими другими белками, для которых известно, что они влияют на функцию хроматина, и было продемонстрировано, что возникают комплексы хроматина, содержащие белки HMGB плюс дополнительные белки (Gerlitz et al., 2009). Таким образом, в дополнение к простым аддуктам нуклеосома-белок в хроматине появляются аддукты нуклеосома-белок-комплекс, в которых 2 или многие белки ассоциированы с нуклеосомами.
EZH2 является представителем семейство группы Polycomb (PcG), которые образуют мультимерные белковые комплексы, участвующие в поддержании транскрипционно-репрессивного состояния генов. EZH2 представляет собой фермент модификации гистонов (N-метилтрансферазу лизинов гистонов), который метилирует лизин 27 аминокислотного остатка 3 гистона нуклеосом. Такая модификация гистона ассоциирована с конденсацией хроматина и подавлением экспрессии генов (Cao et al., 2002).
Ядерные рецепторы представляют собой молекулы, которые регулируют экспрессию гена под контролем гормонов или лигандов, например, эстрогеновый рецептор (ER) регулирует экспрессию эстроген-зависимых генов. Многие из этих белков вовлечены в патологические процессы, например, ER участвует в прогрессировании рака молочной железы, и терапия многих типов рака молочной железы направлена на ER и/или предназначена предотвращать взаимодействие ER с его лигандом эстрадиолом.
Наряду с аддуктами нуклеосома-белок, которые появляются в клетке, существуют другие аддукты нуклеосома-белок, которые могут образовываться после высвобождения нуклеосом из клетки после гибели клеток. Такие аддукты нуклеосом включают аддукты нуклеосома-иммуноглобулин, которые являются ключевым признаком SLE.
Ниже авторы описывают простые способы иммунологического анализа для прямой оценки аддуктов белок-нуклеосома в биологических образцах. Авторы разработали простые способы детекции связанных с нуклеосомой EZH2, HMGB1 и нескольких ядерных рецепторов и продемонстрировали, что такие аддукты нуклеосом можно детектировать в образцах сыворотки, и что их можно использовать в качестве биомаркеров при заболевании.
Сущность изобретения
В первом аспекте изобретение относится к применению аддукта нуклеосома-белок в качестве биомаркера в крови для диагностики рака, аутоиммунного заболевания или воспалительного заболевания.
Во втором аспекте изобретение относится к способу детекции наличия аддукта нуклеосома-белок в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведение нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(iii) детекции или количественного определения связывания указанного второго связывающего средства со связанным белком в образце и
(iv) использования наличия или степени такого связывания, как показателя наличия аддуктов нуклеосом в образце.
В третьем аспекте изобретение относится к способу детекции наличия аддуктов нуклеосом в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(ii) приведения нуклеосомы или образца в контакт со вторым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детекции или количественного определения связывания указанного второго связывающего средства с нуклеосомами или их компонентом в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
В дополнительном аспекте изобретение относится к способу детекции аддукта нуклеосомы в клетке, который включает этапы:
(i) выделения хроматина из клетки;
(ii) расщепления, обработки ультразвуком или иным образом разрушения хроматина с образованием мононуклеосом и/или олигонуклеосом и
(iii) детекции или измерения присутствия аддукта нуклеосомы способом ELISA по изобретению, описанным в указанных выше втором или третьем аспектах.
В дополнительном аспекте изобретение относится к способу детекции или диагностики статуса заболевания у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума и
(ii) применения обнаруженного уровня аддукта нуклеосом для идентификации статуса заболевания индивидуума.
В дополнительном аспекте изобретение относится к способу оценки индивидуума, являющегося животным или человеком, в отношении целесообразности медицинского лечения, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкостях организма индивидуума и
(ii) применения обнаруженного уровня аддукта нуклеосом в качестве параметра для выбора подходящего лечения для индивидуума.
В дополнительном аспекте изобретение относится к способу мониторинга лечения индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума;
(ii) повторения детекции или измерения аддукта нуклеосом в жидкостях организма индивидуума в одном или более случаях;
(iii) применение любых изменений обнаруженного уровня аддукта нуклеосом в качестве параметра любого изменения состояния индивидуума.
В дополнительном аспекте изобретение относится к способу идентификации биомаркера аддукта нуклеосом для детекции или диагностики статуса заболевание у индивидуума, являющегося животным или человеком, который включает этапы:
(i) детекции или измерения аддукта нуклеосом в жидкости организма индивидуума;
(ii) детекции или измерения аддукта нуклеосом в жидкости организма здорового индивидуума или контрольного индивидуума и
(iii) применения разницы обнаруженных уровней у больных и контрольных индивидуумов для идентификации, является ли аддукт нуклеосом пригодным в качестве биомаркера статуса заболевания.
В дополнительном аспекте изобретение относится к биомаркеру, идентифицируемому способами, определяемыми в настоящем описании.
В дополнительном аспекте изобретение относится к набору для детекции аддукта нуклеосом, который содержит лиганд или связывающее средство, специфичное к аддукту нуклеосом или части его компонента, или средству, имитирующему структуру/форму основания ДНК, нуклеотиду или нуклеозиду или части его компонента совместно с инструкциями по использованию набора.
Краткое описание чертежей
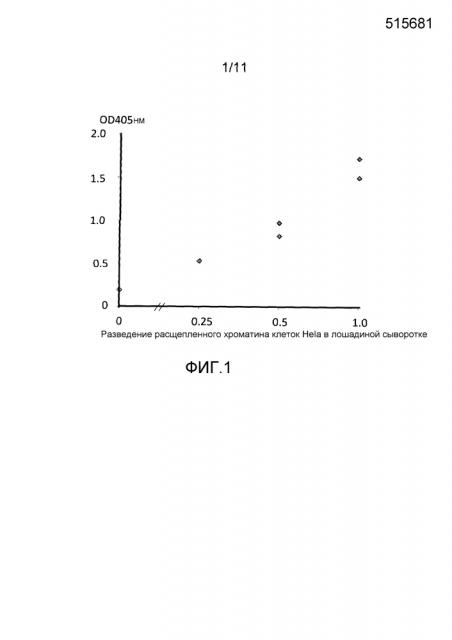
Фигура 1: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-EZH2 в расщепленном хроматине, выделяемом из клеток Hela, разбавленных лошадиной сывороткой.
Фигура 2: результаты ELISA аддукта нуклеосома-EZH2 для образцов сыворотки, полученных у 5 здоровых индивидуумов и 11 индивидуумов с опухолями.
Фигура 3: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-HMGB1 в расщепленном хроматине, выделяемом из клеток Hela, разбавленных лошадиной сывороткой.
Фигура 4: результаты ELISA аддукта нуклеосома-HMGB1 для образцов сыворотки, получаемых у 5 здоровых индивидуумов и 11 индивидуумов с опухолями.
Фигура 5: результаты ELISA аддукта нуклеосома-HMGB1 для образцов сыворотки, получаемых у 31 здорового индивидуума и 74 индивидуумов с (A) раком толстого кишечника, (B) раком молочной железы или (C) раком легких.
Фигура 6: кривая доза-ответ ELISA для детекции уровней аддукта нуклеосома-прогестероновый рецептор во внеклеточных нуклеосомах, получаемых способом *Holdenrieder et al., 2001.
Фигура 7: результаты ELISA детекции уровней аддукта нуклеосома-андрогеный рецептор в 2 случаях рака предстательной железы и образце внеклеточных нуклеосом, получаемом способом *Holdenrieder et al., 2001.
Фигура 8: кривая доза-ответ ELISA детекции уровней аддукта нуклеосома-эстрогеновый рецептор альфа (ERα) во внеклеточных нуклеосомах, получаемых способом *Holdenrieder et al., 2001.
Фигура 9: результаты ELISA детекции уровней аддукта нуклеосома-ERβ в расщепленном хроматине MCF7. Анализ проводили в двух различных форматах. В первом формате антителом против нуклеосомы покрывали лунки, и антитело против ERβ подвергали биотинилированию. Во втором формате антителом против ERβ покрывали лунки, и антитело против нуклеосомы подвергали биотинилированию.
Фигура 10: результаты ELISA аддукта нуклеосома H2AZ-ERβ.
Фигура 11: результаты ELISA аддукта нуклеосома-ERβ для образцов сыворотки, получаемых у 12 здоровых индивидуумов и 16 индивидуумов с опухолями.
Подробное описание изобретения
В первом аспекте изобретение относится к использованию аддукта нуклеосома-белок в качестве биомаркера в крови для диагностики рака, аутоиммунного заболевания или воспалительного заболевания. В одном из вариантов осуществления биомаркер используют для диагностики рака. Авторы продемонстрировали, что два таких аддукта, содержащие HMGB1 и EZH2, присутствуют в кровотоке индивидуумов со злокачественной опухолью, но не детектируются в кровотоке здоровых индивидуумов.
В данной области хорошо известно, что злокачественные опухоли могут являться гормонально зависимыми, и для роста им необходимо наличие гормона. Также хорошо известно, что ядерные гормоны функционируют посредством ядерной локализации рецептора, связанного с гормональным комплексом, и связывания с конкретными элементами гормонального ответа в геноме. Экспрессия генов, ассоциированных с элементами, регулируется связыванием рецептора, связанного с гормональным комплексом, с геномными элементами ответа. В одном из вариантов осуществления изобретение относится к биомаркерам аддукта гормональный рецептор-нуклеосома и аддукта комплекса гормон-гормональный рецептор-нуклеосома для характеристики статуса опухоли индивидуума. Такие аддукты могут представлять собой циркулирующие аддукты, содержащиеся в крови или другой жидкости организма, или их можно получать расщеплением хроматина из образца ткани опухоли.
В данной области хорошо известно, что ядерные гормональные рецепторы регулируют экспрессию гена под контролем гормонов или лигандов. Например, эстрогеновый рецептор функционирует посредством связывания со своим субстратом (стероидным гормоном эстрогеном) на поверхности клеточной мембраны. Связывание сопровождается интернализацией комплекса гормон-рецептор и внутриклеточной локализацией, в случае, когда рецептор связывается с конкретными элементами гормонального ответа в геноме. Конкретная последовательность гена, с которой связывается эстрогеновый рецептор, известна как эстрогеновый ответный элемент (ERE). Экспрессия генов, ассоциированных с ERE, может регулироваться рецептором, и, таким образом, присутствием или уровнем эстрогена в кровотоке индивидуума. Также в данной области хорошо известно, что рост злокачественной опухоли молочной железы, как правило, находится под контролем эстрогена, и такую злокачественную опухоль, как правило, называют эстроген-зависимой. Вследствие того, что такие опухоли сверхэкспрессируют эстрогеновый рецептор (ER), их часто называют ER+ опухолями. Рост эстроген-зависимых опухолей можно замедлять или предотвращать посредством терапевтических вмешательств, направленных на предотвращение связывания эстрогена с эстрогеновым рецептором, и это представляет собой общепринятый способ лечения рака молочной железы. Примеры таких видов лечения включают лекарственное средство тамоксифен, которое действует как антагонист эстрогена при эстроген-зависимом раке молочной железы, и ингибиторы ароматазы, которые замедляют или предотвращают продукцию эстрогена. Однако со временем злокачественные опухоли развиваются в эстроген-независимые опухоли, которые растут даже при отсутствии стимуляции эстрогеном и требуют других видов лечения. В настоящее время диагностику эстроген-зависимых и эстроген-независимых опухолей общепринято проводят иммуноокрашиванием ткани биопсии опухоли для определения относительного содержания или иным образом эстрогенового рецептора в опухолевых клетках. Клиницистам, возможно, потребуется неоднократное повторное тестирование эстрогеновой зависимости опухоли в течение курса лечения опухоли для определения, является ли подходящим эстроген-зависимое лечение или уже не является таковым, или следует ли изменять схему лечения индивидуума для отражения изменяющегося характера опухоли по мере прогрессирования заболевания. К сожалению, существующие в настоящее время тесты не являются оптимальными и требуют проведения повторной болезненной биопсии при каждом случае проведения теста. В одном из вариантов осуществления изобретения для облечения выбора подходящего лечения и для предиктивной прогностической информации используют детекцию аддуктов эстрогеновый рецептор-нуклеосама в кровотоке у пациентов с раком молочной железы в качестве показателя связывания эстрогенового рецептора с ERE в ядре опухолевых клеток в качестве показателя эстрогеновой зависимости опухоли. Такой способ обладает преимуществами, которые заключаются в том, что он является показателем связывания ERE-эстрогенового рецептора в опухоли, а не простым показателем наличия или отсутствия эстрогенового рецептора, и его можно повторять с желаемой частотой посредством простого тестирования крови без необходимости биопсии. Авторы разработали простые способы ELISA детекции и количественного определения аддуктов нуклеосома-ER, содержащих ERα и ERβ формы рецептора. Неожиданно, такие аддукты содержатся в кровотоке пациентов со злокачественными опухолями.
Специалистам в данной области будет понятно, что аналогичный принцип можно применять для детекции аддуктов эстрогеновый рецептор-нуклеосома в гидролизатах хроматина клеток, получаемых из самой ткани опухоли. Такой способ оценки эстрогеновой зависимости опухоли превосходит существующие способы, т.к. является показателем связывания ERE-эстрогенового рецептора в опухоли, а не простым показателем наличия или отсутствия эстрогенового рецептора.
В другом варианте осуществления изобретения детекция наличия самого стероидного эстрогена в аддукте комплекса эстроген-эстрогеновый рецептор-нуклеосома в кровотоке или другой жидкости организма или в нуклеосомах, получаемых в виде гидролизата хроматина из опухолевой ткани, используют в качестве показателя статуса эстрогеновой зависимости опухоли.
Опубликовано, что циркулирующие нуклеосомы повышаются при эндометриозе (Holdenrieder et al., 2001) и, вследствие того, что эндометриоидная ткань является чувствительной к эстрогену, связывание эстрогенового рецептора в хроматине эндометриоидных клеток может приводить к появлению к аддуктам эстрогеновый рецептор-нуклеосама или аддуктам комплекса эстроген-эстрогеновый рецептор-нуклеосома в кровотоке. В дополнительном варианте осуществления изобретения аддукты эстрогеновый рецептор-нуклеосама или аддукты комплекса эстроген-эстрогеновый рецептор-нуклеосома детектируют в жидкости организма в качестве биомаркера наличия эстроген-зависимого гинекологического патологического состояния, включая например, эндометриоз.
Аналогичным образом как в случае эстроген-зависимого рака молочной железы, для роста андроген-зависимой опухоли предстательной железы требуется андроген, или ее рост ускоряется андрогеном. Андроген-зависимые опухоли предстательной железы аналогично лечат способами, которыми предотвращают связывание андрогена с андрогенным рецептором (AR). Андроген-зависимые опухоли предстательной железы также могут развиваться и становится андроген-независимыми и, таким образом, устойчивыми к видам лечения, включая физическую или химическую кастрацию лекарственными средствами, для предотвращения связывания андрогена с его рецептором. Статус андрогенной зависимости опухоли можно определять по уровню связывания андрогенного рецептора с андрогенными ответными элементами (ARE) в геноме, и его можно определять анализом уровней аддуктов андрогенный рецептор-нуклеосома, содержащихся в кровотоке индивидуума или в гидролизатах хроматина из ткани предстательной железы. Варианты осуществления изобретения для этой цели включают детекцию аддуктов андрогенный рецептор-нуклеосома или аддуктов комплекса андроген-андрогеный рецептор-нуклеосома в кровотоке или в жидкости организма индивидуума, или в нуклеосомах, получаемых расщеплением хроматина из ткани опухоли индивидуума. В настоящее время авторы разработали простые способы ELISA детекции и количественного определения аддуктов нуклеосома-AR и продемонстрировали их пригодность. Авторы также разработали простые способы ELISA для детекции и количественного определения аддуктов нуклеосома-прогестероновый рецептор. Другие зависимые от гормонов заболевания можно разрешать аналогичными вариантами осуществления способа по изобретению. Такие варианты осуществления включают детекцию других аддуктов рецептор-нуклеосома, включая, например, аддукты глюкокортикоидого рецептора, рецептора гормона щитовидной железы и рецептора ретиноевой кислоты с нуклеосомой для детекции опухолей, включая, например, различные типы лейкозов, в которые вовлечен рецептор ретиноевой кислоты.
В дополнительном аспекте изобретения, способы, описываемые выше в настоящем описании, можно использовать для детекции аддуктов комплекса гормон-рецептор гормона-нуклеосома. В одном из вариантов осуществления аддукты комплекса гормон-рецептор гормона-нуклеосома содержат аддукт комплекса тироксин-рецептор гормона щитовидной железы-нуклеосома, аддукт комплекса трийодтиронин-рецептор гормона щитовидной железы-нуклеосома, аддукт комплекса ретиноевая кислота-рецептор ретиноевой кислоты-нуклеосома, аддукт комплекса андроген-андрогенный рецептор-нуклеосома или аддукт комплекса эстроген-эстрогеновый рецептор-нуклеосома. Этот аспект изобретения обладает преимуществом, которое заключается в определении активируемых гормоном аддуктов, а также аддуктов, содержащих рецептор гормона дикого типа или нормального типа, из рецептора гормона, который не связывается со своим лигандом, например, вследствие мутации во время прогрессирования заболевания (например, при эстроген-независимом раке молочной железы). Этот аспект изобретения можно воплощать многими способами. В одном из вариантов осуществления используют антитело или другое связывающее средство, направленное, чтобы связываться с самим гормоном, вместо антитела, направленного, чтобы связываться с рецептором гормона. В альтернативном варианте осуществления гормон выделяют из захваченного антителом аддукта комплекса гормон-рецептор гормона-нуклеосома и количественно определяют общепринятыми способами, например, способами иммунологического анализа, спектральными способами или хроматографическими способами, включая высокоэффективную жидкостную хроматографию (ВЭЖХ), жидкостную хроматографию с последующей масс-спектроскопией (LC/MS) или газовую хроматографию с последующей масс-спектроскопией (GC/MS). Например, аддукт комплекса андроген-андрогенный рецептор-нуклеосома захватывается иммобилизованными антителами, направленными для связывания с эпитопом, содержащимся в аддукте (например, в андрогенном рецепторе или в нуклеосоме). Затем, гормон экстрагируют из связанного с твердой фазой аддукта в органический растворитель (например, простой диэтиловый эфир). Растворитель переносят, сушат и андроген повторно растворяют в буфере для анализа и измеряют его концентрацию (например, конкурентным иммунологическим анализом). Специалистам в данной области будет понятно, что этот вариант осуществления имеет конкретное применение для низкомолекулярных гормонов, таких как стероидные гормоны и гормоны щитовидной железы.
Целью настоящего изобретения является детекция белков, которые являются связанными с нуклеосомами. Это можно проводить тестом ELISA с двойным антителом, в котором одно антитело направлено, чтобы связываться с нуклеосомами, а другое направлено, чтобы связываться с белком, связанным с нуклеосомой. Однако антитело, направленное, чтобы связываться с нуклеосомой, необязательно является направленным на целый комплекс нуклеосомы, а может быть направлено на часть белкового компонента или компонента нуклеиновой кислоты нуклеосомы. В этом варианте осуществления изобретения антитело, применяемое для связывания с нуклеосомой, может быть направлено, чтобы связываться с любой частью компонента нуклеосомы, включая, например, с конкретным гистоном, модификацией гистона, вариантом или изоформой гистона или с конкретным нуклеотидом или модифицированным нуклеотидом. Авторы продемонстрировали, что такая схема анализа хорошо работает с использованием, например, антитела, направленного, чтобы связываться с вариантом гистона H2AZ, в качестве связывающего средства нуклеосом. Специалистам в данной области будет понятно, что этот способ имеет дополнительное преимущество селективного связывания только с такими нуклеосомами, которые содержат представляющий интерес белок в аддукте и H2AZ. Такая схема обеспечивает способ анализа для тестирования любой комбинации белка аддукта с любым конкретным гистоном, модификацией гистона, вариантом гистона, нуклеотида, модифицированного нуклеотида или другой нуклеосомной структуры.
Во втором аспекте изобретение относится к способу детекции наличия аддукта нуклеосома-белок в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(iii) детекции или количественного определения связывания указанного второго связывающего средства со связанным белком в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
Специалистам в данной области будет понятно, что связывающее средство, которое необходимо детектировать, можно выбирать так, чтобы оно являлось антителом, направленным на связанный белок или на нуклеосому или часть компонента нуклеосомы.
В третьем аспекте изобретение относится к способу детекции наличия аддукта нуклеосом в образце, который включает этапы:
(i) приведения образца в контакт с первым связывающим средством, которое связывается с белком, связанным с нуклеосомой;
(ii) приведения нуклеосом или образца в контакт со вторым связывающим средством, которое связывается с нуклеосомами или их компонентом;
(iii) детекции или количественного определения связывания указанного второго связывающего средства с нуклеосомами или их компонентом в образце и
(iv) использования наличия или степени такого связывания в качестве показателя наличия аддуктов нуклеосом в образце.
В одном из вариантов осуществления аддукт нуклеосом содержит провоспалительный белок, белок группы с высокой подвижностью, белок polycomb, модифицирующий хроматин фермент, ядерный рецептор или гормон. В альтернативном варианте осуществления аддукт нуклеосом содержит белок группы с высокой подвижностью, белок polycomb, модифицирующий хроматин фермент, рецептор гормона или гормон. В дополнительном варианте осуществления аддукт нуклеосом содержит модифицирующий хроматин фермент, ядерный рецептор или гормон. В дополнительном варианте осуществления белок группы с высокой подвижностью представляет собой HMGB1. В одном из вариантов осуществления, когда биомаркер используют для диагностики рака, аддукт нуклеосома-белок содержит белок группы с вы