Улучшенные нанотела против сывороточного альбумина человека
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности нанотелам против сывороточного альбумина человека, а также к полипептидам против сывороточного альбумина человека, содержащим одно или более таких нанотел. Нанотела согласно изобретению используют для получения биспецифичных и триспецифичных полипептидов, связывая их с одним или двумя нанотелами против антигенов, отличных от сывороточного альбумина человека. Настоящее изобретение позволяет получить нанотела и полипептиды, их содержащие, обладающие улучшенным сродством к сывороточному альбумину человека. 9 н. и 20 з.п. ф-лы, 62 ил., 47 табл., 65 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к улучшенным нанотелам (Nanobodies™) против фактора некроза опухоли (TNF-альфа), а также к полипептидам, содержащим или по существу состоящим из одного или более таких нанотел. [Примечание: Nanobody™, Nanobodies™ и Nanoclone™ являются товарными знаками от Ablynx N.V.]
Также изобретение относится к нуклеиновым кислотам, кодирующим такие нанотела и полипептиды; к способам приготовления таких нанотел и полипептидов; к клеткам-хозяевам, экспрессирующих или способных к экспрессии таких нанотел или полипептидов; к композициям, содержащим такие нанотела, полипептиды, нуклеиновые кислоты или клетки-хозяева; и к применениям таких нанотел, таких полипептидов, таких нуклеиновых кислот, таких клеток-хозяев или таких композиций, а именно, в профилактических, терапевтических и диагностических целях, таких как профилактические, терапевтические и диагностические цели, приведенные ниже.
Другие аспекты, воплощения, преимущества и применения изобретения станут понятны из дальнейшего описания, приведенного ниже.
Уровень техники
WO 04/041862 заявителя относится к нанотелам против TNF-альфа и к их приготовлению и применению, в частности, для профилактики и/или лечения заболеваний и нарушений, связанных с и/или опосредованных TNF-альфа, таких как воспаление, ревматоидный артрит, болезнь Крона, неспецифический язвенный колит, воспалительные заболевания кишечника, рассеянный склероз, болезнь Аддисона, аутоиммунный гепатит, аутоиммунный паротит, диабет 1 типа, эпидидимит, гломерулонефрит, болезнь Грейвса, синдром Гийена—Барре, тиреоидит Хашимото, гемолитическая анемия, системная красная волчанка, мужское бесплодие, множественный склероз, злокачественная миастения, пузырчатка, псориаз, ревматический полиартрит, ревматоидный артрит, саркоидоз, склеродермия, Синдром Шегрена, спондилоартропатия, тиреоидит и васкулит.
Анти-TNF нанотела в соответствии с WO 04/041862 могут быть гуманизированными и могут быть одновалентными или поливалентными, последние из которых приводят к повышенному сродству к TNF. Анти-TNF Nanobodies™ no WO 04/041862 могут также быть мультиспецифичными, и могут, в частности, быть представлены в форме мультиспецифичной конструкции, содержащей два или более нанотел против TNF и дополнительно нанотело, направленное против сывороточного белка, такого как сывороточный альбумин человека, который приводит к удлинению времени полужизни in vivo.
WO 04/041862 также относится к способам приготовления анти-TNF нанотел, к нуклеиновым кислотам или конструкциям, кодирующим анти-TNF нанотела, а также к фармацевтическим композициям, содержащим анти-TNF нанотела, которые могут быть пригодными для внутривенного, подкожного, перорального, сублингвального, топического, назального, вагинального или ректального применения или для применения путем ингаляционного введения. Анти-TNF нанотела согласно WO 04/041862 могут также применяться для диагностических целей, необязательно в виде комплекса.
ЕР 0486526 описывает связывающие TNF-альфа-лиганды против специфичного эпитопа TNF. Среды связывающих лигандов упоминаются однодоменные антитела ("dAbs").
Reiter et al., J. Mol. Biol. (1999), 290, 685-698, описывают однодоменные антитела против TNF-альфа, полученные из рандомизированной фаговой дисплейной библиотеки, которая создавалась начиная с домена VH, происходящего из мышиной гибридомы.
WO 00/29004 описывает мышиные однодоменные антитела ("микротела") против TNF-альфа.
WO 04/003019, в частности, описывает лиганды. Содержащие первый связывающий домен против TNF-альфа и второй связывающий домен против сывороточного белка, такого как сывороточный альбумин.
Раскрытие изобретения
Основная цель настоящего изобретения состоит в обеспечении нанотел против TNF-альфа, в частности против TNF-альфа человека.
В особенности, цель настоящего изобретения заключается в обеспечении нанотел против TNF-альфа, а именно против TNF-альфа человека, и в обеспечении белков или полипептидов, содержащих такие нанотела, которые пригодны для терапевтического и/или диагностического применения, и, в частности, для профилактики, лечения и/или диагностики одного или более заболеваний или нарушений, связанных с и/или опосредованных TNF-альфа, которые упоминались выше, и/или которые могут применяться для приготовления фармацевтической композиции для профилактики и/или лечения одного или более заболеваний, связанных с и/или опосредованных TNF-альфа, которые указаны выше.
Кроме того, цель настоящего изобретения заключается в обеспечении нанотел против TNF-альфа, и в обеспечении белков или полипептидов, содержащих такие нанотела, при этом каждый альтернативен нанотелам и полипептидам против TNF-альфа, описанным в WO 04/041862, и/или которые имеют одно или более улучшенных свойств или характеристик, по сравнению с нанотелами и полипептидами против TNF-альфа, описанными в WO 04/041862.
Более того, целью настоящего изобретения является обеспечение нанотел против TNF-альфа, и обеспечение белков или полипептидов, содержащих такие нанотела, которые усовершенствованы, по сравнению с нанотелами и полипептидами против TNF-альфа, описанными в WO 04/041862, в отношении одного или более из следующих свойств или характеристик:
- повышенное сродство к TNF-альфа, или в моновалентной форме, в мультивалентной форме (например, в бивалентной форме) и/или в мультиспецифичной форме (например, одна из мультиспецифичных форм, описанная в WO 04/041862 или приведенная ниже);
- лучшая пригодность для форматирования в мультивалентный формат (например, для бивалентного формата);
- лучшая пригодность для форматирования в мультиспецифичный формат (например, один из мультиспецифичных форматов, описанных в WO 04/041862 или приведенных ниже);
- повышенная пригодность или предрасположенность для "гуманизированных" замещений (как определено здесь); и/или
- меньшая иммуногенность, либо в моновалентном формате, в мультивалентном формате (например, в бивалентном формате) и/или в мультиспецифичном формате (например, один из мультиспецифичных форматов, описанных в WO 04/041862 или приведенных ниже) в моновалентном формате;
- повышенная стабильность, или в моновалентном формате, в мультивалентном формате (например, в бивалентном формате) и/или в мультиспецифичном формате (например, один из мультиспецифичных форматов, описанных в WO 04/041862 или приведенных ниже) в моновалентном формате;
- повышенная специфичность по отношению к TNF-альфа, или в моновалентном формате, в мультивалентном формате (например, в бивалентном формате) и/или в мультиспецифичном формате (например, один из мультиспецифичных форматов, описанных в WO 04/041862 или приведенных ниже) в моновалентном формате;
- сниженная или при необходимости повышенная перекрёстная реактивность с TNF-альфа из различных видов;
и/или
- одно или более других свойств, подходящих для фармацевтического применения (включая профилактическое применение и/или терапевтическое применение) и/или для диагностического применения (включая, но не ограничиваясь, применение для изображаемых целей), или в моновалентном формате, в мультивалентном формате (например, в бивалентном формате) и/или в мультиспецифичном формате (например, один из мульти специфичных форматов, описанных в WO 04/041862 или приведенных ниже).
Данные цели достигаются с помощью нанотел, белков и полипептидов, описанных в данном документе. Эти нанотела также обозначаются здесь как "Нанотела изобретения"; и эти белки и полипептиды также в совокупности обозначаются здесь "полипептиды изобретения".
Поскольку нанотела и полипептиды, описываемые здесь, главным образом предназначаются для терапевтического и/или диагностического применения, они направлены против (как определено здесь) человеческого TNF-альфа. Однако не исключается (но также и не является желаемым), что нанотела и полипептиды, описываемые здесь, демонстрируют перекрестную реактивность с TNF-альфа от одного или более других видов теплокровных животных, например, с TNF-альфа от одного или более других видов приматов и/или с TNF-альфа от одного или более других видов животных, которые часто применяются в экспериментальных моделях болезней (например, мышь, крыса, кролик, свинья или собака), и, в особенности, в экспериментальных моделях болезней и нарушений, связанных с TNF-альфа (такие как экспериментальные модели на видах и животных, указанные в данном документе). В связи с этим, для специалиста в данной области является ясным, что такая перекрестная реактивность, при наличии, может иметь преимущества от усовершенствования лекарственного средства, поскольку обеспечиваются нанотела и полипептиды против человеческого TNF-альфа, которые тестируются в таких моделях заболеваний.
Настоящее изобретение в его широком понимании также не ограничивается или характеризуется специфичной антигенной детерминантой, эпитопом, частью, доменом, субъединицей или конфирмацией (где применимо) TNF-альфа, против которого направлены нанотела и полипептиды изобретения.
Однако, в предпочтительном воплощении, нанотела, белки или полипептиды, описываемые здесь, направлены против и/или могут связываться с эпитопом TNF-альфа, который находится в и/или является частью сайта(ов) связывания с TNF-рецепторами (напр., сайты связывания для TNF-RI, THF-RII, также известные как р55 или р75). Из уровня техники хорошо известно, что тример TNF содержит три сайта связывания с рецепторами, которые по существу эквивалентны и которые образованы с помощью/на стыке двух мономеров TNF с тримером TNF. Например, нанотела, белки или полипептиды, описываемые здесь, предпочтительно направлены против и/или могут связываться с эпитопом TNF-альфа, который содержит следующие аминокислотные остатки TNF-альфа: Gln в положении 88, Lys в положении 90 и/или Glu в положении 146.
В частности, нанотела, белки или полипептиды, описываемые здесь, направлены против и/или могут связываться с эпитопом тримера TNF-альфа, который находится в и/или является частью сайта(ов) связывания с TNF-рецепторами. Например, нанотела, белки или полипептиды, описываемые здесь, могут быть направлены против и/или могут связываться с эпитопом тримера TNF-альфа, который содержит следующие аминокислотные остатки: Gin в положении 88 и Lys в положении 90 в первом мономере TNF (обозначаемый здесь как "мономер А"), и Glu в положении 146 во втором мономере TNF (обозначаемый здесь как "мономер В") (в котором Мономер А и Мономер В совместно, в тримере TNF, из сайта(ов) связывания с TNF-рецепторами).
Более того, нанотела, белки или полипептиды, описываемые здесь, могут быть направлены против и/или могут связываться с эпитопом тримера TNF-альфа, который содержит вышеуказанные аминокислоты (Gin в положении 88 в мономере А; Lys в положении 90 в мономере А и Glu в положении 146 в мономере В), и в дополнение, по меньшей мере, один, предпочтительно два или более, более предпочтительно 5 или более, и предпочтительно все или по существу все, из следующих аминокислотных остатков мономера А TNF-альфа: Gly в положении 24, Gin в положении 25, Thr в положении 72, His в положении 73, Val в положении 74, Leu в положении 75, Thr в положении 77, Thr в положении 79, Не в положении 83, Thr в положении 89, Val в положении 91. Asn в положении 92, Не в положении 97, Arg в положении 131, Glu в положении 135, Не в положении 136, Asn в положении 137, Arg в положении 138, Pro в положении 139, Asp в положении 140 и следующие остатки в мономере В: Pro в положении 20, Arg в положении 32, Lys в положении 65, Lys в положении 112, Tyr в положении 115, Ala в положении 145, Ser в положении 147.
Альтернативно, нанотела, белки или полипептиды, описываемые здесь, могут быть направлены против и/или могут связываться с эпитопом TNF-альфа, который содержит вышеуказанные аминокислоты (Gln в положении 88 в мономере А; Lys в положении 90 в мономере А и Glu в положении 146 в мономере В), и в дополнение, по меньшей мере, один, предпочтительно два или более, более предпочтительно 5 или более, и предпочтительно все или по существу все, из следующих аминокислотных остатков TNF-альфа мономера A: Leu в положении 75, Thr в положении 77, Thr в положении 79, Ile в положении 80, Ser в положении 81, Tyr в положении 87, Thr в положении 89, Val в положении 91, Asn в положении 92, Ser в положении 95, Не в положении 97, Glu в положении 135, Не в положении 136, Asn в положении 137 и следующие остатки в мономере В: Ala в положении 33, Ala в положении 145, Ser в положении 147.
Такой эпитоп может определяться при помощи структурного анализа нанотела, кристаллизованного в комплексе с молекулой TNF, или при помощи других способов, таких как картирование эпитопов посредством метода Pepscan.
Для сравнения необходимо отметить, что на основании данных кристаллографии (не показаны), можно увидеть, что нанотело 3Е из WO 04/041862 связывается с другим эпитопом (т.е. эпитопом, содержащим Tyr в положении 141, Asp в положении 140, Gln в положении 67, Gly в положении 24 и Glu в положении 23), чем предпочтительный эпитоп изобретения.
Таким образом, в другом аспекте, настоящее изобретение относится к вариабельному домену иммуноглобулина (или его пригодного фрагмента), который может связываться с эпитопом TNF-альфа, который находится в и/или является частью сайта связывания с TNF-рецепторами, и предпочтительно с эпитопом, который содержит, по меньшей мере, один, предпочтительно два или более, и предпочтительно все из следующих аминокислотных остатков TNF-альфа: Gin в положении 88; Lys в положении 90 и Glu в положении 146. Такой вариабельный домен иммуноглобулина предпочтительно представляет собой вариабельный домен тяжелой цепи или вариабельный домен легкой цепи, и, в частности, вариабельный домен тяжелой цепи, который может являться любым вариабельным доменом тяжелой цепи млекопитающих, включая, но не ограничиваясь, вариабельные домены тяжелой цепи иммуноглобулина человека, вариабельные домены тяжелой цепи мыши и вариабельные домены тяжелой цепи Camelid (такие как вариабельные домены тяжелой цепи из четырехцепочечных иммуноглобулинов Camelid или вариабельные домены тяжелой цепи (VHH домены) от так называемых антител тяжелой цепи). Вариабельный домен иммуноглобулина предпочтительно представляет собой доменное антитело или монодоменное антитело или пригоден для применения в качестве (моно) доменного антитела. Наиболее предпочтительно, вариабельный домен иммуноглобулина представляет собой нанотело (как здесь определено), и особенно предпочтительными, но не ограничивающими примерами нанотел, которые пригодны для применения в данном аспекте изобретения, являются РМР1С2 (TNF1, SEQ ID NO: 52) и PMP5F10 (TNF3, SEQ ID NO: 60), а также гуманизированные и другие их варианты (что в дальнейшем здесь описывается).
Также вышеуказанный вариабельный домен иммуноглобулина может быть гуманизированным (как например и без ограничений), описываемый здесь, в отношении нанотел. Изобретение также относится к белкам и полипептидам, которые содержат или по существу состоят из таких вариабельных доменов иммуноглобулинов, которые могут, например, представлять собой те, которые as здесь описываются. Альтернативно, такие вариабельные домены могут являться частью конструкций ScFv, биспецифичных конструкций, химерного антитела или структур антитела и других иммуноглобулиновых конструкций, которые, например, рассмотрены Hoogenboom (Nature Biotechnology (1997), 15:125-126). Предпочтительно, однако, чтобы вариабельные домены иммуноглобулинов, направленные против указанного эпитопа, представляли нанотела, при этом белки и полипептиды, содержащие такие нанотела, могут быть такими, как далее описывается.
Таким образом, некоторые предпочтительные аспекты изобретения относятся к:
I) Нанотелу, которое направлено против того же эпитопа на тримере TNF-альфа, что и нанотело TNF1 (SEQ ID NO: 52).
II) Нанотелу, которое направлено против того же эпитопа на тримере TNF-альфа, что и нанотело TNF3 (SEQ ID NO: 60).
III) Нанотелу, которое направлено против того же эпитопа на тримере TNF-альфа, которое, по меньшей мере, содержит следующие аминокислотные остатки: Gln в положении 88 в мономере A; Lys в положении 90 в мономере А и Glu в положении 146 в мономере В.
IV) Нанотелу, которое направлено против того же эпитопа на тримере TNF-альфа, которое содержит следующие аминокислотные остатки: Gln в положении 88 в мономере А; Lys в положении 90 в мономере А и Glu в положении 146 в мономере В; и которое дополнительно содержит, по меньшей мере, содержит, по меньшей мере, один, предпочтительно два или более, более предпочтительно 5 или более, и предпочтительно все или по существу все, из следующих аминокислотных остатков TNF-альфа мономера A: Gly в положении 24, Gin в положении 25, Thr в положении 72, His в положении 73, Val в положении 74, Leu в положении 75, Thr в положении 77, Thr в положении 79, Не в положении 83, Thr в положении 89, Val в положении 91, Asn в положении 92, Не в положении 97, Arg в положении 131, Glu в положении 135, Не в положении 136, Asn в положении 137, Arg в положении 138, Pro в положении 139, Asp в положении 140 и следующие остатки в мономере В: Pro в положении 20, Arg в положении 32, Lys в положении 65, Lys в положении 112, Tyr в положении 115, Ala в положении 145, Ser в положении 147.
V) Нанотелу, которое направлено против того же эпитопа на тримере TNF-альфа, которое содержит следующие аминокислотные остатки: Gln в положении 88 в мономере A; Lys в положении 90 в мономере А и Glu в положении 146 в мономере В; и которое дополнительно содержит, по меньшей мере, один, предпочтительно два или более, более предпочтительно 5 или более, и предпочтительно все или по существу все, из следующих аминокислотных остатков TNF-альфа мономера A: Leu в положении 75, Thr в положении 77, Thr в положении 79, Не в положении 80, Ser в положении 81, Tyr в положении 87, Thr в положении 89, Val в положении 91, Asn в положении 92, Ser в положении 95, Ile в положении 97, Glu в положении 135, Не в положении 136, Asn в положении 137 и следующие остатки в мономере В: Ala в положении 33, Ala в положении 145, Ser в положении 147.
Нанотелу по любому из вышеуказанных I)-V), которое имеет значение Koff (константы диссоциации) для TNF более чем 2⋅10-3 (1/с), предпочтительно более чем 1⋅10-3.
Нанотелу по любому из вышеуказанных I)-V), которое имеет значение ЕС50 по клеточному анализу при использовании KYM-клеток, описанных в примере 1, под 3), из WO 04/041862, которое больше чем значение ЕС50 для нанотела VHH 3Е (SEQ ID NO: 4) из WO 04/041862 по аналогичному анализу; или гуманизированный вариант такого нанотела.
Нанотелу по любому из вышеуказанных I)-V), которое имеет значение ЕС50 по клеточному анализу при использовании KYM-клеток, описанных в примере 1, под 3), из WO 04/041862, которое лучше чем 12 нМ; или гуманизированный вариант такого нанотела.
Нанотелу по любому из вышеуказанных I)-V), которое имеет значение ЕС50 по клеточному анализу при использовании KYM-клеток, описанных в примере 1, под 3), из WO 04/041862, которое лучше чем 5 нМ; или гуманизированный вариант такого нанотела.
Нанотелу по любому из вышеуказанных I)-V), которое имеет значение ЕС50 по клеточному анализу при использовании KYM-клеток, описанных в примере 1, под 3), из WO 04/041862, которое лучше чем 3 нМ; или гуманизированный вариант такого нанотела.
Нанотелу по любому из вышеуказанных I)-V), которое представляет собой гуманизированное нанотело.
И некоторые предпочтительные аспекты этого воплощения относятся к:
Нанотелу по любому из вышеуказанных I)-V), которое представляет собой нанотело класса GLEW.
Нанотелу по любому из вышеуказанных I)-V), которое представляет собой гуманизированное нанотело класса GLEW.
Нанотелу по любому из вышеуказанных I)-V), которое содержит остаток аргинина (R) в положении 103.
Нанотелу по любому из вышеуказанных I)-V), которое содержит остаток аргинина (R) в положении 103, и которое является гуманизированным.
Нанотелу по любому из вышеуказанных I)-V), которое представляет собой нанотело класса GLEW, и которое содержит остаток аргинина (R) в положении 103, и которое является гуманизированным.
Нанотелу по любому из вышеуказанных I)-V), которое содержит остаток лейцина (L) в положении 108.
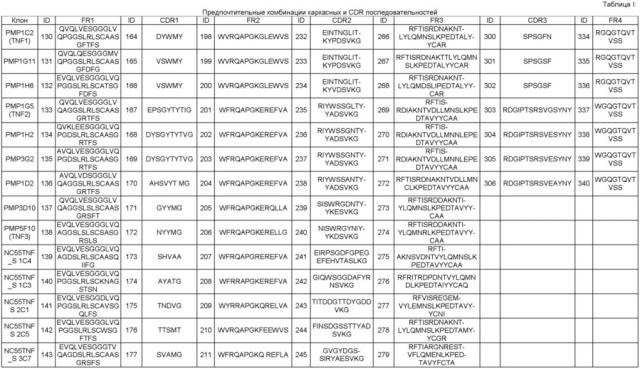
Нанотелу по любому из вышеуказанных I)-V), которое имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности (как здесь определено) с одной из аминокислотных последовательностей SEQ ID NO 52 (TNF1), 76 (TNF13), 77 (TNF14), 95 (TNF29) или 96 (TNF30)
Нанотелу по любому из вышеуказанных I)-V), в котором:
a) CDR1 содержит:
аминокислотную последовательность DYWMY; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью DYWMY; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью DYWMY;
и
b) CDR2 содержит:
аминокислотную последовательность EINTNGLITKYPDSVKG; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью EINTNGLITKYPDSVKG; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью EINTNGLITKYPDSVKG;
и
с) CDR3 содержит:
аминокислотную последовательность SPSGFN; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%,
даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью SPSGFN; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 содержит аминокислотную последовательность DYWMY.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR2 содержит аминокислотную последовательность EINTNGLITKYPDSVKG.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR3 содержит аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором:
CDR1 содержит аминокислотную последовательность DYWMY; и CDR3 содержит аминокислотную последовательность SPSGFN; или
CDR1 содержит аминокислотную последовательность DYWMY; и CDR2 содержит аминокислотную последовательность EINTNGLITKYPDSVKG; или
CDR2 содержит аминокислотную последовательность EINTNGLITKYPDSVKG; и CDR3 содержит аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 содержит аминокислотную последовательность DYWMY; и CDR3 содержит аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 содержит аминокислотную последовательность DYWMY; CDR2 содержит аминокислотную последовательность EINTNGLITKYPDSVKG и CDR3 содержит аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором:
а) CDR1 представляет собой:
аминокислотную последовательность DYWMY; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью DYWMY; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью DYWMY;
и в котором:
b) CDR2 представляет собой:
аминокислотную последовательность EINTNGLITKYPDSVKG; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью EINTNGLITKYPDSVKG; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью EINTNGLITKYPDSVKG;
и в котором:
c) CDR3 представляет собой:
аминокислотную последовательность SPSGFN; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью SPSGFN; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 представляет собой аминокислотную последовательность DYWMY.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR2 представляет собой аминокислотную последовательность EINTNGLITKYPDSVKG.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR3 представляет собой аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором:
CDR1 представляет собой аминокислотную последовательность DYWMY; и CDR3 представляет собой аминокислотную последовательность SPSGFN; или
CDR1 представляет собой аминокислотную последовательность DYWMY; и CDR2 представляет собой аминокислотную последовательность EINTNGLITKYPDSVKG; или
CDR2 представляет собой аминокислотную последовательность EINTNGLITKYPDSVKG; и CDR3 представляет собой аминокислотную последовательность SPSGFN
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 представляет собой аминокислотную последовательность DYWMY; и CDR3 представляет собой аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 представляет собой аминокислотную последовательность DYWMY; CDR2 представляет собой аминокислотную последовательность EINTNGLITKYPDSVKG и CDR3 представляет собой аминокислотную последовательность SPSGFN.
Нанотелу по любому из вышеуказанных I)-V), в котором:
любая аминокислотная замена является предпочтительно консервативной аминокислотной заменой; и/или
Указанная аминокислотная последовательность предпочтительно содержит только аминокислотные замены и не содержит аминокислотные делеции или инсерции, по сравнению с вышеуказанной(ыми) аминокислотной(ыми) последовательностью(ями).
И некоторые другие предпочтительные аспекты этого воплощения относятся к:
Нанотелу по любому из вышеуказанных I)-V), которое является нанотелом класса KERE.
Нанотелу по любому из вышеуказанных I)-V), которое является гуманизированным Нанотелом класса KERE.
Нанотелу по любому из вышеуказанных I)-V), которое, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности (как здесь определено) с одной из аминокислотных последовательностей SEQ ID NO 50 (TNF3), 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) или 98 (TNF33).
Нанотелу по любому из вышеуказанных I)-V), в котором:
a) CDR1 представляет собой:
аминокислотную последовательность NYYMG; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью NYYMG; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью NYYMG;
и
b) CDR2 представляет собой:
аминокислотную последовательность NISWRGYNIYYKDSVKG; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью NISWRGYNIYYKDSVKG; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью NISWRGYNIYYKDSVKG;
и
с) CDR3 представляет собой:
аминокислотную последовательность SILPLSDDPGWNTY; или
аминокислотную последовательность, которая имеет, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, даже более предпочтительно, по меньшей мере, 99% идентичности последовательности с аминокислотной последовательностью SILPLSDDPGWNTY; или
аминокислотные последовательности, которые имеют 2 или только 1 аминокислотное(ые) отличие(ия) с аминокислотной последовательностью SILPLSDDPGWNTY.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 представляет собой аминокислотную последовательность NYYMG.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR2 представляет собой аминокислотную последовательность NISWRGYNIYYKDSVKG.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR3 представляет собой аминокислотную последовательность SILPLSDDPGWNTY.
Нанотелу по любому из вышеуказанных I)-V), в котором:
CDR1 представляет собой аминокислотную последовательность NYYMG; и CDR3 представляет собой аминокислотную последовательность SILPLSDDPGWNTY; или
CDR1 представляет собой аминокислотную последовательность NYYMG; и CDR2 представляет собой аминокислотную последовательность NISWRGYNIYYKDSVKG; или
CDR2 представляет собой аминокислотную последовательность NISWRGYNIYYKDSVKG; и CDR3 представляет собой аминокислотную последовательность SILPLSDDPGWNTY.
Нанотелу по любому из вышеуказанных I)-V), в котором CDR1 представляет собой аминокислотную последовательность NYYMG; CDR2 представляет собой аминокислотную последовательность SILPLSDDPGWNTY и CDR3 представляет собой аминокислотную последовательность ILPLSDDPGWNTY.
Нанотелу по любому из вышеуказанных I)-V), в котором:
любая аминокислотная замена является предпочтительно консервативной аминокислотной заменой; и/или
указанная аминокислотная последовательность предпочтительно содержит только аминокислотные замены и не содержит аминокислотных делеций или инсерций, по сравнению с вышеуказанной(ыми) аминокислотной(ыми) последовательностью(ями).
и вместе с еще другими некоторыми особенно предпочтительными аспектами:
VI) Белку или полипептиду, который содержит или по существу состоит из нанотела по любому из вышеуказанных I)-V).
VII) Белку или полипептиду, который содержит или по существу состоит из, по меньшей мере, одного нанотела по любому из вышеуказанных I)-V).
VIII) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V).
IX) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V) и который остается таким же, как и указанный белок или полипептид, после связывания с тримером TNF, способен ингибировать или снижать перекрестное сшивание рецептора TNF, что опосредовано указанным тримером TNF, и/или сигнальную трансдукцию, которая опосредуется таким перекрестным сшиванием рецептора.
X) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V) и который способен к внутримолекулярному связыванию с, по меньшей мере, двумя сайтами связывания для рецептора TNF на тримере TNF.
XI) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), связанных посредством пригодного линкера.
XII) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), связанных посредством пригодного линкера, и который пегилирован.
XIII) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V) и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека.
XIV) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, и который является таким же, как и указанный белок или полипептид, после связывания с тримером TNF, способен ингибировать или снижать перекрестное сшивание рецептора TNF, что опосредовано указанным тримером TNF, и/или сигнальную трансдукцию, которая опосредована таким перекрестным сшиванием.
XV) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, и который способен к внутримолекулярному связыванию, по меньшей мере, с двумя сайтами связывания рецепторов TNF на тримере TNF.
XVI) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, в котором каждый из двух нанотел по любому из вышеуказанных I)-V) связан, необязательно через пригодный линкер, с одним нанотелом, направленным против сывороточного альбумина человека.
XVII) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V), и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, в котором каждый из двух нанотел по любому из вышеуказанных I)-V) связан, необязательно через пригодный линкер, с одним нанотелом, направленным против сывороточного альбумина человека, и который является таким же, как и указанный белок или полипептид, после связывания с тримером TNF, способен ингибировать или снижать перекрестное сшивание рецептора TNF, что опосредовано указанным тримером TNF, и/или сигнальную трансдукцию, которая опосредована таким перекрестным сшиванием рецептора.
XVIII) Белку или полипептиду, который содержит два нанотела по любому из вышеуказанных I)-V) и который дополнительно содержит, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, в котором каждый из двух нанотел по любому из вышеуказанных I)-V) связан, необязательно через пригодный линкер, с одним нанотелом, направленным против сывороточного альбумина человека, и который способен к внутримолекулярному связыванию, по меньшей мере, с двумя сайтами связывания рецепторов TNF на тримере TNF.
Белку или полипептиду по любому из вышеуказанных VI)-XVIII), в котором, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, является гуманизированным нанотелом.
Белку или полипептиду по любому из вышеуказанных VI)-XVIII), в котором, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, является гуманизированным вариантом нанотела ALB 1 (SEQ ID NO: 63).
Белку или полипептиду по любому из вышеуказанных VI)-XVIII), в котором, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, выбирается из группы, состоящей из ALB 3 (SEQ ID NO: 87), ALB 4 (SEQ ID NO: 88), ALB 5 (SEQ ID NO: 89), ALB 6 (SEQ ID NO: 100), ALB 7 (SEQ ID NO: 101), ALB 8 (SEQ ID NO: 102) ALB 9 (SEQ ID NO: 103) и ALB 10 (SEQ ID NO: 104).
Белку или полипептиду по любому из вышеуказанных VI)-XVIII), в котором, по меньшей мере, одно нанотело, направленное против сывороточного альбумина человека, представляет собой ALB 8.
Белку или полипептиду по любому из вышеуказанных VI)-XVIII), который содержит или по существу состоит из двух гуманизированных нанотел по любому из вышеуказанных I)-V), и одного гуманизированного варианта нанотела ALB I (SEQ ID NO: 63).
Следует отметить, что если нанотело обозначается как "по любому из вышеуказанных I)-V)", то соответствует, по меньшей мере, по одному из I)-V), может быть по двум или более из I)-V), и могут также включать любой один или более из других аспектов, которые указываются как "по любому из вышеуказанных I)-V)". Аналогично, если белок или полипептид обозначается как "по любому из вышеуказанных VI)-XVIII)", то соответствует, по меньшей мере, по одному из VI)-XVIII), может быть по двум или более из VI)-XVIII), и могут также включать любой один или более из других аспектов, которые указываются как "по любому из вышеуказанных VI)-XVIII)".
Также в объем изобретения входит то, что, если применимо, нанотело или полипептид изобретения может связываться с двумя или более антигенными детерминантами, эпитопами, частями, доменами, субъединицами или конфирмациями TNF-альфа. При этом, антигенные детерминанты, эпитопы, части, домены или субъединицы TNF-альфа, с которыми связаны нанотела и/или полипептиды изобретения, могут быть по существу аналогичными (например, если TNF-альфа содержит множественные структурные фрагменты или присутствует как мультимер) или могут отличаться (и во втором случае, нанотела и полипептиды изобретения могут связываться с такими разными антигенными детерминантами, эпитопами, частями, доменами, субъединицами TNF-альфа со сродством и/или специфичностью, которые могут одинаковыми или отличаться). Также, например, ес