Нуклеиновая кислота, содержащая или кодирующая структуру "стебель-петля" гистонов и последовательность поли(а) или сигнал полиаденилирования, для повышения экспрессии кодируемого терапевтического белка
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Предложены нуклеиновая кислота, кодирующая терапевтический белок или антитело, структуру «стебель-петля» гистонов, и последовательность поли(А) или сигнал полиаденилирования, набор и фармацевтическая композиция, содержащие одну или более указанную нуклеиновую кислоту, для использования в генной терапии, а также способ повышения экспрессии кодируемого белка и применение указанных нуклеиновой кислоты, набора или композиции для повышения экспрессии кодируемого белка. Строение предложенной нуклеиновой кислоты, заключающееся в комбинации элементов последовательности поли(А) или сигнала полиаденилирования совместно со структурой «стебель-петля» гистонов, обеспечивает повышение экспрессии белка значительно выше уровня, наблюдаемого при использовании указанных элементов отдельно. Предложенная группа изобретений может быть использована в медицине в генной терапии. 6 н. и 15 з.п. ф-лы, 25 ил., 15 табл., 11 пр.
Реферат
Настоящее изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей кодирующую область, кодирующую по меньшей мере один пептид или белок, содержащий терапевтический белок или его фрагмент, вариант или производное, по меньшей мере одну структуру "стебель-петля" гистонов и последовательность поли(A) или сигнал полиаденилирования. Кроме того, настоящее изобретение относится к применению нуклеиновой кислоты для повышения экспрессии указанного кодируемого пептида или белка, например, в генной терапии. Настоящее изобретение также относится к применению указанной нуклеиновой кислоты для получения фармацевтической композиции, предназначенной для использования в генной терапии, в частности, при лечении заболеваний, требующих применения терапевтического пептида или белка, предпочтительно рассмотренных в настоящем описании изобретения. Настоящее изобретение, кроме того, относится к способу повышения экспрессии пептида или белка, содержащего терапевтический белок или его фрагмент, вариант или производное, используя нуклеиновую кислоту, содержащую или кодирующую структуру "стебель-петля" гистонов и последовательность поли(A) или сигнал полиаденилирования.
Генная терапия предполагает использование нуклеиновых кислот в качестве фармацевтического средства для лечения заболевания. Генная терапия получила свое название благодаря использованию нуклеиновых кислот для дополнения или изменения экспрессии гена в клетках индивида в качестве метода лечения заболевания. Наиболее распространенной формой генной терапии является использование нуклеиновых кислот, кодирующих функциональный терапевтический белок, для замены мутированного гена. Другие формы генной терапии включают прямую коррекцию мутации или использование нуклеиновых кислот, кодирующих терапевтический белок, в качестве лекарственного средства.
Генная терапия представляют собой способы молекулярной медицины, которые уже зарекомендовали себя в лечении и профилактики заболеваний и, как правило, демонстрируют значительный эффект в повседневной медицинской практике, в частности, при лечении заболеваний, как упомянуто в настоящем документе. Генная терапия основана на введении в клетки или ткани пациента нуклеиновых кислот и дальнейшем процессинге информации, кодируемой нуклеиновой кислотой, которую ввели в клетки или ткани, то есть (белковой) экспрессии желаемых полипептидов.
Генная терапия позволяет получить благоприятные результаты при лечении целого ряда наследственных или приобретенных заболеваний, в том числе инфекционных заболеваний, новообразований (например, раковых или опухолевых заболеваний), заболеваний крови и кроветворных органов, заболеваний эндокринной системы, заболеваний, связанных с питанием и обменом веществ, заболеваний нервной системы, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи и подкожной ткани, заболеваний костно-мышечной системы и соединительной ткани и заболеваний мочеполовой системы.
При генотерапевтических подходах, как правило, используют ДНК, хотя в недавних разработках также появилась информация об использовании РНК. Важно отметить, что во всех этих генотерапевтических подходах мРНК действует как посредник для информации о последовательности кодируемого белка, вне зависимости от того, используется ДНК, вирусная РНК или мРНК.
Как правило, РНК считают нестабильной молекулой: РНКазы встречаются повсеместно и известно, что они трудно поддаются инактивации. Кроме того, РНК химически более лабильна, чем ДНК. Таким образом, вероятно, является неожиданностью тот факт, что "состояние по умолчанию" для мРНК в эукариотической клетке характеризуется относительной стабильностью и для разрушения отдельных мРНК необходимы специфические сигналы. Основной причиной этого обнаружения, по-видимому, является тот факт, что разрушение мРНК в клетках катализируют практически только экзонуклеазы. Однако концы эукариотических мРНК защищены от этих ферментов специфическими концевыми структурами и связанными с ними белками: кэпом m7GpppN на 5ʹ-конце и, как правило, последовательностью поли(A) на 3ʹ-конце. Таким образом, удаление двух концевых модификаций считают лимитирующим скорость разрушения мРНК. Хотя в 3ʹ-UTR мРНК альфа-глобина охарактеризован стабилизирующий элемент, последовательности РНК, воздействующие на функциональный цикл эукариотических мРНК, как правило, действуют как промотор разрушения, как правило, ускоряя деаденилирование (обзор Meyer, S., C. Temme, et al. (2004), Crit Rev Biochem Mol Biol 39(4): 197-216.).
Как указано выше, 5ʹ-концы эукариотических мРНК, как правило, посттранскрипционно модифицированы метилированной кэпирующей структурой, например, m7GpppN. Кроме ее роли в сплайсинге, стабилизации и транспорте РНК, кэпирующая структура значительно повышает привлечение субъединицы 40S рибосомы к 5ʹ-концу мРНК при инициации трансляции. Для реализации последней функции требуется распознавание кэпирующей структуры комплексом факторов инициации эукариот eIF4F. Последовательность поли(A) дополнительно стимулирует трансляцию посредством повышенного привлечения субъединицы 40S к мРНК, эффект, требующий вмешательства связывающего поли(A) белка (PABP). Недавно было показано, что в свою очередь PABP физически взаимодействует с eIF4G, который является частью связанного с кэпом комплекса eIF4F. Таким образом, была постулирована модель закрытой петли инициации трансляции на кэпированной полиаденилированной мРНК (Michel, Y.M., D. Poncet, et al. (2000), J Biol Chem 275(41): 32268-76.).
Такой последовательностью поли(A), которую добавляют на их 3ʹ-конец повсеместно встречающаяся система расщепления/полиаденилирования, заканчиваются почти все эукариотические мРНК. Наличие последовательности поли(A) на 3ʹ-конце является одной из наиболее распознаваемых характеристик эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависимых от репликации транскриптов гистонов, получают полиаденилированный хвост. В этом контексте, процессинг 3ʹ-конца представляет собой ядерный совместный с транскрипцией процесс, который способствует транспорту мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК. Формирование 3ʹ-конца происходит в двухстадийной реакции под управлением системы расщепления/полиаденилирования и зависит от присутствия двух элементов последовательности в предшественниках мРНК (пре-мРНК), высококонсервативного гексануклеотида AAUAAA (сигнала полиаденилирования) и расположенной ниже последовательности, богатой G/U. На первой стадии происходит расщепление пре-мРНК между двумя этими элементами. На второй стадии, тесно связанной с первой стадией, происходит достройка вновь сформированного 3ʹ-конца посредством добавления последовательности поли(A), состоящей из 200-250 аденилатов, которые затем влияют на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski, Z. и W.F. Marzluff (2007), Gene 396(2): 373-90.).
Единственным известным исключением из этого правила являются зависимые от репликации мРНК гистоны, которые вместо последовательности поли(A) заканчиваются структурой "стебель-петля" гистонов. Примеры последовательностей структуры "стебель-петля" гистонов описаны в Lopez et al. (Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308.).
Как правило, за структурами "стебель-петля" в пре-мРНК гистонов расположена последовательность, богатая пуринами, известная как нижерасположенный элемент гистонов (HDE). Эти пре-мРНК подвергаются процессингу в ядре посредством одного эндонуклеолитического расщепления приблизительно на 5 нуклеотидов ниже структуры "стебель-петля", катализируемого мяРНП U7 посредством спаривания оснований мяРНК U7 с HDE. Последовательность 3ʹ-UTR, содержащую структуру "стебель-петля" гистонов и нижерасположенный элемент гистонов (HDE) (участок связывания мяРНП U7), как правило, обозначают как 3ʹ-сигнал процессинга гистонов (см. например, Chodchoy, N., N.B. Pandey, et al. (1991). Mol Cell Biol 11(1): 497-509.).
Из-за необходимости упаковки вновь синтезированной ДНК в хроматин, синтез гистонов контролируется согласованно с клеточным циклом. Повышенный синтез гистоновых белков в течение S-фазы достигается посредством активации транскрипции генов гистонов, а также посттранскрипционной регуляции уровней мРНК гистонов. Можно показать, что структура "стебель-петля" гистонов необходима для всех посттранскрипционных стадий регуляции экспрессии гистонов. Она необходима для эффективного процессинга, экспорта мРНК в цитоплазму, помещения в полирибосомы и регуляции стабильности мРНК.
В указанном выше случае идентифицирован белок 32 кДа, который в ядре и цитоплазме связан со структурой "стебель-петля" гистонов на 3ʹ-конце мРНК гистонов. Уровень экспрессии этого связывающего структуру "стебель-петля" белка (SLBP) регулируется клеточным циклом и наибольшим является в течение S-фазы, когда повышены уровни мРНК гистонов. SLBP необходим для эффективного 3ʹ-концевого процессинга пре-мРНК гистонов посредством мяРНП U7. После завершения процессинга SLBP остается связанным со структурой "стебель-петля" на конце зрелых мРНК гистонов и стимулирует их трансляцию в гистоновые белки в цитоплазме. (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90). Интересен тот факт, что РНК-связывающий домен SLBP является консервативным у всех представителей метазоа и протозоа (Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), и можно показать, что его связывание с последовательностью структуры "стебель-петля" гистонов зависит от структуры "стебель-петля", и что минимальный участок связывания содержит по меньшей мере 3 нуклеотида с 5ʹ-конца и 2 нуклеотида с 3ʹ-конца от структуры "стебель-петля" (Pandey, N.B., et al. (1994), Molecular and Cellular Biology, 14(3), 1709-1720 и Williams, A.S., & Marzluff, W.F., (1995), Nucleic Acids Research, 23(4), 654-662.).
Хотя гены гистонов, как правило, классифицируют как "зависимые от репликации", дающие начало мРНК, оканчивающимся структурой "стебель-петля" гистонов, или "заместительного типа", дающие начало мРНК, несущим вместо этого поли(A)-хвост, в некоторых редких случаях идентифицированы природные мРНК, содержащие и структуру "стебель-петля" гистонов и поли(A) или олиго(A) с 3ʹ-конца. Sanchez et al. изучали действие природных олиго(A)-хвостов, добавляемых c 3ʹ-конца от структуры "стебель-петля" гистонов в мРНК гистонов, при оогенезе Xenopus с использованием в качестве репортерного белка люциферазы и выявили, что олиго(A)-хвост является активной частью механизма репрессии трансляции, который осуществляет сайленсинг мРНК гистонов при оогенезе, и его удаление является частью механизма, который активирует трансляцию мРНК гистонов (Sanchez, R. and W. F. Marzluff (2004), Mol Cell Biol 24(6): 2513-25).
Кроме того, исследовали необходимые условия регуляции зависимых от репликации гистонов на уровне процессинга пре-мРНК и стабильности мРНК, используя искусственные конструкции, кодирующие маркерный белок альфа-глобин, используя преимущество того факта, что ген глобина, в отличие от безинтронных генов гистонов, содержит интроны. Для этой цели получали конструкции, в которых после кодирующей последовательности альфа-глобина располагалась сигнальная последовательность структуры "стебель-петля" гистонов (структура "стебель-петля" гистонов с последующим нижерасположенным элементом гистонов) и сигнал полиаденилирования (Whitelaw, E., et al. (1986). Nucleic Acids Research, 14(17), 7059-7070.; Pandey, N.B., & Marzluff, W.F. (1987). Molecular and Cellular Biology, 7(12), 4557-4559.; Pandey, N.B., et al. (1990). Nucleic Acids Research, 18(11), 3161-3170).
В другом подходе Lüscher et al. исследовали зависимую от клеточного цикла регуляцию гена рекомбинантного гистона H4. Получали конструкции, в которых после кодирующей последовательности H4 располагалась сигнальная последовательность структуры "стебель-петля" и сигнал полиаденилирования, два сигнала процессинга, независимо разделенные кодирующей последовательностью галактокиназы (Lüscher, B. et al., (1985). Proc. Natl. Acad. Sci. USA, 82(13), 4389-4393).
Кроме того, Stauber et al. идентифицировали минимальную последовательность, необходимую для зависимой от клеточного цикла регуляции на уровне мРНК гистона H4. Для этих исследований использовали конструкции, содержащие кодирующую последовательность селективного маркера ксантин : гуанин фосфорибозилтрансферазы (GPT), предшествующую сигнальной последовательности структуры "стебель-петля" гистонов со следующим за ней сигналом полиаденилирования (Stauber, C. et al., (1986). EMBO J, 5(12), 3297-3303).
Исследуя процессинг пре-мРНК гистонов, Wagner et al. идентифицировали факторы, необходимые для расщепления пре-мРНК гистонов, с использованием репортерной конструкции, где между сигнальной последовательностью структуры "стебель-петля" гистонов и сигналом полиаденилирования помещен EGFP так, что EGFP экспрессируется только в случае нарушения процессинга пре-мРНК гистонов (Wagner, E.J. et al., (2007). Mol Cell 28(4), 692-9).
Следует отметить, что трансляция полиаденилированной мРНК, как правило, требует, чтобы 3ʹ-последовательность поли(A) сблизилась с 5ʹ-кэпом. Это опосредовано белок-белковым взаимодействием между связывающим поли(A) белком и эукариотическим фактором инициации eIF4G. В отношении зависимых от репликации мРНК гистонов был обнаружен аналогичный механизм. Для этого случая Gallie et al. показали, что структура "стебель-петля" гистонов функционально сходна с последовательностью поли(A) в том, что увеличивает эффективность трансляции и одновременно зависит от 5ʹ-кэпа для обеспечения эффективного уровня трансляции. Они показали, что структура "стебель-петля" гистонов необходима и достаточна для усиления трансляции репортерной мРНК трансфицированных клеток яичника китайского хомяка, но для оптимального функционирования она должна находиться на 3ʹ-конце. Таким образом, подобно поли(A)-хвосту других мРНК, 3ʹ-конец этих мРНК гистонов, по-видимому, необходим для трансляции in vivo и функционально аналогичен поли(A)-хвосту (Gallie, D.R., Lewis, N.J., & Marzluff, W.F. (1996), Nucleic Acids Research, 24(10), 1954-1962).
Кроме того, можно показать, что SLBP связан с цитоплазматической мРНК гистонов и необходим для ее трансляции. Хотя SLBP не взаимодействует с eIF4G напрямую, домен, необходимый для трансляции мРНК гистонов, взаимодействует с недавно выявленным белком SLIP1. На следующей стадии, SLIP1 взаимодействует с eIF4G и обеспечивает циркуляризацию мРНК гистонов и поддержку эффективной трансляция мРНК гистонов по механизму, сходному с трансляцией полиаденилированных мРНК.
Как указано выше, в генотерапевтических подходах для переноса кодирующей информации в клетку в норме используют ДНК, которая затем транскрибируется в мРНК, несущую природные элементы мРНК, в частности, 5ʹ-кэпирующую структуру и 3ʹ-последовательность поли(A), для экспрессии кодируемого терапевтического или антигенного белка.
Однако во многих случаях экспрессирующие системы на основе введения таких нуклеиновых кислот в клетки или ткани пациента и последующей экспрессии желаемых полипептидов, кодируемых этими нуклеиновыми кислотами, не демонстрируют желаемого или даже необходимого уровня экспрессии, которым мог бы обеспечить эффективную терапию, вне зависимости от того используют ли ДНК или РНК.
В уровне техники ранее принимались различные попытки повышения выхода экспрессии кодируемого белка, в частности, используя улучшенные экспрессирующие системы, in vitro и/или in vivo. Способы повышения экспрессии, в основном описанные в уровне техники, как правило, основаны на использовании векторов экспрессии или кассет, содержащих специфические промоторы и соответствующие регуляторные элементы. Так как эти векторы экспрессии или кассеты, как правило, ограничены конкретными клеточными системами, то эти экспрессирующие системы необходимо адаптировать для использования в других клеточных системах. Затем такие адаптированные экспрессирующие векторы или кассеты, как правило, трансфицировали в клетки и, как правило, обрабатывали в зависимости от конкретной линии клеток. Таким образом, предпочтение отдают преимущественно тем молекулам нуклеиновой кислоты, которые способны экспрессировать кодируемые белки в клетке-мишени посредством систем, характерных для клетки, вне зависимости от промоторов и регуляторных элементов, которые специфичны для конкретных типов клеток. В этом контексте, можно различать стабилизирующие мРНК элементы и элементы, которые увеличивают эффективность трансляции мРНК.
мРНК с оптимизированной кодирующей последовательностью и в основном подходящие для такой цели описаны в заявке WO 02/098443 (CureVac GmbH). Например, в WO 02/098443 описаны мРНК, стабилизированные в основной форме и оптимизированные для трансляция кодирующих областей. В WO 02/098443, кроме того, описан способ определения модификаций последовательности. В WO 02/098443 дополнительно описаны возможности замены адениновых и урациловых нуклеотидов в последовательностях мРНК для повышения содержания в последовательностях гуанина/цитозина (G/C). По WO 02/098443 такие замены и адаптации с повышением содержания G/C можно использовать для генотерапевтических приложений, а также для генетических вакцин для лечения злокачественных опухолей или инфекционных заболеваний. В этом контексте, в WO 02/098443, как правило, указаны последовательности в виде основных последовательностей для таких модификаций, в которых модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который у пациента, получаемого лечение, например, не транслируется или транслируется некорректно или с дефектами. Альтернативно, в WO 02/098443 предоставлены мРНК, кодирующие антигены, например, терапевтические белки или вирусные антигены, в виде основных последовательностей для таких модификаций.
В дополнительном подходе в отношении повышения экспрессии кодируемого белка в заявке WO 2007/036366 описано положительное действие длинных последовательностей поли(A) (особенно длиннее 120 п.н.) и комбинации по меньшей мере двух 3ʹ-нетранслируемых областей гена бета-глобина на стабильность и активность трансляции мРНК.
Однако хотя во всех этих последних документах уровня техники были уже сделаны попытки получить достаточно эффективные инструменты для генотерапевтических подходов и дополнительно повысить стабильность и активность трансляции мРНК, все еще остается проблема по существу меньшей стабильности при использовании РНК-вакцин по сравнению с ДНК-вакцинами и с генотерапевтическими подходами на основе ДНК. Таким образом, в данной области существует необходимость получения улучшенных инструментов для генотерапевтических подходов или как дополнительная терапия для общепринятых способов лечения, как указано выше, которые позволят обеспечить кодируемыми белками in vivo, например, посредством дополнительно повышенной стабильности и/или активности трансляции мРНК, предпочтительно, для генной терапии.
Кроме того несмотря на общий прогресс в данной области, эффективная экспрессия кодируемого пептида или белка в бесклеточных системах, клетках или организмах (рекомбинантная экспрессия) все еще остается серьезной проблемой.
Таким образом, целью настоящего изобретения является получение дополнительных и/или альтернативных способов повышения экспрессии кодируемого белка, предпочтительно, за счет дополнительной стабилизации мРНК и/или повышения эффективности трансляции такой мРНК в отношении таких нуклеиновых кислот, которые, как известно из уровня техники, используются в генотерапии для лечения или профилактики наследственных или приобретенных заболеваний, в частности, рассмотренных в настоящем описании изобретения.
Эту задачу решают благодаря объектам, перечисленным в приложенной формуле изобретения. В частности, целью настоящего изобретения является в соответствии с первым аспектом последовательность нуклеиновой кислоты по изобретению, содержащая или кодирующая
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов и
c) последовательность поли(A) или сигнал полиаденилирования,
предпочтительно, для повышения экспрессии указанного кодируемого пептида или белка.
Альтернативно, в соответствии с настоящим изобретением во всех его аспектах и вариантах осуществления можно использовать любую подходящую последовательность структуры "стебель-петля", отличающуюся от последовательности структуры "стебель-петля" гистонов (получаемую из генов гистонов, в частности, генов гистонов семейств H1, H2A, H2B, H3 и H4).
В этом контексте особенно предпочтительно, что нуклеиновую кислоту по изобретению в соответствии с первым аспектом настоящего изобретения получают, по меньшей мере частично, посредством синтеза ДНК или РНК, предпочтительно, как описано в настоящем документе, или нуклеиновая кислота представляет собой выделенную нуклеиновую кислоту.
Настоящее изобретение основано на неожиданном обнаружении авторами настоящего изобретения, что комбинация последовательности поли(A) или сигнала полиаденилирования и по меньшей мере одной структуры "стебель-петля" гистонов, несмотря на то, что обе в природе являются альтернативными механизмами, действует синергически, так как эта комбинация повышает экспрессию белка значительно выше уровня, наблюдаемого при использовании любого из элементов отдельно. Синергическое действие комбинации поли(A) и по меньшей мере одной структуры "стебель-петля" гистонов отличают вне зависимости от порядка поли(A) и структуры "стебель-петля" гистонов и вне зависимости от длины последовательности поли(A).
Таким образом, особенно предпочтительной является последовательность нуклеиновой кислоты по изобретению, которая содержит или кодирует a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов, и c) последовательность поли(A) или последовательность полиаденилирования; предпочтительно, для повышения уровня экспрессии указанного кодируемого пептида или белка, где кодируемый белок, предпочтительно, не является гистоновым белком, в частности, не является гистоновым белком гистоновых семейств H4, H3, H2A и/или H2B или его фрагментом, производным или вариантом, сохраняющим гистоновую (гистоноподобную) функцию), а именно, возможность формирования нуклеосомы. Также кодируемый белок, как правило, не является линкерным гистоновым белком семейства гистонов H1. Как правило, молекула нуклеиновой кислоты по изобретению не содержит никаких регуляторных сигнальных последовательностей (с 5ʹ-конца и/или, особенно, с 3ʹ-конца) от гена гистона мышь, в частности, гена гистона H2A мыши, и, кроме того, наиболее предпочтительно, гена гистона H2A614 мыши. В частности, она не содержит гистон со структурой "стебель-петля" и/или сигнальную последовательность процессинга гистона со структурами "стебель-петля" из гена гистона мыши, в частности, гена гистона H2A мыши и, наиболее предпочтительно, гена гистона H2A614 мыши.
Также нуклеиновая кислота по изобретению, как правило, не содержит репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, в частности, EGFP), галактокиназу (galK) и/или маркерный или селективный белок (например, альфа-глобин, галактокиназу и ксантин:гуанинфосфорибозилтрансферазу (GPT)) или бактериальный репортерный белок, например, хлорамфеникол ацетилтрансферазу (CAT) или другие белки, устойчивые к бактериальным антибиотикам, например, происходящие из бактериального гена neo в его элементе (а).
Следует отметить, что репортерный, маркерный или селективный белок не является терапевтическим белком по настоящему изобретению. Репортерный, маркерный или селективный белок либо его ген обычно используют в качестве научно-исследовательского инструмента в бактериях, культурах клеток, животных или растениях. Указанные белки сообщают экспрессирующим их организмам (предпочтительно гетерологично) легко идентифицируемый признак, который может быть измерен или позволяет произвести отбор. Маркерные или селективные белки выполняют функцию отбора. Такие селективные, маркерные или репортерные белки обычно отсутствуют у человека или других млекопитающих, но указанные белки выделяют из других организмов, в частности, из бактерий или растений. Таким образом, белки, обладающие селективной, маркерной или репортерной функцией и выделенные из видов, отличных от млекопитающих, в частности, отличных от человека, предпочтительно, исключаются из определения “терапевтический белок” по настоящему изобретению. В частности, селективный, маркерный или репортерный белок позволяет идентифицировать трансформированные клетки при выполнении анализов in vitro при помощи флуоресцентных или других спектроскопических методов и определить устойчивость к антибиотикам. Селективные, репортерные или маркерные гены, сообщающие такие свойства трансформированным клеткам, обычно не считаются терапевтическими белками по настоящему изобретению.
В любом случае репортерные, маркерные или селективные белки обычно не выполняют какую-либо терапевтическую функцию. Если какой-либо единичный репортерный, маркерный или селективный белок тем не менее должен выполнять такую функцию (помимо репортерной, селективной или маркерной функции), то такой репортерный, маркерный или селективный белок, предпочтительно, не является ”терапевтическим белком” в значении, использованном в настоящем изобретении.
Напротив, терапевтический белок (включая его фрагменты, варианты и производные), за исключением генов гистона семейств Н1, Н2А, Н2В, Н3 и Н4 по настоящему изобретению, обычно не проявляет селективного, маркерного или репортерного действия. Если какой-либо единичный “терапевтический белок” тем не менее выполняет такую функцию (помимо своих терапевтпических функций), то такой терапевтический белок, предпочтительно, не является “селективным, маркерным или репортерным белком” в значении, использованном в настоящем изобретении.
Терапевтический белок по настоящему изобретению, который, наиболее предпочтительно, выделяют у млекопитающего, в частности, человека, не определяется как селективный, маркерный или репортерный белок.
Таким образом, предпочтительно, кодирующая область (a), кодирующая по меньшей мере один пептид или белок, является гетерологичной по меньшей мере (b) по меньшей мере одной структуре "стебель-петля" гистонов или, более широко, любой подходящей структуре "стебель-петля". Другими словами, "гетерологичный" в контексте настоящего изобретения означает, что по меньшей мере одна последовательность структуры "стебель-петля" не встречается в природе как (регуляторная) последовательность (например, как 3ʹ-UTR) конкретного гена, кодирующего (терапевтический) белок или пептид, элемента (a) нуклеиновой кислоты по изобретению. Таким образом, структура "стебель-петля" (гистонов) нуклеиновой кислоты по изобретению, предпочтительно, происходит из 3ʹ-UTR гена, отличного от гена, содержащего кодирующую область элемента (a) нуклеиновой кислоты по изобретению. Например, кодирующая область элемента (a) не кодирует гистоновый белок или его фрагмент, вариант или производное (сохраняющие функцию гистонового белка), если нуклеиновая кислота по изобретению является гетерологичной, а кодирует любой другой пептид или последовательность (того же или другого вида), который проявляет биологическое действие, предпочтительно, терапевтическую функцию, отличную от гистонового (гистоноподобного) действия, например, кодирует терапевтический белок (выполняющий терапевтическую функцию, например, в случае эндокринных нарушений, и заменяющий дефектные эндогенные белки, например, белки млекопитающего, в частности, белки человека).
В этом контексте особенно предпочтительна нуклеиновая кислота по изобретению в направлении от 5ʹ к 3ʹ, которая содержит или кодирует:
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов, необязательно без нижерасположенного элемента гистона (HDE) с 3ʹ-конца от структуры "стебель-петля" гистонов;
c) последовательность поли(A) или сигнал полиаденилирования.
Термин "нижерасположенный элемент гистона (HDE)" относится к полинуклеотидному участку, богатому пуринами, длиной приблизительно от 15 до 20 нуклеотидов с 3ʹ-конца от природных структур "стебель-петля" гистонов, который представляет собой участок связывания мяРНК U7, вовлеченной в процессинг пре-мРНК гистонов в зрелую мРНК гистонов. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90).
Кроме того, предпочтительно, чтобы нуклеиновая кислота по настоящему изобретению в первом аспекте не содержала интрон.
В другом конкретном предпочтительном варианте осуществления последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения в направлении от 5ʹ-конца к 3ʹ-концу содержит или кодирует:
a) кодирующую область, предпочтительно, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) последовательность поли(A) и
c) по меньшей мере одну структуру "стебель-петля" гистонов.
Последовательность нуклеиновой кислоты по изобретению по первому варианту осуществления настоящего изобретения содержит любую подходящую нуклеиновую кислоту, например, выбранную из любой (одноцепочечной или двухцепочечной) ДНК, предпочтительно, без ограничения ими, например, из геномной ДНК, плазмидной ДНК, одноцепочечных молекул ДНК, двухцепочечных молекул ДНК, или ее можно выбирать, например, из любых ПНК (пептидные нуклеиновые кислоты), или ее можно выбирать, например, из любой (одноцепочечной или двухцепочечной) РНК, предпочтительно, матричной РНК (мРНК); и т.д. Также последовательность нуклеиновой кислоты по изобретению может содержать вирусную РНК (вРНК). Однако последовательность нуклеиновой кислоты по изобретению может не быть вирусной РНК или может не содержать вирусной РНК. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не содержать элементов вирусных последовательностей, например, вирусных энхансеров, или вирусных промоторов (например, не содержать инактивированного вирусного промотора или элементов последовательностей, более конкретно, не инактивированных посредством стратегий замен), или других элементов вирусных последовательностей, или последовательностей нуклеиновых кислот вирусов или ретровирусов. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не быть ретровирусным или вирусным вектором или модифицированным ретровирусным или вирусным вектором.
В любом случае, последовательность нуклеиновой кислоты по изобретению может содержать или не содержать энхансерную и/или промоторную последовательности, которые могут быть модифицированными или нет или которые могут быть активированными или нет. Энхансер и/или промотор могут быть экспрессируемыми или неэкспрессируемыми у растений, и/или экспрессируемыми или неэкспрессируемыми у эукариот, и/или экспрессируемыми или неэкспрессируемыми у прокариот. Последовательность нуклеиновой кислоты по изобретению может содержать последовательность, кодирующую (самосплайсируемый) рибозим, или нет.
В конкретных вариантах осуществления последовательность нуклеиновой кислоты по изобретению может представлять собой или может содержать самореплицирующуюся РНК (репликон).
Предпочтительно, последовательность нуклеиновой кислоты по изобретению представляет собой плазмидную ДНК или РНК, в частности, мРНК.
В конкретных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению представляет собой последовательность нуклеиновой кислоты, содержащуюся в нуклеиновой кислоте, подходящей для транскрипции in vitro, в частности, в подходящем векторе для транскрипции in vitro (например, в плазмиде или в линейной последовательности нуклеиновой кислоты, содержащей специфические промоторы для транскрипции in vitro, такие как промоторы T3, T7 или Sp6).
В дополнительных конкретных предпочтительных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению содержится в нуклеиновой кислоте, подходящей для транскрипции и/или трансляции в экспрессирующей системе (например, в экспрессирующих векторе или плазмиде), в частности, в прокариотической (например, бактерии, такие как E. coli) или эукариотической (например, клетки млекопитающих, такие как клетки CHO, дрожжевые клетки или клетки насекомых, или целые организмы, такие как растения или животные) экспрессирующей системе.
Термин "экспрессирующая система" означает систему (культуру клеток или целые организмы), которая подходит для продукции пептидов, белков или РНК, особенно мРНК (рекомбинантная экспрессия).
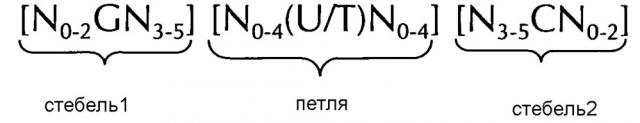
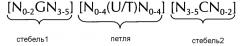
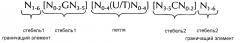
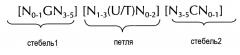
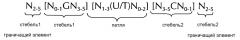
Последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения содержит или кодирует по меньшей мере одну структуру "стебель-петля" гистонов. Вообще, структура "стебель-петля" (вне зависимости от того, является ли она структурой "стебель-петля" гистонов или нет) может встречаться в одноцепочечной ДНК или, более часто, в РНК. Структура также известна как шпилька или петля шпильки и, как правило, состоит из стебля и (концевой) петли в пределах непрерывной последовательности, где стебель формируется двумя соседними полностью или частично обратно комплементарными последовательностями, разделенными короткой последовательностью в качестве своего рода спейсера, который формирует петлю структуры "стебель-петля". Две соседних полностью или частично обратно комплементарных последовательности можно определять, например, как элементы структуры "стебля-петли" стебель1 и стебель2. Структура "стебель-петля" формируется, когда эти две соседних полностью или частично обратно комплементарных последовательности, например, элементы структуры "стебель-петля" стебель1 и стебель2, формируют пары оснований друг с другом, что приводит к образованию участка двухцепочечной последовательности нуклеиновой кислоты, содержащего на своем конце неспаренную петлю, сформированную короткой последовательностью, расположенной между элементами структуры "стебель-петля" стебель1 и стебель2 на непрерывной последовательности. Таким образом, неспаренная петля, как правило, представляет собой область нуклеиновой кислоты, которая не способна к спариванию оснований ни с каким из этих элементов структуры "стебель-петля". Полученная в результате структура в форме леденца на палочке представляет собой ключевой структурный элемент многих вторичных структур РНК. таким образом формирование структуры "стебель-петля" зависит от стабильности образующихся областей стебля и петли, где первым необходимым условием, как правило, является присутствие последовательностей, которая может загибаться сама на себя с формированием спаренной двойной цепи. Стабильность спаренных элементов структуры "стебель-петля" определяется длиной, количеством содержащихся в ней несоответствий или выпетливаний (небольшое количество несоответствий, как правило, допустимо, особенно в большом двухцепочечном участке) и составом оснований спаренной области. В контексте настоящего изобретения, допустима длина петли от 3 до 15 оснований, хотя более предпочтительная длина петли составляет 3-10 оснований, более предпочтительно, от 3 до 8, от 3 до 7, от 3 до 6 или, еще более предпочтительно, от 4 до 5 оснований, и наиболее предпочтительно, 4 основания. Длина последовательности стебля, формирующей двухцепочечную структуру, как правило, составляет от 5 до 10 оснований, более предпочтительно, от 5 до 8 оснований.
В контексте настоящего изобретения, структура "стебель-петля" гистонов, как правило, происходит из генов гистонов (например, гены семейств гистонов H1, H2A, H2B, H3, H4) и содержит внутримолекулярное спаривание оснований двух соседних полностью или частично обратно комплементарных последовательностей, таким образом, формируя структуру "стебель-петля". Как правило, 3ʹ-UTR структура "стебель-петля" гистонов представляет собой элемент РНК, вовлеченн