Способ приготовления гетерогенного биокатализатора на основе бактериальных клеток, агрегированных с углеродными нанотрубками
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен способ приготовления гетерогенного биокатализатора. Способ включает выращивание обладающих нитрил- и амидгидролизующей активностью клеток бактерий в жидкой минеральной среде до стационарной фазы, смешивание клеток бактерий путём осаждения с помощью центрифугирования, отмывание калий-фосфатным буфером, повторное центрифугирование, ресуспендирование в калий-фосфатном буфере и инкубирование с многослойными углеродными нанотрубками на шейкере. После инкубирования суспензию с несвязавшимися клетками бактерий отделяют путем фильтрования от агрегатов бактерий с многослойными углеродными нанотрубками. Изобретение обеспечивает сохранение ферментативной активности, легкость отделения биокатализатора от реакционной среды, содержащей продукт реакции, а также возможность повторного использования. 4 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к биотехнологии и касается способа приготовления гетерогенного биокатализатора, который представляет собой клетки бактерий, способные к ферментативной трансформации органических соединений, агрегированные с многослойными углеродными нанотрубками (МУНТ).
Углеродные нанотрубки обладают уникальными свойствами, такими как высокая удельная поверхность, необычные магнитные свойства, рекордная упругость и сверхпроводимость, и находят применение в различных областях хозяйственной деятельности человека - электронике, механике, энергетике.
Наиболее близким по технической сущности к предлагаемому решению аналогом является метод удаления бактерий вида Escherichia coli из водной среды [1], принятый за прототип. Метод извлечения бактерий Е. coli из водной среды включает этап внесения функционализированных многостенных углеродных нанотрубок в водную среду, содержащую бактерии. Концентрация многостенных углеродных нанотрубок, функционализированных додециламином, составляет от 0,007 до 0,2 г на 100 мл воды. Данное изобретение относится главным образом к методам обработки воды или водного раствора, заключающимся в удалении из него бактерий.
Также близким по технической сущности к предлагаемому решению аналогом является метод удаления бактерий вида Escherichia coli из водной среды [2]. Метод заключается в смешивании многослойных углеродных нанотрубок в концентрации 0,002 г на 100 мл воды, содержащей бактерии. Многостенные углеродные нанотрубки имеют антибактериальный эффект по отношению к Е. coli. Для усиления антибактериального эффекта углеродные нанотрубки могут быть обработаны коротковолновым облучением, вызывающим нагревание и дальнейшую гибель бактерий. Для усиления антимикробного эффекта углеродные нанотрубки могут быть функционализированы карбоксильными, фенольными, С 18 группами или импрегнированы наночастицами серебра.
Предлагаемый нами способ обеспечивает достижение противоположной цели - бактерии в агрегатах с многостенными углеродными нанотрубками остаются жизнеспособными и каталитически активными и могут быть использованы в качестве гетерогенного биокатализатора трансформаций органических веществ, после чего извлечены из реакционной среды, отделены от продукта биокаталитической реакции путем фильтрования через крупнопористые фильтры, которые не могут задерживать суспендированные бактерии, и использованы повторно.
Известен способ увеличения стабильности белков, иммобилизованных на наночастицах [3]. Наноматериалы, такие как одностенные углеродные нанотрубки, могут значительно увеличивать стабильность ферментов в результате подавления белок-белковых взаимодействий. Конъюгаты протеин-наночастица представляют собой высокоселективные, активные и стабильные каталитические материалы.
Предлагаемый нами метод позволяет использовать в качестве гетерогенного биокатализатора агрегированную с углеродными нанотрубками целую микробную клетку без процедуры выделения внутриклеточных ферментов.
Известен метод присоединения нанотрубок к одноклеточным организмам [4], таким как бактерии и планктон, который заключается в помещении микроорганизмов в сосуд с питательным агаром и нанотрубками, последующим перемешивании, в результате которого достигается проникновение нанотрубок через клеточную стенку бактерий и выработка мутаций устойчивости к нанотрубкам. Затем такие бактерии используются для лечения рака.
Предлагаемый нами способ не предполагает обработку клеток бактерий нанотрубками с целью выработки мутаций, бактерии остаются жизнеспособными в присутствии многослойных углеродных нанотрубок и могут быть использованы как биокатализаторы трансформации органических веществ.
Способ получения гетерогенного биокатализатора путем агрегации клеток бактерий, обладающих способностью к трансформации органических веществ, с многослойными углеродными нанотрубками имеет преимущество перед способом получения иммобилизованного биокатализатора для синтеза водных растворов амидов путем иммобилизации клеток на углеродных носителях - активных углях из растительного и полимерного сырья тем, что максимальное количество клеток, иммобилизованное путем контакта бактериальной суспензии с активными углями не превышает 16 мг (по сухому весу) на 1 г носителя; путем центрифугирования с носителем - 78 мг сухих клеток/г [5]. При реализации заявленного способа получения гетерогенного биокатализатора очищенные многослойные углеродные нанотрубки (1 г) связывают в агрегаты до 200 мг клеток (по сухому весу), неочищенные - до 440 мг сухих клеток/г. Преимуществом заявленного метода в данном случае является возможность уменьшения объема реактора за счет снижения некаталитических масс в реакционной среде. При этом сохраняется преимущество иммобилизованных клеток перед суспендированными, а именно легкость отделения биокатализатора от реакционной среды, содержащей продукт ферментативной трансформации, путем фильтрования через крупнопористые фильтры, пропускающие единичные бактериальные клетки в суспензии.
Известен способ приготовления биокатализатора и способ получения инвертного сиропа с использованием такого биокатализатора [6]. Биокатализатор готовят путем смешения ферментативно-активной биомассы - автолизатов дрожжей с носителем - гидрогелем диоксида кремния и наноуглеродным компонентом в соотношении в мас. % по сухим веществам: автолизаты дрожжей 30-50, наноуглеродный компонент 5-15, диоксид кремния - до 100%, с последующим высушиванием при температуре не выше 50°С, прессованием и фракционированием до размера гранул 0.1-4 мм. Наноуглеродный компонент может иметь структуру углеродных нанотрубок. Заявленный способ отличается тем, что каталитически активные жизнеспособные клетки бактерий смешивают с многослойными углеродными нанотрубками без дополнительных связующих компонентов в водной среде и отделяют от несвязавшихся клеток путем фильтрования.
Технической задачей настоящего изобретения является получение биокатализатора синтеза органических веществ на основе бактериальных клеток, обладающего преимуществами иммобилизованных клеток, среди которых сохранение ферментативной активности, легкость отделения биокатализатора от реакционной среды, содержащей продукт реакции, возможность повторного использования.
Решение поставленной задачи осуществляется смешиванием многослойных углеродных нанотрубок с водной суспензией бактерий, обладающих способностью к трансформации органических веществ, последующим отделением агрегатов бактерий с нанотрубками от несвязавшихся клеток и использовании гетерогенного биокатализатора в процессе синтеза органических веществ.
Способ поясняется следующими примерами
Пример 1. Приготовление и очистка многослойных углеродных нанотрубок
Многослойные углеродные нанотрубки синтезировали осаждением из газовой фазы природного газа (содержание метана по объему около 97%). Осаждение МУНТ проводили на катализаторе, содержащем оксид магния, оксид никеля, оксид кобальта и частицы металлического сплава никеля и кобальта. Неочищенные МУНТ содержали 83,0% С, 16,6% MgO, 0,3% Со, 0,1% Ni.
Образцы МУНТ очищали посредством травления в 20% растворе азотной кислоты при кипячении в течение 2 часов. После охлаждения раствор промывали дистиллированной водой до нейтральной реакции промывных вод (рН 6,5-7,0) и сушили при 180°С в течение 4 часов. Очищенные МУНТ содержали 99,3% С, на остальную долю. приходился химически связанный кислород и остаточные примеси Со и Ni (менее 0,1%). МУНТ обладали следующими характеристиками: внешний диаметр 5-35 нм, внутренний диаметр 3-14 нм, длина не менее 2 мкм, удельная поверхность, измеренная по методу БЭТ, не менее 400 м2/г. Характеристика МУНТ представлена в таблице 1.
Пример 2. Агрегация бактерий с очищенными и неочищенными многослойными углеродными нанотрубками
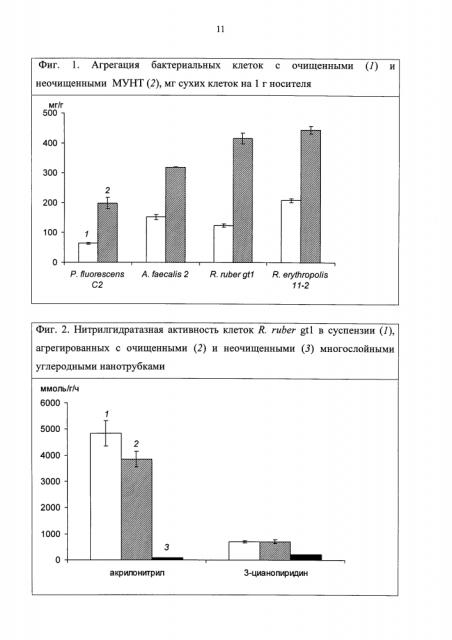
Штаммы нитрилгидролизующих бактерий: Rhodococcus ruber gt1, обладающий нитрилгидратазной активностью, R. erythropolis 11-2 и Alcaligenes faecalis 2, содержащие амидазу, и Pseudomonas fluorescens С2, обладающий нитрилазой активностью, выращивали до стационарной фазы в жидкой минеральной среде на шейкере со скоростью вращения платформы 90-150 об/мин. Источниками азота (г/л) для R. ruber gt1 являлся хлорид аммония (0,3); для P. fluorescens С2 и R. erythropolis 11-2 - ацетонитрил (3,9 и 0,39 соответственно), источниками углерода для всех перечисленных штаммов являлась глюкоза в концентрации 1,0 г/л. Для A. faecalis 2 источником и углерода, и азота являлся 0,1 М ацетамид.
Клетки осаждали центрифугированием при 10000 g в течение 20 мин, однократно отмывали калий-фосфатным буфером (рН 7,2±0,2), центрифугировали повторно при тех же параметрах, ресуспендировали в 10-100 мл калий-фосфатного буфера и инкубировали с 0,05-0,5 г очищенных или 0,025-0,25 г неочищенных МУНТ в течение 2 ч при 22°С на шейкере со скоростью вращения платформы 150 об/мин, затем суспензию, содержащую несвязавшиеся клетки, отфильтровывали через бумажный фильтр «красная лента». Количество связанных клеток определяли по формуле:
А=m V (ОДисх-ОДфильтр)/ОДисх,
где ОДисх - оптическая плотность суспензии клеток до адсорбции, измеренная при длине волны 540 нм; ОДфильтр - оптическая плотность фильтрата после адсорбции клеток; m - концентрация клеток в суспензии до адсорбции, мг/мл, V - объем суспензии.
Контакт МУНТ с нерастущими клетками R. ruber gt1, R. erythropolis 11-2, A. faecalis 2 и P. fluorescens C2 приводил к образованию клеточных агрегатов, покрытых нанотрубками.
Величина связывания клеток с неочищенными нанотрубками достигала 415-440 мг сухой биомассы на 1 г носителя, очищенными углеродными нанотрубками - 50-200 мг/г (Фиг. 1).
Пример 3. Трансформация алифатических и ароматических нитрилов и амидов клетками нитрилгидролизующих бактерий, агрегированными с многослойными углеродными нанотрубками
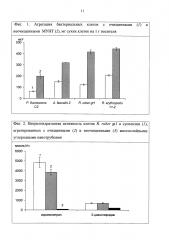
Для определения нитрилгидратазной активности суспендированных и агрегированных с МУНТ клеток R. ruber gt1 проводили реакцию трансформации 0,6 М раствора акрилонитрила и 0,2 М раствора 3-цианопиридина в калий-фосфатном буфере (рН 7,2±0.2) при температуре 30°С, пробы отбирали через 10, 30 и 120 мин реакции, реакцию с акрилонитрилом в качестве субстрата останавливали концентрированной HCl до конечной концентрации 2%, реакцию с 3-цианопиридином останавливали быстрым замораживанием пробы при -18°С.
Для определения амидазной активности суспендированных и агрегированных с МУНТ клеток R. erythropolis 11-2 и A. faecalis 2 проводили реакцию трансформации 0,1 М раствора акриламида в условиях, как описано выше, пробы отбирали через 30 и 120 мин и останавливали реакцию концентрированной HCl до конечной концентрации 2%.
При трансформации акрилонитрила до акриламида у клеток R. ruber gt1, агрегированных с очищенными МУНТ, сохраняется 80% нитрилгидратазной активности клеток в суспензии, тогда как у клеток, агрегированных с неочищенными МУНТ, активность составляет не более 2% от исходной (Фиг. 2). При конверсии 3-цианопиридина до никотинамида агрегаты клеток R. ruber gt1 с очищенными МУНТ проявляют активность, равную активности суспензии, а при связывании с неочищенными МУНТ сохраняется 33% первоначальной активности интактных клеток.
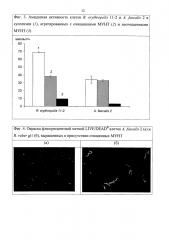
При трансформации раствора акриламида до акриловой кислоты штаммами R. erythropolis 11-2 и A. faecalis 2, обладающими амидазной активностью, у R. erythropolis 11-2 наблюдается сохраняется 55% ферментативной активности при связывании с очищенными МУНТ и 14% при агрегации с неочищенными МУНТ. У A. fatcalis 2 активность агрегатов клеток с очищенными МУНТ достигает активности интактных клеток, а с неочищенными нанотрубками снижается в 10 раз (Фиг. 3).
Пример 4. Многократное использование гетерогенного биокатализатора на основе бактериальных клеток, агрегированных с МУНТ
Операционную стабильность агрегатов МУНТ с клетками R. ruber gt1 и R. erythropolis 11-2 определяли по сохранению ферментативной активности при проведении последовательных циклов 20-минутной трансформации 0,6 М раствора акрилонитрила и 24-часовой трансформации 0,2 М раствора акриламида соответственно. Реакцию проводили в 0,01 М калий-фосфатном буфере (рН 7,2±0,2) при 22°С, останавливали в пробе концентрированной HCl до конечной концентрации 5%, центрифугировали 15 мин при 10500 g, и определяли концентрацию продуктов методом ВЭЖХ. МУНТ с клетками отфильтровывали через фильтр "красная лента", промывали калий-фосфатным буфером (рН 7,2±0,2) и использовали в следующем цикле. У агрегатов R. ruber gt1/МУНТ сохраняется 50% активности на протяжении 6 последовательных циклов реакции, причем на протяжении первых 4 циклов активность агрегатов значимо превышает таковую интактных клеток. Амидазная активность агрегатов и суспендированных клеток R. erythropolis 11-2 теряется уже к 3 циклу, хотя во втором цикле активность агрегатов выше таковой свободных клеток на 60% (Фиг. 4).
Пример 5. Жизнеспособность клеток R. ruber gt1 и A. faecalis 2 при росте в присутствии многослойных углеродных нанотрубок
R. ruber gt1 и A. faecalis 2 выращивали в 50 мл жидкой минеральной среды при добавлении 100 мг очищенных и неочищенных многослойных углеродных нанотрубок. Количество колониеобразующих единиц (КОЕ) в 1 мл было подсчитано при высеве из 3-х суточной суспензии на полноценную агаризованную среду LB (Луриа-Бертани). Степень очистки нанотрубок не влияла на количество КОЕ A. faecalis 2, которое составило 1.6×1010 в мл суспензии. У R. ruber gt1 было отмечено снижение количества КОЕ/мл в присутствии неочищенных нанотрубок - оно составляло 1.2×106 против 1.4×108 при росте в среде с очищенными МУНТ. При окраске клеток бактерий, выращенных в присутствии МУНТ, флюоресцентным красителем LIVE/DEAD® (Syto 9/пропидиум иодид) BacLightTM Bacterial Viability Kits ("Invitrogen", США) и визуализации в световом микроскопе с флюоресценцией было обнаружено, что 100% клеток окрашены в зеленый цвет, т.е. жизнеспособны (Фиг. 5). Зеленая окраска предполагает ненарушенную цитоплазматическую мембрану, красная - нарушение цитоплазматической мембраны и жизнеспособности клетки.
| ТаблицаХарактеристика МУНТ | |
| Характеристика | Значение |
| Внешний диаметр трубок, нм | 5–35 |
| Внутренний диаметр, нм | 3–14 |
| Длина, мкм, не менее | 2 |
| Массовая доля углерода, %, не менее | 99 |
| Удельная поверхность, м2/г, по методу БЭТ, не менее | 400 |
Используемые источники
1. Патент US 8754041 B2, Muataz Ali Atieh; Amjad Bajes Khalil; Tahar Laoui; Samer Mohammed Al-Hakami. Method of removing E.coli bacteria from an aqueous solution.
2. Патент US 20120213663 A1, Muataz Ali Atieh; Amjad Bajes Khalil; Tahar Laoui; Samer Mohammed Al-Hakami. Method of removing E.coli bacteria from an aqueous solution.
3. Патент WO 2007/001355 A2, Dordick Jonathan S.; Kane Ravindra S.; Asuri Prashanth; Karajanagi Sandeep S. Enhanced stability of proteins immobilized on nanoparticles.
4. Патент US 20060024810 A1, Surendra Khadkikar; Erach Irani. Method of atttaching nanotubes to bacteria and applications.
5. Патент RU 2352635 С2, Максимов А.Ю., Демаков В.А., Максимова Ю.Г., Олонцев В.Ф. Способ получения иммобилизованного биокатализатора и способ получения водных растворов амидов с использованием этого биокатализатора.
6. Патент RU 2451546 C1, Коваленко Г.А., Перминова Л.В., Мосеенков С.И., Кузнецов В.Л. Биокатализатор, способ его приготовления и способ получения инвертного сиропа с использованием этого катализатора.
Способ приготовления гетерогенного биокатализатора, отличающийся тем, что осуществляют выращивание клеток бактерий, обладающих нитрил- и амидгидролизующей активностью, в жидкой минеральной среде до стационарной фазы, затем осуществляют смешивание клеток бактерий путем осаждения с помощью центрифугирования, отмыванием калий-фосфатным буфером, повторным центрифугированием, ресуспендированием в калий-фосфатном буфере и инкубированием с многослойными углеродными нанотрубками на шейкере, после чего суспензию, содержащую несвязавшиеся клетки бактерий, отделяют путем фильтрования от агрегатов бактерий с многослойными углеродными нанотрубками.