Замещенные 3-(3-пиридил)изоксазолидины, обладающие фунгицидной активностью
Иллюстрации
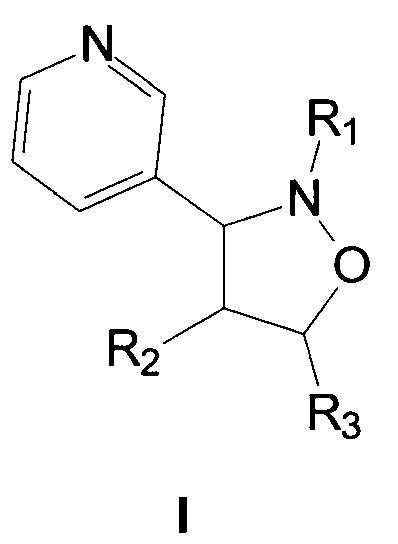
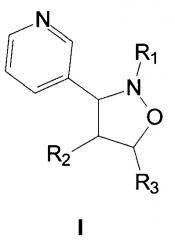
Показать всеИзобретение относится к замещенным 3-(3-пиридил)изоксазолидинам общей формулы I, где R1 означает фенил или 4-хлорфенил, R2 означает атом водорода или 4-фторфенил, R3 означает карбэтокси-группу. Технический результат – 3-(3-пиридил)изоксазолидины, обладающие фунгицидной активностью. 3 табл., 3 пр.
.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 3-(3-пиридил)изоксазолидинам общей формулы I, где R1 означает фенил или 4-хлорфенил, R2 означает атом водорода или 4-фторфенил, R3 означает карбэтокси-группу.
3-(3-Пиридил)изоксазолидины общей формулы I могут найти применение для борьбы с вредоносными грибами в медицине, ветеринарии, сельском хозяйстве, строительстве.
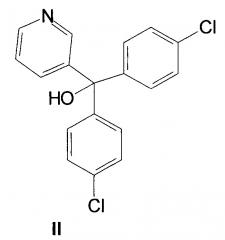
Известно соединение паринол формулы II [Заявка 3126819 ФРГ, 1983], обладающее фунгицидной активностью.
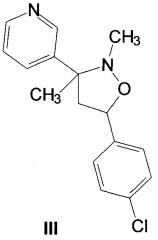
Известно вещество SYP-Z048 (III), обладающее фунгицидной активностью. [China's fungicides with self-dominated property right // Fungicides China News. 2009. V. 2. Is. 6. P. 1-2].
2
Однако соединения структур II и III имеют ряд недостатков, таких как не всегда удовлетворительные физико-химические характеристики или недостаточную фунгицидную активность в отношении отдельных классов грибов. Кроме того, к фунгицидам у грибов часто развивается устойчивость.
Наиболее близкими по химической структуре к предлагаемым соединениям являются известные производные оказолидинов IV, где R1 означает водород, алкил или акилен, R2 означает водород, алкил, циано-, алкокси-группу, галогенметил, фенил, бензил и др., R3 означает водород или алкил, R4 означает водород, алкил, циано-группу и др., X означает водород, метил, алкокси-, циано-группу, галоген и др., n=0-3, активные против мучнистой росы ячменя Erysiphe graminis [пат. GB 1540580, 1979, & пат. SU 621301, 1978].
Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов, активных против иных патогенов, кроме Erysiphe graminis, на иных видах растений, кроме ячменя.
Поставленная задача решается получением 3-(3-пиридил)изоксазолидинов общей формулы I, обладающих фунгицидной активностью против парши яблони Venturia inaequalis (Ascomycota, Pleosporales) черной парши картофеля Rhizoctonia solani (Basidiomycota, Cantarellalis), фузариозной корневой гнили зерновых и бобовых Fuzarium oxysporum (Ascomycota, Hypocreales), белой гнили моркови и подсолнечника Sclerotinia sclerotiorum (Ascomycota, Helotiales), гельминтоспориозной корневой гнили злаков Helminthosporium sativum (Fungi imperfecti, Hyphomycetales), фузариозной стеблевой гнили кукурузы Fuzarium moniliforme (Ascomycota, Hypocreales).
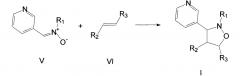
3-(3-Пиридил)изоксазолидины общей формулы I могут быть получены взаимодействием N-(3-пиридилметилен)анилиноксидов общей формулы V, где R1 имеет те же значения, что и в формуле I, с (не)замещенными акрилатами общей формулы VI, где R2 и R3 имеют те же значения, что и в формуле I:
3
Аналогичные реакции описаны в литературе [А.В. Просяник, А.И Мищенко. Производные 2-алкилизоксазолидин-3-карбоновых кислот // Химия гетероцикл. соед., 1979, №5, с 599-603].
Соединения общей формулы V могут быть получены взаимодействием фенилгидроксиламинов общей формулы VII, где R1 имеет те же значения, что и в формуле I, и 3-пиридинкарбальдегида:
Аналогичные реакции описаны в литературе [А.Д. Николаева, B.C. Приходько // О некоторых свойствах алифатических нитронов. Журн. орг. химии, 1972, Т. 8, с. 194-205]. Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. 0,37 г (0,0034 моль) 3-пиридинкарбальдегида и 0,38 г (0,034 моль) N-фенилгидроксиламина растворяют в 3 мл этанола и выдерживают при комнатной температуре в течение 7 ч. Реакционную массу разбавляют водой до появления молочно-белой окраски, нагревают до образования прозрачного раствора и оставляют на ночь при 0°C. Выпавшие кристаллы отфильтровывают и перекристаллизовывают из этанола. Получают 0,64 г (95%) N-(3-пиридилметилен)анилиноксида, т.пл. 115-117°C.
Пример 2. Смесь 0,35 г (0,002 моль) N-(3-пиридилметилен)анилиноксида, 0,388 г (0,002 моль) этил-4-фторциннамата и 10 мл толуола кипятят с обратным холодильником в течение 20 ч. Растворитель отгоняют. Получают 0,26 г этил-3-(3-пиридил)-2-фенил-4-(4-фторфенил)изоксазолидин-5-кабоксилата в виде светло-желтого масла.
Выходы и температуры плавления 3-(3-пиридил)изоксазолидинов общей формулы I представлены в табл.1, их ЯМР 1Н-спектры - в табл. 2.
ЯМР 1Н-спектры зарегистрированы на приборе Bruker АМ300 в DMSO-d6.
Пример 3. Испытания на фунгицидную активность соединений проводили in vitro на грибах Venturia inaequalis (V.i.), Rhizoctonia solani (R.s.), Fuzarium oxysporum (F.o.), Sclerotinia sclerotiorum (S.s.), Helminthosporium sativum (H.s.), Fuzarium moniliforme (F.m.) при концентрации активного компонента 30 мг/л. В качестве питательной среды использовали сахарозно-картофельный агар. Инокулированные среды выдерживали в термостате при 25°C в течение 3 суток. Активность соединений определяли как процент подавления роста мицелия гриба по отношению к контролю. В качестве эталона использовали коммерческий фунгицид триадимефон. Фунгицидная активность замещенных анилидов никотиновой кислоты общей формулы I приведена в табл. 3.
Замещенные 3-(3-пиридил)изоксазолидины общей формулы I, где R1 означает фенил или 4-хлорфенил, R2 означает атом водорода или 4-фторфенил, R3 означает карбэтокси-группу
.