Комплексное соединение 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой, проявляющее антидотную активность, и способ его получения
Иллюстрации
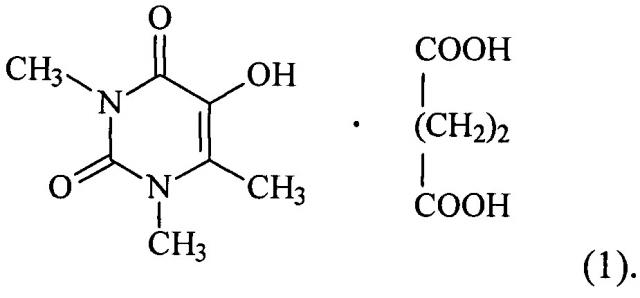
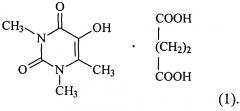
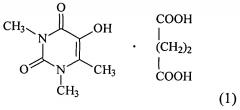
Показать всеИзобретение относится к новому комплексному соединению 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой формулы
Соединение обладает антидотной активностью в условиях воздействия токсических доз яда - метгемоглобинообразователя. Соединение получают путем смешения янтарной кислоты и 5-гидрокси-1,3,6-триметилурацила в эквимолекулярном количестве в органическом растворителе при нагревании реакционной смеси. Предпочтительно процесс проводят при температуре до 40°C с последующим охлаждением и фильтрацией выпавших кристаллов. Соединение получают с 90%-ным выходом. 2 н. и 2 з.п. ф-лы, 5 табл., 3 пр.
Реферат
Группа изобретений относится к органической химии, конкретно к новому комплексному соединению 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой, проявляющему антидотную активность, и способу его получения.
Наиболее близким аналогом изобретения является препарат, обладающий антитоксической активностью и содержащий комплексное соединение производного метилурацила с органической кислотой, который может использоваться в качестве антидота при отравлении нитритами и нитратами. Препарат представляет собой комплексное соединение 5-гидрокси-6-метилурацила с аскорбиновой кислотой (5-гидрокси-6-метилурацил аскорбат). Способ получения препарата заключается во взаимодействии 5-гидрокси-6-метилурацила и аскорбиновой кислоты, взятых в мольном соотношении аскорбиновая кислота : 5-гидрокси-6-метилурацил, равном 1:(0,0015-0,0022), в воде в качестве растворителя при температуре 20-40°С в течение 30-60 минут. Удаление воды из реакционной смеси проводят при пониженном давлении [патент №2533423, 2014 г.].
Единая задача, на решение которой направлена заявляемая группа изобретений, заключается в расширении арсенала биологически активных веществ.
Технический результат при использовании группы изобретений - повышение антидотной активности, уменьшение токсичности.
Указанный технический результат по объекту вещество достигается комплексным соединением 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой формулы:
При этом комплексное соединение проявляет антидотную активность.
Указанный технический результат по объекту способ достигается тем, что 5-гидрокси-1,3,6-триметилурацил смешивают с янтарной кислотой в эквимолярном количестве в органическом растворителе при нагревании с выделением полученного продукта. При этом взаимодействие реагентов проводят при температуре 40°С в течение 2-3 часов, а выделяют продукт после охлаждения путем фильтрации.
Комплексное соединение 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой (1) получают путем смешивания эквимолярных количеств 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой в органическом растворителе с последующим нагреванием реакционной смеси в течение 2-3 часов при температуре 40°С, охлаждением реакционной смеси и фильтрацией выпавших кристаллов. Выход целевого продукта составляет 90%.
Острая токсичность соединения (1) при однократном введении в желудок и внутрибрюшинно определена на мышах-самцах массой 20±3 г. Соединение (1) в интервале доз от 5000 до 8000 мг/кг при введении в желудок не вызывает гибели животных в течение 14 суток наблюдения. ЛД50 соединения (1), рассчитанная по методу Литчфилда-Уилкоксона, равна 6500 (5745÷7255) мг/кг. В соответствии с ГОСТом 12.1.007-76 соединение (1) при введении в желудок относится к малоопасным веществам [ГОСТ 12.1.007-76. Вредные вещества. Классификация и общие требования безопасности. Государственный комитет стандартов. М., 1976].
При внутрибрюшинном способе введения мышам соединения (1) доза 2500 мг/кг вызывает 50% гибель животных, что позволяет классифицировать соединение (1) как практически нетоксичное [Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов при однократном введении. Справочник. М.: Медицина, 1977. - 240 с.].
При внутрибрюшинном способе введения в организм соединение (1) в 1.54 раза менее токсично по сравнению с 5-гидрокси-1,3,6-триметилурацилом и в 3.24 раза - по сравнению с гидрохлоридом цистамина (таблица 1).
Биологическая активность соединения (1) исследована на модели отравления мышей нитритом натрия. Опыты выполнены на белых мышах-самцах массой 20±3 г, разделенных на 3 группы - контрольную и 2 опытных.
Животным контрольной группы за 1 час до отравления вводили физиологический раствор. Второй группе мышей - соединение (1) в дозах 12,5; 25; 50; 100 и 200 мг/кг, а мышам третьей группы в аналогичных дозах вводили гидрохлорид цистамина.
Результаты опытов свидетельствуют о том, что соединение (1) превосходит цистамин по широте терапевтического (защитного) действия: средне-эффективная доза (ED50) предлагаемого соединения (1), рассчитанная по методу пробит-анализа [7], равна 12,4 мг/кг, а цистамина - 34,0 мг/кг. Соответственно, широта терапевтического (защитного) действия соединения (1) равна
а цистамина
Таким образом, соединение (1) по данному критерию превосходит референтный препарат цистамин и имеет более низкую токсичность при внутрибрюшинном введении в организм.
Сущность технического решения поясняется следующими примерами.
Пример 1. Синтез соединения (1)
В 50 мл этилового спирта перемешивали 3,4 г (0,02 моль) 5-гидрокси-1,3,6-триметилурацила и 2,4 г (0,02 моль) янтарной кислоты при комнатной температуре, затем реакционную смесь нагревали при температуре 40°C в течение 2 часов в водяной бане, охлаждали. Выпавшие кристаллы отфильтровывали и получали 5,2 г (90%) комплексного соединения 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой (1) в виде бесцветных кристаллов. Тпл 178-180°C.
ИК-спектр, (ν см-1): 1660, 1648, 1672 (С=O, =N-С=O), 1648, 1616, 1552, 1528, 1504 (νa С=O), 1448-1352 (νs С=O), 2856, 2880, 2928, 3072, 3376 (ОН).
УФ-спектр (С2Н5ОН): λmax1=210,70; λmax2=291,00; λmax=254,70.
Найдено, %: С 45,00; Н 5,30; N 10,00; C11H16N2O7. Вычислено, %: С 45,83; Н 5,59; N 9,72.
Пример 2. Методика изучения антидотной активности соединения (1)
Антидотная активность соединения (1) была изучена на белых беспородных мышах-самцах массой 20±3 г на модели отравления нитритом натрия. Животные были разделены на группы - контрольную и опытные. Животным контрольной группы за 1 час до отравления внутрибрюшинно вводили физиологический раствор. Опытным мышам 2-й группы внутрибрюшинно вводили соединение (1) в дозах 12,5; 25; 50; 100 мг/кг, мышам 3-й группы вводили антидот метгемоглобинобразующих ядов - цистамин, а мышам 4 и 5 групп - соответственно комплексное соединение 6-метилурацила с янтарной кислотой и мексидол в тех же дозах по аналогичной схеме (таблица 2). Нитрит натрия вводили животным контрольной и опытной групп в дозах 130-430 мг/кг.
Защитное действие соединений оценивали по числу павших и выживших мышей в контрольной и опытной группах через 48 часов после отравления. Результаты обработаны статистически по методу пробит-анализа [Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л., 1963] и представлены в таблицах 2, 3 и 4.
Сопоставление параметров токсикометрии в группах опыт/контроль свидетельствует о значительном, более чем в 3 раза повышении выживаемости мышей, которым вводили соединение (1), в условиях смертельного отравления нитритом натрия.
Индекс защиты
Индекс гарантированной защиты (по В.Б. Прозоровскому)
Индекс гарантированной защиты по В.Б. Прозоровскому [Прозоровский В.Б. Индекс гарантированной защиты - новый показатель эффективности антидотов // Токсикологический вестник. - 1999. - №4. - С. 10-14] >1, что может свидетельствовать о высокой антидотной активности соединения (1).
Как видно из представленных в таблицах 3-4 данных, соединение (1) превосходит препарат цистамин в 1.71 раза, а комплексное соединение 6-метилурацила с янтарной кислотой и мексидол - в 1.95 и 2.28 раза соответственно.
Таким образом, соединение 1 превосходит по антидотной активности все препараты сравнения. Соединение (1) активнее цистамина также по антирадикальной активности, которая была исследована методом хемилюминесценции и оценивалась по константе К7 - скорости взаимодействия перекисных радикалов этилбензола с молекулами изучаемого соединения (таблица 5).
Пример 3. Методика определения антирадикальной активности
Антирадикальная активность соединения (1) исследована методом хемилюминесценции путем определения константы скорости взаимодействия перекисных радикалов этилбензола с молекулами изучаемого соединения (К7) [Шляпинтох В.Я., Карпухин О.Н., Постников Л.Н. Хемилюминесцентные методы исследования медленных химических процессов. - М.: Наука, 1966. - 300 с.]. К7 соединения (1) сравнивали с К7 референс-препаратами: антиоксидантом ионола, цистамином, мексидолом и янтарной кислотой. Результаты опытов представлены в таблице 5, из которых видно, что соединение (1) по антирадикальной активности превосходит рефернс-препараты - ионол, мексидол и цистамин.
Таким образом, соединение (1) обладает более высокой антидотной активностью и низкой токсичностью по сравнению с препаратами сравнения при введении в желудок и внутрибрюшинно, а также имеет более высокую антирадикальную активность.
1. Комплексное соединение 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой формулы:
2. Комплексное соединение 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой по п. 1, проявляющее антидотную активность.
3. Способ получения комплексного соединения 5-гидрокси-1,3,6-триметилурацила с янтарной кислотой по п. 1, заключающийся в том, что 5-гидрокси-1,3,6-триметилурацил смешивают с янтарной кислотой в эквимолярном количестве в органическом растворителе при нагревании с выделением полученного продукта.
4. Способ по п. 3, отличающийся тем, что взаимодействие реагентов проводят при температуре 40°С в течение 2-3 часов, а выделяют продукт после охлаждения путем фильтрации.