Фармацевтический препарат для профилактики и лечения прогрессирующей близорукости
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для профилактики и лечения прогрессирующей близорукости. Фармацевтический препарат для профилактики и лечения прогрессирующей близорукости содержит в своем составе эффективное количество первичного или вторичного амина с функциональными группами в виде соли или в составе комплексного соединения переходного металла или их смеси. При получении указанного фармацевтического препарата выполняют нейтрализацию первичного или вторичного амина с функциональными группами кислотой. Использование группы изобретений позволяет повысить эффективность профилактики и лечения прогрессирующей близорукости. 2 н. и 31 з.п. ф-лы, 5 табл., 19 пр.
Реферат
Область техники
Изобретение относится к медицине, в частности к офтальмологии, и предназначено для укрепления склеры при прогрессирующей близорукости.
Уровень техники
Прогрессирующая близорукость остается одной из самых актуальных проблем современной офтальмологии. Несмотря на определенные успехи, достигнутые в профилактике и лечении этого заболевания, последнее нередко приводит к развитию необратимых изменений глазного дна и к существенному снижению зрения в молодом трудоспособном возрасте, что становится причиной значительных ограничений в профессиональной деятельности или инвалидности по зрению (см. Либман Е.С., Рязанов Д.П., Калеева Э.В. «Инвалидность вследствие нарушения зрения в России». V Российский общенациональный офтальмологический форум. Сборник научных трудов научно-практической конференции с международным участием. М., 2012, 2, 797-798 - [1]).
В связи с этим, разработка новых эффективных способов патогенетически ориентированной терапии этого заболевания глаз является весьма актуальной научно-практической задачей.
В настоящее время установлено, что одним из ведущих патогенетических факторов возникновения и прогрессирования миопии (близорукости), сопровождающегося удлинением глазного яблока в передне-заднем направлении, является растяжение и ослабление склеральной оболочки глаза, связанное с развитием в ее соединительной ткани дистрофического процесса (см. Аветисов Э.С. «Близорукость». М., 1999, 285 с. - [2]; Иомдина Е.Н. «Биомеханические и биохимические нарушения склеры при прогрессирующей близорукости и методы их коррекции». Зрительные функции и их коррекция у детей» / Под ред. Аветисова С.Э., Кащенко Т.П., Шамшиновой A.M.. М., 2006, 163-183 - [3]; Curtin B.J. «The Myopias: Basic science and clinical managements. Harper and Row. Philadelphia. 1985 - [4]). Этот процесс проявляется в деструкции фибриллярных структур, снижении в склере по мере роста миопической рефракции уровня нерастворимого коллагена и повышении уровня его растворимых фракций, что свидетельствуют об определенной незрелости коллагеновых структур склеры и о преобладании процессов их катаболизма над процессами синтеза. Такой дисбаланс во многом связан с недостаточным образованием внутри- и межмолекулярных связей (сшивок), стабилизирующих склеральный коллаген (см. Bailey A.J. intermediate labile inter molecular cross-links in collagen fibrils». Biochim. Biophys. Acta. 1968. v. 160, 447-453 - [5]). Как известно, поперечные сшивки играют исключительно важную роль в формировании оптимальных биомеханических характеристик ткани, поэтому выявленное снижение уровня поперечной связанности коллагена склеры при прогрессирующей миопии является важнейшим фактором, приводящим к ослаблению ее опорной функции и, как следствие, к удлинению передне-задней оси глаза и прогрессированию близорукости [3].
В связи с этим были разработаны различные методы укрепления этой оболочки глаза. В частности, широкое применение получили также хирургические методы укрепления склеры, предусматривающие использование различных пластических материалов (донорских и синтетических), которые располагались вокруг глазного яблока, захватывая задний полюс глаза и осуществляя его механическую поддержку, а также частично стимулируя склеральную ткань продуктами диссоциации трансплантатов, (см. Е.П. Тарутта. «Склероукрепляющее лечение и профилактика осложнений прогрессирующей близорукости». Зрительные функции и их коррекция у детей / Под ред. С.Э. Аветисова, Т.П. Кащенко, A.M. Шамшиновой. М., 2006, 191-202 - [6]; Ward В., Tarutta Е. «The efficacy and safety of posterior pole buckles in the control of progressive high myopia». Eye, (Lond). 2009 Dec; 23(12): 2169-74 - [7]).
Недостатком существующих склероукрепляющих вмешательств является то, что клинически значимый эффект (стабилизация длины передне-задней оси глаза и рефракции) ограничивается в основном 1-2 годами, а затем (в отдаленные сроки наблюдения) прогрессирование миопии возобновляется [6]. Это обусловлено тем, что сама структура миопической склеры и после лечения остается патологически измененной, а поддерживающие свойства имплантатов со временем ослабевают.
Для укрепления ослабленной миопической склеры использовался также способ, предусматривавший введение под тенонову капсулу (фасцию) глаза на задненаружную поверхность склеры вспенивающуюся гелеобразную полимерную композицию на основе сухого компонента, жидкого водосодержащего компонента, 3%-ного раствора перекиси водорода и комплексного соединения меди и пиридоксина - дихлорид[2-метил-3-окси-4,5-ди(оксиметил)-пиридин] меди(II) (МНН - «Купир»), содержание которого в композиции составляет 0,11-0,31 вес. % (см. Патент РФ 2012336, 1987/1994. «Состав для лечения прогрессирующей близорукости». Аветисов Э.С., Винецкая М.И., Иомдина Е.Н.и др. - [8]). Полученная вспененная композиция в процессе постепенной деградации замещалась новообразованной соединительной тканью (капсулой), на поверхности склеры, в результате чего формировался новый биокомпозит «склера-соединительная ткань». Через 6 мес после введения состава с Купиром толщина сформированной капсулы составляет в среднем 146 мкм, в то время как при введении полимерной композиции без Купира - 109 мкм. При этом биомеханические свойства новообразованного комплекса «склера-соединительная ткань» изменяются незначительно и статистически недостоверно: так модуль упругости (наиболее важный параметр, свидетельствующий об эффекте склероукрепления) после введения состава с Купиром составляет 27,1±2,3 МРа, а при введении состава без Купира 25,3±1,9 МРа, т.е. увеличивается всего на 7,1%.
Кроме того, процесс вспенивания композиции может привести к невоспроизводимым результатам, а сама вспененная композиция, находящаяся под теноновой капсулой не менее 12 мес до полной резорбции, может существенно травмировать прилегающие ткани глаза.
Данное техническое решение принято за ближайший аналог.
В уровне техники отсутствуют сведения о возможности использования для склероукрепления лекарственных препаратов, вводимых неинвазивно, т.е. непосредственно в конъюнктивальный мешок глаза (например, с помощью инсталляций).
Наружная соединительная оболочка - конъюнктива, как известно, имеет хорошо развитую кровеносную и лимфатическую системы, надежно защищающие находящуюся под конъюнктивой склеру от проникновения большинства химических соединений (см. Л.В. Шильников. Энциклопедия клинических глазных болезней. 2013, Научная книга, 380 с. - [9]).
В силу этого внешние оболочки глаза - конъюнктива, а также теноновая оболочка практически непроницаемы и для большинства лекарственных препаратов, особенно, для водорастворимых полярных веществ. И лишь небольшое количество малополярных липофильных веществ, малорастворимых в воде, например, кортикостероиды способны проникать через этот защитный барьер (см. Морозов В.И., Яковлев А.А. Фармакотерапия глазных болезней: Справочник. Изд. 3-е. М.: Медицина, 1998. - 336 с. - [10]).
Поэтому к функциональным свойствам лекарственных средств, предназначенных для склероукрепления и введения путем инсталляций, помимо собственно их эффективного склероукрепляющего действия, необходимо также отнести их способность эффективно проникать через внешнюю конъюнктивальную оболочку и попадать в ткань склеры.
Сущность изобретения
Задача предлагаемого изобретения состоит в создании готового к употреблению фармацевтического препарата (далее также - препарат, лекарственный препарат), способствующего существенному и быстрому увеличению упруго-прочностных характеристик склеры при его неинвазивном введении в конъюнктивальную полость (что может использоваться при профилактики и лечения прогрессирующей близорукости), например, в форме раствора, глазного геля или глазной лекарственной пленки (далее также - ГЛП), т.е. препарата, способного проникать в склеру непосредственно через конъюнктиву и теноновую оболочку.
Еще одной задачей является создание лекарственного препарата, основные компоненты которого предпочтительно были бы продуктами природного происхождения или получены на основе таких продуктов и, соответственно, характеризовались бы минимальной иммунной реакцией организма и меньшей вероятностью побочных эффектов, нежели известные из уровня техники аналоги.
Техническими результатами от использования заявляемого решения являются:
- укрепление склеры при прогрессирующей миопии и снижение сроков такого укрепления путем активации поперечной сшивки молекул коллагена склеры, исключение травмирующих, токсических и воспалительных действий на глазное яблоко и окружающие его ткани орбиты при лечении прогрессирующей близорукости;
- удобство и неинвазивность воздействия - путем проведения обычных инстилляций, с помощью глазного геля или глазной лекарственной пленки;
- отсутствие токсических или воспалительных явлений на протяжении всего курса лечения препаратом;
- в область глазной орбиты не вводится никакое длительно находящееся там инородное тело (пеноматериал), что исключает его возможное повреждающее и раздражающее действие на глазное яблоко и окружающие его ткани орбиты.
Технические результаты достигаются за счет создания и применения фармацевтического препарата для профилактики и лечения прогрессирующей близорукости, представляющего собой водный раствор для инстилляций или глазной гель или глазную лекарственную пленку, содержащего в своем составе эффективное количество амина с функциональными группами в виде соли или в составе комплексного соединения переходного металла или их смеси.
Используемые амины с функциональными группами (далее также АФГ) в соответствии с настоящим изобретением имеют в своем составе первичные и/или вторичные и/или третичные аминогруппы, а также карбоксильные и/или гуанидиновые, и/или имидазольные, и/или гидроксильные, и/или альдегидные группы. Все эти функциональные группы, потенциально являются реакционноспособными и могут участвовать в процессах сшивки коллагеновых молекул. При этом в молекуле амина с функциональными группами, выполняющего роль сшивающего агента, таковых должно быть не менее двух.
Особым критерием в выборе этих материалов является их нетоксичность или минимальная токсичность, поэтому большинство из используемых соединений природного происхождения. В соответствии с настоящим изобретением в качестве аминов с функциональными группами могут применяться аминоспирты, аминокислоты, производные этих аминокислот, олигопептиды, полипептиды, полиамины, производные 3-гидрокси-2-метилпиридина, аминосахариды или их смесь.
В качестве аминоспиртов используются синтетические первичные амины, содержащие две и более гидроксиметильные группы, например: 2-амино-2-метил-1,3-пропандиол, трис(гидроксиметил)аминометан или их смесь.
В качестве аминокислот используются известные природные и синтетические аминокислоты, содержащие две и более аминогруппы, например: 2,4-диаминобутановую кислоту или 2,5-диаминопентановую кислоту (орнитин), или 2,6-диаминогексановую кислоту (лизин), или 2,6-диамино-5-гидроксигексановую кислоту (гидроксилизин), или 2,7-диаминогептановую кислоту, или 2,8-диаминооктановую кислоту, или 2,9-диаминононановую кислоту, или 2,10-диаминодекановую кислоту, или 2,12-диаминододекановую кислоту, или 2-амино-5-гуанидинпентановую кислоту (аргинин), 2-амино-3-(4-имидазолил)пропионовую кислоту (гистидин), или их смесь.
При этом могут быть использованы D-, L-(природные) оптические изомеры или их D,L-смесь (рацемат) указанных аминокислот.
В качестве производных приведенных выше аминокислот используются их лактамы и сложные эфиры (содержащие этерифицированные аминокислотные карбоксильные групп).
В качестве лактамов используются лактамы аминокислот, например, 2,4-диаминобутановую кислоту или 2,5-диаминопентановую кислоту (орнитин), или 2,6-диаминогексановую кислоту (лизин), или 2,6-диамино-5-гидроксигексановую кислоту (гидроксилизин), или 2,7-диаминогептановую кислоту, или 2,8-диаминооктановую кислоту, или 2,9-диаминононановую кислоту, или 2,10-диаминодекановую кислоту, или 2,12-диаминододекановую кислоту, или 2-амино-5-гуанидинпентановую кислоту (аргинин), или 2-амино-3-(4-имидазолил)пропионовую кислоту (гистидин), или их смесь.
При этом могут быть использованы лактамы D-, L-(природные) оптических изомеров или их D,L-смесь (рацемат) указанных аминокислот.
В качестве сложных эфиров, приведенных выше аминокислот, используют их этиловый эфир, пропиловый эфир, изопропиловый эфир, трет-бутиловый эфир, каприловый эфир, ундециловый эфир, лауриловый эфир, миристиловый эфир, олеиловый эфир, стеариловый эфир, эфир 1,2-пропиленгликоля, эфир 1,3-бутиленгликоля, эфир 1,4-бутиленгликоля, эфир глицерина или их смесь. При этом могут быть использованы сложные эфиры D-, L-(природные) оптических изомеров или их D,L-смесь (рацемат) указанных аминокислот.
В качестве олигопептидов используют гетеромерные олигопептиды, имеющие, по крайней мере, одно звено L-орнитина, L-лизина или L-гидроксилизина, например, дипептиды: L-аланин-L-лизин, L-аргинин-L-лизин, L-валин -L-лизин, L-гидроксилизин-L-лизин, L-гидроксипролин-L-лизин, L-гистидин-L-лизин, глицин-L-лизин, L-изолейцин-L-лизин, L-лейцин-L-лизин, L-метионин-L-лизин, L-пролин-L-лизин, L-серин-L-лизин, L-тирозин-L-лизин, L-треонин-L-лизин, L-триптофан-L-лизин, L-фенилаланин-L-лизин, L-цистеин-L-лизин, или трипептиды:L-аланин-L-гистидин- L-лизин, L-аргинин-L-гистидин-L-лизин, L-валин-L-гистидин-L-лизин, L-гидроксилизин-L-гистидин-L-лизин, L-гидроксипролин-L-гистидин- L-лизин, L-гистидин-L-гистидин-L-лизин, глицин-L-гистидин-L-лизин, L-изолейцин-L-гистидин-L-лизин, L-лейцин-L-гистидин-L-лизин, L-метионин-L-гистидин-L-лизин, L-пролин-L-гистидин-L-лизин, L-серин-L-гистидин-L-лизин, L-тирозин-L-гистидин-L-лизин, L-треонин-L-гистидин-L-лизин, L-триптофан-L-гистидин-L-лизин, L-фенилаланин-L-гистидин-L-лизин, L-цистеин-L-гистидин-L-лизин или их смесь.
В качестве полипептидов используют гомомерные соединения, полученные на основе аминокислот, содержащих две аминогруппы: поли-L-орнитин, поли-L-лизин, поли-L-гидроксилизин, поли-L-аргинин или их смесь. При этом используют соединения, имеющие молекулярную массу от 300 (соответствует димеру) до 30000.
В качестве полиаминов могут использоваться природные или модифицированные природные соединения, содержащие 2-4 основные аминогруппы или гуанидиновые группы, в частности:
- диамины или аминогуанидины: путресцин (1,4-диаминбутан), 1,4-пиперазин, 2-гидроксипутресцин, кадаверин (1,5-пентаметилендиамин), агматин [1-(4-аминобутил)гуанидин], 1,8-диаминооктан, 1,12-диаминододекан, 2,2'-(этилендиокси)бис(этиламин), 4,9-диокса-1,12-додекандиамин, 3,6,9-триокса-1,11-ундекандиамин, 4,7,10-триокса-1,13-тридекандиамин;
- спермидин и его производные: 1-метилспермидин, 2-метилспермидин, 3-метилспермидин, 8-метилспермидин, 1,1-диметил спермидин, 2,2-диметилспермидин, 3,3-диметил спермидин, 5,5-диметилспермидин, 5,8-диметилспермидин, 8,8-диметилспермидин, 2-гидроксиспермидин, гомоспермидин;
- спермин и его производные: спермин, 1-метилспермин, 6-метилспермин, 1,12-диметилспермин, 5,8-диметилспермин, 1,1,12,12-тетраметилспермин, 3,3,10,10-тетраметилспермин, норспермин, или их смесь.
В качестве производных 3-гидрокси-2-метилпиридина используются природные соединения различного строения, содержащие третичную аминогруппу, например: пиридоксин, пиридоксин-5-фосфат, пиридоксаль, пиридоксаль-5-фосфат, пиридоксамин, пиридоксамин-5-фосфат или их смесь.
В качестве аминосахаридов используют природные соединения, содержащие первичную аминогруппу, например: D-глюкозамин (хитозамин) (2-амино-2-дезокси-D-глюкоза), D-галактозамин (хондрозамин) (2-амино-2-дезокси-D-галактоза), D-маннозамин (2-амино-2-дезокси-D-манноза), D-фукозамин (2-амино-2,6-дидезокси-D-галактоза), нейраминовая кислота (5-амино-3,5-дезокси-D-глицеро-D-галактононулозоновая кислота) или их смесь.
Вышеназванные олигопептиды и полипептиды, а также полиамины из-за своей высокой эффективности могут использоваться в концентрациях меньших, чем заявляемые интервалы концентраций, приведенные ниже. Для разных типов фармацевтических препаратов эта концентрация может составлять 0,05-0,3 вес. %. Однако предпочтительно их использовать в сочетании с другими АФГ, например, с аминокислотами, так, чтобы суммарная концентрация обоих типов сшивателей находилась в заявляемом интервале.
АФГ, содержащие в своем составе основные аминогруппы и их водные растворы, имеют щелочную реакцию. Поэтому их использование возможно только в нейтрализованной форме - в виде соли или комплексного соединения с катионом переходного металла. Такого рода соль может быть получена при нейтрализации амина с функциональными группами кислотой.
В качестве кислот для нейтрализации АФГ в соответствии с настоящим изобретением используются низкомолекулярные кислоты синтетического или природного происхождения, имеющие одну или несколько кислотных групп и образующие нетоксичные или малотоксичные соли, например: неорганические - хлористоводородная, бромистоводородная, азотная, серная, фосфорная кислота или органические кислоты - уксусная, или дихлоруксусная, или пивалевая (триметилуксусная), или гликолевая, или молочная, или глутаминовая, или пироглутаминовая, или аспарагиновая кислота, или аскорбиновая, или валерьяновая, или пеларгоновая, или каприновая, или ундециловая, или лауриновая, или миристиновая, или ундециленовая, или сорбиновая, или пировиноградная кислота, или янтарная, или фумаровая, или малеиновая, или адипиновая, или пимелиновая, или себациновая, или азелаиновая кислота, или яблочная, или винная, или лимонная кислота, муциновая (галактаровая), или никотиновая (витамин РР), или салициловая, или фенилуксусная, или 2-[(2,6-дихлорфенил)амино]бензолуксусная (Диклофенак), или галловая (3,4,5-триоксибензойная кислота), или пантоевая, или пантотеновая (витамин В3), или фолиевая (витамин В9), или азиатиковая, или мадекассоновая кислота или их смесь.
Кроме низкомолекулярных кислот для нейтрализации АФГ могут использоваться полимерные кислоты: полиакриловая кислота, или сополимеры акриловой кислоты, или их смесь, причем в качестве сополимеров акриловой кислоты используют метакриловую, малеиновую, итаконовую кислоту, N-винилпирролидон или их смесь.
Указанные полимерные кислоты имеют молекулярную массу 1000-30000. Из-за такой сравнительно невысокой молекулярной массы эти полимеры могут проникать в склеру через конъюнктиву и теноновую оболочку, а также легко выводятся из организма.
Двух- и более основные низкомолекулярные кислоты, а также полимерные кислоты могут использоваться также в частично нейтрализованной форме, которую получают при их нейтрализации основанием до степени нейтрализации не более 0,5. При этом в качестве основания используются гидроксиды щелочных и щелочноземельных металлов (Na, K, Са, Mg) и амины: аммиак, первичные, вторичные, третичные органические амины или их смеси.
Известно, что в глазах с высокой миопией (в экваториальном и заднем отделах склеры, а также в сосудистой оболочке) выявлено достоверное снижение уровня цинка, меди, железа и некоторых других микроэлементов, принимающих участие в метаболизме соединительной ткани, в частности в процессе образования стабилизирующих поперечных связей в коллагеновом волокне, а также в функционировании антиокислительной защитной системы организма (см. Е.Н. Иомдина. «Биомеханика склеральной оболочки глаза при миопии: диагностика нарушений и их экспериментальная коррекция». Дисс. докт. биол. наук. М., 2000, 316 с. - [11]). Дисбаланс указанных микроэлементов, связанный с нарушением структуры склеры при миопии, является одним из существенных факторов, обусловливающих изменение биомеханических характеристик склеры, т.е. ослабление ее опорных свойств. Поэтому введение в композицию наряду с АФГ соединений переходных металлов (меди и цинка) для решения поставленной задачи укрепления ткани склеры физиологически целесообразно.
Наилучшей формой использования этих переходных металлов в соответствии с настоящим изобретением является их применение в иммобилизованном виде - в виде комплексных соединений с используемыми аминами. Указанные катионы переходных металлов взаимодействуют с основными аминами, а также с аминокислотами, давая устойчивые нейтральные комплексы (координационные соединения) (см. «Координационная химия» Скопенко В.В., Цивадзе А.Ю, Савранский Л.И., Гарновский А.Д. М.: ИКЦ «Академкнига», 2007, 487 с. - [12]).
Как известно, в комплексных соединениях центральный атом (комплексообразователь) связывает одну или несколько молекул лиганда в зависимости от координационного числа комплексообразователя и дентности лиганда (количество в нем функциональных групп - связывающих центров).
Амины с функциональными группами при взаимодействии с катионами переходных металлов обычно выступают как бидентные лиганды. В то же время, катионы Cu2+ и Zn2+ имеют координационное число 4, поэтому при взаимодействии аминов с функциональными группами они образуют устойчивые комплексные соединения с двумя молекулами этих лигандов (см. Conato С, Contino А., Maccarrone G., Magr A., Remelli М., Tabb G. Copper (II) complexes with l-lysine and l-ornithine: is the side-chain involved in the coordination. A thermodynamic and spectroscopic study. Thermochimica Acta, 362, №1, 2000, 13-23. - [13]; Н.Г. Фурманова, Ж.И. Бердалиева, T.C. Черная, В.Ф. Реснянский, Н.К. Шыйтиева, К.С. Сулайманкулов. Синтез и кристаллические структуры координационных соединений пиридоксина с сульфатами цинка и кадмия. Кристаллография. 2009, 54, №2, 255-261 - [14]).
Указанные переходные металлы - катионы Cu2+ и Zn2+ используются в составе солей со следующими анионами: хлорид, бромид, нитрат, сульфат, ацетат, гликолат, лактат или их смесь.
Все перечисленные соединения АФГ (соединения, сшивающие коллаген) - разновидности активного вещества, применяемого в составе заявленного изобретения.
Настоящее техническое решение, по существу, представляет собой альтернативные варианты форм лекарственного препарата:
- водный раствор, предназначенный для инстилляций (может содержать гелеобразователь для пролонгирования действия);
- глазной гель (содержит сшитый гелеобразователь), закладываемый за нижнее веко;
- лекарственная пленка, закладываемая за нижнее веко.
Получение заявленного препарата
Активное вещество - «соль или комплексное соединение переходного металла на основе амина с функциональными группами» (соединение АФГ) может быть получено в водной среде и применяться в виде раствора, а также может быть выделено в сухом виде при удалении используемых растворителей и в дальнейшем использоваться для приготовления соответствующих растворов.
Соединение АФГ может быть получено в среде этанола или смеси вода-этанол, предпочтительно в концентрированном виде, и применяться без выделения, например, для получения лекарственных пленок.
Следует также отметить, что некоторые соединения АФГ выпускаются в качестве готового реактива.
Кроме того, соединения АФГ, будучи расплавленными, могут перерабатываться совместно с полимерным связующим в глазные лекарственные пленки, например, экструзионным способом.
Вещества, состоящие из соли АФГ, приготовляются при нейтрализации исходного АФГ, содержащие основные аминогруппы, соответствующей кислотой, взятой в стехиометрическом количестве или близким к нему, что определяется необходимым конечным значением рН. Поскольку кислоты, используемые для нейтрализации АФГ в соответствии с настоящим изобретением, главным образом, органические и, в большинстве случаев, слабые, их необходимо использовать в количествах, превышающих стехиометрические для достижения нейтральных значений рН или использовать для этого другие, предпочтительно, сильные кислоты. Реакция получения соли АФГ проводится в дистиллированной воде, изотоническом растворе, этаноле или их смеси.
Подобная композиция может быть также получена при растворении в водной среде уже имеющейся (предварительно полученной) соли амина с функциональными группами и кислоты, обычно, сильной, например, хлористоводородной. В этом случае корректировка величины рН до необходимого значения может осуществляться добавлением соответствующих количеств основания, предпочтительно амина, например, трис(гидроксиметил)аминометана, L-лизина или пиридоксина.
В соответствии с настоящим изобретением для нейтрализации соединений АФГ используют неорганические или органические одно-, двух- и полиосновные кислоты. При этом в качестве кислот используют низкомолекулярные и полимерные кислоты: полиакриловую кислоту или сополимеры на ее основе, а также их частично нейтрализованная форма или их смесь.
Частично нейтрализованную форму полимерных кислот получают при нейтрализации полимерной кислоты основанием до степени нейтрализации не более 0,5. При этом в качестве основания используются гидроксиды щелочных металлов (Na, K) и амины: аммиак, первичные, вторичные, третичные амины или их смеси.
Кроме получения солей АФГ непосредственной нейтрализацией АФГ кислотами они могут быть получены и другими известными способами, например, действием кислот на карбаматы АФГ, соли АФГ со слабыми кислотами, а также кислотным гидролизом амидов и пептидов на основе соответствующих АФГ.
Как известно, на комфортность глазных капель большое влияние оказывает значение рН. Большинство глазных капель имеет рН в пределах 5,0-9,0. При значениях рН>9 и <5,0 глазные капли вызывают при закапывании негативную реакцию (сильное слезотечение и чувство жжения).
Заявляемый лекарственный препарат в виде раствора, предназначенный для укрепления склеры, должен иметь рН 5,5-8,0, предпочтительно 7,0-7,4.
Лекарственные препараты на основе комплексного соединения переходного металла приготовляются при взаимодействии АФГ с солью соответствующего переходного металла (Cu2+ или Zn2+), взятой в стехиометрическом количестве или близким к нему, что определяется необходимым конечным значением рН. Реакция проводится в водной среде или этаноле. Подобная композиция может быть также получена при растворении в водной среде уже имеющегося (предварительно полученного) комплексного соединения на основе АФГ и соответствующей соли переходного металла.
Лекарственный препарат в виде раствора может быть получен на основе дистиллированной воды, изотонического раствора или их смеси.
В качестве изотонического раствора используют физиологический (0,9 вес. % NaCl), сбалансированный физиологический раствор BSS (Balanced Salt Solution, раствор Хенкса) или водные растворы неионных соединений, такие как глицерин, сорбит, маннит, пропиленгликоль или декстроза, концентрация которых, предпочтительно, не более 4 вес. %. При получении в дистиллированной воде раствора соединения АФГ с концентрацией меньшей, чем изотоническая, его желательно изотонировать введением соответствующего количества изотонической добавки (в сухом виде).
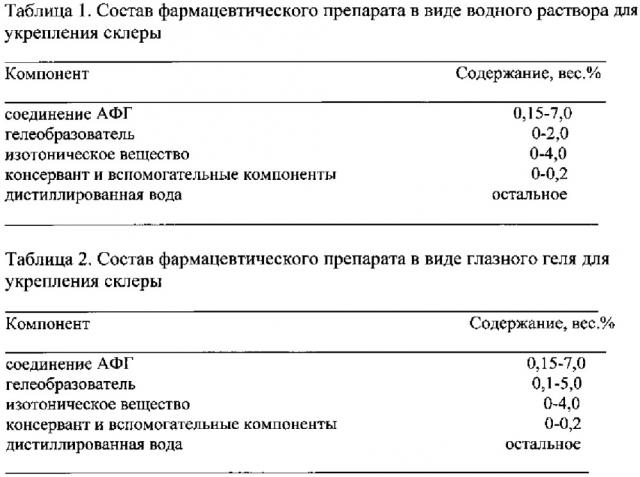
При получении фармацевтического препарата в виде раствора и глазного геля полимерный гелеобразователь используется в виде водной среды (предварительно полученного полимерного раствора соответствующей концентрации) или вноситься в уже приготовленный водный раствор АФГ в концентрированном виде в соответствующем количестве.
При получении фармацевтического препарата в виде раствора используются водорастворимые полимеры. При получении фармацевтического препарата в виде глазного геля - только сшитые гели.
Способ получения гелеобразователя на основе сшитой полиакриловой кислоты и ее сополимеров с С10-30-алкилакрилатами, имеющей кислую реакцию, включает предварительное диспергирование этих полимерных кислот в воде при перемешивании и последующую нейтрализацию основанием, в качестве которого используются гидроксиды щелочных металлов (Na, K) или амины: аммиак, первичные, вторичные, третичные амины, включая АФГ, или их смеси.
Раствор для инстилляций и глазной гель
Фармацевтический препарат в виде водного раствора на основе соединения АФГ может быть получен на основе дистиллированной воды, изотонического раствора или их смеси.
В качестве изотонического раствора используют физиологический (0,9 вес. % NaCl), сбалансированный физиологический раствор BSS (раствор Хенкса) или водные растворы неионных соединений, такие как глицерин, сорбит, маннит, пропиленгликоль или декстроза. При получении в дистиллированной воде раствора соединения АФГ с концентрацией меньшей, чем изотоническая, его желательно изотонировать введением соответствующего количества изотонической добавки (в сухом виде).
В соответствии с настоящим техническим решением концентрация активного соединения АФГ в растворе для укрепления склеры предпочтительно составляет 0,15-7,0 вес. %. При больших концентрациях возможны нежелательные побочные эффекты, например, раздражение прилегающих тканей. При меньших концентрациях эффект от использования лекарственного препарата незначителен.
Для пролонгирования действия заявленный препарат в виде раствора может содержать полимерный гелеобразователь: гиалуроновую кислоту, хондроитинсульфат, поливиниловый спирт, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилгуар, или блок-сополимер полиэтиленгликоль-полипропиленгликоль-полиэтиленгликоль (например, Kolliphor® P188 и Р407, BASF), или поли-N-винилпирролидон, или Na-карбоксиметилцеллюлозу. Те же гелеобразователи в сшитом виде или соли сшитой полиакриловой кислоты и ее сополимеров с С10-30-алкилакрилатами (например, Carbopol®, Noveon, Inc.) используются для получения глазного геля с пролонгированным действием.
Содержание гелеобразователя в фармацевтическом препарате составляет 0,1-5,0 вес. %. Такой широкий диапазон концентраций и варьирование природы гелеобразователя позволяет получать фармацевтические препараты для профилактики и лечения прогрессирующей близорукости с разнообразными свойствами. Так, фармацевтический препарат в виде раствора для инстилляций получают при использовании гелеобразователя в несшитом виде или при его отсутствии (см. таблицу 1), а глазной гель (имеющий более высокую высокую - убрать повтор вязкость, чем раствор для инстилляций) - при использовании сшитого гелеобразователя (см. таблицу 2). При этом необходимо отметить, что при использовании гелеобразователя вязкость водного раствора определяется не только его содержанием, но и его природой и молекулярной массой, а также, в значительной степени тем, в сшитой или несшитом виде он используется.
В полученный раствор после введения основных компонентов могут добавляться консерванты, например хлорбутанол гидрат, цетилпиридиний хлорид, бензалконий хлорид, метиловый эфир параоксибензойной кислоты (Нипагин), пропиловый эфир параоксибензойной кислоты (Нипазол), а также другие дополнительные ингредиенты.
Глазные лекарственные пленки
Применение фармацевтических препаратов в виде глазных лекарственных пленок, как известно, увеличивает эффективность их применения и, одновременно, снижает раздражающее или токсическое действия на глаз, поскольку, постепенно освобождаясь из пленок, действующее вещество препарата длительно и равномерно поступает в конъюнктиву и роговую оболочку, а количество его, отводимое в нос со слезной жидкостью, невелико.
Важными качествами ГЛП являются также стабильность, позволяющая хранить их до двух лет, высокая стерильность и незначительная опасность инфицирования, удобство закладывания в конъюнктивальный мешок как медицинским персоналом, так и самим больным.
К полимерным носителям для глазных лекарственных пленок с различными видами терапевтической активности предъявляются следующие специфические требования:
- полимеры должны быстро набухать в слезной жидкости сразу после помещения ее в конъюнктивальную полость с целью снижения травмирующего действия на окружающие ткани;
- полимеры должны полностью растворяться в слезной жидкости с образованием вязких растворов, способных обволакивать ткани глаза и долго удерживаться на их поверхности;
- полимеры должны долго связывать используемые активные вещества препарата, обеспечивая пролонгированное терапевтическое действие.
В настоящем изобретении в состав глазных пленок включается соединение АФГ. Его содержание в лекарственных пленках предпочтительно составляет 5-50 вес % (таблица 3).
В качестве полимерного связующего для препарата в данном техническом решении используют различные синтетические и природные полимеры: полиакриламид и его сополимеры, поливинил-N-пирролидон и его сополимеры, поливиниловый спирт, Na-карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, альгинат натрия, хитозан.
Для получения препарата в виде ГЛП приготовляют совместный раствор на основе описанного выше соединения АФГ и полимерного носителя в водной, водно-спиртовой или спиртового среде. Дополнительно в этот раствор может вноситься также пластификатор и вспомогательные компоненты (например, ПАВы). После этого полученный однородный раствор компонентов выливается на подложку и высушивается. Из сформированной полимерной ленты вырезают или вырубают пленки необходимой формы и размеров.
Препарат в виде ГЛП может приготовляться также при совместной экструзионной переработке соединения АФГ и полимерного связующего.
При использовании фармацевтический препарат в виде ГЛП, содержащий соединение АФГ, помещается в конъюнктивальный мешок и, смачиваясь слезной жидкостью и набухая, переходит в эластичное мягкое состояние и удерживается в нижнем конъюнктивальном своде до полного растворения.
Примеры применения заявленных фармацевтических препаратов
Для укрепления склеры с помощью инстилляций лекарственный препарат в виде раствора вводился ежедневно в конъюнктивальный мешок левого глаза кроликов породы «Шиншилла», правый интактный глаз служил контролем. Курс лечения состоял из ежедневных инстилляций 2 раза в день по 1-2 капли в течение 1 месяца. В этот период и в течение 1 месяца после окончания курса инстилляций методом биомикроскопии контролировалось состояние глаз кроликов. Никаких токсических или воспалительных явлений обнаружено не было. В конце срока наблюдения глаза были энуклеированы и использованы для приготовления образцов склеры.
Для укрепления склеры с помощью глазного геля гелевая субстанция весом 20-25 мг ежедневно в течение 1 месяца шпателем закладывалась за нижнее веко левого глаза кроликов породы «Шиншилла», правый интактный глаз служил контролем. В этот период и в течение 1 месяца после окончания курса лечения методом биомикроскопии контролировалось состояние глаз кроликов. Никаких токсических или воспалительных явлений обнаружено не было. В конце срока наблюдения глаза были энуклеированы и использованы для приготовления образцов склеры.
Для укрепления склеры с помощью глазной лекарственной пленки различные виды пленок весом по 15 мг закладывались ежедневно в течение 1 месяца в нижний конъюнктивальный свод левого глаза кроликов породы «Шиншилла», правый интактный глаз служил контролем. В этот период и в течение 1 месяца после окончания курса инстилляций методом биомикроскопии контролировалось состояние глаз кроликов. Никаких токсических или воспалительных явлений обнаружено не было. В конце срока наблюдения глаза были энуклеированы и использованы для приготовления образцов склеры.
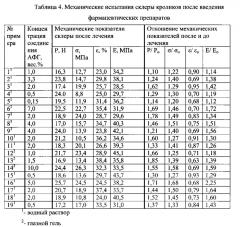
Биомеханические показатели склеры млекопитающего после применения заявленного препарата
Для определения биомеханических показателей склеры (разрывной нагрузки Р (Н), прочности при разрыве σ (МПа), относительного удлинения при разрыве ε (%) и модуля упругости Е (МПа) из этих тканей специальным ножом с двумя режущими поверхностями вырезали стандартные образцы шириной 4,0 мм. После измерения их толщины на аппарате PosiTector 6000 фирмы DeFelsko (США) образцы помещали в зажимы деформационной машины Autograph AGS-H фирмы Shimadzu (Япония) и проводили механические испытания. Зависимость «напряжение-деформация», получаемая в процессе растяжения образца (скорость 1 мм/мин) вплоть до разрыва, непрерывно записывалась в цифровом и графическом режиме компьютерным блоком аппарата.
Данные биомеханических испытаний склеры приведены в таблице 4.
Как видно из таблицы 4, биомеханические показатели склеры, в которые вводился лекарств